朱文慧1,宦海珍1,步 营1,徐永霞1,励建荣1,*,李学鹏1,*,宋 强2,马永钧3
(1.渤海大学食品科学与工程学院,辽宁省高校重大科技平台“食品贮藏加工及质量安全控制工程技术研究中心”,辽宁 锦州 121013;2.大连东霖食品股份有限公司,辽宁 大连 116000;3.浙江兴业集团有限公司,浙江 舟山 316101)
摘要:比较静水解冻、流水解冻、盐水解冻、空气解冻及冷藏解冻5 种不同解冻方式及对秘鲁鱿鱼品质的影响。结果表明:流水解冻方式用时最短,其次是盐水解冻。5 种不同解冻方式秘鲁鱿鱼的解冻损失率和蒸煮损失率差异极显著(P<0.01),经冷藏解冻和盐水解冻后秘鲁鱿鱼的持水能力较高,而静水解冻和空气解冻对鱿鱼的保水性影响较大。低场核磁共振实验结果也证实,经冷藏解冻和盐水解冻后秘鲁鱿鱼的持水能力较高。样品解冻过程中,5 种不同解冻方式鱿鱼在不同温度条件下其羰基含量、巯基含量和二聚酪氨酸含量差异极显著(P<0.01)。综合蛋白质氧化指标,盐水解冻和冷藏解冻是最适宜的解冻方式。研究结果说明,解冻过程中肌肉保水性的下降和蛋白质氧化存在一定的关系。
关键词:秘鲁鱿鱼;解冻方式;保水性;蛋白氧化
朱文慧, 宦海珍, 步营, 等. 不同解冻方式对秘鲁鱿鱼肌肉保水性和蛋白质氧化程度的影响[J]. 食品科学, 2017, 38(11): 6-11. DOI:10.7506/spkx1002-6630-201711002. http://www.spkx.net.cn
ZHU Wenhui, HUAN Haizhen, BU Ying, et al. Effect of different thawing methods on water holding capacity and protein oxidation in Dosidicus gigas[J]. Food Science, 2017, 38(11): 6-11. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201711002. http://www.spkx.net.cn
鱿鱼捕捞加工是我国水产加工的一大支柱产业,行业年产值约200亿元。《2016中国渔业统计年鉴》统计数据显示我国鱿鱼捕获量达38.01万 t,约占世界鱿鱼捕获量的36%,其中,秘鲁鱿鱼(Dosidicus gigas)的渔获产量占我国鱿钓总产量的70%以上,是重要的远洋捕捞经济动物[1-2]。秘鲁鱿鱼原料多为远洋捕捞,捕捞后需及时进行船上冻结,因此,冷冻鱿鱼是各类鱿鱼制品生产的主要原料。
冻结的秘鲁鱿鱼原料在加工前必须经过解冻处理,解冻是一个复杂的相变传热传质过程,不同解冻方式对解冻产品品质的影响差异显著[3]。在解冻过程中存在汁液流失严重、原料保水性(water holding capacity,WHC)下降、品质劣变和加工性能差等问题,造成严重经济损失[4-5]。因此,解冻成为决定秘鲁鱿鱼原料最终品质的关键因素之一。传统的解冻方式有流水解冻、静水解冻、空气解冻、盐水解冻和冷藏解冻等,已被广泛应用于工业生产中[6]。研究表明,导致肌肉保水性下降的主要原因是冻结、冻藏方式和解冻过程[7-8],因此,选择适宜的解冻方式是进行秘鲁鱿鱼加工的重要环节。
肌原纤维蛋白(myofibrillar protein,MP)是肌纤维的重要组成部分,大约85%的水分保持在MP结构中[9]。近期研究发现,蛋白质氧化也是导致肌肉保水性下降的重要影响因素之一[10-12]。已有文献证明,猪肉解冻过程中存在明显的蛋白质氧化效应,蛋白质的氧化使蛋白质发生交联、降解及变性,肌纤维结构遭到破坏,导致肌肉保水性下降,使解冻汁液流失[13-15]。但鱿鱼解冻过程中肌肉保水性的变化是否伴随蛋白质氧化效应,鲜见报道。鉴于此,本研究比较了静水解冻、流水解冻、盐水解冻、空气解冻及冷藏解冻5 种不同的解冻方式及对秘鲁鱿鱼品质和蛋白质氧化效应的影响,旨在创新和丰富水产原料学的基础理论,为控制鱿鱼解冻汁液损失提供理论依据。
1.1 材料与试剂
冻结秘鲁鱿鱼购自锦州林西路水产市场。液氮保存立即运往实验室,快速分割成砖状,质量约500 g(长宽约15 cm×15 cm),置于-80 ℃超低温冰箱中备用。
BCA试剂盒 美国Pierce公司;三羟甲基氨基甲烷(tris(hydroxymethyl)metyl aminomethane,Tris)、2,4-二硝基苯肼(2,4-dinitrophenylhydrazone,DNPH)、乙二胺四乙酸(ethylene diaminetetraacetic acid,EDTA)、二硫代二硝基苯甲酸(5,5-dihiobis-(2-nitrobenzoic acid),DNTB)、三氯乙酸、盐酸、盐酸胍、脲(均为分析纯) 南京圣比奥生物科技公司。
1.2 仪器与设备
UV-2550紫外-可见光分光光度计 岛津仪器(苏州)有限公司;970CRT 荧光分光光度计 上海精密科学仪器有限公司;SORVALL Stratos 冷冻高速离心机美国Thermo公司;JHG-Q60-P100实验室均质机 上海融合机械设备有限公司;106高精度食品温度计 德国德图集团;NMI-20低场核磁共振仪 上海纽迈电子科技有限公司。
1.3 方法
1.3.1 样品解冻
将秘鲁鱿鱼从-80 ℃超低温冰箱中取出,随机分为5 组,采用如下5 种方式进行解冻,随时监测鱿鱼体中心温度变化情况,直至鱼体中心温度达0 ℃,视为解冻终点,记录解冻时间并进行指标测定。
空气解冻:将秘鲁鱿鱼样品放入塑料托盘中,置于(10±1) ℃静止空气介质中进行解冻;静水解冻:秘鲁鱿鱼样品置于水浴中解冻,温度控制为(10±1) ℃;流水解冻:使用流速为30 mL/s的温度为(10±1) ℃的自来水进行解冻;盐水解冻:配制质量分数3.0%的食盐水,将秘鲁鱿鱼样品置于盐水中,温度控制(10±1) ℃解冻;冷藏解冻:将秘鲁鱿鱼样品置于4 ℃的冰箱中。
1.3.2 指标测定
1.3.2.1 解冻时间的测定
解冻时间是指样品中心温度从-80 ℃升高至0 ℃所需要的时间,用106高精度食品温度计进行测定。
1.3.2.2 鱿鱼保水性的测定
解冻损失率:精确称量解冻前(m1)及解冻后(m2)鱿鱼的质量,按照式(1)计算解冻损失率。
蒸煮损失率:称取一定大小(约2 cm×2 cm× 2 cm)的鱿鱼样品在85 ℃水浴锅中蒸煮20 min,蒸煮前称质量(m3)。蒸煮后冷却至室温,用吸水纸吸干水分,然后再次称质量(m4),蒸煮损失率的计算公式如(2)所示。
1.3.3 低场核磁共振实验
鱿鱼样品解冻后,切成10 mm×10 mm×20 mm的长方体,转入核磁管,采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列,在32 ℃条件下进行横向弛豫时间T2的测定。参数设定:SFI=22 MHz、P90=16.5 μs、SW=200 kHz、TR=2 000 ms、NS=8、τ=100 μs、Echocnt=4 000。
1.3.4 蛋白氧化指标测定
1.3.4.1 鱿鱼肌原纤维蛋白提取
依据李学鹏等[16]的方法并加以修改,取鱿鱼肉搅碎,加入4 倍体积的10 mmol/L 的Tris-HCl(pH 7.2),高速均质1次时间20 s,在4 500 r/min条件下离心20 min。取沉淀再次均质机均质一次,加入4 倍体积的10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)混匀均质,在4 500 r/min条件下离心20 min,取上清液于-20 ℃冰箱中保存备用,提取的肌原纤维蛋白要在2 d内使用。
1.3.4.2 羰基含量测定
参照Oliver等[17]的方法并加以改进。取1 mL MP溶液(质量浓度为5 mg/mL),放入离心管中并加入1 mL DNPH溶液(10 mmol/L HCl)。在室温条件下避光静止1 h,每15 min振荡一次。在样品中加入3 mL质量分数20%三氯乙酸后10 000 r/min,离心时间为5 min,去掉上层清液,用1∶1的乙酸乙酯-乙醇冲洗沉淀2~4 次,加入6 mol/L盐酸胍溶液5 mL,37 ℃保温15 min使沉淀溶解,10 000 r/min离心3 min,弃掉不可溶物质,所得溶液于370 nm波长处测定吸光度。使用分子吸光系数22 000 L/(mol·cm)计算每毫克蛋白中羰基含量。
1.3.4.3 总巯基含量测定
参考张茜茜等[18]的方法如下,将MP溶解于缓冲液A(86 mmol/L Tris、90 mmol/L甘氨酸、4 mmol/L EDTA、 8 mol/L脲),用牛血清白蛋白试剂盒测定蛋白质量浓度后稀释至4 mg/mL。取1 mL蛋白溶液与4 mL缓冲液A混合,加入40 μL 0.4% DTNB(用缓冲液A配制),室温条件下放置1 h,随后12 000×g离心10 min,412 nm波长处测吸光度即为总巯基的吸光度,缓冲液A作空白对照,使用分子吸光系数13 600 L/(mol·cm)计算蛋白中总巯基的含量。
1.3.4.4 二聚酪氨酸含量测定
参考Davies等[19]描述的方法加以修改,精确称取氧化后提取的10 mg鱿鱼MP样品溶解在10 mL、pH 6.0的20 mmol/L磷酸盐缓冲液中(含有浓度为0.6 mol/L的KCl)。溶液经过过滤除去不溶物质后,通过双缩脲法测定被溶解的蛋白浓度。二聚酪氨酸含量利用荧光分光光度计测定,发射波长选择420 nm、激发波长选择325 nm、狭缝宽度均匀10 nm。最终的二聚酪氨酸含量利用所测定的吸光度除以蛋白质量浓度获得,为相对荧光值,单位为AU。
1.4 数据分析
数据以重复为统计单位,采用SAS 9.2统计软件中广义线性模型(general liner model,GLM)以单因素方差分析(analysis of variance,ANOVA)方法进行分析。若各个处理间差异显著,则用Duncan’s多重比较进行检验。结果表示为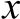 ±s,以P<0.05为差异显著,P<0.01为差异极显著。
±s,以P<0.05为差异显著,P<0.01为差异极显著。
2.1 不同解冻方式对秘鲁鱿鱼解冻时间的影响
采用不同解冻方式对冷冻秘鲁鱿鱼进行解冻,测量鱼体中心从温度-80 ℃升高至0 ℃所需要的时间。不同解冻方式所需的解冻时间不同,且差异较大。空气解冻、静水解冻、流水解冻、盐水解冻和冷藏解冻解冻所需时间分别为12.5、6.0、4.5、5.0 h和10.5 h。其中,空气解冻所需时间最长,分别约为静水解冻、流水解冻和盐水解冻所需时间的2.1、2.8 倍和2.5 倍。由于水的传热性能比空气好,能大大提高热的传导速率,而加盐促进了水的渗透速率,同样缩短了解冻时间,因此与其他几种解冻方式相比,流水解冻所需解冻时间最短,盐水解冻次之。翁梅芬等[20]研究也发现,静水解冻、流水解冻、盐水解冻和冷藏解冻这4 种不同的解冻方式解冻碎虾仁,流水解冻所需的时间最短为40 min,次之为盐水解冻80 min。
2.2 不同解冻方式对鱿鱼保水性的影响
2.2.1 不同解冻方式对鱿鱼解冻损失率和蒸煮损失率的影响
表1 5 种解冻方式对鱿鱼保水性的影响(n=3)
Table 1 Effects of five different thawing methods on water holding capacity of Dosidicus gigas (n= 3)

注:同行肩标字母不同表示差异极显著(P<0.01)。下同。
解冻损失率和蒸煮损失率是衡量蛋白保水性的重要指标,不同解冻方式对保水性的影响如表1所示。不同解冻方式的解冻损失率差异极显著(P<0.01)。在各种解冻方式中,冷藏解冻的解冻损失率最低,为16.30%,极显著低于其他处理组(P<0.01)。其次是盐水解冻,盐水熔点低,能够大大缩短鱿鱼解冻的时间,因此有效阻止了解冻损失率。静水解冻鱿鱼的解冻损失率最高为26.61%,与其他处理组相比差异极显著(P<0.01)。从解冻损失率可以看出,冷藏解冻和盐水解冻鱿鱼的解冻损失率较低,可以降低鱿鱼解冻过程中的营养损失。对于蒸煮损失率而言,冷藏解冻和盐水解冻的蒸煮损失率与其他3 种差异极显著(P<0.01)。在各种解冻方式中,冷藏解冻的蒸煮损失率最低为24.73%,极显著低于空气解冻、静水解冻和流水解冻(P<0.01)。其中,静水解冻的蒸煮损失率最高为31.22%,极显著高于其他处理组(P<0.01)。因此,从蒸煮损失率来看,冷藏解冻和盐水解冻蒸煮损失率较低,可以降低鱿鱼蒸煮过程中的营养损失。综合分析,经冷藏解冻和盐水解冻秘鲁鱿鱼的持水能力较高,静水解冻和空气解冻对鱿鱼的持水力影响较大。解冻时间与解冻速率成反比,解冻时间越短,解冻速率越快[21]。从本研究不同解冻方式所需的解冻时间及对应的解冻损失率可知,解冻时间和解冻损失率呈非线性关系。余小岭等[22]研究发现,解冻速率对解冻损失率呈非线性关系,在一定范围内可能存在最佳解冻速率使解冻损失率最低。
2.2.2 不同解冻方式对横向弛豫时间的影响

图1 不同解冻方式的秘鲁鱿鱼横向弛豫时间T2分布
Fig. 1 Distribution of transverse relaxation time (T2) in Dosidicus gigas of different thawing methods
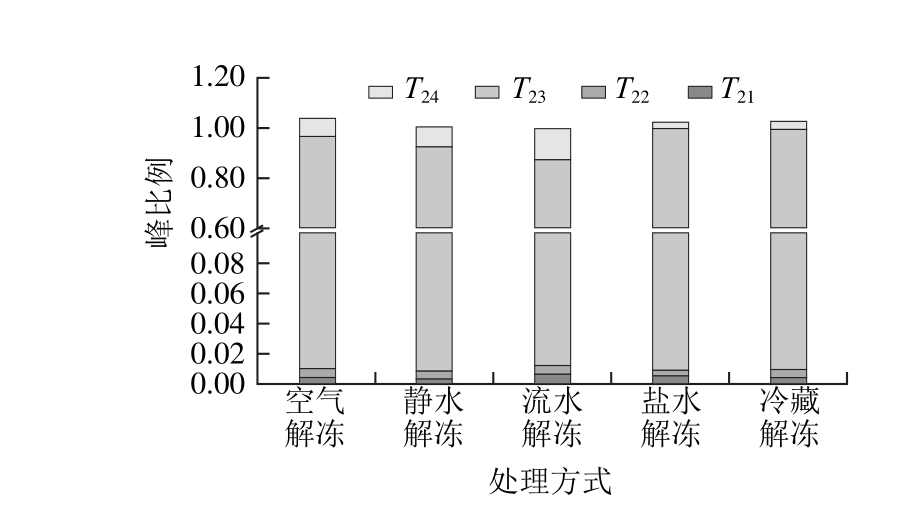
峰比例的影响
Fig. 2 Effects of different thawing methods on transverse relaxation time distribution in Dosidicus gigas
图2 不同解冻方式对鱿鱼横向弛豫时间T2
由图1可知,弛豫图谱上显示4 个峰,其中0~10 ms(T21、T22)间有两个小峰,代表与肌肉蛋白分子表面极性基团紧密结合的化合水;10~150 ms(T23)的峰为主峰,代表肌原纤维内截留的不易流动水,为肌肉中水分的主要存在形式,也是影响肌肉保水性的决定因素[12];200~1 000 ms(T24)间组分代表肌原纤维晶格内的自由水。由图1、2可知,5 种不同解冻方式下的秘鲁鱿鱼的结合水(T21、T22)差异不大,而空气解冻、静水解冻和流水解冻的自由水含量大于盐水解冻和冷藏解冻方式的,说明盐水解冻和冷藏解冻方式秘鲁鱿鱼的保水性较高,低场核磁结果和解冻损失率、蒸煮损失率结果基本一致。
2.3 不同解冻方式对鱿鱼蛋白氧化指标的影响
2.3.1 不同解冻方式对鱿鱼蛋白羰基含量变化的影响
表2 不同解冻方式对秘鲁鱿鱼蛋白羰基含量的影响(n=3)
Table 2 Effects of different thawing methods on carbonyl content in Dosidicus gigas (n= 3)
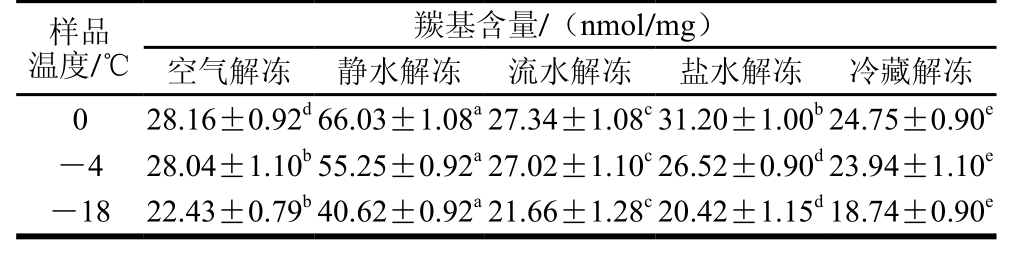
蛋白羰基含量是蛋白质氧化损伤的敏感指标,羰基(醛基和酮基)的形成是蛋白质分子被自由基氧化修饰的一个重要标记[23-25],因而,可通过测定羰基含量判断蛋白质是否被氧化损伤[26-27]。羰基含量测定结果如表2所示,在样品温度分别为-18、-4 ℃和0 ℃时,5 种不同解冻方式解冻后秘鲁鱿鱼肉中蛋白质羰基含量差异均极显著(P<0.01)。随着解冻时间的延长,样品温度升高,秘鲁鱿鱼肉开始发生化学反应,蛋白质氧化速率加快,羰基含量明显上升。在各温度条件下,静水解冻方式下鱿鱼羰基含量最高,与其他处理组差异均极显著
(P<0.01),说明该方式下蛋白质氧化速率最快。而冷藏解冻方式下,秘鲁鱿鱼蛋白中羰基含量最少,可见蛋白质氧化速率最慢。因而从羰基含量这一指标来看,冷藏解冻方式明显优于其他4 种解冻方式。
2.3.2 不同解冻方式对鱿鱼蛋白巯基含量变化的影响
表3 不同解冻方式对秘鲁鱿鱼蛋白总巯基含量的影响(n=3)
Table 3 Effects of different thawing methods on sulphur content in Dosidicus gigas (n= 3)
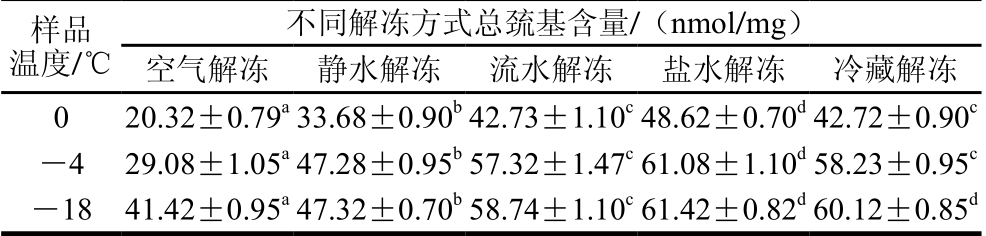
蛋白质氧化过程中,巯基转化成二硫键是初期的一个反应产物,在蛋白质变性和降解过程中巯基含量减少[28]。对于肉类食品,二硫键和二酪氨酸的形成是肌肉食品中蛋白交联的主要形式[29]。不同解冻方式对鱿鱼蛋白巯基变化的影响见表3。在样品温度分别为-18、-4 ℃和0 ℃时,5 种解冻方式秘鲁鱿鱼肉蛋白质巯基含量变化差异极显著(P<0.01)。样品从-18 ℃升温至解冻终点即0 ℃过程中,空气解冻、静水解冻、流水解冻、盐水解冻和冷藏解冻5 种解冻方式的巯基含量分别降低了50.9%、28.8%、27.2%、20.8%和28.9%,可以看出,盐水解冻优于其他几种解冻方式。在解冻终点,盐水解冻的巯基含量值为48.62 nmol/mg,与其他处理组差异极显著(P<0.01)。因此,从秘鲁鱿鱼肉中蛋白质巯基含量对比来看,盐水解冻为5 种解冻方式中较为适宜的解冻方式。
2.3.3 不同解冻方式对鱿鱼蛋白二聚酪氨酸含量变化的影响
表4 不同解冻方式对秘鲁鱿鱼蛋白二聚酪氨酸含量的影响(n=3)Table 4 Effects of different thawing methods on dimerization tyrosine content in Dosidicus gigas (n= 3)
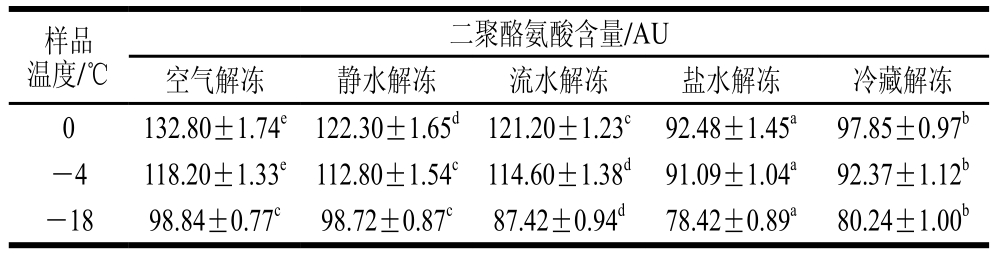
二聚酪氨酸形成是因为蛋白质酪氨酸残基发生氧化,通过共价和非共价作用形成了蛋白质聚合物,因此,检验蛋白质氧化后二聚酪氨酸含量变化可以了解蛋白质的氧化情况[19-30]。不同解冻方式对鱿鱼蛋白二聚酪氨酸含量变化的影响见表4。不同解冻温度条件下,5 种不同解冻方式解冻后秘鲁鱿鱼肉蛋白质二聚酪氨酸含量变化差异均极显著(P<0.01)。随着秘鲁鱿鱼解冻的进行,5 种不同解冻方式下二聚酪氨酸含量均升高,说明5 种不同解冻方式均使秘鲁鱿鱼肉中蛋白质发生了缓慢的氧化。随着解冻时间的延长,秘鲁鱿鱼冻品内部温度升高,化学反应速率加剧,导致秘鲁鱿鱼肉中蛋白质发生氧化反应。在-18 ℃时空气解冻和静水解冻方式中蛋白二聚酪氨酸含量差异不大,但随着反应的进行,空气解冻中蛋白质氧化速率明显加快,导致解冻完成后蛋白二聚酪氨酸含量达到5种解冻方式中最高,相对荧光值为132.80 AU。样品解冻至终点(0℃)时,盐水解冻的蛋白二聚酪氨酸含量最低,相对荧光值为92.48 AU,且与其他几种解冻方式差异极显著(P<0.01)。其次是冷藏解冻的蛋白二聚酪氨酸含量,相对荧光值为97.85 AU。盐水解冻和冷藏解冻的蛋白二聚酪氨酸含量增加较少,分别增加了17.9%和21.9%,说明这两种解冻方式的氧化速率较低。因此,就二聚酪氨酸指标而言,盐水解冻和冷藏解冻为最适宜的解冻方式。
不同的解冻方式对秘鲁鱿鱼解冻后的品质有不同的影响。就解冻时间而言,流水解冻时间最短,盐水解冻次之。经冷藏解冻和盐水解冻后的秘鲁鱿鱼持水能力较高。在样品温度分别为-18、-4 ℃和0 ℃时,5 种不同解冻方式解冻后秘鲁鱿鱼肉中蛋白质羰基含量、巯基含量和二聚酪氨酸含量差异极显著(P<0.01)。就羰基含量变化指标看,冷藏解冻优于其他几种解冻方式;就巯基含量变化而言,盐水解冻则为最佳的解冻方式;分析二聚酪氨酸指标变化可以得出,冷藏解冻和盐水解冻是最适宜的解冻方式。综合蛋白质氧化指标,盐水解冻和冷藏解冻是最适宜的解冻方式。归纳分析本研究保水性和蛋白氧化结果,在秘鲁鱿鱼解冻过程中同时伴随着肌肉保水性下降和蛋白质氧化反应,说明肌肉保水性的下降和蛋白质氧化可能存在一定的内在关系,然而在秘鲁鱿鱼解冻过程中肌肉保水性的下降是否由蛋白质氧化介导引起,需要进一步深入研究。
参考文献:
[1] 农业部渔业渔政管理局. 2016中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2016: 44.
[2] 杨宪时, 王丽丽, 李学英, 等. 秘鲁鱿鱼和日本海鱿鱼营养成分分析与评价[J]. 现代食品科技, 2013, 29(9): 2247-2251.
[3] 张珂, 关志强, 李敏, 等. 解冻方法对冻藏肉类食品品质影响的研究进展[J]. 肉类研究, 2014, 28(8): 24-29.
[4] 邸静, 靳烨. 不同解冻方法对牛肉品质的影响[J]. 食品工业, 2015, 36(1): 174-177.
[5] 刘欢, 陈雪, 宋立玲, 等. 不同解冻方式对鲐鱼鲜度及品质的影响[J]. 食品科学, 2016, 37(10): 259-265. DOI:10.7506/spkx1002-6630-201610044.
[6] 刘燕, 王锡昌, 刘源. 金枪鱼解冻方法及其品质评价的研究进展[J]. 食品科学, 2009, 30(21): 476-480. DOI:10.3321/ j.issn:1002-6630.2009.21.108.
[7] VIEIRA C, DIAZ M T, MARTINEZ B, et al. Effect of frozen storage conditions (temperature and length of storage) on microbiological and sensory quality of rustic crossbred beef at different states of ageing[J]. Meat Science, 2009, 83(3): 398-404. DOI:10.1016/ j.meatsci.2009.06.013.
[8] 苏永玲, 谢晶. 冻结和解冻过程对水产品品质的影响[J]. 食品工业科技, 2011, 32(1): 304-308.
[9] 陈洪生, 孔保华, 刁静静, 等. 氧化引起的肌肉蛋白质功能性变化及其控制技术的研究进展[J]. 食品科学, 2015, 36(11): 215-220. DOI:10.7506/spkx1002-6630-201511041.
[10] 李银. 蛋白氧化对肌肉保水性的影响机制研究[D]. 北京: 中国农业科学院, 2014: 5-6.
[11] TRAORE S, AUBRY L, GATELLIER P, et al. Higher drip loss is associated with protein oxidation[J]. Meat Science, 2012, 90(4): 917-924. DOI:10.1016/j.meatsci.2011.11.033.
[12] HUFF-LONERGAN E, LONERGAN S M. Mechanisms of waterholding capacity of meat: the role of postmortem biochemical and structural changes[J]. Meat Science, 2005, 71(1): 194-204. DOI:10.1016/j.meatsci.2005.04.022.
[13] XIONG Youling L.. Protein oxidation and implications for muscle foods quality[M]// DECKER E A. Antioxidants in Muscle Foods. New York: Wiley, 2000: 85-111.
[14] BERTRAM H C, KRISTENSEN M, ☒STDAL H, et al. Does oxidation affect the water functionality of myofibrillar proteins?[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2342-2348. DOI:10.1021/jf0625353.
[15] 刘泽龙. 蛋白质氧化对肉制品持水与水合特性影响机理研究[D].无锡: 江南大学, 2014: 6-7.
[16] 李学鹏, 周凯, 周名言, 等. 自由基氧化对大黄鱼肌原纤维蛋白交联和聚集影响[J]. 中国食品学报, 2015, 15(4): 13-21.
[17] OLIVER C N, AHN B W, MOERMAN E J, et al. Aged related changes in oxidized proteins[J]. Journal of Biological Chemistry, 1987, 262(12): 5488-5491.
[18] 张茜茜, 黄明, 邹玉峰, 等. 辐照和反复冻融对牛肉蛋白质氧化及食用品质的影响[J]. 食品科学, 2014, 35(19): 1-5. DOI:10.7506/ spkx1002-6630-201419001.
[19] DAVIES K J A, DELSIGNORE M E, LIN S W. Protein damage and degradation by oxygen radicals.Ⅱ: modification of amino acids[J]. Journal of Biological Chemistry, 1987, 262(20): 9902-9907.
[20] 翁梅芬, 郇延军, 樊明明, 等. 不同解冻方式对碎虾仁品质特性的影响[J]. 食品工业科技, 2015, 36(16): 162-166.
[21] 华泽钊, 李云飞, 刘宝林. 食品冷冻冷藏原理与设备[M]. 北京: 机械工业出版社, 1999: 123-125.
[22] 余小岭, 李学斌, 闫雪萍, 等. 不同冻结和解冻速率对猪肉保水性和超微结构的影响[J]. 农业工程学报, 2007, 23(8): 261-265. DOI:10.3321/j.issn:1002-6819.2007.08.049.
[23] LEVINE R L, GARLAND D, OLIVER C N. Determination of carbonyl content in oxidatively modified proteins[J]. Methods in Enzymology, 1990, 186: 464-477. DOI:10.1016/0076-6879(90)86141-H.
[24] 朱卫星, 王远亮, 李宗军. 蛋白质氧化机制及其评价技术研究进展[J].食品工业科技, 2011, 32(11): 483-486.
[25] EST☒VEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89: 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[26] SITTE N, MERKER Z T, von ZGLINICKI T, et al. Protein oxidation and degradation during proliferative senescence of human MRC-5 fibroblasts[J]. Free Radical Biology and Medicine, 2000, 28(5): 701-708. DOI:10.1016/S0891-5849(99)00279-8.
[27] 文镜, 张春华, 董雨, 等. 蛋白质羰基含量与蛋白质氧化损伤[J]. 食品科学, 2003, 24(10): 153-157. DOI:10.3321/ j.issn:1002-6630.2003.10.039.
[28] DEAN R T, FU S, STOCHKER R, et al. Biochemistry and pathology of radical-mediated protein oxidation[J]. The Journal of Biological Chemistry, 1997, 324(1): 1-18. DOI:10.1042/bj3240001.
[29] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research, 2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[30] 李学鹏, 王祺, 周凯, 等. 丙烯醛氧化对大黄鱼肌肉组织和肌原纤维蛋白结构性质的影响[J]. 现代食品科技, 2014, 30(10): 1-7.
Effect of Different Thawing Methods on Water Holding Capacity and Protein Oxidation in Dosidicus gigas
ZHU Wenhui1, HUAN Haizhen1, BU Ying1, XU Yongxia1, LI Jianrong1,*, LI Xuepeng1,*, SONG Qiang2, MA Yongjun3
(1. Engineering and Technology Research Center of Food Preservation, Processing and Safety Control of Liaoning Province, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China; 2. Dalian Donglin Food Co. Ltd., Dalian 116000, China; 3. Zhejiang Xingye Group Co. Ltd., Zhoushan 316101, China)
Abstract:This study compared the effects of fi ve different thawing methods namely water soaking, running water thawing, salt water soaking, air thawing ((10 ± 1) ℃) and refrigeration on the quality of frozen Dosidicus gigas. The results showed that the thawing time with running water was the shortest, followed by salt water thawing. The thawing loss and cooking loss of fi ve thawed samples were signif i cantly different (P < 0.01). Water holding capacity of salt water thawing and refrigeration thawing were higher than those of water soaking thawing and air thawing, which was confirmed by low-field nuclear magnetic resonance (LF-NMR). Carbonyl, sulphur and dimer tyrosine contents of fi ve thawed samples were signif i cantly different (P < 0.01) at −18, −4 and 0 ℃. Taking protein oxidation indexes into account, salt water thawing and refrigeration thawing were considered to be the most suitable methods to thaw frozen Dosidicus gigas. Furthermore, there was a certain association between the reduction in water-holding capacity and protein oxidation.
Key words:Dosidicus gigas; thawing method; water holding capacity (WHC); protein oxidation
DOI:10.7506/spkx1002-6630-201711002
中图分类号:TS254.2
文献标志码:A
文章编号:1002-6630(2017)11-0006-06引文格式:
收稿日期:2016-06-24
基金项目:国家自然科学基金青年科学基金项目(31301569);中国博士后科学基金项目(2015M582143);“十二五”国家科技支撑计划项目(2015BAD17B03)
作者简介:朱文慧(1982—),女,讲师,博士,研究方向为水产品加工及贮藏。E-mail:wenhuiby130@163.com
*通信作者:励建荣(1964—),男,教授,博士,研究方向为水产品贮藏加工及质量安全控制。E-mail:lijr6491@163.com李学鹏(1982—),男,副教授,博士,研究方向为水产品贮藏加工。E-mail:xuepengli8234@163.com