胡志和,王星璇,张晴青,吴子健,薛 璐,贾 莹
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
摘要:以凡纳滨对虾原肌球蛋白为原料,研究不同高压条件下引发构象的变化与致敏性的关系。采用不同高压条件(压力0.1~800.0 MPa,处理时间10~40 min,温度10~37 ℃)处理原肌球蛋白(tropomyosin,TM),用圆二色谱法检测二级结构变化,荧光光度法检测三级结构变化,间接酶联免疫吸附法检测致敏性。结果显示,超高压处理能够引发TM的致敏性和三级结构变化,而对二级结构无显著影响;高压条件下TM致敏性的变化与其三级结构的改变有显著相关性。在实验压力范围内,20 ℃、300 MPa处理40 min TM疏水性氨基酸暴露程度最小,且致敏性最低(OD492nm为0.210±0.005);700 MPa条件下暴露程度最高,且致敏性最高(OD492nm为0.328±0.004)。因此,TM致敏性与其三级结构有关,与二级结构无关。
关键词:凡纳滨对虾;原肌球蛋白;超高压处理;蛋白质结构;致敏性
凡纳滨对虾(Litopenaeus vannamei)又称为南美白对虾(Penaeus vannamei),是一种被广泛食用、肉鲜味美且营养价值高的商品虾[1]。然而,该虾也是主要的过敏性食物之一[2-3]。研究表明,原肌球蛋白(tropomyosin,TM)是虾类等甲壳动物的主要过敏原[4-9]。L. vannamei TM亚基的一级结构由284 个氨基酸残基组成,其中,亲水性残基含量较为丰富,约占66.2%,疏水性残基约占33.8%,TM蛋白分子质量约为36 ku[10],其中蛋白部分的分子质量约为32.849 ku,其他部分为糖基,其等电点pI为4.72,整个亚基的脂溶指数为79.12,是一种热稳定性蛋白[11]。TM的二级结构组成以α-螺旋为主[10,12-13],三级结构主要由TM的亚基进一步相互缠绕形成天然状态下的卷曲之卷曲螺旋二聚体结构[14-16]。
TM作为致敏性蛋白,其空间结构(构象)的改变,会引起致敏性[17-18]的改变。在研究蛋白质构象变化的方法中,超高压技术是普遍采用的方法之一。超高压(ultra high pressure,UHP)技术,又称高静压(high hydrostatic pressure,HHP)技术是指将样品密封在容器内,以水或油作为传压介质,在常温或较低的温度条件下,用100 MPa以上的压力(100~1 000 MPa)处理,使蛋白质等高分子化合物中的非共价键(包括氢键、离子键、疏水作用力等)发生变化[19-20],改变其空间结构,从而改变其功能特性。Penas等[21-22]在200 MPa和300 MPa条件下处理大豆蛋白可大幅度降低其致敏性。Husband等[23]研究了热和高压对苹果的2 个主要过敏原(Mal d 1、Mal d 3)及Bet v 1(类似芹菜中过敏原Api g 1)的影响,发现通过加热或提高压力可以有效降低其主要过敏原。
本研究采用超高压处理凡纳滨对虾的主要过敏原TM,研究不同处理条件下引发TM构象的变化与致敏性的关系,为利用超高压技术生产低致敏性虾仁提供理论参考。
1.1 材料与试剂
凡纳滨对虾的TM(纯度为97.65%) 天津商业大学食品专业实验室制备;苯胺基萘磺酸(8-anilino-1-naphthalene-sulfonate,ANS)、兔抗南美白对虾TM-IgG抗体、辣根过氧化物酶标记的羊抗兔IgG抗体美国Sigma公司;其他实验试剂(均为分析纯) 天津市凯通化学试剂有限公司;3590康宁96 孔酶标板 美国Corning Costar公司。
1.2 仪器与设备
MOS-450/AF-CD圆二色谱仪 法国Biologic公司;F-4600荧光分光光度计 日立高新技术公司;HHP.L2-800/2.5超高压实验机 天津华泰森淼生物工程技术有限公司;DC-2030节能型智能恒温槽 宁波新芝生物科技股份有限公司;SpectraMax190光吸收酶标仪 美国美谷分子仪器有限公司;FDU-810型冷冻干燥机 日本东京理化公司。
1.3 方法
1.3.1 样品超高压处理
将TM样品用超纯水配制成2 mg/mL的蛋白溶液,分装于聚乙烯塑料袋,真空密封后,在不同压力条件下(压力0.1~800.0 MPa、处理时间40 min、处理温度20 ℃)进行处理,以常压(0.1 MPa)处理的TM作为对照。处理后的样品冻干备用。
1.3.2 圆二色性光谱检测处理后TM的二级结构
委托天津大学化工学院分析测试中心,采用圆二色性光谱(circular dichroism spectrum,CD)检测[24-25]TM样品在190~250 nm范围内的变化。用10 mmol/L的磷酸盐缓冲液将高压处理的样品稀释成质量浓度为0.5 mg/mL的蛋白溶液,溶液样品经过0.2 μm滤膜处理后装样,防止杂散光对实验的影响;样品去气,有效防止气泡生成。仪器参数设置:采用2 mm光径,扫描速率为60 nm/min,带宽为1 nm,溶液上样体积为0.2~0.5 mL,用Bio-Logic圆二色谱仪在室温条件下记录光谱。CD检测3 次,得到远紫外光区蛋白质二级结构摩尔残基椭圆值,结果取平均值,用[θ]×103((deg·cm2)/dmol)表示。用在线分析程序dichroweb(http://dichroweb.cryst.bbk.ac.uk/html/process.shtml)计算二级结构含量(采用SELCON3算法)。
1.3.3 苯胺基萘磺酸荧光探针法检测TM的表面疏水性
根据Wang Xiansheng等[26]的方法并稍作改动,使用疏水荧光探剂ANS,测定TM的疏水性。用10 mmol/L的磷酸盐缓冲溶液(pH 7.4)将各条件下处理的TM样品配制为质量浓度500 ☒g/mL的溶液,在4 mL样品溶液中加入20 μL 5.0 mmol/L的ANS(10 mmol/L的磷酸盐溶解)溶液,混合均匀后室温放置反应1 h,在激发波长380 nm、发射波长400~650 nm条件下用荧光分光光度计进行光谱扫描。
1.3.4 间接酶联免疫吸附法检测TM的致敏性
根据Tong Ping等[27]的方法并作修改。采用间接酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测致敏性。将处理的TM用pH 9.6的Na2CO3/ NaHCO3缓冲液配制质量浓度为0.5 mg/mL的溶液,向酶标板中每孔加入100 μL,4 ℃条件下包被26 h。弃掉抗原稀释液,用PBST(1 000 mL pH 7.4的磷酸盐溶液中含1 mL吐温20)洗液洗板,拍干后每孔加入封闭液(含1%的牛血清白蛋白的PBST溶液)200 μL,37 ℃条件下保温2.5 h。弃去封闭液,用PBST洗液洗板,拍干。每孔加入100 μL抗体溶液(兔抗南美白对虾TM-IgG抗体,用封闭液1∶750稀释),37 ℃条件下孵育2 h。弃去孔中液体,用 PBST洗液洗板。每孔加100 μL二抗溶液(辣根过氧化物酶标记的羊抗兔IgG抗体用封闭液1∶1 000稀释),37 ℃条件下孵育1 h。弃去孔中液体,用PBST洗液洗板,拍干。每孔加入100 μL底物液(0.1 mol/L 柠檬酸4.86 mL,0.2 mol/L Na2HPO45.14 mL,加4 mg邻苯二胺,再加3% H2O250 μL),37 ℃条件下闭光放置15 min,然后每孔加入50 μL 2 mol/L H2SO4终止液。用酶标仪在492 nm波长处检测其OD492nm值。按照以下公式计算致敏性消减率。
1.4 数据统计分析
每次实验均进行3 次重复操作,所有实验数据采用SPSS 16.0统计软件对结果进行显著性分析,处理结果均以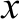 ±s表示,图表制作利用软件Origin 8.6和Excel 2007。
±s表示,图表制作利用软件Origin 8.6和Excel 2007。
2.1 超高压处理对TM致敏性的影响
2.1.1 处理压力对TM致敏性的影响
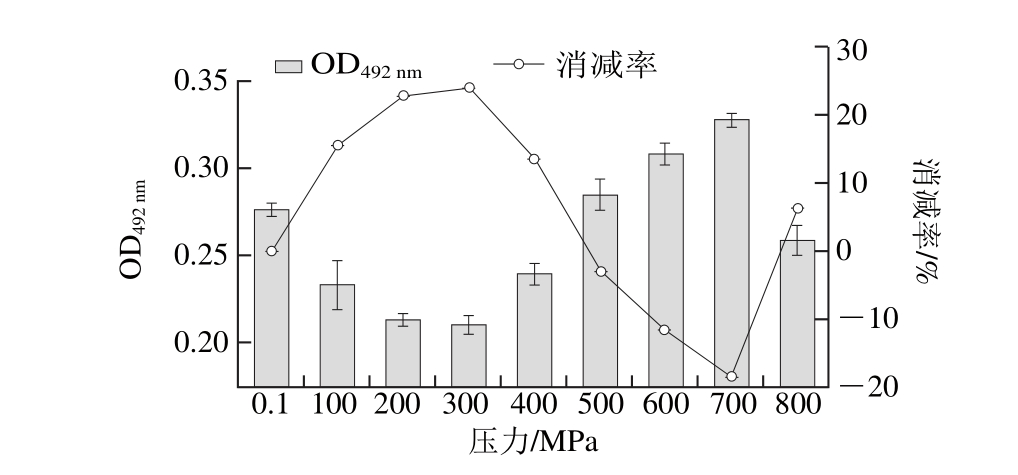
图1 在20 ℃不同压力下处理40 min对TM致敏性的影响
Fig. 1 Effects of different pressure treatments at 20 ℃ for 40 min on TM allergenicity
将TM在20 ℃、不同压力(0.1~800.0 MPa)条件下处理40 min,其致敏性变化见图1。与0.1 MPa处理的TM致敏性(OD492nm为0.276±0.004)相比,在100~300 MPa压力范围内,随着压力增加,TM致敏性逐渐降低,在300 MPa时最低,其OD492nm为0.210±0.005,致敏性消减率约为23.91%;当压力在300~700 MPa范围内,随着压力的升高,TM的致敏性逐渐增大,当压力为700 MPa时TM致敏性最高(OD492nm为0.328±0.004);当压力在700~800 MPa范围内,致敏性随压力升高,又逐渐降低,且在800 MPa时其致敏性低于对照组。该现象的原因,可能是由于在不同压力下,TM的抗原表位暴露程度发生变化,从而导致致敏性的变化[28-29]。
2.1.2 处理时间对TM致敏性的影响
TM在20 ℃、400 MPa条件下分别处理10、20、30、40 min,采用间接ELISA测定处理后TM的免疫原性,见图2。与对照组(OD492nm为0.276±0.004)比较,处理时间为20 min时TM免疫原性最低,其OD492nm为0.187±0.005,消减率约为32.73%。在10~20 min范围内,随着处理时间的延长,TM致敏性逐渐降低;在20~40 min范围内,随时间的延长,TM的致敏性逐渐升高。因此,处理时间能对虾TM的致敏性产生影响。

图2 20 ℃ 400 MPa条件下不同处理时间对TM致敏性的影响
Fig. 2 Effects of different treatment times at 20 ℃ and 400 MPa on TM allergenicity
2.1.3 处理温度对TM致敏性的影响
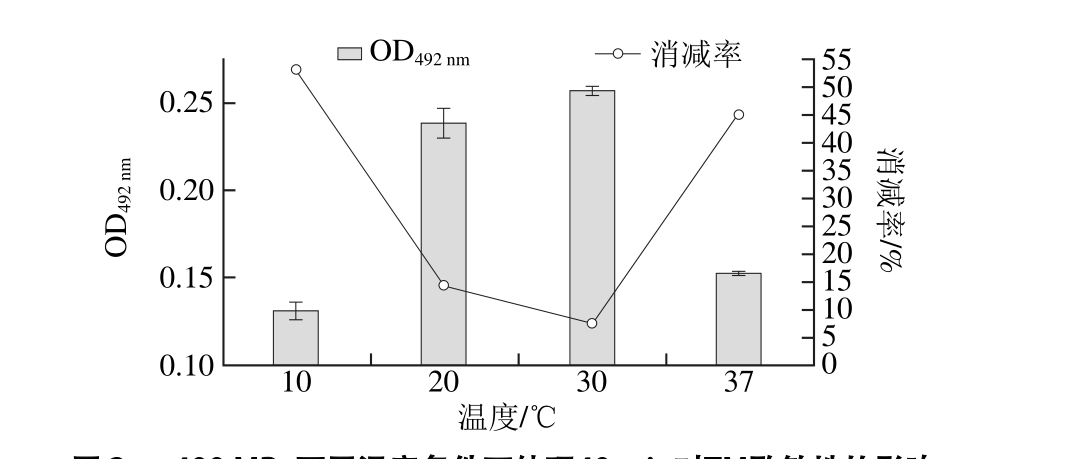
图3 400 MPa不同温度条件下处理40 min对TM致敏性的影响
Fig. 3 Effects of different temperatures at 400 MPa for 40 min on TM allergenicity
TM在400 MPa和不同温度(10、20、30 ℃和37 ℃)条件下处理40 min,其致敏性的变化如图3所示。采用压力为400 MPa处理40 min条件下,在10~30 ℃范围内,随着处理温度的升高TM致敏性呈升高趋势,10 ℃时,其致敏性最低(OD492nm为0.132±0.005),与未处理蛋白相比,致敏性消减率为52.6%,在30 ℃处理时其致敏性达到最高(OD492nm为0.258±0.002);当温度升高为37 ℃时其致敏性下降(OD492nm为0.152±0.001),与未处理相比,致敏性消减45.32%。该变化趋势体现了压力与温度对蛋白变性影响的复杂性,与Balny等[30]的研究结果相似。
2.2 超高压处理对TM二级结构的影响
2.2.1 压力对TM二级结构的影响
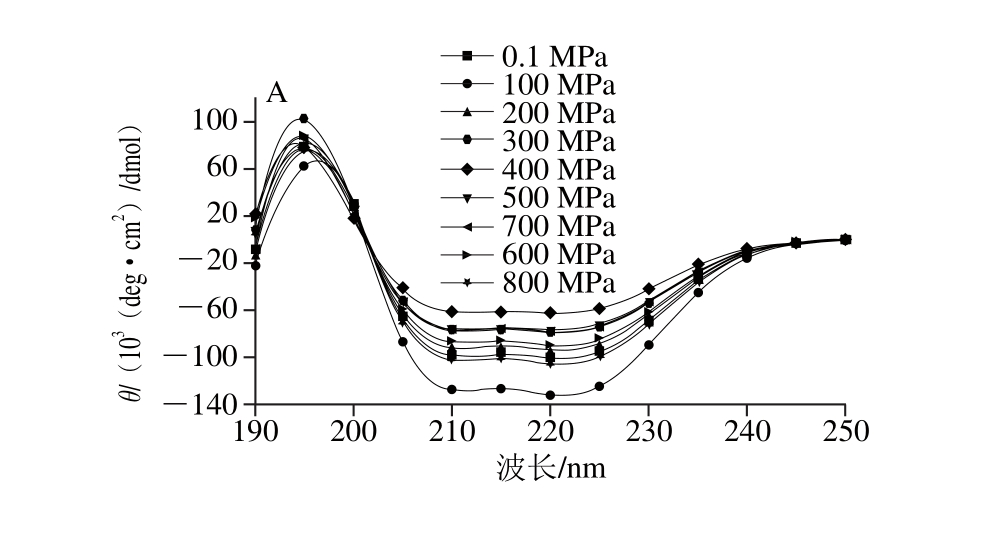
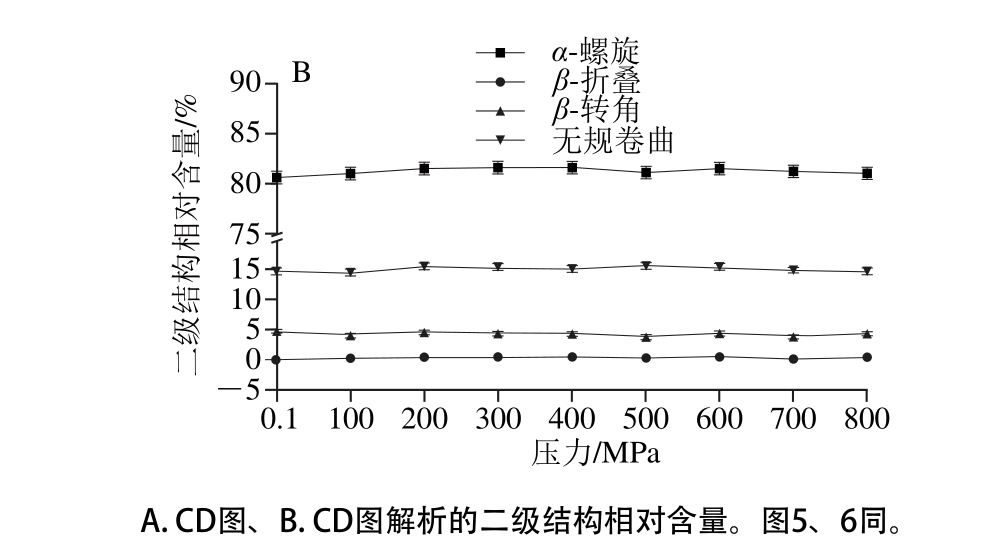
图4 不同压力条件下20 ℃处理40 min对虾TM蛋白二级结构的影响
Fig. 4 Effect of different pressure treatments for 40 min at 20 ℃ on secondary structure of TM
TM在不同压力(0.1~800 MPa)条件下20 ℃处理40 min,用CD远紫外光谱测定TM蛋白二级结构相对含量,通过Dichroweb在线分析软件分析计算二级结构相对含量(采用SELCON3算法)。根据未处理TM(0.1 MPa)CD谱图(图4)的特征,远紫外区(185~245 nm),在191~193 nm波长处有正吸收峰,在210 nm波长处和221~222 nm波长处分别有负吸收峰,属于典型的α-螺旋结构。在217~218 nm和195~197 nm波长处无明显吸收峰的存在,说明其β-折叠相对含量很小;在192.5 nm波长处无负吸收峰,在200~205 nm波长范围内,是正吸收和负吸收过渡范围,但无明显吸收峰的变化,并且在227 nm波长处无吸收峰,因此,β-转角的相对含量较少;在195~202 nm范围内,存在正吸收和负吸收的过渡,但无明显峰的变化,在230 nm波长处无明显负吸收峰,因此,无规卷曲的相对含量较少。根据Dichroweb在线分析软件分析计算,未处理TM的二级结构相对含量分别为:α-螺旋约占80.4%、β-折叠占0%、β-转角约占5.2%、无规卷曲约占14.4%。该结果与Jin Yafang等[31]测定Todarodes pacif i cus TM二级结构含量一致(α-螺旋约占81%,不规整二级结构约占19%);而与自优化预测法(self-optimized prediction method,SOPM)[12]预测其二级结构组成(α-螺旋约占95.07%、而β-折叠、β-转角以及无规卷曲结构相对含量分别为0.70%、1.76%、2.46%)的结果稍有差别。其原因可能时所有软件的差异。
经过不同压力(100~800 MPa)处理后,虽然光谱图有所变化,但图形趋势基本一致。在各波长下出峰的位置及结构没有变化(图4A),经过在线分析软件计算的各二级结构的相对含量(图4B)与对照组(0.1 MPa组)相比,无显著差异(P>0.05)。
2.2.2 保压时间对TM二级结构的影响
TM在20 ℃、400 MPa条件下分别处理10、20、30 min和40 min,其CD谱图及二级结构相对含量的变化见图5。与未处理TM(0.1 MPa)相比,经不同时间处理后TM的二级结构相对含量(图5B)无显著变化(P>0.05)。
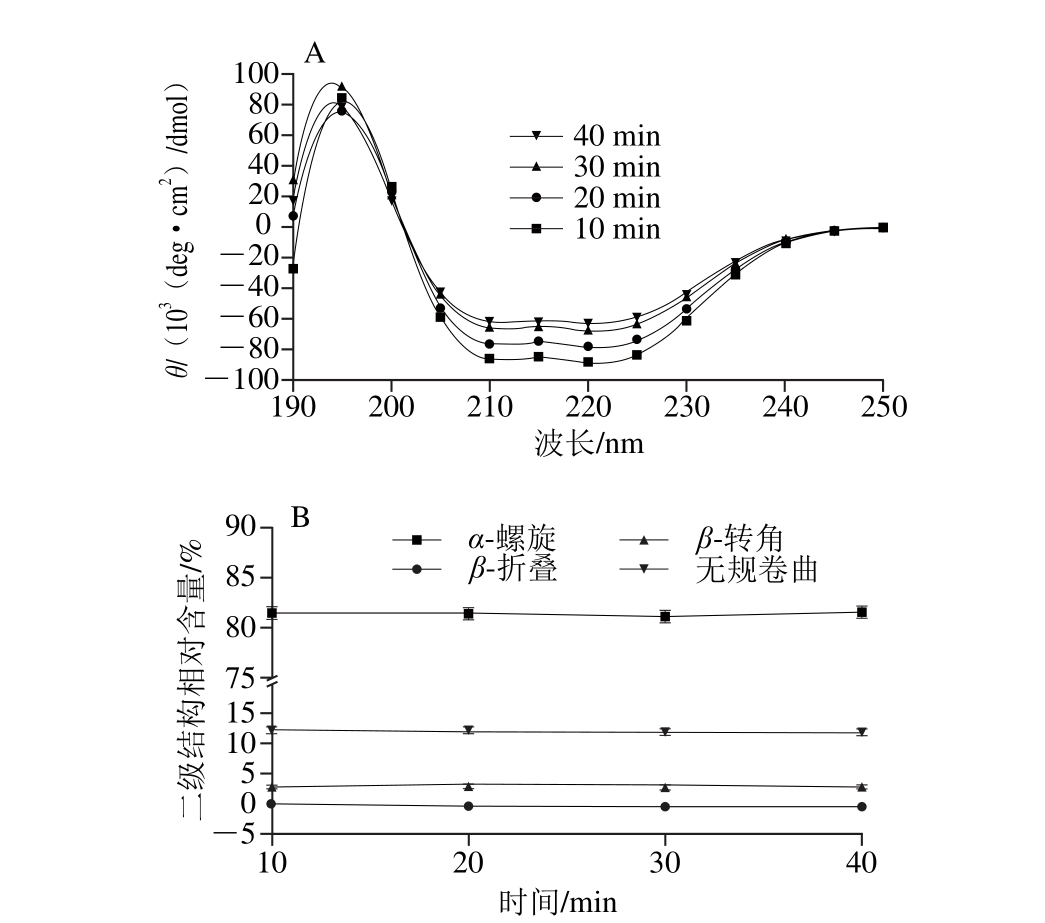
图5 在20 ℃ 400 MPa条件下处理不同时间对虾TM蛋白二级结构的影响
Fig. 5 Effect of different treatment times at 400 MPa and 20 ℃ on secondary structure of TM
2.2.3 处理温度对TM二级结构的影响
将TM在不同温度(10、20、30、37 ℃)条件下,400 MPa处理40 min,其CD谱图及二级结构相对含量的变化见图6。与对照组(0.1 MPa)相比,不同温度条件下处理的TM二级结构相对含量无显著变化(P>0.05)(图6B)。
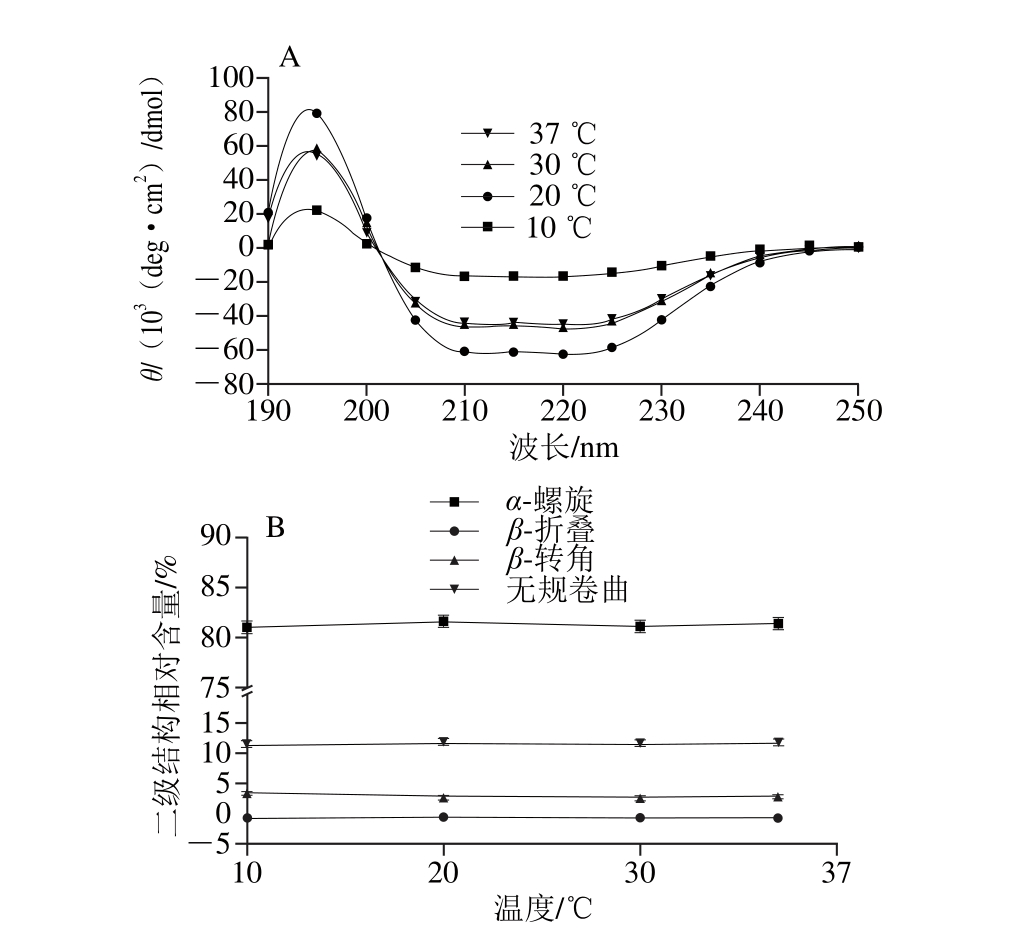
图6 不同温度、400 MPa条件下处理40 min对虾TM蛋白二级结构的影响
Fig. 6 Effect of different temperatures at 400 MPa for 40 min on TM secondary structure
因此,在不同的高压条件下处理凡纳滨对虾TM,其二级结构无显著变化。该结果与Nolwennig等[18]的研究结果一致,虽然其研究所用的TM是采用基因重组技术获得,但其结果表明TM的二级结构是相对稳定的。
由于不同高压条件下处理的TM二级结构无显著变化,而处理后TM的致敏性发生了显著变化(图1~3)。因此,可以推论,高压处理后TM致敏性的变化与其二级结构无关。
2.3 超高压处理TM氨基酸微环境的变化与致敏性关系
采用疏水荧光探剂ANS测定不同高压条件处理的TM的疏水性变化,表征高压条件处理后TM三级结构的变化。同时,与相同处理条件下TM致敏性进行比较,揭示二者的关系。
2.3.1 压力引发TM氨基酸微环境变化与致敏性的关系

图7 不同压力20 ℃条件下处理40 min对虾TM荧光强度的影响
Fig. 7 Effects of different pressure treatments at 20 ℃ for 40 min on fluorescence intensity of TM
在20 ℃不同压力(0.1~800 MPa)条件下处理40 min,TM荧光图谱和表面疏水性氨基酸的荧光强度变化如图7所示。与0.1 MPa处理样品相比,在100~300 MPa范围内,TM的荧光强度呈下降趋势,表明其表明疏水性氨基酸的数量逐渐减少;在300~700 MPa范围内,其荧光轻度呈上升趋势,只有压力大于600 MPa,其荧光强度才大于0.1 MPa的样品组,700 MPa达到最高;当压力在700~800 MPa范围内,其荧光强度呈下降趋势。因此,压力对TM的三级结构有影响;随着压力的变化,呈现较好的规律性。

图8 压力引发TM三级结构变化与致敏性的关系
Fig. 8 Relationship between tertiary structure changes of TM caused by ultra-high pressure and its allergenicity
不同压力处理后,TM的三级结构的变化与致敏性的关系见图8。在0.1~300 MPa范围内,随着压力的增大,致敏性随之减小,并且其荧光强度同样呈减小的趋势;在300~700 MPa范围内,随着压力的变化升高,其致敏性逐渐增大,700 MPa达到最高,而TM的荧光强度呈现同样的趋势。因此,在实验的压力范围内,TM的致敏性与其三级结构有关。
2.3.2 处理时间引发TM氨基酸微环境变化与致敏性的关系
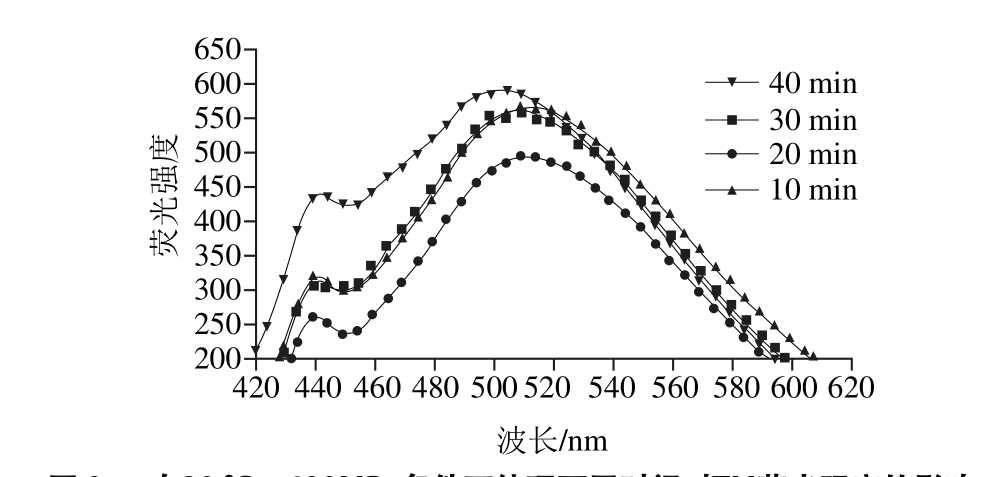
图9 在20 ℃、400MPa条件下处理不同时间对TM荧光强度的影响
Fig. 9 Effects of different treatment times at 400 MPa and 20 ℃ on fluorescence intensity of TM
在20 ℃、400 MPa条件下,分别处理10、20、30、40 min,TM的荧光强度变化见图9。当处理时间在10~20 min范围,随着处理时间的延长,荧光强度从559.3±8.4下降至494.5±7.4,表明其疏水性氨基酸数量逐渐减少;当处理时间在20~40 min范围,随时间延长,荧光强度呈增强趋势(从494.5±7.4增至595.5±6.8);在20 min时荧光强度最低。因此,处理时间对TM的三级结构有影响。

图10 处理时间引发TM三级结构变化与致敏性的关系
Fig. 10 Relationship between tertiary structure changes of TM at different treatment times and its allergenicity
处理不同时间后TM的三级结构与相同条件下处理TM的致敏性的关系见图10。在实验的时间范围内,TM三级结构变化与其致敏性的强弱呈现相同的趋势。因此,TM的致敏性与三级结构有关。
2.3.3 处理温度引发TM氨基酸微环境变化与致敏性的关系
在400 MPa和不同温度(10、20、30、37 ℃)条件下,处理40 min,TM的荧光强度变化如图11所示。当温度在10~30 ℃范围内,其荧光强度随着温度提高而增强(468.4±5.5增至604.5±6.9);当温度在30~37 ℃范围内,其荧光轻度随温度升高而降低。因此,处理温度对TM的三级结构有影响。
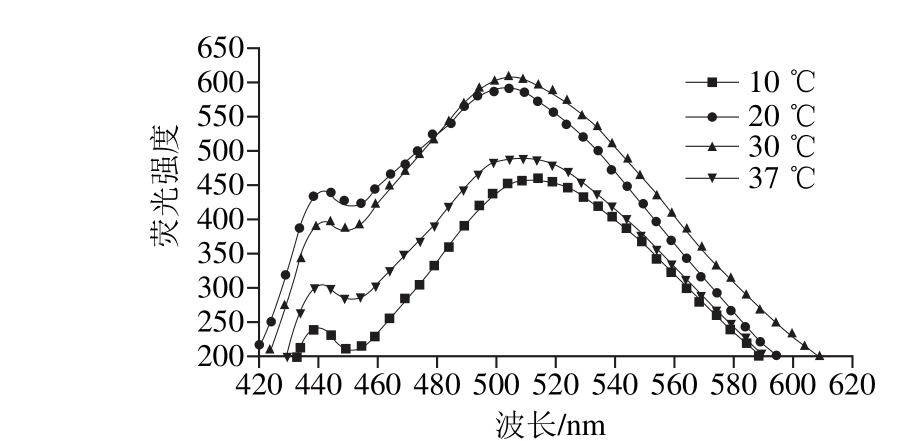
图11 在400 MPa不同温度条件下处理40 min对TM荧光强度的影响
Fig. 11 Effects of different temperatures at 400 MPa for 40 min on fluorescence intensity of TM

图12 处理温度引发TM三级结构变化与致敏性的关系
Fig. 12 Relationship between tertiary structure changes of TM induced by different temperatures and its allergenicity
在不同温度条件下处理的TM三级结构变化与致敏性的关系见图12。在实验的温度范围内,TM的三级结构与致敏性的变化趋势一致。因此,TM的致敏性与其三级结构有关。
因此,综合各高压条件氨基酸微环境的变化,处理压力、时间及温度均对TM的三级结构产生影响。该影响可能与TM具有较高的可塑性区域比例[13-14]有关。另外,TM的致敏性与三级结构有关。
不同超高压条件(压力、温度、时间)下处理凡纳滨对虾的TM,能够引发其致敏性和三级结构的变化,而对二级结构无影响。各高压条件下TM致敏性的变化与其三级结构的改变存在显著的相关性,而与二级结构无关。
参考文献:
[1] 王锡荣, 肖光明, 文乐元. 南美白对虾[J]. 湖南农业, 2008(7): 33.
[2] BURKS A, TANG M, SICHERER S, et al. ICON: food allergy[J]. Journal of Allergy and Clinical Immunology, 2012, 129(4): 906-920. DOI:10.1016/j.jaci.2012.02.001.
[3] LOPATA A L, O’HEHIR R E, LEHRER S B. Shellfish allergy[J]. Clinical and Experimental Allergy, 2010, 40(6): 850-858. DOI:10.1111/ j. 365-2222.2010.03513.x.
[4] LIN H, ZHENG L, LI Z, et al. Identification of the major allergen in greasy-back shrimp (Metapenaeus ensis) by MALDI-TOFMS[J]. Journal of Ocean University of China, 2010, 9(2): 178-184. DOI:10.1007/s11802-010-0178-6.
[5] DAUL C B, MORGA J E N, LEHRER S B. Hypersensitivity reactions to crustacea and mollusks[J]. Clinical Reviews in Allergy, 1993, 11(2): 201-222. DOI:10.1007/BF02914471.
[6] MOTOYAMA K, SUMA Y, ISHIZAKI S, et al. Identification of tropomyosins as major allergens in antarctic krill and mantis shrimp and their amino acid sequence characteristics[J]. Marine Biotechnology, 2008, 10: 709-718. DOI:10.1007/s10126-008-9109-6.
[7] LEUNG P S, CHU K H, CHOW W K, et al. Cloning, expression, and primary structure of Metapenaeus ensis tropomyosin, the major heatstable shrimp allergen[J]. Journal of Allergy and Clinical Immunology, 1994, 94(5): 882-888. DOI:10.1016/0091-6749(94)90156-2.
[8] ANAS M, ABDEL R, SANDIP K, et al. Analysis of the allergenic proteins in black tiger prawn (Penaeus monodon) and characterization of the major allergen tropomyosin using mass spectrometry[J]. Rapid Communication in Mass Spectrometry, 2010, 24(16): 2462-2470. DOI:10.1002/rcm.4664.
[9] YADZIR Z H M, MISNAN R, ABDULLAH N, et al. Identification of the major allergen of Macrobrachium rosenbergii (giant freshwater prawn)[J]. Asian PacificJournal of Tropical Biomedicine, 2012, 2(1): 50-54. DOI:10.1016/S2221-1691(11) 60189-5.
[10] LEHRER S B, AYUSO R, REESE G. Seafood allergy and allergens: a review[J]. Marine Biotechnology, 2003, 5(4): 339-348. DOI:10.1007/ s10126-002-0082-1.
[11] ROSMILAH M, SHAHNAZ M, ZAILATUL H M Y, et al. Identification of tropomyosin and arginine kinase as major allergens of Portunus pelagicus (blue swimming crab)[J]. Tropical Biomedicine, 2012, 29(3): 467-478.
[12] LYON G P. Póle bioinformatique lyonnais network protein sequence analysis[EB/OL]. [2013-11-26]. http://npsa-pbil.ibcp.fr/cgi-bin/npsa_ automat.pl?page=/NPSA/npsa_sopm.html.
[13] 郑礼娜. 虾类过敏原的活性分析及其抗原表位的研究[D]. 青岛: 中国海洋大学, 2011: 42-65.
[14] 沈海旺, 陈亨莉, 曹敏杰, 等. 甲壳类动物4 种过敏原的序列分析, 抗原表位预测及三维结构建模[J]. 免疫学杂志, 2012, 28(7): 613-619. DOI:10.13431/j.cnki.immunol.j.20120143.
[15] TALBOT J A, HODGES R S. Tropomyosin: a model protein for studying coiled-coil and .alpha.-helix stabilization[J]. Accounts of Chemical Research, 1982, 15(7): 224-230.
[16] MORAIS A C, FERREIRA S T. Folding and stability of a coiledcoil investigated using chemical and physical denaturing agents: comparative analysis of polymerized and non-polymerized forms of α-tropomyosin[J]. The International Journal of Biochemistry and Cell Biology, 2005, 37(7): 1386-1395. DOI:10.1016/j.biocel.2005.01.008.
[17] SEN M, KOPPER R, PONS L, et al. Protein structure plays a critical role in peanut allergen stability and may determine immunodominant IgE-binding epitopes[J]. The Journal of Immunology, 2002, 169(2): 882-887. DOI:10.4049/jimmunol.169.2.882.
[18] NOLWENNIG R, JEAN R, G☒RARD D. Development of high hydrostatic pressure in biosciences: pressure effect on biological structures and potential applications in Biotechnologies[J]. Biotechnology Advances, 2010, 28(6): 659-672. DOI:10.1016/ j.biotechadv.2010.04.001.
[19] LULLIEN-PELLERIN V, BALNY C. High-pressure as a tool to study some proteins’ properties: conformational modification, activity and oligomeric dissociation[J]. Innovative Food Science and Emerging Technologies, 2002, 3(3): 209-221. DOI:10.1016/S1466-8564(02)00045-0.
[20] RIVALAIN N, ROQUAIN J, DEMAZEAU G. Development of high hydrostatic pressure in biosciences: pressure effect on biological structures and potential applications in biotechnologies[J]. Biotechnology Advances, 2010, 28(6): 659-672. DOI:10.1016/ j.biotechadv.2010.04.001.
[21] PENAS E, RESTANI P, BALLABIO C, et al. Assessment of the residual immunoreactivity of soybean whey hydrolysates obtained by combined enzymatic proteolysis and high pressure[J]. European Food Research and Technology, 2006, 222(3): 286-290. DOI:10.1007/ s00217-005-0108-9.
[22] PENAS E, PR☒STAMO G, POLO F, et al. Enzymatic proteolysis, under high pressure of soybean whey: analysis of peptides and the allergen Gly m 1 in the hydrolysates[J]. Food Chemistry, 2006, 99(3): 569-573. DOI:10.1016/j.foodchem.2005.08.028.
[23] HUSBAND F A, ALDICK T, van der PLANCKEN I, et al. High pressure treatment reduces the allergenicity of the major allergens in apple and celeriac[J]. Molecular and Nutrition and Food Research, 2011, 55(7): 1087-1095. DOI:10.1002/mnfr.201000566.
[24] YAMAMOTO S, MIKAMI N, MATSUNO M, et al. Effects of a highpressure treatment on bovine gamma globulin and its reduction in allergenicity[J]. Bioscience, Biotechnology, and Biochemistry, 2010, 74(3): 525-530. DOI:10.1271/bbb.90715.
[25] TANG C H, SUN X. A comparative study of physicochemical and conformational properties in three vicilins from Phaseolus legumes: implications for the structure-function relationship[J]. Food Hydrocolloids, 2011, 25(3): 313-324. DOI:10.1016/jfoodhyd.2010.06.009.
[26] WANG Xiansheng, TANG Chuanhe, LI Biansheng, et al. Effects of high-pressure treatment on some physicochemical and functional properties of soy protein isolates[J]. Food Hydrocolloids, 2008, 22(4): 560-567. DOI:10.106/j.foodhyd.2007.01.027.
[27] TONG Ping, GAO Jinyan, CHEN Hongbing, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610.
[28] 董晓颖, 高美须, 潘家荣, 等. 不同处理方法对虾过敏蛋白分子量及抗原性的影响[J]. 核农学报, 2010, 24(3): 548-554.
[29] LI H, ZHU K, ZHOU H, et al. Effects of high hydrostatic pressure treatment on allergenicity and structural properties of soybean protein isolate for infant formula[J]. Food Chemistry, 2012, 132(2): 808-814. DOI:10.1016/j.foodchem.2011.11.040.
[30] BALNY C, MOZHAEV V V, LANGE R. Hydrostatic pressure and proteins: basic concepts and new data[J]. Comparative Biochemistry and Physiology, 1997, 116(4): 299-304. DOI:10.1016/S0300-9629(96)00355-6.
[31] JIN Yafang, DENG Yun, QIAN Bingjun, et al. Allergenic response to squid (Todarodes pacificus) tropomyosin Tod p1 structure modifications induced by high hydrostatic pressure[J]. Food and Chemical Toxicology, 2015, 76(12): 86-93. DOI:10.1016/ j.fct.2014.12.002.
Relationship between Conformational Changes Caused by Ultra-high Pressure and Allergenicity of Shrimp Tropomyosin
HU Zhihe, WANG Xingxuan, ZHANG Qingqing, WU Zijian, XUE Lu, JIA Ying
(Tianjin Key Laboratory of Food Biotechnology, School of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Abstract:The objective of this work was to research the relationship between the conformational changes and allergenicity of tropomyosin (TM) from the white shrimp Litopenaeus vannamei after ultra-high pressure. TM was treated under different conditions of pressure (0.1–800.0 MPa), holding time (10–40 min) and temperature (10–37 ℃) and then tested for changes in it secondary and tertiary structures and allergenicity by circular dichroism spectrum (CD), fluorospectrophotometry and indirect enzyme linked immunosorbent assay (ELISA), respetively. Results showed that both the allergenicity and tertiary structure rather than the secondary structure of TM were changed under different high pressure conditions. There was a significant correlation between the changes in the allergenicity and tertiary structure of TM under different high pressure conditions. In the pressure range tested, the number of surface-exposed hydrophobic amino acids was the lowest at 20 ℃, 40 min, 300 MPa while achieving minimal allergenicity (OD492nmwas 0.210 ± 0.005), and the largest number of exposed hydrophobic amino acids and the maximal allergenicity (OD492nmwas 0.328 ± 0.004) were observed at 700 MPa. Therefore, the allergenicity of TM was related to its tertiary structure but not its secondary structure.
Key words:Litopenaeus vannamei; tropomyosin; ultra-high prssure treatment; protein conformation; allergenicity
DOI:10.7506/spkx1002-6630-201711006
中图分类号:TS254
文献标志码:A
文章编号:1002-6630(2017)11-0033-07
引文格式:
胡志和, 王星璇, 张晴青, 等. 高压处理诱发虾原肌球蛋白结构变化与致敏性的关系[J]. 食品科学, 2017, 38(11): 33-39. DOI:10.7506/spkx1002-6630-201711006. http://www.spkx.net.cn
HU Zhihe, WANG Xingxuan, ZHANG Qingqing, et al. Relationship between conformational changes caused by ultra-high pressure and allergenicity of shrimp tropomyosin[J]. Food Science, 2017, 38(11): 33-39. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711006. http://www.spkx.net.cn
收稿日期:2016-10-27
基金项目:国家自然科学基金面上项目(31271841);天津市高等学校创新团队项目(TD12-5049)
作者简介:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn