蔡路昀1,2,马 帅2,曹爱玲3,李秀霞2,张宇昊1,赵国华1,赵元晖4,林 洪4,励建荣2,*
(1.西南大学食品科学学院,重庆 400715;2.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁省食品安全重点实验室,辽宁 锦州 121013;3.萧山出入境检验检疫局,浙江 杭州 311208;4.中国海洋大学食品科学与工程学院,山东 青岛 266100)
摘要:以新鲜的鲽鱼黑皮和白皮为研究对象,从其中提取酸溶性胶原蛋白(acid-soluble collagens,ASC),并对其理化性质和乳化活性及乳化稳定性进行比较研究,为鲽鱼皮的开发利用提供一定的理论依据。通过傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)技术和扫描电子显微镜(scanning electron microscopy,SEM)初步研究了黑皮和白皮ASC的结构特征;同时对其溶解性、流变学特性、等电点、乳化活性指数(emulsifying activity index,EAI)及乳化稳定性指数(emulsifying stability index,ESI)进行了研究。FTIR扫描结果表明,黑皮和白皮ASC都存在酰胺A、酰胺B、酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ,均保持了胶原蛋白三维螺旋结构的完整性;SEM观察结果表明,黑皮和白皮ASC均呈现多空的网络结构,且分布比较均匀,说明酸法提取胶原蛋白的过程基本上保留了胶原纤维原有的空间网状结构。EAI及ESI结果表明,黑皮ASC的EAI明显低于白皮ASC(P<0.05),分别为(2.60±0.53)、(7.30±0.41) m2/g,而黑皮ASC的ESI明显高于白皮ASC(P<0.05),分别为(49.12±5.18)、(27.56±4.91) min。以上结果显示,从黑皮和白皮中提取的ASC的理化性质和功能特性存在一定的差异。
关键词:鲽鱼;鱼皮;酸溶性胶原蛋白;提取;理化特性
蔡路昀, 马帅, 曹爱玲, 等. 不同部位鲽鱼皮酸溶性胶原蛋白的提取及其特性[J]. 食品科学, 2017, 38(11): 52-58. DOI:10.7506/spkx1002-6630-201711009. http://www.spkx.net.cn
CAI Luyun, MA Shuai, CAO Ailing, et al. Extraction and characterization of collagens from different skins of flounder (Pleuronichthys cornutus)[J]. Food Science, 2017, 38(11): 52-58. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711009. http://www.spkx.net.cn
鲽鱼(Pleuronichthys coconuts)又称比目鱼(Pleuronectiformes),属鲆鲽类,是一种深海鱼,主要产于温带及寒带海域,是我国北方海域的主要经济鱼种之一,也是我国海水鱼养殖种类中重要的组成部分[1]。因其肉质细腻鲜美、口感鲜嫩、营养丰富等特点,一直被作为高档鱼种深受消费者的青睐[2]。然而,在鲽鱼加工过程中,由于缺乏相应的精深加工技术,会产生大量的鱼皮等加工副产物,约占鱼体质量的50%~70%左右,这些加工副产物往往被直接丢弃或低价卖给鱼粉加工厂,不仅造成了严重的环境污染和资源浪费,而且有效利用率较低。因此利用鲽鱼皮生产鱼胶原蛋白不仅可以有效地避免环境污染和资源浪费的问题,还可以开发出高附加值的产品,这就为鱼类胶原蛋白产品提供了更广阔的市场前景和发展空间,促进了鲽鱼产业的健康可持续发展。
胶原蛋白(collagen)是动物体内分布最广、含量最丰富的一种糖蛋白,由3 条α-肽链相互缠绕而形成的螺旋结构的纤维状蛋白[3],目前,胶原蛋白在诸多行业中都有广泛的应用[4-5]。然而,近年来牛海绵状脑病、传染性海绵状脑病及口蹄病的爆发引起了人们对陆源胶原蛋白及其衍生产品安全性的担忧[6]。新的、安全的胶原蛋白资源开发利用是当前要解决的首要问题。近年来,鱼胶原蛋白因其来源广、低抗原性、低过敏性和使用安全等特点深受研究者的广泛关注。鱼胶原蛋白逐渐替代了传统的胶原蛋白,为鱼类加工副产物的高值化利用提供了一条新的途径,具有重要的经济价值和理论意义。
近年来,对鱼类加工副产物的开发利用已成为研究热点之一,而目前国内关于鲽鱼皮胶原蛋白的研究鲜有报道。本实验以新鲜的鲽鱼黑皮和白皮为研究对象,采用酸法从其中提取胶原蛋白,得到黑皮和白皮酸溶性胶原蛋白(acid-soluble collagens,ASC),探讨其黑皮和白皮ASC的理化性质及功能特性是否存在显著的差异,以期为后续鲽鱼皮酸溶性胶原蛋白的深入研究提供了一定的参考,为鲽鱼皮综合利用及高值化产品的开发提供理论和科研依据。
1.1 材料与试剂
新鲜鲽鱼,由大连天宝绿色食品股份有限公司提供,规格一致,每条鱼质量为(1 500±50) g。
NaOH、正丁醇、冰乙酸、NaCl、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴化钾(均为分析纯) 锦州国药器化玻有限公司;考马斯亮蓝R-250(优级纯) 美国BioBasic公司。
1.2 仪器与设备
PL602-L电子天平 梅特勒-托利多仪器(上海)有限公司;Milli-Q超纯水系统 美国Millipore公司;Biofuge stratos台式高速冷冻离心机 美国Thermo公司;Free Zone2.5真空冷冻干燥机 美国Labconco公司;Scimitar2000傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Agilent公司;S-4800场发射扫描电子显微镜(scanning electron microscopy,SEM) 日本日立公司;QWWJ-200全无油静音空压机 上海曲晨机电技术有限公司;DHR-1流变仪 美国TA公司;DDSJ-308A电导率仪 上海精密科学仪器有限公司;T25 Digital Ultra-Turrak均质机德国IKA公司;DF-101S集热式恒温加热磁力搅拌器郑州长城科工贸有限公司。
1.3 方法
1.3.1 鲽鱼黑皮和白皮的制备
将新鲜的鲽鱼采用击晕处死→在冰上分别取下黑皮和白皮,剔除鱼皮上残留的碎肉和鱼鳞等杂质→用超纯水冲洗干净→用剪刀剪成0.5 cm×0.5 cm大小,在-20 ℃条件下贮藏、备用。
1.3.2 鲽鱼黑皮和白皮的预处理
取一定量的鱼皮,先用超纯水冲洗3 次,除去鱼皮上残留的杂质。4 ℃条件下,以料液比1∶10(m/V)加入0.1 mol/L的NaOH溶液搅拌浸泡24 h(NaOH溶液每6 h更换一次),除去鱼皮中非胶原蛋白和色素,然后用冰水冲洗鱼皮至中性,充分沥干后,以料液比1∶30(m/V)加入体积分数10%正丁醇溶液搅拌浸泡24 h(正丁醇溶液每6 h更换一次),以除去脂肪,然后用冰水冲洗鱼皮至中性,充分沥干,备用。
1.3.3 鲽鱼黑皮和白皮ASC的提取
分别取经过预处理的鲽鱼黑皮和白皮,以料液比1∶30(m/V)加入0.5 mol/L的冰乙酸溶液,在4 ℃低速搅拌24 h,4 ℃条件下10 000 r/min离心15 min,取上清液;将未提取彻底的鱼皮再次用等量的0.5 mol/L冰乙酸溶液提取。用冰乙酸溶液提取3 次后,混合上清液,加入一定量NaCl溶液搅拌,至最终盐浓度为0.9 mol/L。静置过夜,4 ℃条件下5 000 r/min离心20 min后弃上清液。将沉淀溶于0.5 mol/L冰乙酸溶液,8 000 r/min离心20 min除去不溶性杂质。经3 次盐析后,将沉淀先用0.1 mol/L的冰乙酸溶液透析过夜,每6 h换一次透析液,再用超纯水进行透析,每6 h换一次超纯水。直到透析液中不存在银离子时,停止透析。最后对透析过的胶原蛋白溶液进行冷冻干燥,分别得到黑皮和白皮ASC。
1.3.4 黑皮和白皮ASC的FTIR分析
参考Chen Junde等[7]的方法稍作修改,分别取适量干燥的黑皮和白皮ASC样品与一定量的KBr于玛瑙研钵中研磨均匀,装样,手动压片,取出样品迅速小心放入样品室,用Scimitar2000 FTIR仪在4 000~500 cm-1范围内进行检测,分辨率为0.5 cm-1。
1.3.5 黑皮和白皮ASC的SEM观察
参考Tamilmozhi等[8]的方法,分别将黑皮和白皮ASC样品用体积分数2.5%戊二醛溶液固定24 h,取出后采用0.2 mol/L的磷酸盐缓冲液(pH 6.8)漂洗3 次,每次10 min,然后分别用50%、60%、70%、80%、90%、100%乙醇梯度洗脱,每次10 min,结束后采用冷冻干燥机真空干燥,然后离子溅射镀金,最后在3.0 kV电压下放大1 000 倍观察胶原蛋白的表面结构状态。
1.3.6 黑皮和白皮ASC的溶解性测定
参考Zeng Shaokui等[9]的方法稍作修改,分别取适量干燥的黑皮和白皮ASC样品,用0.5 mol/L冰乙酸溶液配成质量浓度为3.00 mg/mL的ASC溶液,4 ℃溶解24 h,离心(8 000 r/min,6 min,4 ℃),取上清液测定胶原蛋白含量。按式(1)计算相对溶解度。
1.3.6.1 pH值对ASC溶解性的影响
分别取8 mL黑皮和白皮ASC溶液(质量浓度为3 mg/mL,溶于0.5 mol/L冰乙酸溶液)分别放入10 mL离心管中,用6 mol/L NaOH或6 mol/L HCl溶液调pH 1~10,溶液用超纯水(已调到与溶液pH值一致)定容至10 mL,充分混匀后在4 ℃条件下10 000 r/min离心30 min,计算上清液蛋白质的含量(双缩脲法)。考马斯亮蓝G-250测定上清液中蛋白质含量,用牛血清白蛋白作标准曲线,按式(2)计算ASC的相对溶解度(R),以pH值为横坐标,相对溶解度为纵坐标作溶解性曲线[10]。
式中:ρpH为不同pH值条件下蛋白质的含量/(mg/mL);ρpHmax为pH值变化时蛋白质的最大溶解量/(mg/mL)。1.3.6.2 NaCl质量浓度对ASC溶解度的影响
分别取5 mL黑皮和白皮ASC溶液(质量浓度为5 mg/mL,溶于0.5 mol/L冰乙酸溶液)放入10 mL离心管中,与5 mL NaCl溶液(溶于0.5 mol/L冰乙酸溶液中,质量浓度分别为0、1、2、3、4、5、6 g/100 mL)充分混合,混合液在4 ℃条件下静置30 min后在4℃、10 000 r/min离心30 min,上清液中蛋白质含量的测定方法同1.3.6.1节,按式(3)计算ASC的相对溶解度。以NaCl质量浓度为横坐标,相对溶解度(R)为纵坐标作溶解性曲线。
式中:ρNaCl为不同NaCl质量浓度条件下蛋白质的含量/(mg/mL);ρNaClmax为NaCl质量浓度变化时蛋白质的最大溶解量/(mg/mL)。
1.3.7 黑皮和白皮ASC溶液的流变学特性
参考闫鸣艳[11]、张强[12]等的方法稍作修改,取适量干燥的黑皮和白皮ASC溶于0.5 mol/L冰乙酸溶液中,配制成质量分数为0.3%的胶原蛋白溶液。在20 ℃条件下,采用DHR-1流变仪测定胶原蛋白溶液的流变学曲线。测定条件:40 mm;2°椎板;在振荡模式下,采用频率扫描的数据获取模式,剪切频率扫描范围为0.1~10.0 Hz;变量扫描为线性模式,采集33 个变量点,控制变量为形变率(30%)。研究胶原蛋白溶液的储能模量G’(弹性模量)、损耗模量G”(黏性模量)随着剪切频率的变化规律。
1.3.8 黑皮和白皮ASC的等电点测定
称取适量干燥的黑皮和白皮ASC样品用超纯水配成5 mg/mL溶液,用0.01 mol/L盐酸和0.01 mol/L NaOH调节溶液pH值,同时用DDSJ-308A电导率仪测定样品在不同pH值下的电导率值,根据蛋白质在等电点时电导率值最低的原理确定溶液的等电点[13]。
1.3.9 黑皮和白皮ASC的乳化活性和乳化稳定性测定
参考Pearce等[14]的方法稍作修改,采用浊度法测定黑皮和白皮ASC的乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)。将3.0 mL大豆色拉油和9.0 mL(10 mg/mL)黑皮和白皮ASC溶液放入直径为2.5 cm的塑料离心管中用匀浆机高速匀浆1 min,立即从距离心管底0.5 cm的地方取匀浆液100 μL(剩下的匀浆备用),加入到5 mL 0.1% SDS溶液中,振荡混匀后用紫外分光光度计在500 nm波长处测定吸光度记作A0,匀浆后10 min再次在相同位置取匀浆液100 μL,加入到5 mL 0.1% SDS溶液中,振荡混匀后测定吸光度记作A10,用0.1% SDS溶液作空白对照。黑皮和白皮ASC样品的EAI与ESI按公式(4)、(5)计算。
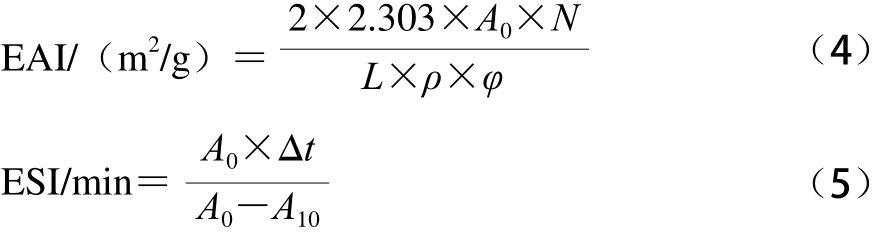
式中:A0为0 min的吸光度;A10为乳化液10 min后测定的吸光度;L为比色皿光径0.01 m;N为稀释倍数50;ρ为乳化前胶原蛋白质量浓度/(g/m3);φ是乳化液中油的体积分数(0.25);Δt为10 min。
1.4 数据处理
每个实验均重复3 次,采用Excel 2003软件及Origin 8.5软件进行数据统计分析与作图;采用SPSS Statistics 19.0软件分析差异显著性。
2.1 黑皮和白皮ASC的FTIR分析
表1 鲽鱼黑皮和白皮ASC出峰位置及FTIR图谱解析
Table 1 Peak positions and FTIR analysis of acid-soluble collagens from black and white skin of flounder
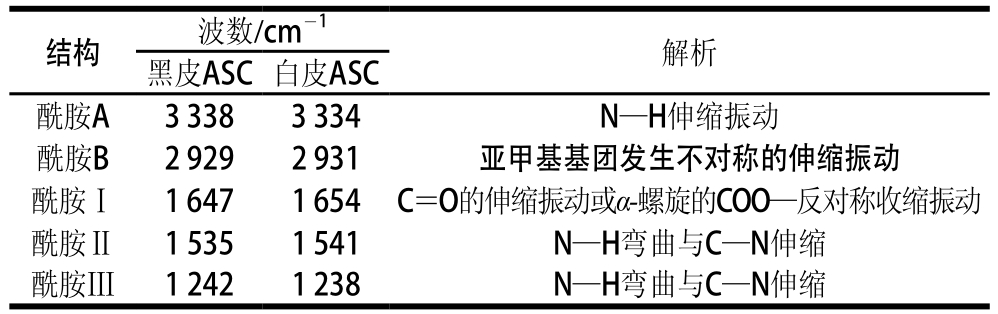
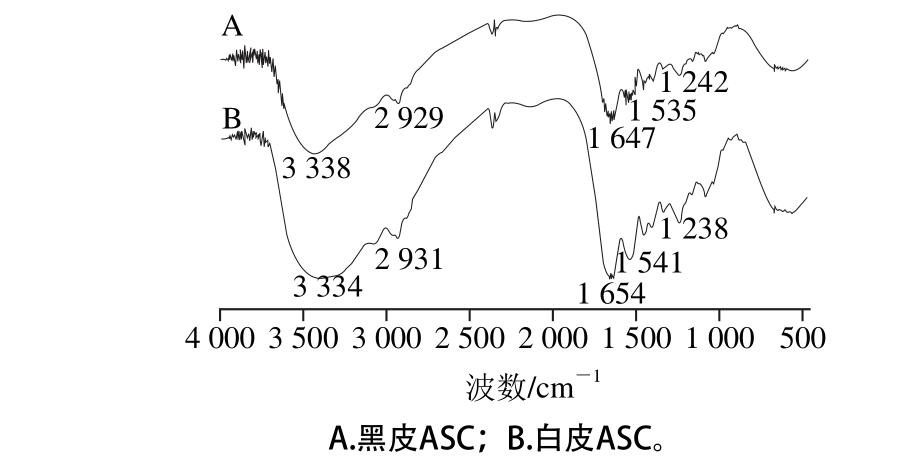
图1 鲽鱼黑皮和白皮ASC的FTIR图
Fig. 1 Infrared spectra of acid-soluble collagens from black and white skin of flounder
由表1和图1可知,黑皮和白皮ASC的FTIR图基本一致,由此说明黑皮和白皮ASC的结构很相似。酰胺A与N—H基团的伸缩振动有关,其中在红外光谱中N—H基团伸缩振动所产生的酰胺A的吸收峰往往在3 400~3 440 cm-1,然而,当含有N—H基团的分子肽段参与氢键的形成时,N—H的伸缩振动会向低频率移动,使N—H的伸缩振动产生的吸收峰减低到3 300 cm-1左右[15]。由表1和图1可知,黑皮和白皮ASC酰胺A的吸收峰分别位于3 338、3 334 cm-1处,均符合酰胺A的特征吸收,由此说明黑皮和白皮ASC分子中均存在氢键。而由于蛋白质分子的亚甲基基团会发生不对称的伸缩振动,使得酰胺B的吸收峰出现在3 080 cm-1附近[16],从表1和图1可知,黑皮和白皮ASC酰胺B的吸收峰分别在2 929、2 931 cm-1。在蛋白质分子中,氨基酸之间存在着大量的肽键,且因C=O键的伸缩振动导致了酰胺Ⅰ带的特征吸收峰位于1 600~1 700 cm-1之间[17],酰胺Ⅰ带为蛋白质二级结构变化的敏感区,常被用于蛋白质二级结构的分析。通过FTIR分析可知,黑皮和白皮ASC酰胺Ⅰ带的特征吸收峰分别在1 647、1 654 cm-1处,该结果均符合酰胺Ⅰ带的出峰位置。从已有的胶原蛋白分子中可知,胶原蛋白酰胺Ⅱ带的吸收峰往往处在1 500~1 600 cm-1范围内[18]。由图1可知,黑皮和白皮ASC分别在1 535、1 541 cm-1处有明显的吸收峰,由此说明该吸收区为酰胺Ⅱ带。和酰胺Ⅰ带一样,酰胺Ⅱ带也是由α-螺旋、β-折叠、转角和无规卷曲叠加共同作用所产生的吸收带。一般来说,酰胺Ⅲ带的存在可以说明胶原蛋白的三维螺旋结构能否保持完整,且其吸收峰往往在1 200~1 300 cm-1处[19]。由表1和图1可知,黑皮和白皮ASC分别在1 242、1 238 cm-1处有明显的吸收峰,这表明鲽鱼黑皮和白皮ASC均存在酰胺Ⅲ带,说明酸法提取胶原蛋白保持了胶原蛋白三维螺旋结构的完整性。
2.2 黑皮和白皮ASC的SEM图像

图2 黑皮(A)和白皮(B)ASC的SEM图像
Fig. 2 Scanning electron micrographs of black (A) and white (B) skin acid-soluble collagens
Zuber等[20]研究表明,胶原蛋白的微观结构是其作为生物医学材料的重要参数。黑皮和白皮ASC在放大1 000 倍时的SEM图如图2所示,从肉眼来看,黑皮和白皮ASC样品均呈白色、质地柔软、类似海绵状状态;经SEM放大1 000 倍后发现这两种胶原蛋白样品均呈现多空的网络结构、表面粗糙、有褶皱现象且分布比较均匀,说明酸法提取胶原蛋白的过程基本上保留了胶原纤维原有的空间网状结构,比较适合作为生物医学材料的基料[21]。
2.3 黑皮和白皮ASC的流变学特性
胶原蛋白溶液的黏弹性可用振荡模式进行测定,也就是说对胶原蛋白分子施加一个摇摆力矩,使其在此摇摆力矩下发生运动。分子链的运动会随着摇摆力矩频率的变化而发生相应的改变,根据此特点可以测定胶原蛋白溶液的黏弹性能。G’为储能模量或弹性模量,反映了胶原蛋白分子随着外力的变化而发生形变的能力;G”为损耗模量或黏性模量,反映了胶原蛋白分子在外力作用发生改变时分子链内或分子间拉伸导致的能量损耗。黑皮和白皮ASC溶液的流变学曲线如图3所示,黑皮和白皮ASC溶液的流变学曲线随着剪切频率的改变出现了相同的变化趋势,说明剪切频率的变化可以影响胶原蛋白溶液的流变特性[22],而黑皮和白皮ASC溶液的流变学曲线呈现了不同程度的变化,说明不同胶原蛋白溶液的流变特性存在着一定的差异[23]。由图3A可知,随着剪切频率的增大,黑皮和白皮ASC溶液的弹性模量G’均呈现增大的趋势,当剪切频率在0.0~5.5 Hz之间时,黑皮ASC溶液的弹性模量G’均高于白皮ASC,随后两者溶液的弹性模量G’相差不大。随着剪切频率的增大,白皮ASC溶液弹性模量G’的变化斜率较大,说明其在给定的剪切频率的范围内,具有较高的凝胶稳定性[24]。由图3可知,当剪切频率较低时,黑皮和白皮ASC溶液主要表现出黏性为主的特征,随着剪切频率的增大,黑皮和白皮ASC溶液主要表现出弹性为主的特征。
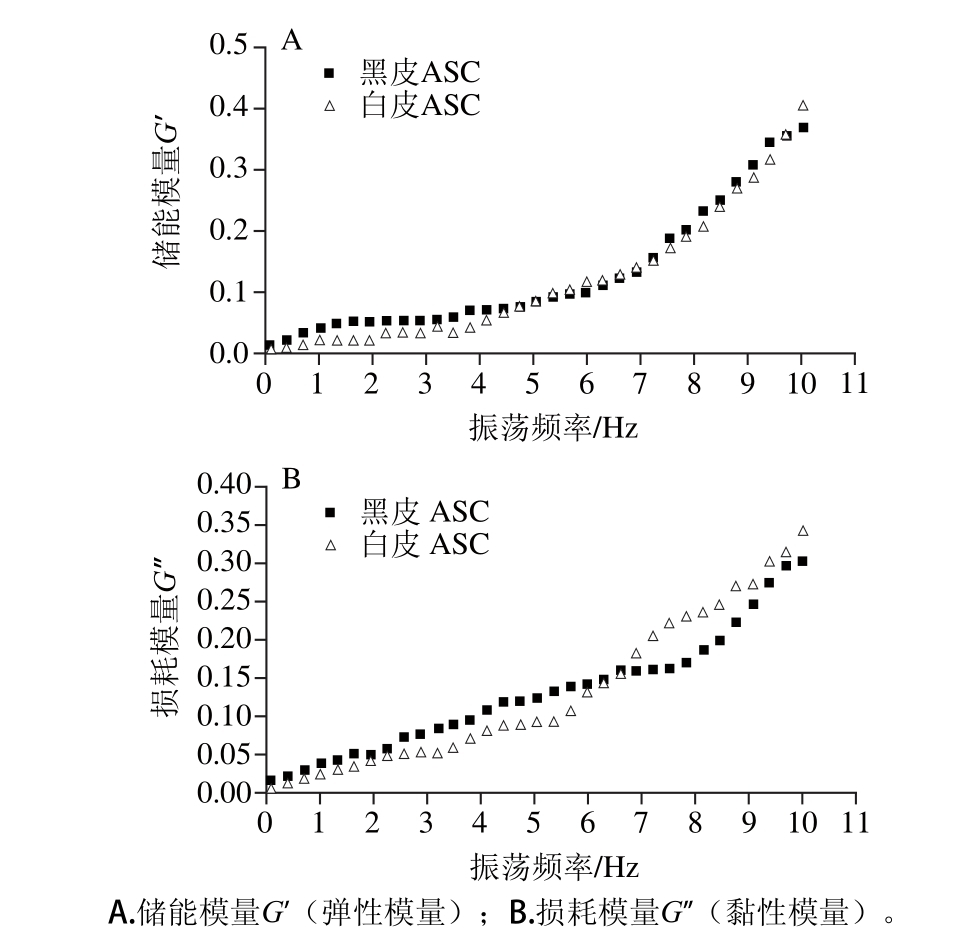
图3 鲽鱼皮胶原蛋白溶液的流变学特性
Fig. 3 Rheological characteristics of collagen solutions of flounder skin
2.4 黑皮和白皮ASC的EAI和ESI
EAI指蛋白质能将油和水结合在一起,形成乳状液的能力;是蛋白质的一种重要功能性质,也是食品加工中重要的质量控制指标。ESI是指油水乳状液保持稳定的能力,可以决定乳化剂在食品中的适用性。黑皮和白皮ASC的EAI和ESI的测定结果如图4所示,黑皮和白皮ASC的EAI分别为(2.60±0.53)、(7.30±0.41) m2/g;ESI分别为(49.12±5.18)、(27.56±4.91) min。由图4可知,白皮ASC的EAI明显高于黑皮ASC(P<0.05),这可能是由于白皮ASC的分子质量高于黑皮ASC所致。乳化是一种液体以极微小的液滴均匀地分散在互不相溶的另一种液体中形成的具有相当稳定性的多相分散体系的过程[25]。胶原蛋白在其乳液聚合过程中可以作单体,同时也可以作乳化剂,而乳化剂对乳液聚合性能有着重要的影响[26]。

图4 黑皮和白皮ASC乳化活性和乳化稳定性的比较
Fig. 4 Comparison of emulsifying activity index and emulsion stability index of black and white skin acid-soluble collagens
2.5 黑皮和白皮ASC的等电点
等电点是当蛋白质溶液的pH值达到某一特定值时,蛋白质极性基团解离的正负离子数相等,蛋白质分子不带净电荷,静电荷为零时溶液的pH值。等电点特性是蛋白质极其重要的性质,对蛋白质的分离、纯化和分析等都具有重要的实用价值[27],也是蛋白质的一个重要参数,与其侧链酸性和碱性氨基酸的残基比例相关,也与蛋白质的结构有关,而与其环境的pH值无关。黑皮和白皮ASC溶液在不同pH值条件下的电导率值如图5所示,从鲽鱼不同部位提取的ASC的等电点是不同的。黑皮ASC溶液的电导率值随着pH值的增大呈先下降再上升又下降最后上升的趋势,且当pH值为7.5时,黑皮ASC溶液的电导率值最小为(104.00±12.03) μS/cm;白皮ASC溶液的电导率值随着pH值的增大呈先下降后上升的趋势,当pH值为6.5时,白皮ASC溶液的电导率值最小为(117.00±11.29) μS/cm;因此,黑皮和白皮ASC溶液的等电点分别为7.5、6.5,两者的等电点均在中性范围内,说明酸法提取的胶原蛋白侧链氨基酸残基没有被破坏[28]。
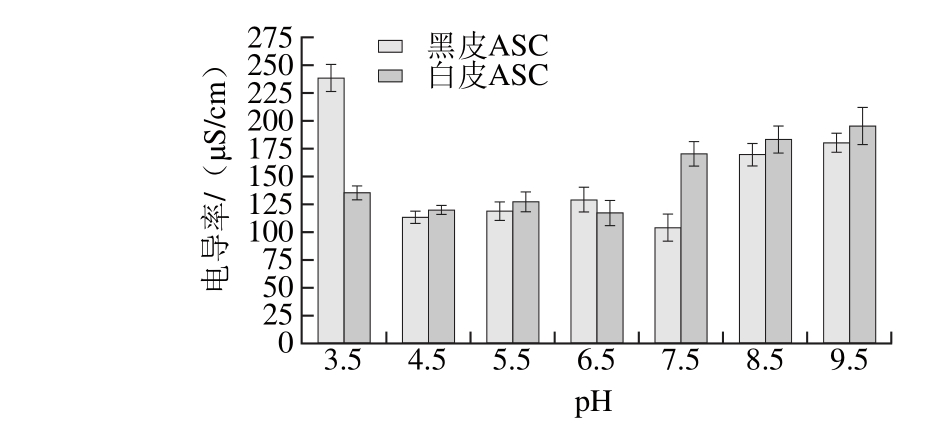
图5 不同pH值条件下黑皮和白皮ASC的电导率
Fig. 5 Electrical conductivity of black and white skin acid-soluble collagens at different pH conditions
2.6 pH值和NaCl质量浓度变化对黑皮和白皮ASC溶解性的影响

图6 pH值(A)和NaCl质量浓度(B)对黑皮和白皮ASC相对溶解度的影响
Fig. 6 Impacts of pH (A) and NaCl concentration (B) on relative solubility of black and white skin acid-soluble collagens
胶原蛋白溶液的溶解性随pH值的变化与其等电点密切相关,在等电点附近,胶原蛋白溶液的静电荷为0,相邻蛋白质分子间不存在静电斥力而出现结聚沉淀。不同pH值条件下鲽鱼黑皮和白皮ASC的相对溶解度如图6A所示。随着pH值的升高,黑皮和白皮ASC的相对溶解度均呈先升高后下降再升高的趋势,但整体上黑皮ASC的相对溶解度高于白皮ASC的相对溶解度。在酸性条件下,黑皮和白皮ASC的相对溶解度较大,在pH值为3时,黑皮和白皮ASC的相对溶解度均达到了最大值(98.29±1.04)%和(95.27±3.20)%。在两者的相对溶解度达到最大值后,随着pH值的升高,两者的相对溶解度迅速下降,在pH值为7左右时,两者的溶解度均达到了最小值,之后两者的相对溶解度均略有回升的趋势。据此,胶原蛋白溶液的相对溶解度在其等电点时最低;在偏离等电点的酸、碱性条件下,胶原蛋白溶液就会带有一定量的静电荷,呈现复杂的正离子或负离子状态,电荷互相排斥,阻止了单分子结聚成沉淀物,分子的分散性较好,从而使得胶原蛋白溶液的相对溶解度较大[29-30]。
不同NaCl质量浓度条件下鲽鱼黑皮和白皮ASC的相对溶解度如图6B所示。黑皮和白皮ASC的相对溶解度均随着NaCl质量浓度的增大而呈下降的趋势,且整体上黑皮ASC的相对溶解度比白皮ASC下降得缓慢;当NaCl质量浓度小于3 g/100 mL时,黑皮和白皮ASC均保持较高的相对溶解度,且比较稳定,这可能是胶原蛋白溶液在较低的NaCl质量浓度时,胶原蛋白分子与Na+相结合,最终使蛋白质的结构趋于稳定且具有较好的分散性,从而使得胶原蛋白溶液在较低NaCl质量浓度时具有较高的相对溶解度。当NaCl质量浓度大于3 g/100 mL时。黑皮和白皮ASC的相对溶解度均明显下降,但黑皮ASC的相对溶解度下降的速率低于白皮ASC的相对溶解度,这可能是胶原蛋白溶液在较高的NaCl质量浓度时,高浓度的盐离子可与周围的水分子结合而形成水化膜,进而使蛋白质脱水发生盐析现象而析出沉淀,导致其相对溶解度降低[31]。
本实验以新鲜鲽鱼黑皮和白皮为研究对象,采用酸法从其中提取胶原蛋白,得到黑皮和白皮ASC,并研究了黑皮和白皮ASC的理化性质及功能特性的差异性,对后续鲽鱼皮酸溶性胶原蛋白的深入研究有一定的借鉴意义。
FTIR扫描结果发现,鲽鱼黑皮和白皮ASC都存在酰胺A、酰胺B、酰胺Ⅰ、酰胺Ⅱ、酰胺Ⅲ,证明其都保留有三螺旋结构,说明酸法提取胶原蛋白保持了胶原蛋白三维螺旋结构的完整性;黑皮和白皮ASC的SEM结果显示,黑皮和白皮ASC均呈现多空的网络结构,且分布比较均匀,说明酸法提取胶原蛋白的过程基本上保留了胶原纤维原有的空间网状结构;EAI及ESI研究表明,黑皮ASC的EAI明显低于白皮ASC的EAI(P<0.05),分别为(2.60±0.53)、(7.30±0.41) m2/g,而黑皮ASC的ESI明显高于白皮ASC的ESI(P<0.05),分别为(49.12±5.18)、(27.56±4.91) min,这可能是由于白皮ASC的分子质量高于黑皮ASC所致。
综上所述,黑皮和白皮ASC的理化性质和功能特性略有差异,可以根据这两种胶原蛋白不同的理化性质和功能特性应用在不同领域,可为鲽鱼皮综合利用以及高值化产品的开发提供一定的理论和科研依据。
参考文献:
[1] JOKINEN H, WENNHAGE H, LAPPALAINEN A, et al. Decline of flounder (Platichthys fl esus (L.)) at the margin of the species’distribution range[J]. Journal of Sea Research, 2015, 105: 1-9. DOI:10.1016/j.seares.2015.08.001.
[2] NISSLING A, THORSEN A, da SILVA F F G. Fecundity regulation in relation to habitat utilisation of two sympatric flounder (Platichtys fl esus) populations in the brackish water Baltic Sea[J]. Journal of Sea Research, 2015, 95: 188-195. DOI:10.1016/j.seares.2014.06.003.
[3] WU X, CAI L, CAO A, et al. Comparative study on acid-soluble and pepsin-soluble collagens from skin and swim bladder of grass carp (Ctenopharyngodon idella)[J]. Journal of the Science of Food and Agriculture, 2016, 96(3): 815-821. DOI:10.1002/jsfa.7154.
[4] KIM S H, PARK H S, LEE O J, et al. Fabrication of duck’s feet collagen-silk hybrid biomaterial for tissue engineering[J]. International Journal of Biological Macromolecules, 2016, 85: 442-450. DOI:10.1016/j.ijbiomac.2015.12.086.
[5] NEEL E A A, BOZEC L, KNOWLES J C, et al. Collagen-emerging collagen based therapies hit the patient[J]. Advanced Drug Delivery Reviews, 2013, 65(4): 429-456. DOI:10.1016/j.addr.2012.08.010. [6] ZHANG Y, LIU W, LI G, et al. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2007, 103(3): 906-912. DOI:10.1016/ j.foodchem.2006.09.053.
[7] CHEN Junde, LI Long, YI Ruizao, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J]. LWT-Food Science and Technology, 2016, 66: 453-459. DOI:10.1016/j.lwt.2015.10.070.
[8] TAMILMOZHI S, VEERURAJ A, ARUMUGAM M. Isolation and characterization of acid and pepsin-solubilized collagen from the skin of sailfish (Istiophorus platypterus)[J]. Food Research International, 2013, 54(2): 1499-1505. DOI:10.1016/j.foodres.2013.10.002.
[9] ZENG Shaokui, YIN Juanjuan, YANG Shuqi, et al. Structure and characteristics of acid and pepsin-solubilized collagens from the skin of cobia (Rachycentron canadum)[J]. Food Chemistry, 2012, 135(3): 1975-1984. DOI:10.1016/j.foodchem.2012.06.086.
[10] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2005, 89(3): 363-372. DOI:10.1016/j.foodchem.2004.02.042.
[11] 闫明艳. 狭鳕鱼皮胶原蛋白结构和物理特性的研究[D]. 青岛: 中国海洋大学, 2009: 54. DOI:10.7666/d.y1503712.
[12] 张强, 王倩倩, 陆剑锋, 等. 不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J]. 现代食品科技, 2014, 30(5): 104-110. DOI:10.13982/ j.mfst.1673-9078.2014.05.025.
[13] 郭荣荣. 甜荞蛋白质组分功能特性评价及对火腿肠质构特性的影响研究[D]. 武汉: 华中农业大学, 2007: 24. DOI:10.7666/ d.y1198079.
[14] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723. DOI:10.1021/jf60217a041.
[15] LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69. DOI:10.1016/S0308-8146(03)00167-5.
[16] MUYONGA J H, COLE C G B, DUODU K G. Characterisation of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 85(1): 81-89. DOI:10.1016/ j.foodchem.2003.06.006.
[17] ZHU B, DONG X, ZHOU D, et al. Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumber Stichopus japonicus[J]. Food Hydrocolloids, 2012, 28(1): 182-188. DOI:10.1016/j.foodhyd.2011.12.010.
[18] AHMAD M, BENJAKUL S. Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (Aluterus monocerous)[J]. Food Chemistry, 2010, 120(3): 817-824. DOI:10.1016/j.foodchem.2009.11.019.
[19] LIU D, LIANG L, REGENSTEIN J M, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J]. Food Chemistry, 2012, 133(4): 1441-1448. DOI:10.1016/ j.foodchem.2012.02.032.
[20] ZUBER M, ZIA F, ZIA K M, et al. Collagen based polyurethanes: a review of recent advances and perspective[J]. International Journal of Biological Macromolecules, 2015, 80: 366-374. DOI:10.1016/j.ijbiomac.2015.07.001.
[21] 朱文学, 邱园园, 肖枫, 等. 响应面法优化黄河鲤鱼鱼鳞酸溶性胶原蛋白提取工艺[J]. 食品科学, 2013, 34(20): 94-98. DOI:10.7506/ spkx1002-6630-201320018.
[22] STARKEY C P, GEESINK G H, van de VEN R, et al. The relationship between shear force, compression, collagen characteristics, desmin degradation and sarcomere length in lamb biceps femoris[J]. Meat Science, 2017, 126: 18-21. DOI:10.1016/j.meatsci.2016.12.006.
[23] ZHANG Q, WANG Q, L☒ S, et al. Comparison of collagen and gelatin extracted from the skins of Nile tilapia (Oreochromis niloticus) and channel catfish (Ictalurus punctatus)[J]. Food Bioscience, 2016, 13: 41-48. DOI:10.1016/j.fbio.2015.12.005.
[24] BINSI P K, SHAMASUNDAR B A, DILEEP A O, et al. Rheological and functional properties of gelatin from the skin of Bigeye snapper (Priacanthus hamrur) fish: influence of gelatin on the gel-forming ability of fish mince[J]. Food Hydrocolloids, 2009, 23(1): 132-145. DOI:10.1016/j.foodhyd.2007.12.004.
[25] JULIAN D, CLEMENTS M. Food emulsions: principles, practice, and techniques[M]. Washington: CRC Press, 2005: 12.
[26] YORGANCIOGLU A, BAYRAMOGLU E E. Production of cosmetic purpose collagen containing antimicrobial emulsion with certain essential oils[J]. Industrial Crops and Products, 2013, 44: 378-382. DOI:10.1016/j.indcrop.2012.11.013.
[27] LUO Y, TIAN Y, ZHU A, et al. pH-dependent electrochemical behavior of proteins with different isoelectric points on the nanostructured TiO2surface[J]. Journal of Electroanalytical Chemistry, 2010, 642(2): 109-114. DOI:10.1016/j.jelechem.2010.02.021.
[28] THUY L T M, OKAZAKI E, OSAKO K. Isolation and characterization of acid-soluble collagen from the scales of marine fishes from Japan and Vietnam[J]. Food Chemistry, 2014, 149: 264-270. DOI:10.1016/j.foodchem.2013.10.094.
[29] NALINANON S, BENJAKUL S, VISESSANGUAN W, et al. Use of pepsin for collagen extraction from the skin of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2007, 104(2): 593-601. DOI:10.1016/j.foodchem.2006.12.035.
[30] WOO J W, YU S J, CHO S M, et al. Extraction optimization and properties of collagen from yellowfin tuna (Thunnus albacares) dorsal skin[J]. Food Hydrocolloids, 2008, 22(5): 879-887. DOI:10.1016/ j.foodhyd.2007.04.015.
[31] PAL G K, NIDHEESH T, SURESH P V. Comparative study on characteristics and in vitro fibril formation ability of acid and pepsin soluble collagen from the skin of catla (Catla catla) and rohu (Labeo rohita)[J]. Food Research International, 2015, 76: 804-812. DOI:10.1016/j.foodres.2015.07.018.
Extraction and Characterization of Collagens from Different Skins of Flounder (Pleuronichthys cornutus)
CAI Luyun1,2, MA Shuai2, CAO Ailing3, LI Xiuxia2, ZHANG Yuhao1, ZHAO Guohua1, ZHAO Yuanhui4, LIN Hong4, LI Jianrong2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Food Safety Key Laboratory of Liaoning Province, National and Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, College of Food Science and Engineering, Bohai University, Jinzhou 121013, China; 3. Xiaoshan Entry-Exit Inspection and Quarantine Bureau, Hangzhou 311208, China; 4. College of Food Science and Engineering, Ocean University of China, Qingdao 266100, China)
Abstract:In this study, acid-soluble collagens were extracted from black and white skins of fresh flounder, and their physicochemical characteristics, emulsifying activity and emulsion stability were compared and analyzed. The structural characteristics were studied by Fourier transform infrared spectroscopy (FTIR) and scanning electron microscopy (SEM). Additionally, solubility, rheological properties, isoelectric point, emulsifying activity index and emulsion stability were also investigated. FTIR analysis proved the existence of amide A, amide B, amide Ⅰ, amide Ⅱ, and amide Ⅲ, confirming that the triple helical chain conformation of the two collagens was completely maintained. The SEM results indicated that both collagens showed a porous, evenly distributed network structure, which proved that the original structure of collagen fibers was basically maintained during the extraction process. The emulsifying activity index (EAI) of the black skin collagen was significantly lower than that of the white skin collagen (P < 0.05), which were (2.60 ± 0.53) and (7.30 ± 0.41) m2/g, respectively, while the emulsion stability index (ESI) of the former was significantly higher than that of the latter (P < 0.05), which were (49.12 ± 5.18) and (27.56 ± 4.91) min, respectively. These results showed that certain differences exist in physicochemical characteristics and functional properties of acid-soluble collagens from different flounder skins.
DOI:10.7506/spkx1002-6630-201711009
中图分类号:TS254.9
文献标志码:A
文章编号:1002-6630(2017)11-0052-07引文格式:
收稿日期:2016-05-19
基金项目:国家自然科学基金青年科学基金项目(31401478);中国博士后基金面上项目(2015M570760);“十二五”国家科技支撑计划项目(2012BAD29B06);辽宁省自然科学基金项目(20170540006);重庆市博士后特别资助项目(Xm2015021);渤海大学研究生创新基金项目(071502224-48)
作者简介:蔡路昀(1981—),男,副教授,博士,研究方向为水产品贮藏加工和功能性食品。E-mail:clyun2007@163.com
*通信作者:励建荣(1964—),男,教授,博士,研究方向为水产品和果蔬贮藏加工及质量安全控制。E-mail:li34008@126.com
Key words: Pleuronichthys cornutus; fish skin; acid-soluble collagen; extraction; physicochemical characterization