徐 媛1,潘思轶2,*
(1.江汉大学生命科学学院,湖北 武汉 430100;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
摘要:对红葡萄柚中番茄红素和色泽进行热降解动力学研究。结果表明,不同温度条件下番茄红素和色泽降解均为一级降解动力学,确定红葡萄柚汁中番茄红素含量与色泽可用线性关系C/C0= 1.770 7(a*/a0*)+0.801 2来表示;纯化后番茄红素含量与色泽在70、80、90 ℃条件下的线性关系分别为:70 ℃:C/C0=1.856(a*/a0*)-0.841 5;80 ℃:C/C0=1.714 (a*/a0*)-0.711 8;90 ℃:C/C0=1.492 1(a*/a0*)-0.467 2。高效液相色谱-二极管阵列在线监测发现番茄红素热降解途径为:加热促使全反式番茄红素向单顺式异构体进行转变,继续加热导致全反式和单顺式异构体转变为双顺式异构体,而加热过程中双顺式异构体也可转变为单顺式异构体或发生降解,从而造成总番茄红素含量的下降。
关键词:红葡萄柚;番茄红素;色泽;热降解动力学;降解机制
葡萄柚(Citrus paradise Macf.)属芸香科柑橘属,其主要商业品种红肉葡萄柚色泽艳丽,香气独特,果肉酸甜适中,营养丰富。红肉葡萄柚为典型的因番茄红素呈色的品种[1],且番茄红素具有抗氧化、抗肿瘤、提高免疫力[2-5]等保健功能。近年来,红葡萄柚汁及其功能食品深受消费者喜爱。然而番茄红素因其高度不饱和长链结构极易发生顺反异构和氧化降解[6-7],导致红葡萄柚及其加工制品的颜色变化,影响产品品质及保健功能,是目前制约红葡萄柚商业化生产的主要问题之一。
研究表明番茄红素的降解主要受光照和热处理的影响[8],Lee等[9]研究发现加热或光照条件下番茄红素的降解符合一级动力学模型,且高温会促使番茄红素异构化加速。Lee[10]、Mayer-Miebach[11]、Lambelet[12]等先后对加热前后柑橘、胡萝卜和番茄中的番茄红素进行分析,发现持续加热会造成番茄红素的顺式异构化。这种反式向顺式的转化致使番茄红素在溶液中的呈色能力明显下降[13]。此外,不同处理温度导致番茄酱中顺式番茄红素显著增加、a*值显著下降,且光辐照下a*值为一级降解反应[8,14]。但有关红葡萄柚中番茄红素热降解动力学及其降解途径以及色泽热降解动力学研究鲜有报道。
本实验通过红葡萄柚汁及纯化后番茄红素热降解动力学研究,得出热处理过程中番茄红素降解与色泽降解的对应关系,并通过色泽变化来表征番茄红素含量的改变,为红葡萄柚的在线监测提供理论模型;同时运用高效液相色谱-二极管阵列(high performance liquid chromatography coupled with photodiode array detection,HPLC-PAD)法在线监测热处理对番茄红素的结构影响及降解产物的变化情况,进而探讨热处理过程中番茄红素的降解机制,为红葡萄柚及其功能食品的生产加工提供一定理论依据。
1.1 材料与试剂
红葡萄柚品种为“Star Ruby”,由浙江省农业科学研究所提供。
红葡萄柚去除过熟和烂果后,手工去皮去籽,用组织研磨机进行均质处理后得到红葡萄柚匀浆。灌装后密封并置于-20 ℃条件下冷冻保存备用。该红葡萄柚匀浆黏度为23.8 mPa•s,其固形物含量为10.5 °Brix,pH值为3.04,番茄红素含量为21.49 mg/kg。
丙酮、石油醚(60~90 ℃)、二氯甲烷(均为分析纯)上海振兴化工一厂;二丁基羟基甲苯(butylated hydoxy toluene,BHT)(分析纯) 国药集团化学试剂有限公司;甲醇、甲基叔丁基醚(methyl tertbutyl ether,MTBE)(均为色谱纯) 美国Fisher Chemicals公司;番茄红素(纯度>90%) 美国Sigma Aldrich公司。
1.2 仪器与设备
HR2168研磨机 美国Philips公司;RE52-99型旋转蒸发器 上海亚荣生化仪器厂;UV-1700 SPC型紫外-可见分光光度计 日本Shimadzu公司;UitraScan XE型色度仪 美国HunterLab公司;HPLC仪(配2996型二极管阵列检测器) 美国Waters公司;液相色谱柱(C30柱150 mm×4.6 mm,3 μm) 日本YMC公司。
1.3 方法
1.3.1 红葡萄柚番茄红素的柱层析纯化
有机溶剂法提取红葡萄柚中番茄红素[15],将提取出的番茄红素初提液用硅胶柱(200 mm×16 mm,100~200 目)分离,采用石油醚与丙酮体积比9∶1的洗脱液洗脱,收集番茄红素部分,将此组分在30 ℃浓缩蒸干后用石油醚复溶进行二次柱层析,方法同前,得到的纯化番茄红素溶液浓缩蒸干后收集至25 mL棕色容量瓶中,石油醚定容。所有样品体系初始浓度均保持一致,整个纯化过程避光进行。
1.3.2 样品热处理
取各样品10 mL于具塞试管中,根据生产加工温度分别设定在70、80、90 ℃条件下对番茄红素样品进行热处理,每隔1 h取样检测,热处理后样品立即冰浴处理以停止反应,整个实验过程需避光进行。
1.3.3 番茄红素含量测定[16]
将番茄红素提取液旋蒸浓缩至干,用50 mL含2%二氯甲烷的石油醚定容,混匀。同时以2%二氯甲烷的石油醚作为空白溶剂,在502 nm波长处测定样品的吸光度。提取液中番茄红素含量按式(1)计算。
式中:ρ为番茄红素的质量浓度/(g/mL);A为溶液在502 nm波长处吸光度;E1%1cm为番茄红素为1%时的消光系数,此处在2%二氯甲烷的石油醚的消光系数为3 087 mL/g。
1.3.4 色度的测定
色度采用UitraScan XE色度仪在RSIN(透射包含部分反射)模式下测定样品CIELab各参数值,各样品测定10 次取平均值。
1.3.5 HPLC分析
全反式番茄红素的含量及番茄红素异构体的鉴定通过HPLC分析完成[17]。全反式番茄红素及热处理后番茄红素溶液过无水硫酸钠柱,30 ℃条件下浓缩蒸发,收集至10 mL棕色容量瓶中,用含0.1% BHT的正己烷定容。准确吸取1.0 mL溶液,吹氮干燥后用0.1% BHT的MTBE复溶至1 mL,10 μL进样HPLC测定。
色谱柱C30(150 mm×4.6 mm,3 μm);洗脱条件如下:流动相为MTBE-甲醇-乙酸乙酯体积比为40∶50∶10;洗脱时间30 min;柱温维持35 ℃,流速为1 mL/min,检测波长476 nm。
通过与标准品的保留时间、紫外-可见光谱(ultraviolet-visible spectroscopy,UV-Vis)等对比进行全反式番茄红素的判定。此外,其他cis-异构体的鉴定通过吸收光谱的特征数据及与文献[15,18]中Q值对比而确定。取番茄红素标品溶液,以25 μg/mL为间隔稀释至0~250 μg/mL,进行标准曲线溶液配制,按上述条件进行HPLC分析,进样量为10 μL,以峰面积对质量浓度绘制标准曲线,并按信噪比3测定最低检出限为0.74 μg/mL。全反式番茄红素的含量以μg/g组织样表示。1.3.6 降解动力学参数计算
国内外研究表明番茄红素热降解遵循一级反应动力学模型[19-21],总番茄红素(all-trans与cis结构的总和)的降解速率常数k和半衰期t1/2可通过公式(2)、(3)计算得出。

式中:C为设定温条件度下加热t时间后番茄红素含量/(μg/g);C0为番茄红素的初始含量/(μg/g);t为热处理时间/h;k为一级反应降解速率常数/h-1。
Arrhenius方程可用来表达番茄红素降解过程的温度依赖性。对一级反应降解速率常数的对数lnk和绝对温度的倒数(1/T)进行线性回归,可以求出降解反应的活化能Ea和频率常数K0,见公式(4)。
式中:Ea为活化能/(kJ/mol);R为气体常数(8.314 J/(K·mol));T为绝对温度/K;k为一级反应速率常数/h-1;K0为频率常数/h-1。
番茄红素色泽热降解同样采用一级反应动力学模型进行表达[22]。由于番茄红素呈红色,因此以Hunter a*值对红葡萄柚热处理过程中色泽降解进行表征。其色泽降解一级反应动力学公式可以改写为:

式中:a*为设定温度条件下加热t时间后样品色度;a0*为样品的初始色度。
1.4 数据分析
各热处理后样品含量及色泽测定均重复3 次并求平均值。所有数据通过SPSS 18.0软件进行Duncan差异分析及方差分析。
2.1 红葡萄柚番茄红素及其色泽热降解动力学
2.1.1 红葡萄柚番茄红素热降解动力学
将红葡萄柚汁置于70、80、90 ℃的水浴中进行热处理,其番茄红素在不同温度条件下的热降解如图1所示。
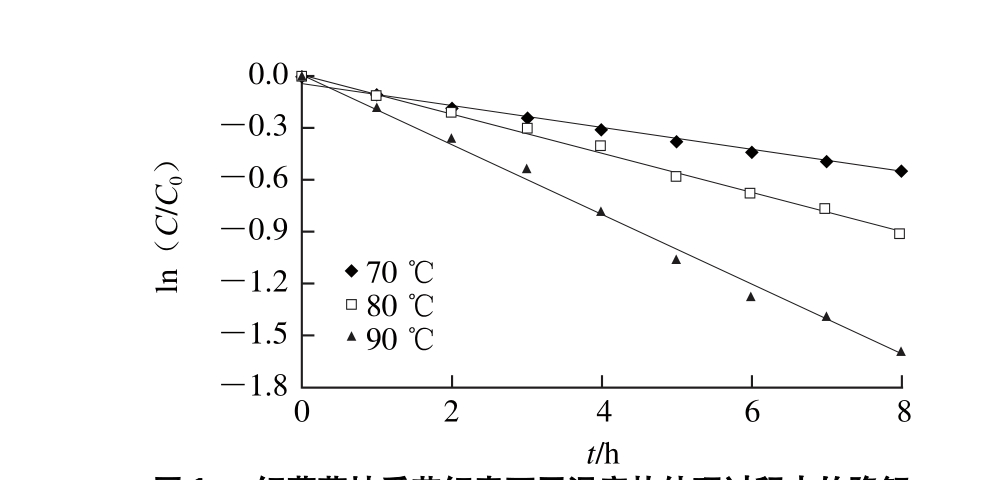
图1 红葡萄柚番茄红素不同温度热处理过程中的降解
Fig. 1 Lycopene degradation in red grapefruit during thermal treatment at different temperatures
对ln(C/C0)与t进行线性回归,发现各温度条件下其相关系数R2均大于0.98,表明红葡萄柚中番茄红素在不同温度条件下的热降解均是符合一级反应动力学的,这与多数学者研究相一致[23-25]。红葡萄柚番茄红素各温度条件下热降解参数如表1所示。
表1 不同温度热处理中红葡萄柚番茄红素的热降解参数
Table 1 Kinetic parameters for degradation of lycopene from red grapefruit during thermal treatment at different temperatures

注:括号内数据为相关系数(R2)。下同。
由表1可知,70、80、90 ℃条件下红葡萄柚番茄红素降解的半衰期分别为10.45、6.11、3.37 h,表明70 ℃条件下番茄红素降解最慢,而90 ℃条件下降解最快。且红葡萄柚番茄红素在90 ℃条件下降解速率常数最大,其k值是80 ℃条件下的1.81 倍,70 ℃条件下的3.10 倍。根据Arrhenius方程,得红葡萄柚番茄红素降解速率随温度变化的回归方程为:y=-7 049.3x+17.815,且相关系数R2=0.991 9,其活化能为58.61 kJ/mol。这与Sharma等[24]所测的番茄酱中番茄红素降解活化能有所不同,这可能是由于其将番茄酱样品进行烘箱加热前处理而导致番茄红素稳定性下降。
2.1.2 红葡萄柚色泽热降解动力学
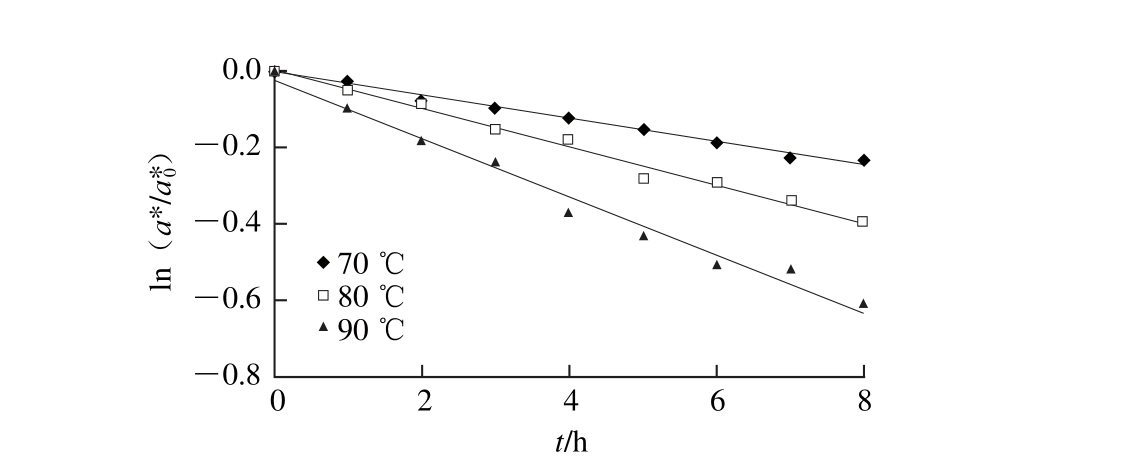
图2 红葡萄柚色泽不同温度热处理过程中的降解
Fig. 2 Color degradation of red grapefruit during thermal treatment at different temperatures
红葡萄柚汁在70、80、90 ℃条件下热处理后的色泽热降解如图2所示。可以看出,红葡萄柚汁在不同温度条件下的色泽热降解也是符合一级降解动力学的,且回归方程的R2均大于0.98。
根据Arrhenius方程,以降解速率常数的对数lnk对1/T进行线性回归,得出红葡萄柚色泽降解随温度变化的回归方程为:y=-577 8.4x+13.333,且相关系数R2=0.991 2,其活化能为48.04 kJ/mol。表2为红葡萄柚热处理过程中色泽热降解动力学的部分参数。可以看出,70、80、90 ℃条件下红葡萄柚色泽降解的半衰期分别为23.26、14.12、9.21 h,表明70 ℃条件下色泽降解最慢,而90 ℃条件下降解最快,且90 ℃条件下红葡萄柚色泽降解速率常数最大,这与红葡萄柚中番茄红素热降解的规律是一致的。
表2 不同温度热处理中红葡萄柚的色泽热降解参数
Table 2 Kinetic parameters for color degradation of red grapefruit during thermal treatment at different temperatures

根据表1、2热降解参数比较发现,番茄红素热降解的速率常数随温度升高而加速上升,80 ℃条件下k值为70 ℃条件下的1.81 倍,而90 ℃条件下k值为70 ℃条件下的3.10 倍;色泽热降解的速率常数呈现相同变化趋势,随温度升高k值增加速率加快,其80、90 ℃的k值分别为70 ℃的1.65、2.53 倍。由以上分析可知,温度对红葡萄柚番茄红素和色泽热降解的影响程度是相当的,但番茄红素对温度变化更为敏感。一般而言,较高活化能表示热降解过程中温度依赖性越大[22],即温度对其影响更大。红葡萄柚番茄红素热降解Ea大于红葡萄柚色泽热降解Ea,因此在加热过程中前者热降解的温度依赖性更大。
此外,红葡萄柚番茄红素及其Hunter a*在各温度热处理中的降解速率常数并不一致,因此其色泽降解并不能直接反映其番茄红素的热降解。即在红葡萄柚汁生产加工等的在线品质监控中,其色泽变化不能直接用以表征红葡萄柚汁中番茄红素含量变化及其对应降解情况,所以找出并建立番茄红素热降解与色泽热降解的相互关系,对红葡萄柚汁生产加工的品控管理是十分必要的。
2.1.3 红葡萄柚番茄红素热降解与色泽热降解的相互关系
由于红葡萄柚色泽热降解与番茄红素热降解在不同温度条件下呈现相同趋势,Hunter a*值变化受红葡萄汁中番茄红素含量变化的影响,随着番茄红素总量的下降其a*值也逐渐降低,因此可将两者变化的相互关系进行线性拟合,设定C/C0=k1(a*/a0*)+k2,其中k1和k2为线性关系中的系数。以C/C0对a*/a0*作图,发现两者之间的线性关系较好,见图3,不同处理温度条件下的线性相关系数R2均大于0.98,说明此模型线性特征非常明显,拟合直线能基本涵盖实验数据,且具有一般性。

图3 红葡萄柚热处理过程中番茄红素含量与色泽的相互关系
Fig. 3 Relationship between lycopene content and a* value of red grapefruit during thermal treatment
表3 热处理中红葡萄柚番茄红素含量与色泽线性关系的相关系数
Table 3 Linear correlation coefficients between lycopene content and a* value during thermal treatment
热处理过程中红葡萄柚番茄红素含量与色泽变化的相关性方程系数如表3所示,在不同设定温度条件下,3 个线性回归方程的k1和k2的差异均不显著,因此可用同一相关性方程来表示番茄红素含量变化与Hunter a*值变化的关系,将3 个温度条件下的k1和k2取平均值,得热处理过程中番茄红素与色泽变化的相互关系为:C/C0=1.770 7(a*/a0*)+0.801 2。因此,实际生产加工中可用红葡萄柚色泽变化对番茄红素的降解情况进行表征,从而达到实时在线监控的目的。
2.2 番茄红素纯化物及色泽热降解动力学
2.2.1 番茄红素纯化物的热降解动力学
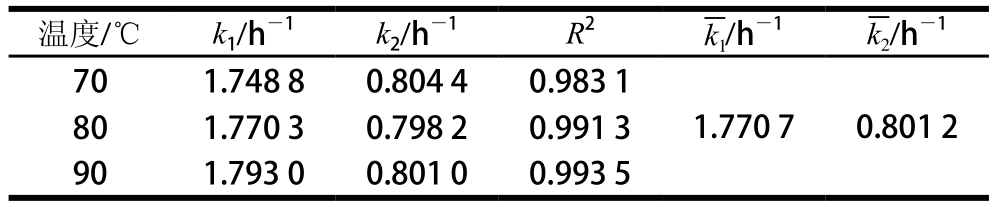
将纯化后番茄红素溶液置于70、80、90 ℃的水浴环境中进行热处理,其在不同温度条件下的热降解如图4所示。
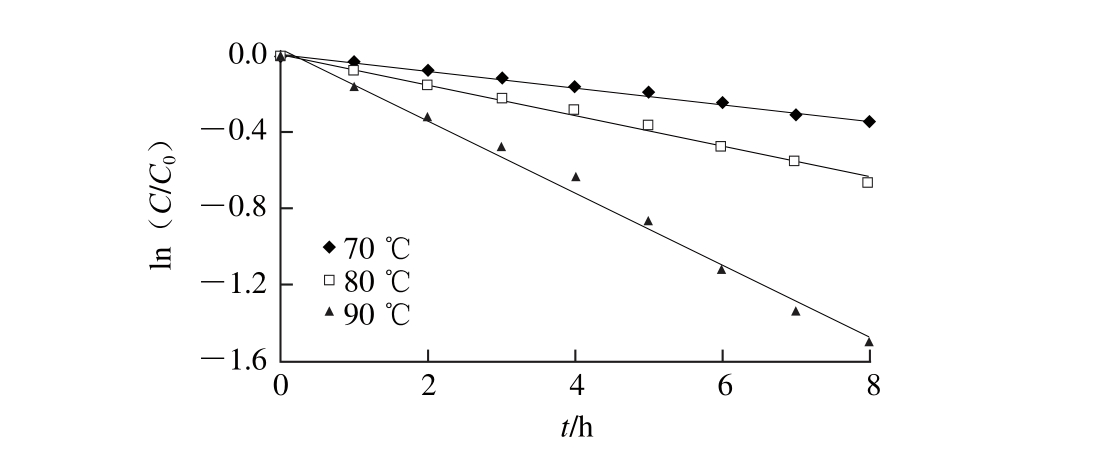
图4 纯化番茄红素在不同温度热处理过程中的降解
Fig. 4 Degradation of purified lycopene during thermal treatment at different temperatures
对ln(C/C0)与t进行线性回归,发现各温度条件下其R2均大于0.99,表明纯化后番茄红素在不同温度条件下的热降解均是符合一级反应动力学的,且可以看出,随着加热温度升高,番茄红素降解速率逐渐增大。根据Arrhenius方程,得纯化后番茄红素降解速率随温度变化的回归方程为:y=-9 314.7x+23.959,R2=0.988 0,纯化后番茄红素各温度条件下的热降解参数如表4所示。
表4 不同温度热处理中纯化番茄红素的热降解参数
Table 4 Kinetic parameters for degradation purified lycopene from red grapefruits during thermal treatment at different temperatures

由表4可知,70、80、90 ℃条件下纯化番茄红素降解的半衰期分别为16.01、8.55、3.58 h,其活化能为77.44 kJ/mol,表明70 ℃条件下番茄红素降解最慢,而90 ℃条件下降解最快。与红葡萄柚番茄红素降解比较可知,纯化后番茄红素的热降解具有更高的活化能,其Ea为77.44 kJ/mol,远高于红葡萄柚番茄红素的Ea值58.61 kJ/mol。而Ea越高表明反应所需能量也就越高,其反应也越不易进行[23]。因此纯化后番茄红素的降解速率慢于红葡萄柚汁中番茄红素的热降解,70、80、90 ℃条件下其热降解的半衰期分别为红葡萄柚汁番茄红素的1.53、1.40、1.06 倍,由此可知,当番茄红素从红葡萄柚中提取纯化后其热稳定性增强,这可能是由于红葡萄柚中的一些内源物质如VC、糖、金属离子等对体系中番茄红素具有促降解作用。
2.2.2 纯化番茄红素的色泽热降解动力学

图5 不同温度热处理纯化番茄红素过程中的色泽降解
Fig. 5 Color degradation of purified lycopene during thermal treatment at different temperatures
纯化后番茄红素体系在70、80、90 ℃条件下热处理过程中其色泽热降解情况如图5所示,不同温度条件下体系的ln(a*/a0*)与t之间线性关系良好,其回归方程的R2均大于0.98,表明该体系中色泽热降解也是符合一级反应动力学模型的。
表5 不同温度热处理纯化番茄红素的色泽热降解参数
Table 5 Kinetic parameters for color degradation of purified lycopene during thermal treatment at different temperatures
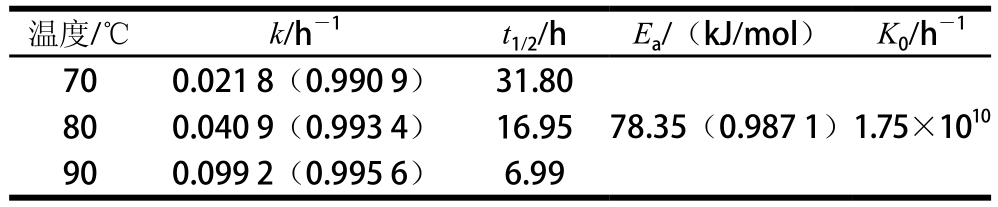
根据Arrhenius方程得纯化番茄红素色泽降解随温度变化的回归方程为:y=-9 423.4x+23.587,且相关系数R2=0.981 7,其活化能为78.35 kJ/mol。由表5可知,70、80、90 ℃条件下纯化番茄红素色泽热降解的半衰期分别为31.80、16.95、6.99 h,表明70 ℃条件下番茄红素色泽降解最慢,而90 ℃条件下降解最快,这与纯化番茄红素的热降解规律是一致的,且90 ℃条件下其色泽降解速率常数最大,k值为0.099 2 h-1,是80 ℃条件下的2.43倍,70 ℃条件下的4.55 倍,由图5也可明显看出,温度越高,色泽降解速率越快,失色越明显。
与红葡萄柚的色泽热降解情况比较可知(表2),70、80 ℃条件下纯化番茄红素的色泽更为稳定,其热降解半衰期分别为红葡萄柚汁半衰期的1.37、1.20 倍,而90 ℃条件下纯化番茄红素色泽热降解半衰期为红葡萄柚汁的0.76 倍,说明高温条件下纯化番茄红素色泽降解速率更快。而总体而言,热处理过程中纯化番茄红素拥有更高的降解活化能,其Ea值78.35 kJ/mol,远高于红葡萄柚色泽降解的Ea值48.04 kJ/mol。因此纯化番茄红素色泽对温度的敏感性也远高于红葡萄柚色泽的温度敏感性,随着体系热处理温度升高,纯化番茄红素色泽降解速率k值加速增加,80 ℃条件下k值为70 ℃条件下的1.88 倍,而90 ℃条件下则为70 ℃的4.55 倍;红葡萄柚汁色泽降解具有较低的活化能,故其降解速率k随温度上升增加的较为缓慢,80 ℃条件下k值为70 ℃条件下的1.65 倍,90 ℃则为70 ℃条件下的2.53 倍,远低于纯化番茄红素体系的4.55 倍。
2.2.3 纯化番茄红素热降解与色泽热降解相互关系

图6 纯化番茄红素热处理中番茄红素含量与色泽的相互关系
Fig. 6 Relationship between lycopene content and a* value of purified lycopene during thermal treatment
以C/C0对a*/a0*作图并进行线性拟合,见图6,发现两者之间的线性关系较好,不同处理温度条件下的线性相关系数R2均大于0.97,说明此模型线性特征明显,拟合直线能基本涵盖实验数据且具有一般性。
表6 热处理中纯化番茄红素含量与色泽线性关系的相关系数
Table 6 Linear correlation coefficients between lycopene content and a* value of purified lycopene during thermal treatment
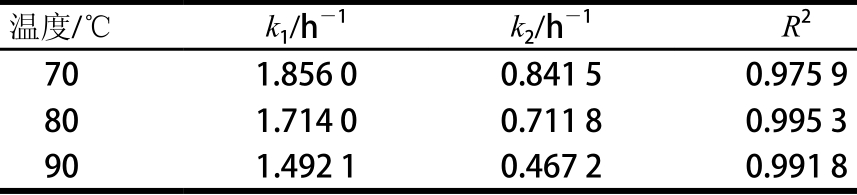
热处理过程中纯化番茄红素含量与色泽变化的相关性方程系数如表6所示,设定C/C0=k1(a*/a0*)+k2,其中k1和k2为线性关系中的相应系数。可以看出,在不同温度条件下其线性方程的k1和k2值均有较大差异,因此3 个温度条件下的番茄红素含量并不能用单独一个方程来表征。70、80、90 ℃条件下番茄红素含量变化与色泽变化的线性方程分别为:C/C0=1.856(a*/a0*)-0.841 5(70 ℃)、C/C0=1.714(a*/a0*)-0.711 8(80 ℃)、C/C0=1.492 1(a*/a0*)-0.467 2(90 ℃)。
由以上分析可知,在不同设定温度下,红葡萄柚汁中番茄红素热降解与色泽热降解的关系可用同一线性方程表征;而纯化番茄红素热降解与其色泽热降解关系随着温度的变化而改变。由图3与图6可知,在70 ℃条件下,红葡萄柚汁色泽的变化大于纯化番茄红素色泽的变化程度;而随着温度升高,纯化番茄红素色泽热降解加速进行,在80、90 ℃条件下,红葡萄柚汁色泽的变化小于纯化番茄红素体系的色泽变化程度。这可能是由于红葡萄柚汁这一体系比纯化番茄红素体系复杂,随着温度升高,其中含有的许多内源物质对其色泽具有一定掩盖性及保护作用,而纯化番茄红素的色泽则表现更高的温度敏感性。
2.3 全反式番茄红素的热降解途径
表7 红葡萄柚中番茄红素异构体的鉴定及色谱数据
Table 7 Identification and chromatographic data of isomers of lycopene in red grapefruit (Citrus paradise Macf.)
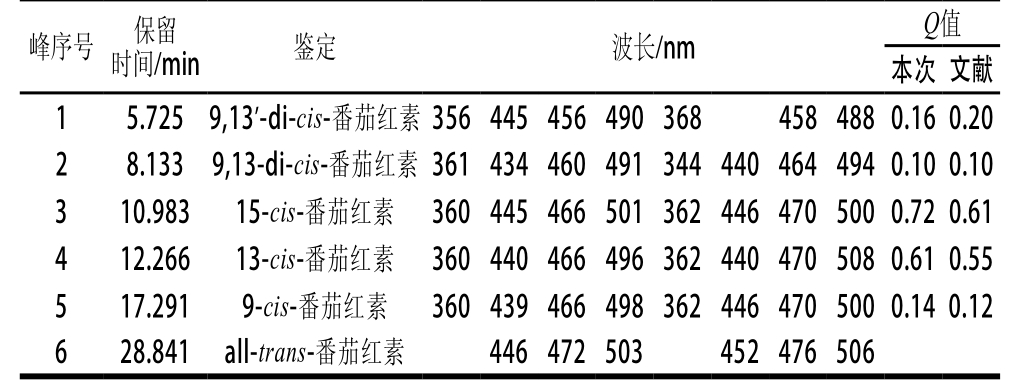
注:峰序号顺序同图7;本次Q值为PDA检测的化合物光谱数据;文献中相应化合物光谱数据来自文献[15]。
为了揭示红葡萄柚番茄红素在食品加工热处理中降解机制,将纯化后番茄红素体系置于90 ℃水浴中进行热降解研究,除每小时对其番茄红素含量进行分光光度法测定外,并对热处理后样品进行HPLC分析。其中全反式(all-trans-),番茄红素的鉴定通过与标准品的保留时间、UV-Vis等对比进行;其他单顺式(mono-cis-)及双顺式(di-cis-)异构体的鉴定通过吸收光谱的特征数据及与文献中Q值(顺式吸收峰362 nm处吸收强度与最大吸收峰的吸收强度比值)对比而确定[15],通过标准曲线计算all-trans-番茄红素的含量,见表7。
当番茄红素从反式向顺式转变时,其特征吸收光谱会在362 nm处出现一顺式特征峰,并且发生顺式异构的位置越靠近分子中部该特征峰越高;与all-trans-相比,cis-异构体主吸收峰的最大吸收波长也会发生轻微紫移,峰高也相应降低,因此常用Q值作为判断顺反异构体的依据,并以此作为异构体特征吸收光谱的标记。本实验中根据保留时间、光谱图及Q值等特征值对番茄红素异构体进行了推测,这种判别方法比之核磁共振分析来说相对简便。
表8 90 ℃热处理过程中番茄红素及其顺式异构体含量及比例变化
Table 8 Changes in contents of lycopene and its cis-isomers during heating at 90 ℃

注:nd.未检出。
表8为纯化后番茄红素热处理过程中各顺反异构体的含量及占总番茄红素含量百分比变化。其中all-trans-番茄红素在90 ℃条件下加热8 h后损失了14.11 μg/g,损失达总量的79%。由表8及图7的A、B可以看出,在热处理的前2 h,13-cis-的含量呈上升趋势,可能是由于加热促使all-trans-发生异构化而转变而成[28]。研究称β-胡萝卜素中心双键异构化所需活化能比其他位置要少,据此理论可知番茄红素中13-cis-异构体增加的最多,其次为9-cis-和15-cis-。虽然理论上应该15-cis-含量最多,然而由于空间位阻效应而较难形成15-cis-,就算生成也容易转变为其他cis结构。从加热2 h开始,番茄红素体系中逐渐生成di-cis-番茄红素9,13’-di-cis-、9,13-di-cis-番茄红素(图7C),这可能是由all-trans-转变为mono-cis-异构体,再由monocis-异构体转变而成。随着热处理时间的继续延长,所有的单顺式异构体mono-cis-均呈现下降趋势(图7D),这可能是由于其向di-cis-异构体或all-trans-番茄红素的转变,并进一步发生氧化降解所致。而di-cis-在4 h内继续增加,然而在4 h后也开始出现下降趋势(图7D),这表明di-cis-可能转化为mono-cis-或随着加热时间延长而发生氧化降解。Sharma[24]、Cole[29-30]等推测番茄红素的降解经历了从all-trans-到mono-cis-或多顺式(poly-cis-)的转变,和进一步氧化降解成小分子物质两个阶段,本研究结果也显示纯化番茄红素在高温条件下从all-trans-到mono-cis-再到di-cis-的转变,这些变化将导致番茄红素的颜色变浅直至消失,其生物活性也会逐渐丧失。
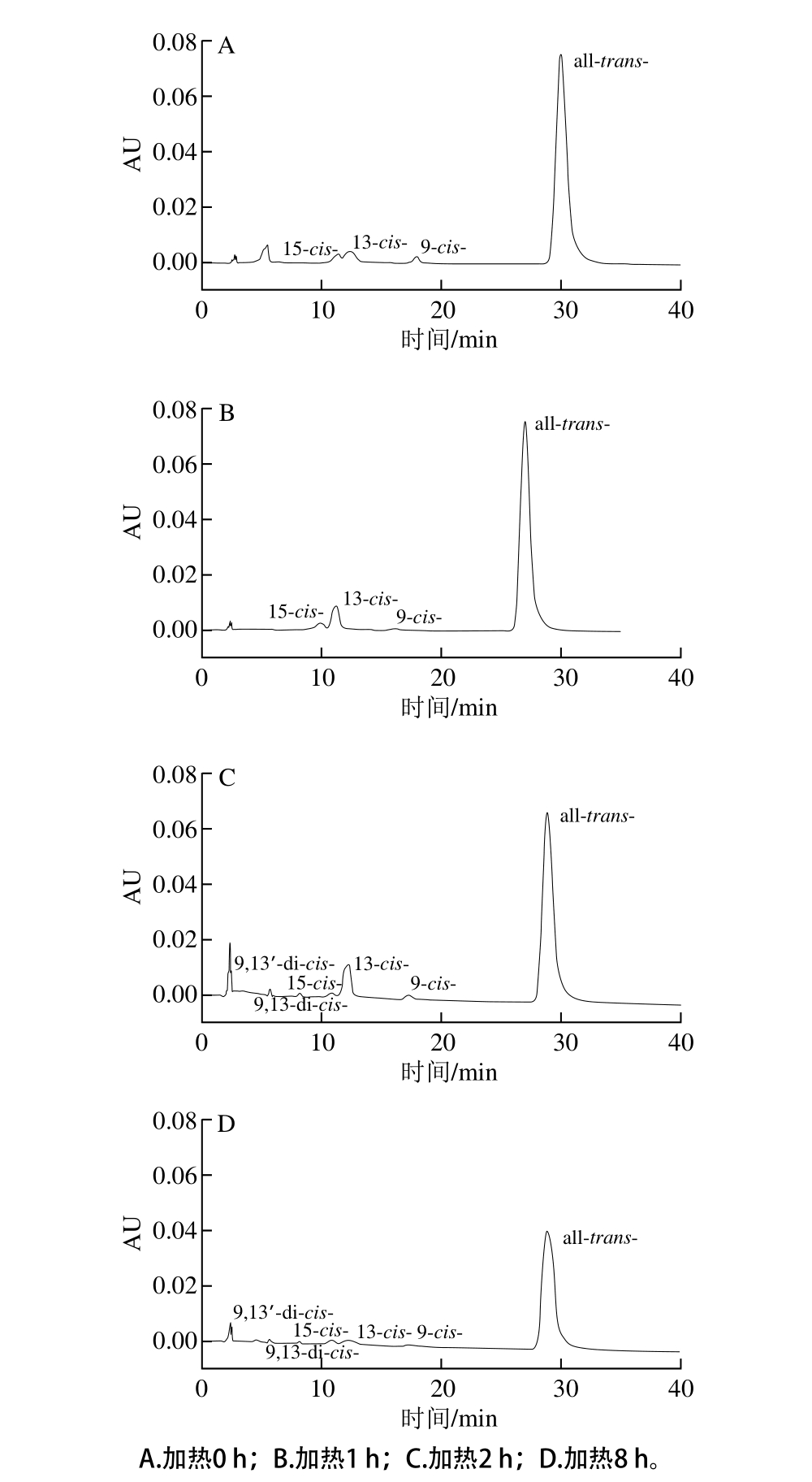
图7 热处理过程中番茄红素及其顺式异构体的HPLC分析
Fig. 7 HPLC analysis of lycopene and its cis-isomers during thermal treatment
在热处理之前,番茄红素体系中分别含有94.1%的all-trans-番茄红素,1.04%的15-cis-、2.25%的13-cis-及1.21%的9-cis-番茄红素。加热8 h后,体系中分别含有87.1%的all-trans-番茄红素、0.21%的9,13’-di-cis-、0.08%的9,13-di-cis-、1.02%的15-cis-、3.23%的13-cis-及1.35%的9-cis-番茄红素,可以发现加热后单顺式番茄红素总含量有些微上升,双顺式异构体也明显增加,而全反式all-trans-番茄红素百分比显著下降。由此可知,在番茄红素热降解过程中,双顺式异构体di-cis-是由all-trans-及mono-cis-异构体转变而成,而mono-cis-异构体也是由all-trans-转变而来,此外di-cis-异构体也可转变为mono-cis-异构体,但持续加热会促使这类di-cis-异构体和mono-cis-异构体发生降解生成小分子物质,所以各异构体含量在加热8 h后均发生显著损失。纯化番茄红素热处理过程中的降解途径如图8所示。

图8 热处理过程中番茄红素的降解途径
Fig. 8 Proposed degradation pathway of lycopene during thermal treatment
在所设定温度条件下,红葡萄柚汁中番茄红素及色泽热降解均为一级降解动力学,且二者线性关系良好,在所选温度范围内二者关系为:C/C0= 1.770 7(a*/a0*)+ 0.801 2,表明在线监测红葡萄柚加工过程中番茄红素含量变化这一难题可由在线监测色泽变化来解决,从而实现生产过程中的品质管理与实时监控。
此外,本研究发现红葡萄柚汁中番茄红素的热稳定性较纯化后番茄红素体系热稳定性差,半衰期更短,可能是内源因子如VC、糖、部分金属离子等对番茄红素具有促降解作用;纯化后番茄红素在模拟体系中也是符合一级降解动力学的,其色泽变化同样符合一级反应动力学,二者线性关系良好。但与红葡萄柚汁体系不同的是,番茄红素与色泽线性关系随温度变化而发生改变,70、80、90 ℃条件下线性方程分别为:C/C0=1.856(a*/a0*)-0.841 5(70 ℃)、C/C0=1.714(a*/a0*)-0.711 8(80 ℃)、C/C0=1.492 1(a*/a0*)-0.467 2(90 ℃)。纯化番茄红素色泽对温度的敏感性远高于红葡萄柚色泽的温度敏感性,高温条件下(80、90℃)当番茄红素含量变化时,纯化番茄红素体系的色泽变化高于红葡萄柚汁色泽的变化;这一差异可能是由红葡萄柚汁复杂体系中所含的其他物质对番茄红素的降解所造成的。
本实验利用HPLC-PAD对热处理过程中番茄红素的降解途径进行了监测,对比其在加热过程中各顺反异构体的含量与百分比变化,进而了解其降解规律。研究发现随着热处理过程延长,单顺式mono-cis-异构体呈现先上升后下降的趋势,加热2 h后生成的双顺式di-cis-异构体由于向mono-cis-转变或发生降解,其含量在加热4 h后也开始下降,而全反式all-trans-番茄红素在整个加热过程中呈持续下降趋势,这是由于其转变为mono-cis-异构体继而发生氧化降解所造成的。表明番茄红素的热降解是由多种异构化反应而造成的,当异构化反应达到最大化后,继续加热会导致这些异构化产物氧化为小分子醛酮,从而造成总番茄红素含量的下降。
参考文献:
[1] PUPIN A M, DENNIS M J, TOLEDO M C F, et al. HPLC analysis of carotenoids in orange juice[J]. Food Chemistry, 1999, 64(2): 269-275. DOI:10.1016/S0308-8146(98)00095-8.
[2] 杨阳, 刘蕊, 王英明, 等. 番茄红素提纯工艺条件的研究[J]. 中国酿造, 2016, 35(3): 111-113. DOI:10.11882/j.issn.0254-5071.2016.03.025.
[3] MEL☒NDEZ-MART☒NEZ A J, VICARIO I M, HEREDIA F J. Review: analysis of carotenoids in orange juice[J]. Journal of Food Composition and Analysis, 2007, 20(7): 638-649. DOI:10.1016/ j.jfca.2007.04.006.
[4] P☒REZ-MASI☒ R, LAGARON J M, LOPEZ-RUBIO A. Morphology and stability of edible lycopene-containing microand nanocapsules produced through electrospraying and spray drying[J]. Food Bioprocess Technology, 2015, 8(2): 459-470. DOI:10.1007/s11947-014-1422-7.
[5] 孙杰, 胡奇, 李世芬, 等. 番茄红素的安全性评价及对小鼠免疫功能的影响[J]. 食品科学, 2015, 36(9): 170-175. DOI:10.7506/spkx1002-6630-201509031.
[6] MART☒NEZ-HERN☒NDEZ G B, BOLUDA-AGUILAR M, TABOADA-RODR☒GUEZ A, et al. Processing, packaging, and storage of tomato products: influence on the lycopene content[J]. Food Engineering Reviews, 2016, 8(1): 52-75. DOI:10.1007/s12393-015-9113-3.
[7] 摆玉芬, 刘玉梅. 番茄红素分析方法的研究进展[J]. 食品研究与开发, 2004, 35(3): 264-267. DOI:10.7506/spkx1002-6630-201403052.
[8] JOHN S, YUZHU D, YUKIO K, et al. Effect of heating and exposure to light on the stability of lycopene in tomato puree[J]. Food Control, 2008, 19(5): 514-520. DOI:10.1016/j.foodcont.2007.06.002.
[9] LEE M T, CHEN B H. Stability of lycopene during heating and illumination in a model system[J]. Food Chemistry, 2002, 78(4): 425-443. DOI:10.1016/S0308-8146(02)00146-2.
[10] LEE H S, CASTLE W S, COATES G A. High-performance liquid chromatography for the characterization of carotenoids in the new sweet orange (Early gold) grown in Florida[J]. Journal of Chromatography A, 2001, 913(1/2): 371-377. DOI:10.1016/S0021-9673(00)01029-3.
[11] MAYER-MIEBACH E, BEHSNILIAN D, REGIER M, et al. Thermal processing of carrots: lycopene stability and isomerisation with regard to antioxidant potential[J]. Food Research International, 2005, 38(8/9): 1103-1108. DOI:10.1016/j.foodres.2005.03.018.
[12] LAMBELET P, RICHELLE M, BORTLIK K, et al. Improving the stability of lycopene Z-isomers in isomerised tomato extracts[J]. Food Chemistry, 2009, 11(1): 156-161. DOI:10.1016/ j.foodchem.2008.05.053.
[13] 陈伟, 丁霄霖. 番茄红素化学和生物学特性[J]. 粮食与油脂, 2002(7): 47-49. DOI:10.3969/j.issn.1008-9578.2002.07.018.
[14] LEE H, COATE S G. Thermal pasteurization effects on color of red grapefruit juices[J]. Journal of Food Science, 2006, 64(4): 663-666. DOI:10.1111/j.1365-2621.1999.tb15106.x.
[15] XU Yuan, PAN Siyi. Effects of various factors of ultrasonic treatment on the extraction yield of all-trans-lycopene from red grapefruit (Citrus paradise Macf.)[J]. Ultrasonics Sonochemistry, 2013, 20(4): 1026-1032. DOI:10.1016/j.ultsonch.2013.01.006.
[16] 张连富, 丁霄霖. 番茄红素简便测定方法的建立[J]. 食品与发酵工业, 2001, 27(3): 51-55. DOI:10.3321/j.issn:0253-990X.2001.03.015.
[17] 惠伯棣, 李京, 裴凌鹏. 应用C30-HPLC-PDA分离与鉴定番茄红素几何异构体[J]. 食品工业科技, 2006, 27(7): 49-54. DOI:10.13386/ j.issn1002-0306.2006.07.009.
[18] SUN Yujing, LIU Donghong, CHEN Jianchu, et al. Effect of different factors of ultrasound treatment on the extraction yield of the all-transβ-carotene from citrus peels[J]. Ultrasonics Sonochemistry, 2011, 18(1): 243-249. DOI:10.1016/j.ultsonch.2010.05.014.
[19] LEE M, CHEN B. Separation of lycopene and its cis isomers by liquid chromatography[J]. Chromatographia, 2001, 54(9): 613-617. DOI:10.1007/BF02492187.
[20] SCHEIBNER M, H☒LSDAU B, ZELENA K. Novel peroxidases of Marasmius scorodonius degrade β-carotene[J]. Applied Microbiology and Biotechnology, 2008, 77(6): 1241-1250. DOI:10.1007/s00253-007-1261-9.
[21] COLLE I J P, LEMMENS L, BUGGENHOUT S V. Modeling lycopene degradation and isomerization in the presence of lipids[J]. Food and Bioprocess Technology, 2013, 6: 909-918. DOI:10.1007/ s11947-011-0714-4.
[22] 曹少谦, 刘亮, 张超, 等. 桑葚花色苷的分离纯化及其热降解动力学研究[J]. 中国食品学报, 2015, 15(5): 55-62. DOI:10.16429/j.1009-7848.2015.05.008.
[23] 王晓文, 张华伟, 闫圣坤, 等. 番茄红素在微乳液制备和贮藏过程中构型转化及稳定性研究[J]. 食品与生物技术学报, 2013, 32(1): 22-29. DOI:10.3969/j.issn.1673-1689.2013.01.004.
[24] SHARMA S K, MAGUER M L. Kinetics of lycopene degradation in tomato pulp solids under different processing and storage conditions[J]. Food Research International, 1996, 29(3/4): 309-315. DOI:10.1016/0963-9969(96)00029-4.
[25] PATIL B S, VANAMALA J, HALLMAN G. Irradiation and storage influence on bioactive components and quality of early and late season ‘Rio Red’ grapefruit (Citrus paradisi Macf.)[J]. Postharvest Biology and Technology, 2004, 34(1): 53-64. DOI:10.1016/ j.postharvbio.2004.03.015.
[26] THIZIRI H, CLAUDIE D M, KHODIR M, et al. Thermal degradation kinetics of xanthophylls from blood orange in model and real food systems[J]. Food Chemistry, 2013, 138(4): 2442-2450. DOI:10.1016/ j.foodchem.2012.12.022.
[27] DUTTA D, DUTTA A, RAYCHAUDHURI U, et al. Rheological characteristics and thermal degradation kinetics of beta-carotene in pumpkin puree[J]. Journal of Food Engineering, 2006, 76(4): 538-546. DOI:10.1016/j.jfoodeng.2005.05.056.
[28] SRIVASTAVA S, SRIVASTAVA A K. Lycopene, chemistry, biosynthesis, metabolism and degradation under various abiotic parameters[J]. Journal of Food Science and Technology, 2015, 52(1): 41-53. DOI:10.1007/s13197-012-0918-2.
[29] COLE E R, KAPUR N S. The stability of lycopene I, degradation by oxygen[J]. Journal of the Science of Food and Agriculture, 1975, 8: 360-365. DOI:10.1002/jsfa.2740080610.
[30] COLE E R, KAPUR N S. The stability of lycopene II, oxidation during heating of tomato pulps[J]. Journal of the Science of Food and Agriculture, 1975, 8: 366-368. DOI:10.1002/jsfa.2740080611.
Thermal Degradation Kinetics and Mechanism of Lycopene and Color in Red Grapefruit
XU Yuan1, PAN Siyi2,*
(1. College of Life Sciences, Jianghan University, Wuhan 430100, China; 2. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Abstract:The thermal degradation kinetics of lycopene and color in red grapefruit was investigated. The results indicated that the degradation of lycopene and color followed the first-order kinetics. The relationship between lycopene content and color during thermal processing at selected temperatures could be expressed by the same equation: C/C0= 1.770 7 (a*/a0*) + 0.801 2. The relationship between purified lycopene content and color at 70, 80 and 90 ℃ could be described by the following equations: C/C0= 1.856(a*/a0*) − 0.841 5, C/C0= 1.714 (a*/a0*) − 0.711 8, and C/C0= 1.492 1 (a*/a0*) − 0.467 2, respectively. The thermal degradation pathway of lycopene as determined by high performance liquid chromatography coupled with photodiode array detection (HPLC-PAD) included the transformation of all-trans-lycopene into mono-cis-isomer and further into di-cis-isomer during heating, which could be transformed into mono-cis-isomer or degraded, resulting in a decrease in the content of total lycopene.
Key words:red grapefruit; lycopene; color; thermal degradation kinetics; degradation mechanism
DOI:10.7506/spkx1002-6630-201711014
中图分类号:TS202.3
文献标志码:A
文章编号:1002-6630(2017)11-0081-08
引文格式:
徐媛, 潘思轶. 红葡萄柚番茄红素和色泽热降解动力学及降解机制[J]. 食品科学, 2017, 38(11): 81-88. DOI:10.7506/ spkx1002-6630-201711014. http://www.spkx.net.cn
XU Yuan, PAN Siyi. Thermal degradation kinetics and mechanism of lycopene and color in red grapefruit[J]. Food Science, 2017, 38(11): 81-88. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711014. http://www.spkx.net.cn
收稿日期:2016-06-01
基金项目:国家自然科学基金面上项目(31571847)
作者简介:徐媛(1986—),女,讲师,博士,研究方向为食品科学。E-mail:xuyuan0804@163.com
*通信作者:潘思轶(1965—),男,教授,博士,研究方向为食品科学。E-mail:pansiyispkx@163.com