姚 蓓,赵慧芳,吴文龙,李维林*
(江苏省中国科学院植物研究所,江苏 南京 210014)
摘要:本研究探讨了pH值、辅色剂、SO2、微波对5 个不同蓝莓品种(巴尔德温、巨蓝、园蓝、灿烂和安娜)花色苷色素稳定性的影响。结果表明,蓝莓色素在pH<4.0时呈红色,且在pH 3.0条件下稳定性较强。不同辅色剂中以对羟基苯甲酸、苹果酸、柠檬酸、阿魏酸和单宁酸的辅色作用最强,其次是丁二酸、抗坏血酸和蔗糖,异抗坏血酸则具有显著的减色作用。丁二酸、蔗糖和单宁酸不仅具有辅色作用,而且能够增强花色苷的热稳定性。SO2和微波处理对蓝莓色素具有破坏作用。在本研究条件下,通过综合分析得出5 个蓝莓品种花色苷色素的稳定性由强及弱排序依次为巴尔德温、巨蓝、园蓝、灿烂和安娜。
关键词:蓝莓;花色苷;色度;稳定性
蓝莓又称越桔、蓝浆果,为杜鹃花科越橘属浆果类果树,栽培驯化源于美国。我国越橘属植物栽培最早集中分布于大小兴安岭和长白山地区,直至20世纪80年代后期,江苏省中国科学院植物研究所开始进行兔眼蓝莓和南方高丛蓝莓的引种研究,探索其在长江流域及南方丘陵地区的适应性与丰产性[1]。
蓝莓以富含花色苷类物质而著称。除了气味、滋味和质地,颜色是食品最重要的品质,而花色苷作为天然水溶性色素以其独特的艳丽色彩,被广泛应用于果酒、饮料、果冻、冰淇淋、糖果、糕点等食品行业,并且因其特殊的生理活性,包括抗氧化、抗炎症、抗衰老、抗癌变等,倍受功能性食品和药品研发领域人士的关注。然而,花色苷稳定性较差、化学性质极不稳定,其颜色和生物活性除了受本身化学结构的影响之外,还受外界环境如pH值、温度、光照、化学添加剂(酶、抗坏血酸、蔗糖等)[2-4]的影响。花色苷的半衰期短、生物利用率低,在加工过程中需尽力保持其理化稳定性。
本实验选取5 个蓝莓品种,以色度、色素保存率为指标,通过对不同pH值、辅色剂,以及不同SO2质量浓度和微波(700 W)时间(蓝莓果品加工中可能存在的因素)的考察,比较5 个品种蓝莓色素稳定性的差异,为不同蓝莓栽培品种的评价及食品加工原料的选择提供参考。
1.1 材料与试剂
兔眼蓝莓:园蓝(Garden Blue)、灿烂(Bright Well)、巴尔德温(Baldwin)、巨蓝(Plolific)、高丛蓝莓:安娜(Anna),2015年6—7月蓝莓成熟期购于种植基地农户,清洗晾干后装袋密封,-18 ℃条件下速冻保存。
柠檬酸、磷酸氢二钠、抗坏血酸、异抗坏血酸钠、蔗糖、单宁酸、苹果酸、阿魏酸、对羟基苯甲酸、丁二酸、偏重亚硫酸钾等试剂均为国产分析纯。
1.2 仪器与设备
HH-S11-2-S型电热恒温水浴锅 上海新苗医疗器械制造有限公司;FA1004电子天平 上海舜宇恒丰科学仪器有限公司;KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;WP700TL23-K5型微波炉 佛山市格兰仕微波炉电器有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 蓝莓色素的制备
称取一定量的蓝莓冻果,微波解冻,充分破碎后,用体积分数0.5% HCl-50%乙醇溶液按照料液比1∶15(m/V)混合均匀,于30 ℃超声提取30 min后离心并收集上清液,经30 ℃减压浓缩得到紫红色黏稠的粗提液。取适量预先处理的LS-305大孔树脂湿法装柱(20 mm×400 mm),上样流速为5 mL/min,上样结束后,用蒸馏水洗至洗出液的固形物含量为0%,用0.5% HCl-50%乙醇洗脱,洗脱流速为6 mL/min,洗脱液30 ℃减压浓缩,真空冷冻干燥得到纯化后的蓝莓色素紫黑色粉末。
1.3.2 蓝莓色素稳定性的测定
1.3.2.1 pH值对色素稳定性的影响
称取蓝莓色素粉末0.05 g,分别用pH 2.2、3.0、4.0、5.0、6.0、7.0、8.0磷酸氢二钠-柠檬酸缓冲溶液溶解并定容至50 mL,在400~700 nm波长范围内进行光谱扫描,记录最大吸收波长,测定吸光度并观察色泽,然后将不同pH值的色素溶液置于70 ℃水浴30 min后冷却,测定其在最大吸收波长处的吸光度,按式(1)计算色素保存率。
评价不同pH值条件下蓝莓色素的变化,用分光光度法[5]以色度表示,计算公式如式(2)所示。
式中:I为色度,表示颜色强度(适用于红葡萄酒);A420nm为420 nm波长处光程为1 cm的吸光度(肉眼可见的黄光);A520nm为520 nm波长处光程为1 cm的吸光度(肉眼可见的红光);A620nm为620 nm波长处光程为1 cm的吸光度(肉眼可见的紫光)。
1.3.2.2 SO2处理对色素稳定性的影响
向50 mL质量浓度1 g/L、pH 3.0的色素水溶液中添加不同质量的偏重亚硫酸钾,使其SO2质量浓度为0、5、10、20、50、100、150、200 mg/L,避光放置30 min。每个处理重复3 次,测定吸光度,并计算色度。SO2质量浓度计算公式如式(3)所示[6]。
式中:ρ为需要达到的SO2的质量浓度/(mg/L);m为需要添加的偏重亚硫酸钾的质量/g;V为汁(或酒)的体积/L。
1.3.2.3 辅色剂对色素稳定性的影响
配制10 mL质量浓度1 g/L、pH 3.0的色素水溶液,分别取1 mL与质量浓度为6.25 g/L的柠檬酸、抗坏血酸、异抗坏血酸钠、蔗糖、单宁酸、苹果酸、阿魏酸、对羟基苯甲酸、丁二酸溶液各4 mL混匀,混匀后辅色剂质量浓度均为5 g/L,以1 mL色素溶液添加4 mL纯水为对照,重复3 次,置于70 ℃水浴30 min后冰水冷却,在最大吸收波长处测定辅色剂作用下高温处理前后的吸光度,并按式(2)计算色度。
1.3.2.4 微波处理对色素稳定性的影响
配制pH 3.0色素溶液60 mL,分为3 份,每份20 mL至于玻璃试管中密封,微波中火分别加热10、20、30 s,重复3 次,取出用温度计迅速测其温度,然后浸入冰水冷却10 min后,观察颜色变化,测定吸光度,并分别按式(1)、(2)计算色素保存率和色度。
1.4 数据处理
数据采用SPSS 19.0软件进行单因素方差分析,用Duncan进行差异显著性检验,Origin 8.0软件进行作图。
2.1 pH值对色素稳定性的影响
2.1.1 pH值对色度的影响
花色苷的结构随pH值不同而改变,在酸性溶液中,花色苷存在4 种主要形式的平衡:红色黄烊阳离子、无色甲醇碱或甲醇假碱、无色查尔酮、蓝色醌式碱,在较低pH值条件下(pH<2),花色苷主要以红色的黄烊阳离子形式存在,当pH值为3~6时,黄烊阳离子被水亲核攻击而水合,浓度下降,使花色苷主要以无色的甲醇假碱和查尔酮假碱的形式存在,随着pH值的升高黄烊离子失去质子,蓝色醌式碱随之增加,当pH值上升到8~10时,花色苷主要以蓝色离子化的醌式碱形式存在[7-8]。实验发现蓝莓色素溶液的颜色在酸性条件下显色较好,呈红色,随pH值变大,花色苷溶液的颜色经由深变浅再变深的过程,在中性或近中性条件下呈无色,在碱性条件下呈蓝色。参照葡萄酒色度的测定方法,测定了不同pH值条件下蓝莓色素溶液的色度,结果见图1。
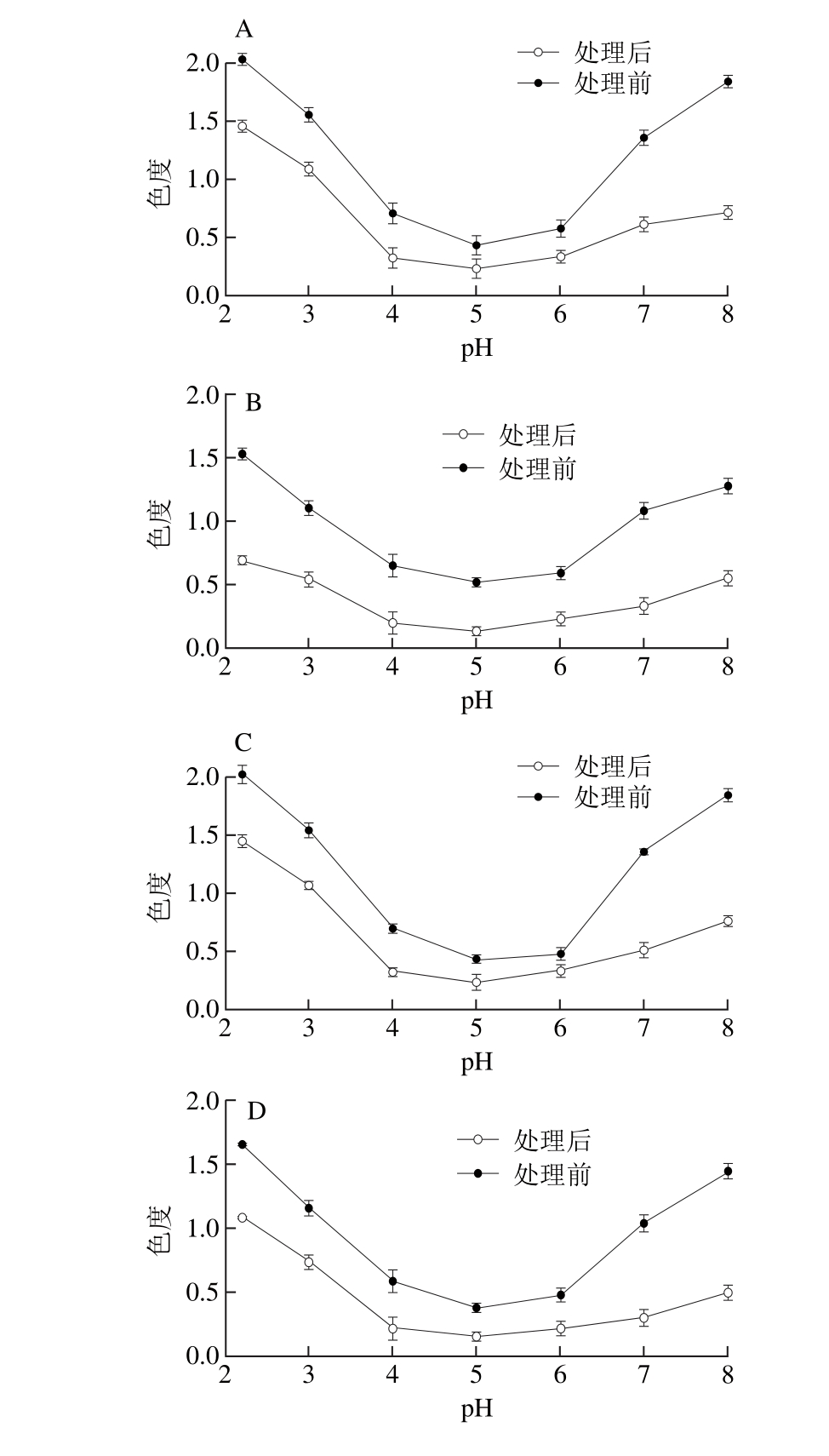
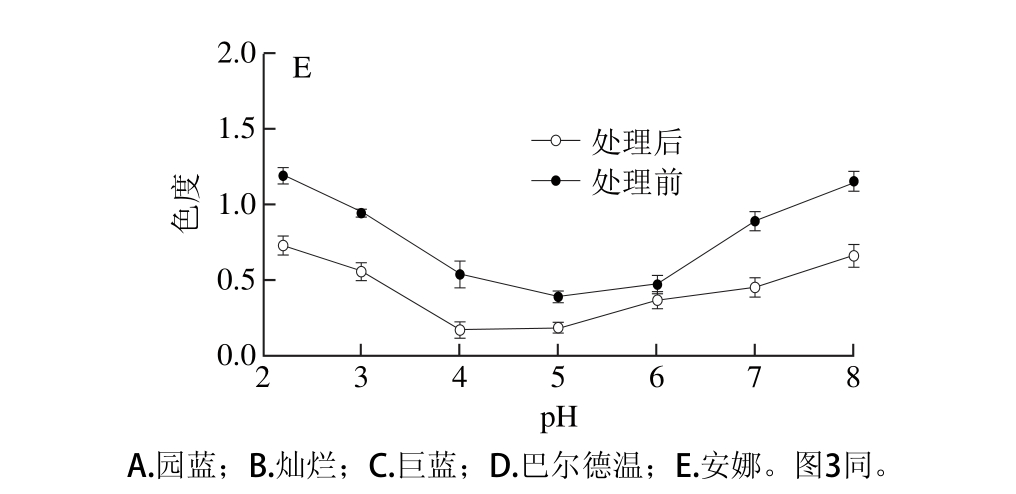
图1 pH对5 个蓝莓品种花色苷色素色度的影响
Fig. 1 Effect of pH on the stability of anthocyanins from five blueberry cultivars
从图1可以看出,5 个蓝莓品种在不同pH值条件下色度的变化趋势一致,酸性条件下(pH<4.0)溶液的色度值较高,随pH值变大,色度值先降后升,呈U形。70 ℃条件下处理30 min后,溶液的色度则普遍下降,其中灿烂色素溶液的色度下降幅度较大,园蓝和巨蓝下降幅度较小。
2.1.2 pH值对色素最大吸收波长及稳定性的影响
已知花色苷类的特征吸收峰在280 nm和520 nm波长处左右,280 nm处左右的吸收峰表明,蓝莓色素可能为复杂花色苷类物质[9],本实验发现,酸性条件下(pH 2.2~4.0)蓝莓色素溶液呈红色,在可见光区的最大吸收峰在520 nm处左右(表1),pH值变化会导致最大吸收峰移动,但在酸性条件下其最大吸收峰的移动范围较小,每个pH值单位波动约为1~5 nm。在pH 5.0~8.0的中性偏碱性溶液中,溶液颜色由红色变逐渐变浅,转而为浅蓝到深灰,其最大吸收峰的移动范围较大,每个pH值单位波动约为10~20 nm。
表1 不同pH条件下5 个蓝莓品种花色苷的最大吸收波长和保存率
Table 1 Maximum absorption wavelengths and preservation rates of anthocyanins from five blueberry cultivars at different pH levels

由表1可见,随pH值的增加,整体上色素保存率呈降低趋势,即色素的稳定性下降,但pH 3.0条件下的色素保存率略高于pH 2.2时,由此可见,蓝莓花色苷色素在pH 3.0左右稳定性较好。比较5 个品种蓝莓花色苷色素在不同pH值条件下的色素保存率发现,酸性条件下(pH 2.2~5.0)巴尔德温和巨蓝的色素保存率高于灿烂、园蓝和安娜,说明巴尔德温和巨蓝色素酸性条件下的稳定性较强。
2.2 SO2处理对色素稳定性的影响
SO2在食品加工领域属于重要的添加剂,如在蓝莓果酒加工中添加适量的SO2具有抑制杂菌、抗氧化、澄清、增酸作用,并能防止褐变,保持原果香味和果酒酒色[10],同时SO2也是漂白剂,对于花色苷含量丰富、色泽靓丽的物料而言,SO2的添加量要适度。对不同质量浓度SO2对蓝莓色素的影响进行了实验,结果见图2。
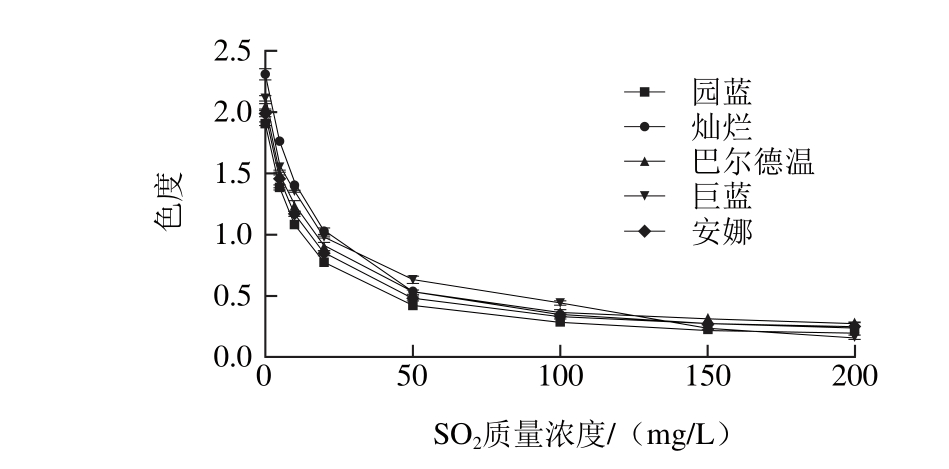
处理对5 个蓝莓品种花色苷稳定性的影响
Fig. 2 Effect of SO2on the stability of anthocyanins from five blueberry cultivars
图2 SO2
由图2可见,5 个蓝莓品种的色素溶液随着SO2质量浓度增加,色度逐渐降低,溶液颜色逐渐消褪,由红色渐变为淡粉色,其原因可能是SO2在酸性条件下形成HSO3-,对花色苷的C2或C4位亲核形成无色的花色苷亚硫酸盐复合物[11];其次SO2也可能起到漂白剂的作用。由此可见,SO2对蓝莓花色苷具有显著的减色作用。根据GB 2760—2014《食品添加剂使用标准》及相关研究结论[12-15],结合本实验分析,建议在食品加工中SO2的质量浓度<20 mg/L。相比较5 个品种发现,在相同的SO2质量浓度条件下,5 个品种间色素的色度比较接近,说明5 个蓝莓品种在SO2的影响下其色素稳定性的表现无明显差异。
2.3 辅色剂对花色苷稳定性的影响

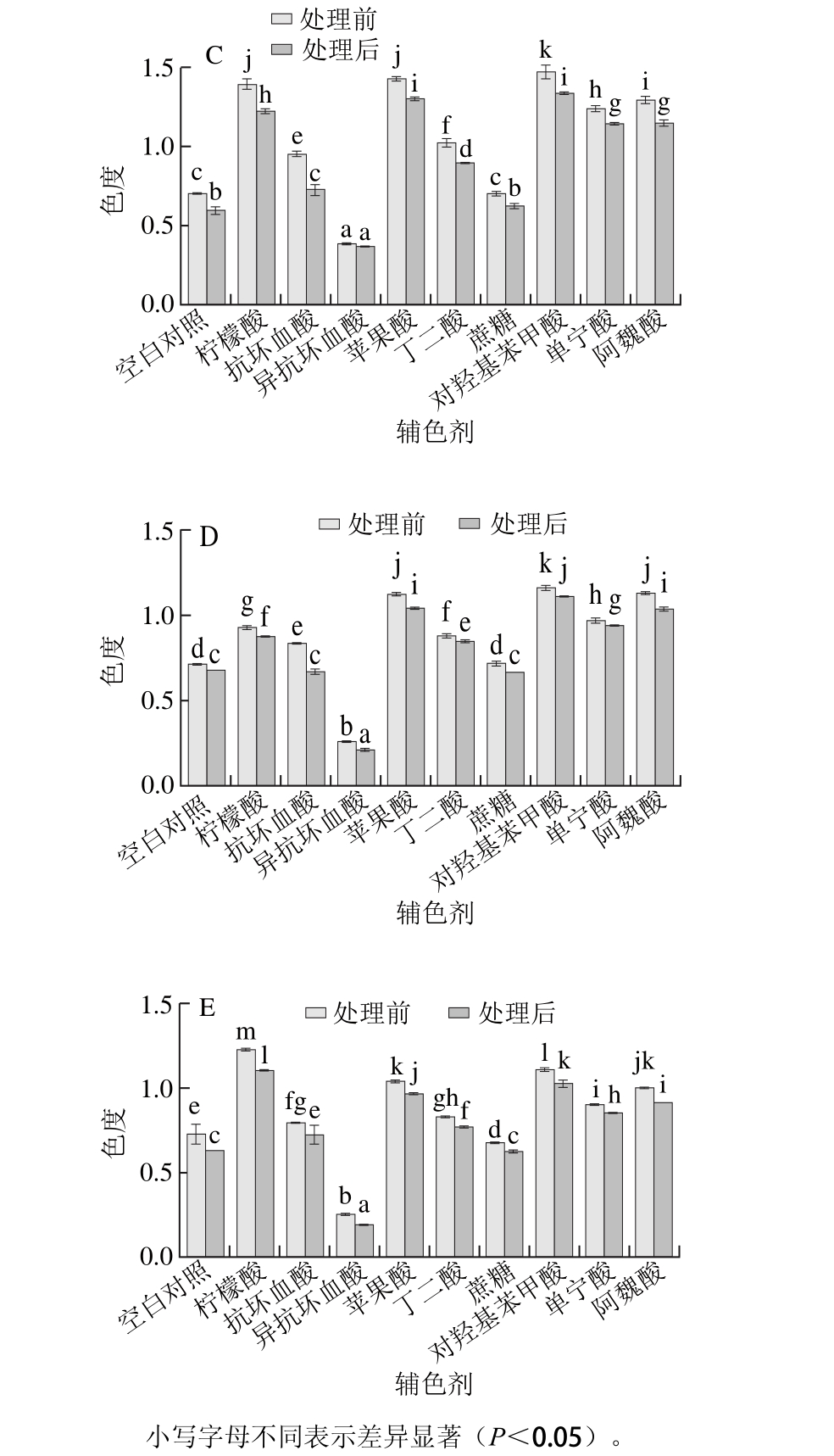
图3 辅色剂对5 个蓝莓品种花色苷稳定性的影响
Fig. 3 Effect of co-pigments on the stability of anthocyanins from five blueberry cultivars
能使花色苷颜色稳定并加深的作用称为共色作用,按其反应途径分为分子内共色作用、分子间共色作用、自聚作用和金属络合作用,辅色剂对花色苷的辅色反应属于分子间共色[8]。由图3可知,在本实验条件下,9 种辅色剂除异抗坏血酸具有显著的减色作用外,其他8 种辅色剂添加后蓝莓色素溶液的色度均大于对照,具有增色作用。同一品种不同实验组之间及实验组与空白对照组之间色度变化存在显著差异(P<0.05),其中实验组与空白对照组差异较显著的是对羟基苯甲酸、苹果酸、柠檬酸、阿魏酸、单宁酸,其次是丁二酸、抗坏血酸,而蔗糖与空白对照组差异不显著。此趋势在5 个品种蓝莓色素中表现基本一致。本实验中抗坏血酸与异抗坏血酸的辅色作用与众多研究结论相背,研究表明各质量浓度的抗坏血酸都会使花色苷降解,随质量浓度提高,破坏作用加强[16-18]。但异抗坏血酸对花色苷的稳定性表现出双重的影响,在低浓度时(<0.5 mmol/L)表现出增色作用,高浓度时表现出减色作用[19-20],对此最被普遍认可的是抗坏血酸和异抗坏血酸易被氧化生成H2O2,而H2O2会导致花色苷降解[21]。本实验中与之相符的是异抗坏血酸质量浓度为5 g/L(相当于25.3 mmol/L),添加到色素溶液中立刻表现出显著的减色效果,而抗坏血酸的辅色表现则与之不符,究其原因可能与非酶褐变有关,在pH>3时非酶褐变反应速率随pH值增大而加快,导致颜色降解,而在pH<3时非酶褐变缓慢,抗坏血酸在pH 3.0左右时较稳定[22],有可能与花色苷发生共色反应。
表2 70 ℃处理30 min前后5 个蓝莓品种花色苷的色度变化值
Table 2 Change in chromaticity of anthocyanins from five blueberry cultivars at 70 ℃ for 30 min
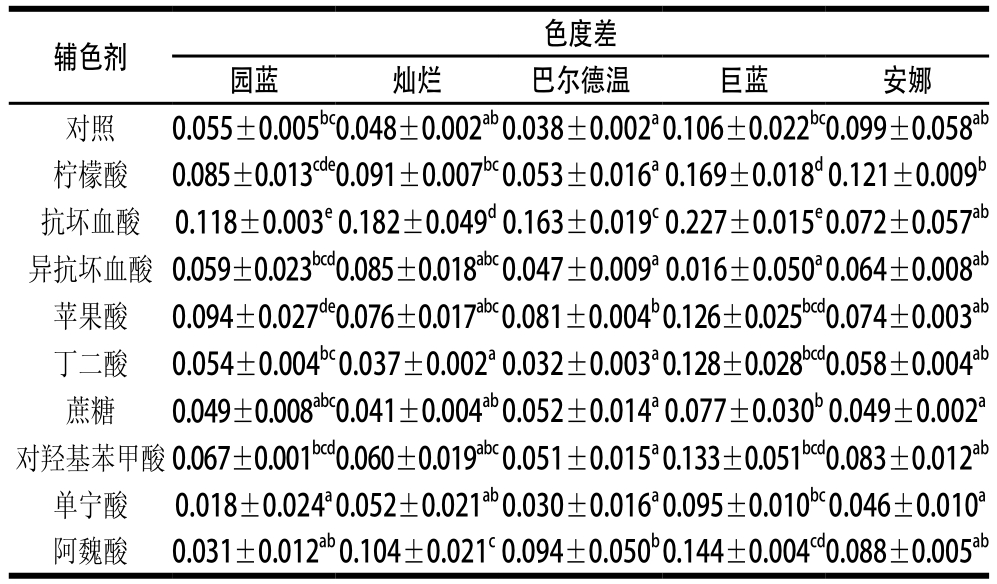
注:同列肩标小写字母不同表示差异显著(P<0.05)。
本实验同时还考察了添加辅色剂后色素溶液的稳定性,通过70 ℃水浴30 min的处理,结果发现处理后溶液的色度均较处理前低,但是处理后添加具有增色效果辅色剂的溶液的色度仍比对照高(图3),说明其在辅色的同时还能增强色素的稳定性,即在高温处理时(70 ℃条件,30 min内)具有抑制颜色消褪的护色作用。研究表明,分子间共色导致花色苷与辅色剂构建出特殊的层状结构,层叠过程产生疏水作用,保护花色苷母核阳离子免受水化反应攻击而减少无色假碱生成[23],很大程度上提高花色苷的稳定性,而且能加强花色苷的呈色效果,红色色调加深[24-25]。比较添加辅色剂的蓝莓色素溶液高温处理前后的色度差值与对照的区别发现,分别添加丁二酸、蔗糖、单宁酸的溶液高温处理前后的色度差值总体上较对照溶液的小(表2),而分别添加柠檬酸、苹果酸、对羟基苯甲酸、阿魏酸、抗坏血酸的色素溶液处理前后的色度差值基本大于对照,可能原因是丁二酸、蔗糖、单宁酸分别与花色苷构筑成的特殊结构比花色苷原有结构的稳定性强,在70 ℃水浴30 min的处理条件下,此结构的受损程度比花色苷本身结构的受损程度轻,因此其色度差值比对照小。而柠檬酸、苹果酸、对羟基苯甲酸、阿魏酸、抗坏血酸与花色苷构筑成的特殊结构比花色苷本身结构的稳定性弱,在70 ℃水浴30 min的处理条件下,此结构的受损程度比花色苷本身结构的受损程度重,因此其色度差值比对照大。综上分析,在70 ℃水浴30 min的处理下,丁二酸、蔗糖、单宁酸对蓝莓花色苷的护色作用较强。
2.4 微波对花色苷稳定性的影响
表3 不同微波处理时间对5 个蓝莓品种色素稳定性的影响
Table 3 Effect of microwave treatment on the stability of anthocyanins from five blueberry cultivars
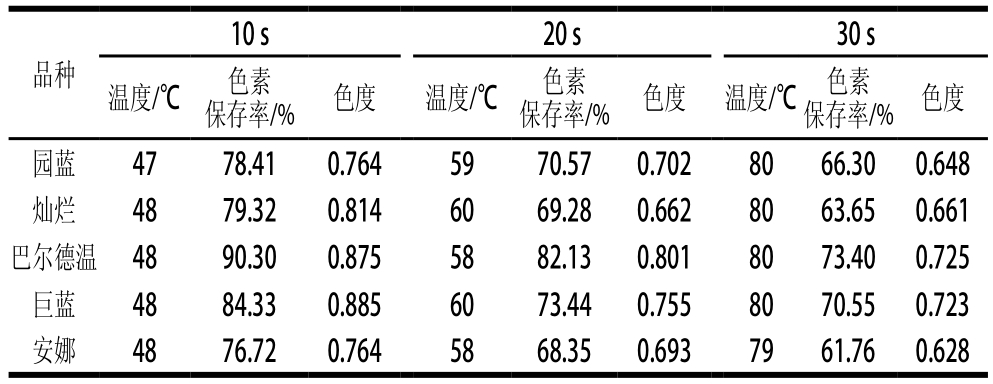
微波加热技术是利用电磁波、电磁场等物理微弱能量对食品、农产品加工、贮藏进行高效节能处理,主要起到加热和杀菌作用,与传统加热方式相比,微波加热的速率是其3~5 倍,因此在保证加热杀菌效果的同时有效降低物料的质量损耗[26]。本实验考察了微波处理对蓝莓色素保存率的影响。由表3可知,随着微波处理时间的延长,色素溶液的温度逐渐升高,5 个蓝莓品种色素在各梯度加热时间里所达到的温度较为一致,10 s时达47~48 ℃,20 s时达58~60 ℃,30 s时达79~80 ℃。而色度和色素保存率则随微波时间的延长而逐渐降低,10 s
时5 个品种蓝莓色素的色度为0.764~0.885,色素保存率在76.72%~90.30%;30 s时色度下降至0.628~0.725,色素保存率仅为61.76%~73.40%。由此可见微波处理具有促使红色消退、加速花色苷降解的作用。相比较5 个蓝莓品种的色素发现,在相同处理条件下巴尔德温的色度和色素保存率最高,而安娜的色度和色素保存率最低,5 个蓝莓品种中色素稳定性由强及弱依次为巴尔德温>巨蓝>园蓝>灿烂>安娜。
本实验选取兔眼和高丛两个蓝莓类型中的5 个品种分别在pH值、SO2、辅色剂、微波因素作用下对其花色苷色素稳定性进行研究,不同品种蓝莓花色苷色素的稳定性和色泽的变化趋势基本一致。蓝莓色素溶液在pH<4.0时显红色,且在pH 3.0左右色素保存率最高、稳定性最强,与此相关的是,辅色剂的辅色作用在酸性条件下才发生。对于多数的天然花色苷来说,辅助成色作用主要是在适当条件下,使花色苷的最大吸收波长红移,在可见波段的吸收增加[24]。研究表明单宁酸在pH 2.0~6.0的范围内对黑米、红树莓和甘蓝色素具有辅色作用,且在pH 3.0左右3 种色素的总色差差异显著[27]。另有研究发现在pH 3.0的条件有助于果胶维持黑加仑果浆花色苷的稳定性[28]。本实验辅色剂在pH 3.0花色苷水溶液中的辅色作用存在显著差异,辅色作用显著的有对羟基苯甲酸、苹果酸、柠檬酸、阿魏酸、单宁酸。本实验中蔗糖具有辅色作用,但效果不显著,可能的原因是高浓度的糖使水分活度降低,花色苷生成假碱式结构的速率减慢,花色苷颜色得到保护;低浓度的糖却使花色苷的降解和变色加速[29-30]。
蓝莓花色苷色素溶液在pH<4时色度较高,呈红色,并在pH 3.0时色素保存率最高,稳定性最强。辅色剂中对羟基苯甲酸、苹果酸、柠檬酸、阿魏酸、单宁酸的辅色作用最显著,其次是丁二酸、抗坏血酸、蔗糖,而异抗坏血酸具有显著的减色作用。其中丁二酸、蔗糖、单宁酸具有高温处理抑制颜色消褪的护色作用。SO2和微波处理均导致花色苷稳定性下降、颜色消褪,在实际生产应用中建议SO2质量浓度<20 mg/L,并减少微波的使用。
综合分析认为,5 个品种的蓝莓花色苷色素理化稳定性由强及弱依次为巴尔德温、巨蓝、园蓝、灿烂、安娜。同时认为,辅色剂对提高蓝莓色素的色泽强度和稳定性具有重要的实用意义。
参考文献:
[1] 於虹, 王传永, 吴文龙. 蓝浆果栽培与采后处理技术[M]. 北京: 金盾出版社, 2003: 6-8.
[2] GIUSTI M M, WROLSTAD R E. Acylated anthocyanins from edible sources and their applications in food systems[J]. Biochemical Engineering Journal, 2003, 14(3): 217-225. DOI:10.1016/S1369-703X(02)00221-8.
[3] CAVALCANTI R N, SANTOS D T, MEIRELES M A A. Nonthermal stabilization mechanisms of anthocyanins in model and food systems-an overview[J]. Food Research International, 2011, 44(2): 499-509. DOI:10.1016/j.foodres.2010.12.007.
[4] CASTA☒EDA-OVANDO A, PACHECO-HERN☒NDEZ M D L, P☒EZ-HERN☒NDEZ M E, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871. DOI:10.1016/ j.foodchem.2008.09.001.
[5] 赵慧芳, 吴文龙, 李维林. 黑莓、树莓露酒加工工艺研究[J]. 酿酒科技, 2015(11): 94-97; 101. DOI:10.13746/j.njkj.2015185.
[6] 樊玺, 阮仕立. 怎样在葡萄酒加工过程中更好地使用SO2[J]. 酿酒科技, 2003(1): 68-70. DOI:10.3969/j.issn.1001-9286.2003.01.022.
[7] COOPER-DRIVER G A. Contributions of Jeffrey Harborne and coworkers to the study of anthocyanins[J]. Phytochemistry, 2001, 56(3): 229-236. DOI:10.1016/S0031-9422(00)00455-6.
[8] 王锋, 邓洁红, 谭兴和, 等. 花色苷及其共色作用研究进展[J]. 食品科学, 2008, 29(2): 472-476. DOI:10.3321/j.issn:1002-6630.2008.02.104.
[9] 邝敏杰, 齐敏玉, 何静仁, 等. 紫菜薹花色苷组分鉴定及其稳定性和抗氧化性[J]. 中国农业科学, 2014(20): 4067-4077. DOI:10.3864/ j.issn.0578-1752.2014.20.015.
[10] 刘功良, 白卫东, 赵文红, 等. 贡柑果酒酿造工艺的研究[J]. 中国酿造, 2012, 31(8): 158-161. DOI:10.3969/j.issn.0254-5071.2012.08.048.
[11] 王孝荣, 罗佳丽, 潘年龙, 等. 草莓果酒酿造工艺的优化及其香气成分分析[J]. 食品科学, 2014, 35(7): 196-201. DOI:10.7506/spkx1002-6630-201407039.
[12] 卫生和计划生育委员会. 食品添加剂使用卫生标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2014: 17.
[13] 李东, 左勇, 祁峰, 等. 桑椹果酒稳定性研究[J]. 江苏农业科学, 2015, 43(3): 253-255. DOI:10.15889/j.issn.1002-1302.2015.03.083.
[14] 李伟雄, 刘功良, 陈伟. 脐橙果酒酿造工艺的研究[J]. 中国酿造, 2012, 31(8): 158-161. DOI:10.3969/j.issn.0254-5071.2012.08.056.
[15] 冀照君, 孙波, 迟玉杰, 等. 黑加仑果酒酿造工艺的研究[J]. 酿酒, 2010, 37(1): 69-71. DOI:10.3969/j.issn.1002-8110.2010.01.028.
[16] 曹雪丹, 方修贵, 赵凯, 等. 蓝莓汁花色苷热降解动力学及抗坏血酸对其热稳定性的影响[J]. 中国食品学报, 2013, 13(3): 47-54. DOI:10.16429/j.1009-7848.2013.03.023.
[17] 付红岩, 李自强, 姚晶, 等. 金属离子和食品添加剂对紫甘薯花色苷稳定性的影响[J]. 食品工业科技, 2013, 34(15): 273-276. DOI:10.13386/j.issn1002-0306.2013.15.059.
[18] 任二芳, 李昌宝, 孙健, 等. 金属离子和食品添加剂对桑果花色苷稳定性的影响[J]. 南方农业学报, 2014, 45(1): 98-103. DOI:10.3969/ j.issn.2095-1191.2014.1.98.
[19] 田密霞, 胡文忠, 李亚东, 等. 不同品种蓝莓花色苷稳定性的比较研究[J]. 食品工业科技, 2015, 36(13): 60-65. DOI:10.13386/ j.issn1002-0306.2015.13.004.
[20] 陈伟平, 陈华江, 曹雪丹, 等. 抗坏血酸和异抗坏血酸对蓝莓花色苷稳定性的影响[J]. 浙江农业科学, 2013(9): 1145-1148. DOI:10.3969/ j.issn.0528-9017.2013.09.032.
[21] 李颖畅, 孟宪军, 周艳, 等. 金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J]. 食品科学, 2009, 30(9): 80-84. DOI:10.3321/ j.issn:1002-6630.2009.09.019.
[22] 舒念辉. 果汁褐变及控制研究[J]. 食品与发酵科技, 2011(5): 59-61; 71. DOI:10.3969/j.issn.1674-506X.2011.05.016.
[23] MARKOVIĆ J D M, PETRANOVIĆ N A, BARANAC J M. The copigmentation effect of sinapic acid on malvin: a spectroscopic investigation on colour enhancement[J]. Journal of Photochemistry and Photobiology B Biology, 2005, 78(3): 223-228. DOI:10.1061/ j.jphotobiol.2004.11.009.
[24] 任玉林, 李华, 邴贵德, 等. 天然食用色素: 花色苷[J]. 食品科学, 1995, 16(7): 22-27.
[25] MAZZA G, BROUILLARD R. The mechanism of co-pigmentation of anthocyanins in aqueous solutions[J]. Medical Education, 1990, 29(4): 1097-1102. DOI:10.1016/0031-9422(90)85411-8.
[26] 余恺, 胡卓炎, 黄智洵, 等. 微波杀菌研究进展及其在食品工业中的应用现状[J]. 食品工业科技, 2005, 26(7): 185-189. DOI:10.3969/ j.issn.1002-0306.2005.07.071.
[27] 刘松, 李小定, 姜红, 等. 单宁酸对三种天然色素辅色作用的评价[J]. 食品工业科技, 2015, 36(20): 320-325. DOI:10.13386/ j.issn1002-0306.2015.20.057.
[28] BUCHWEITZ M, SPETH M, KAMMERER D R, et al. Impact of pectin type on the storage stability of black currant (Ribes nigrum L.) anthocyanins in pectic model solutions[J]. Food Chemistry, 2013, 139(1/2/3/4): 1168-1178. DOI:10.1016/j.foodchem.2013.02.005.
[29] WATANABE Y, YOSHIMOTO K, OKADA Y, et al. Effect of impregnation using sucrose solution on stability of anthocyanin in strawberry jam[J]. LWT-Food Science and Technology, 2011, 44(4): 891-895. DOI:10.1016/j.lwt.2010.11.003.
[30] 卢钰, 董现义, 杜景平, 等. 花色苷研究进展[J]. 山东农业大学学报(自然科学版), 2004, 35(2): 315-320. DOI:10.3969/ j.issn.1000-2324.2004.02.039.
Comparative Stability of Anthocyanins from Five Blueberry Cultivars
YAO Bei, ZHAO Huifang, WU Wenlong, LI Weilin*
(Institute of Botany, Jiangsu Province and Chinese Academy of Sciences, Nanjing 210014, China)
Abstract:In this study, four important factors including pH, co-pigment, sulfur dioxide and microwave influencing the stability of anthocyanins from five blueberry cultivars were investigated. It was found that the color of the blueberry pigments was red at pH less than 4.0, and the stability was stronger at pH 3.0. Five co-pigments including hydroxybenzoic acid, malic acid, citric acid, ferulic acid and tannic acid most significantly contributed to enhancing the color of the pigments, followed by succinic acid, ascorbic acid and sucrose. On the contrary, isoascorbic acid showed a remarkable negative effect on the color of blueberry anthocyanins. Furthermore, succinic acid, sucrose and tannic acid could also enhance the thermal stability of the anthocyanins. Additionally, sulfur dioxide and microwave could damage the stability of blueberry anthocyanins. Taking our results together, the stability of anthocyanins from five blueberry cultivars in this study was in the decreasing order Baldwin, Plolific, Garden Blue, Bright Well and Anna.
Key words:blueberry; anthocyanin; chroma; stability
DOI:10.7506/spkx1002-6630-201711023
中图分类号:S663.2
文献标志码:A
文章编号:1002-6630(2017)11-0142-06
引文格式:
姚蓓, 赵慧芳, 吴文龙, 等. 不同品种蓝莓花色苷色素稳定性的比较[J]. 食品科学, 2017, 38(11): 142-147. DOI:10.7506/
spkx1002-6630-201711023. http://www.spkx.net.cn
YAO Bei, ZHAO Huifang, WU Wenlong, et al. Comparative stability of anthocyanins from five blueberry cultivars[J]. Food Science, 2017, 38(11): 142-147. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711023. http://www.spkx.net.cn
收稿日期:2016-06-17
基金项目:南京市科技计划项目(201505033);江苏省农业科技自主创新资金项目(CX(15)1026)
作者简介:姚蓓(1991—),女,硕士研究生,研究方向为黑莓蓝莓等小浆果果品加工与果品化学。E-mail:yb910310@126.com
*通信作者:李维林(1966—),男,研究员,博士,研究方向为经济植物引种驯化、资源评价和开发利用。
E-mail:lwlcnbg@mail.cnbg.net