
胡 博1,2,范大明2,3,*,吴晔君2,陶 源2,高艺书2,连惠章4,黄略略5,赵建新2,3,张 灏2
(1.江南大学 国家功能食品工程技术研究中心,江苏 无锡 214122;2.江南大学食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122;3.江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122;4.无锡华顺民生食品有限公司,江苏 无锡 214218;5.深圳职业技术学院应用化学与生物技术学院,广东 深圳 518055)
摘要:水分广泛存在于物料中,且水分子作为极性分子在微波场中有着极强的响应。结合大米中重要组分米蛋白与米淀粉,本研究从模拟米粉组分的角度出发,配制不同水分含量的米蛋白-淀粉复配体系,考察微波处理条件及复配比例对体系加热过程中自由基生成及贮藏稳定性的影响。采用电子顺磁共振技术获得微波致自由基的信号谱图。研究发现水分含量高的体系自由基含量下降,说明水分对自由基有一定的猝灭作用。对比微波场下不同比例的米蛋白-淀粉复配体系自由基的生成情况发现,米蛋白产生的自由基多于米淀粉,且二者生成的自由基之间无抑制作用。复配体系在贮存期内经微波加热后产生大量自由基,自由基信号强度先逐渐增强,而后随贮藏时间的延长缓慢且持续下降。
关键词:微波;水分含量;米粉复配;自由基;电子顺磁共振
引文格式:
胡博, 范大明, 吴晔君, 等. 水分等典型影响因素对微波场下米蛋白-淀粉复配体系自由基生成及贮藏稳定性的干预[J].食品科学, 2017, 38(11): 148-154. DOI:10.7506/spkx1002-6630-201711024. http://www.spkx.net.cn
HU Bo, FAN Daming, WU Yejun, et al. Effect of water and other factors on the formation of free radicals and storage stability of rice protein and starch mixture under microwave irradiation[J]. Food Science, 2017, 38(11): 148-154. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711024. http://www.spkx.net.cn
自由基是指具有一个未成对电子的原子、分子或离子,通常具有生理及致病的双重作用[1-2]。任何生物体内都存在自由基,一般来说,受控的自由基对机体是有益的,它们既可以辅助传递能量以维持生命活力,也可用于杀灭有害的细菌和寄生虫,还能参与机体内毒素的排除[3]。在某些生理情况下,如果自由基的生成量超过一定限制,导致自由基过剩,则会出现自由基的“攻击”作用,将破坏自由基的相对稳定状态,化学性质活泼的自由基将攻击周围的分子,致使新的自由基生成,由此形成恶性循环。如果生物体适应不了这种变化,不及时猝灭,则会在细胞、组织中不断产生,这种破坏作用累积到一定程度则会直接或间接对机体造成损伤。有文献表明,食品过度加工引发的自由基会对细胞层面造成负面影响,同时还与人体的衰老和疾病相关[4-5]。
电子顺磁共振(electron paramagnetic resonance,EPR)技术检测食品大分子中自由基的研究,主要集中在淀粉、谷物类物料[6-10]。早期对于食品体系自由基的研究主要是纯淀粉质物料,Ciesielski等[11-14]对淀粉经热解后生成自由基情况进行了研究,结合EPR检测手段发现,热解淀粉的未成对电子未均匀分布于淀粉的结晶区和不定型区,并推测自由基的生成是由化学键如C—H、O—H、C—O等的断裂导致。Łabanowska等[15]对高温处理后的淀粉进行了自由基检测和化学结构变化研究,根据电子耦合裂分规律结合软件拟合分析手段推测出自由基的信号组成,如淀粉葡萄糖环上C1和C6自由基的形成及脱水,同时发现随着加热温度的升高,自由基信号的成分也有相应的变化。也有研究针对米淀粉[16]与米蛋白[17]等单一组分,研究表明米淀粉或米蛋白在微波场中能够产生碳自由基,且自由基生成情况受多种因素影响,包括微波参数、水分含量等。
微波作为一种熟化和干燥技术,广泛应用于谷物类物料的加工[18-19]。微波加热依据物质的介电特性及吸波性能,具有靶向加热的特点,针对食品中的极性分子在微波场中的响应实现快速加热过程[20-21]。近年来随着微波炉的普及,微波加工引发的食品安全问题备受关注[22],已有初步研究表明微波致淀粉和蛋白自由基的存在,但鲜有研究分析微波条件和物料基本组分对自由基生成情况的影响。本研究采用ERP技术,探究在民用微波频率(2 450 kHz)条件下,不同水分含量的米蛋白-淀粉复配体系自由基的生成及目标产品贮藏稳定性,旨在为相关研究提供借鉴和食品微波加工过程的安全性评价提供实验依据。
1.1 材料
大米淀粉、大米蛋白 江西金农生物科技有限公司。
1.2 仪器与设备
EMX-8/2.7型电子自旋共振仪 德国Bruker公司;MultiSyNTH微波单模多模合成仪 意大利Milestone公司;FA-st lab水分活度仪 法国GBX公司;光纤温度探针、温度测定系统 加拿大Fiso公司;分散机 德国IKA公司。
1.3 方法
1.3.1 基本成分的测定
蛋白质、淀粉、粗脂肪、水分及金属元素含量的测定分别依据AACC 46-10改进凯氏定氮法、GB/T 5009.9—2008《食品中淀粉的测定》酸水解法、GB/T 22427.3—2008《食品中脂肪的测定》索氏抽提法及GB 5009.3—2010《食品中水分的测定》105℃恒质量法;金属元素含量的测定均采用原子吸收法,具体根据GB/T 5009.90—2003《食品中铁、镁、锰的测定》测定Fe、Mn元素含量,GB/T 5009.91—2003《食品中钾、钠的测定》测定K、Na元素含量,GB/T 5009.13—2003《食品中铜的测定》测定Cu元素含量。
1.3.2 米蛋白-淀粉复配体系的制备
参照米粉中蛋白与淀粉含量的真实比例,配制5%、10%、15%、20%蛋白含量的复配体系。以总质量200 g为基准,称量相应比例含量的米蛋白与米淀粉,用分散机以500 r/min速率不断搅拌物料直至分散均匀。
1.3.3 米蛋白-淀粉复配体系水分含量的调节
结合谷物干燥前的水分含量及米改性湿热处理条件(水分含量18%~27%),配制16%、22%、28% 3 个水分梯度的样品。将配制好的复配体系平铺于容器中,向表面均匀喷洒去离子水,通过喷水前后的质量差控制水分含量,用GB 5009.3—2010中直接干燥法测定水分含量,根据结果加适量复配体系/去离子水,直至样品水分含量达到水分梯度要求值(±0.50)。
1.3.4 微波加热方法
称取(1.00±0.02) g样品于微波合成仪专用配套石英试管中,轻敲试管壁使得样品均匀分布于试管底部,并保证试管内样品上表面水平。将装有样品的试管放入微波专用的聚酯套管中,旋紧套管盖使样品处于密闭的环境。再将套管放入微波合成仪腔体,进行单模处理,微波频率2 450 kHz,最大功率400 W/g。处理结束后立即将样品进行EPR检测,每组样品平行测定3 次。
1.3.5 传导加热方法
传导加热与微波加热方式的原理完全不同,微波加热是直接与反应体系中的极性分子耦合,达到靶向加热物料的效果,而传导加热是采用直接或间接热源对容器内的物料进行处理的方法。以水分活度为0.84的样品为实验对象,以控制相同加热温度和时间的思路变换加热方式,准确称取1.0 g蛋白样品于内径为1.2 cm的石英试管中,设置烘箱温度为100 ℃,将样品置于烘箱中加热30 min。对加热过程的自由基信号变化情况进行监测,分别在2、4、6、8、10、15、20、25、30 min时取样品进行EPR测定,每组样品平行测定3 次。
1.3.6 样品的贮存方法
称取微波处理后的样品60~80 mg于核磁管中,转移至密封容器,在室温(20 ℃)条件下避光保存,在微波处理的1 d内密集测定EPR信号变化,测定时间点分别为0.25、0.50、1.00、2.00、10.00 h和24.00 h,处理1 d后取5、10、30、60、90、120 d的时间点,分别进行ERP检测。
1.3.7 ERP检测方法
综合参考Łabanowska[6]、刘意骁[23]等的方法将微波处理前后的样品于内径3 mm的样品核磁管内,用分析天平准确称取装样前后核磁管的质量,将样品管置于谐振腔。设置仪器的微波频率和调试频率分别为9.85 Hz和100 kHz。在室温20 ℃条件下测定,设定中心磁场为350 mT,调制幅度为0.6 T,扫场宽度为10 mT,微波功率为20 mW。采用比较法测定朗德因子g值,将一个已知g值等于1.980 0的标准样品和待测样品分别置于双样品微波谐振腔的前后腔中,分别记录下两个样品的ERP谱图。由于两样品在同一微波频率v下产生共振,则由共振条件式可求得:

式中:h表示Planck常数(6.63×10-34J☒s);v表示微波频率/mW;β表示Bohr磁子;g表示朗德因子;H表示磁感应强度/Gs;下标s、x分别表示标准样品和未知样品;Hs和Hx可用核磁共振高斯计测得。
1.4 数据处理
数据计算和图谱分析制作应用了Office Excel 2013软件以及Origin Pro 8 SR1软件;数据用±s表示。
2.1 原材料基本组成
原材料的纯度对其在微波场中的自由基反应具有一定影响,且实验需探究不同淀粉含量对蛋白自由基生成的影响,原材料越纯,其他成分对微波致蛋白自由基反应的干扰越少。米蛋白及米淀粉的基本成分结果见表1。
表1 米蛋白及米淀粉中基本组分含量
Table 1 Basic components of rice protein and starch

物料在制备过程中往往会引入一些金属成分,并且谷物类的麸皮中含有丰富的金属元素,其加工精度也能显著影响物料的金属含量。研究表明,一些金属元素如碱土金属元素(K、Mg)和过渡金属元素(Fe、Cu)由于自身性质的不同对淀粉热处理产生自由基的种类和数量影响不同[6,24-25],因此推测蛋白及淀粉中的金属离子对于微波致自由基反应具有催化作用,能够促进或抑制自由基生成。由表1中数据可知,金属元素含量较低,对于ERP检测的影响水平相对较低,并且将空核磁管与装有米蛋白样品的核磁管进行ERP检测,将得到的谱图进行比较可知(图1),谱图信号中g=4.3处均有比较明显的Fe元素信号峰[26],但装样前后Fe元素信号强度差异不大,推测原因可能是核磁管本身含有一定量的Fe元素,且含量远大于样品中Fe含量,故本研究暂且忽略金属元素对ERP谱图的影响。

图1 装样前后自由基信号强度的比较
Fig. 1 Comparison of signal intensity of free radicals with or without sample
2.2 微波加热米蛋白-淀粉复配体系自由基种类

图2 复配样品160 W/g处理6 min的自由基信号强度
Fig. 2 Free radical signal intensity of mixture samples treated for 6 min with microwave power at 160 W/g
将米蛋白-淀粉复配体系进行微波处理,比较不同蛋白含量的样品自由基的生成情况,结果如图2所示。参照1.3.7节中样品g值的确定方法,计算得到各复配体系自由基的g值均在2.004 1~2.005 4之间,且微波处理后自由基信号明显,峰形接近,均为上下两个相对称的峰,由此可以判定米蛋白-淀粉复配体系所产生的自由基为碳自由基[6,27-30]。
2.3 微波场下米蛋白-淀粉复配体系自由基的生成规律
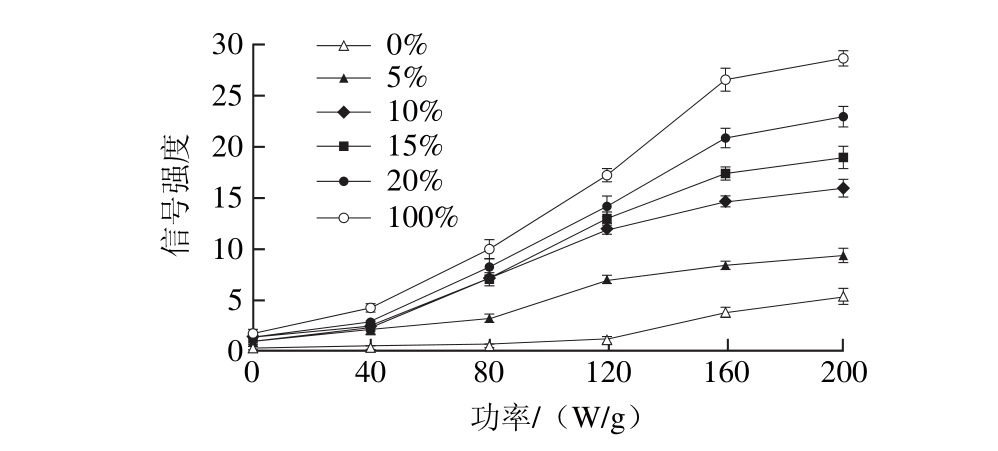
图3 复配样品在不同功率下微波处理6 min的自由基信号强度
Fig. 3 Free radical signal intensity of mixture samples treated for 6 min at different microwave powers
2.3.1 微波功率对复配体系自由基生成的影响由不同微波功率下的ERP结果由图3可知,6 种体系自由基水平增长趋势均随微波功率的增大而上升。其中,各体系自由基基本在功率大于40 W/g后便表现出快速增长趋势,米淀粉体系增长速率最为缓慢,120 W/g后才表现出明显的上升趋势。由此可以得出,蛋白质对于淀粉自由基的生成无抑制作用,且在复配体系中,蛋白质生成的自由基显著影响总自由基的增长趋势。另外,在微波加热过程中发现,微波功率大于160 W/g时会导致部分样品的焦糊,为了比较过/非过热状态下微波加热致自由基的变化情况,后续微波功率采用80 W/g和160 W/g。
2.3.2 加热时间对米蛋白-淀粉复配体系自由基生成的影响

图4 复配样品微波加热不同时间后的自由基信号强度
Fig. 4 Free radical signal intensity of mixture samples radicals microwaved for different times
实验设定微波功率分别为80 W/g和160 W/g,得到复配体系在不同加热时间下自由基信号的增长情况。由图4可知,加热时间对复配体系自由基的影响趋势基本一致,均随时间的增加自由基强度逐渐增大。80 W/g条件下,加热时间对复配体系自由基的增长作用影响较小,自由基含量增长最多仅为原始样品的2~3 倍;而在160 W/g条件下,自由基的增长速率在加热4 min后显著提高,自由基水平最多可达到原始样品的8 倍。由此可见,高功率及长时间的微波处理可使自由基呈现阶段性快速增长趋势。
2.3.3 水分含量对米蛋白-淀粉复配体系自由基生成的影响
选取微波功率为80 W/g和160 W/g,微波加热时间为6 min,处理不同水分含量的样品,对处理后的样品进行EPR检测。两种微波功率下不同水分含量对应的自由基信号强度关系如图5所示,80 W/g微波功率下自由基信号强度的变化相对较小,且水分含量越高,各体系间自由基含量的差值越小,可见水分子对自由基具有较强的猝灭作用。在160 W/g条件下,水分含量增加,复配体系自由基信号强度均有较为明显的下降趋势,且下降速率几乎一致,各体系自由基含量差异随水分含量的增加而减小,由此可以得到水分对物料生成自由基的猝灭作用较为显著。

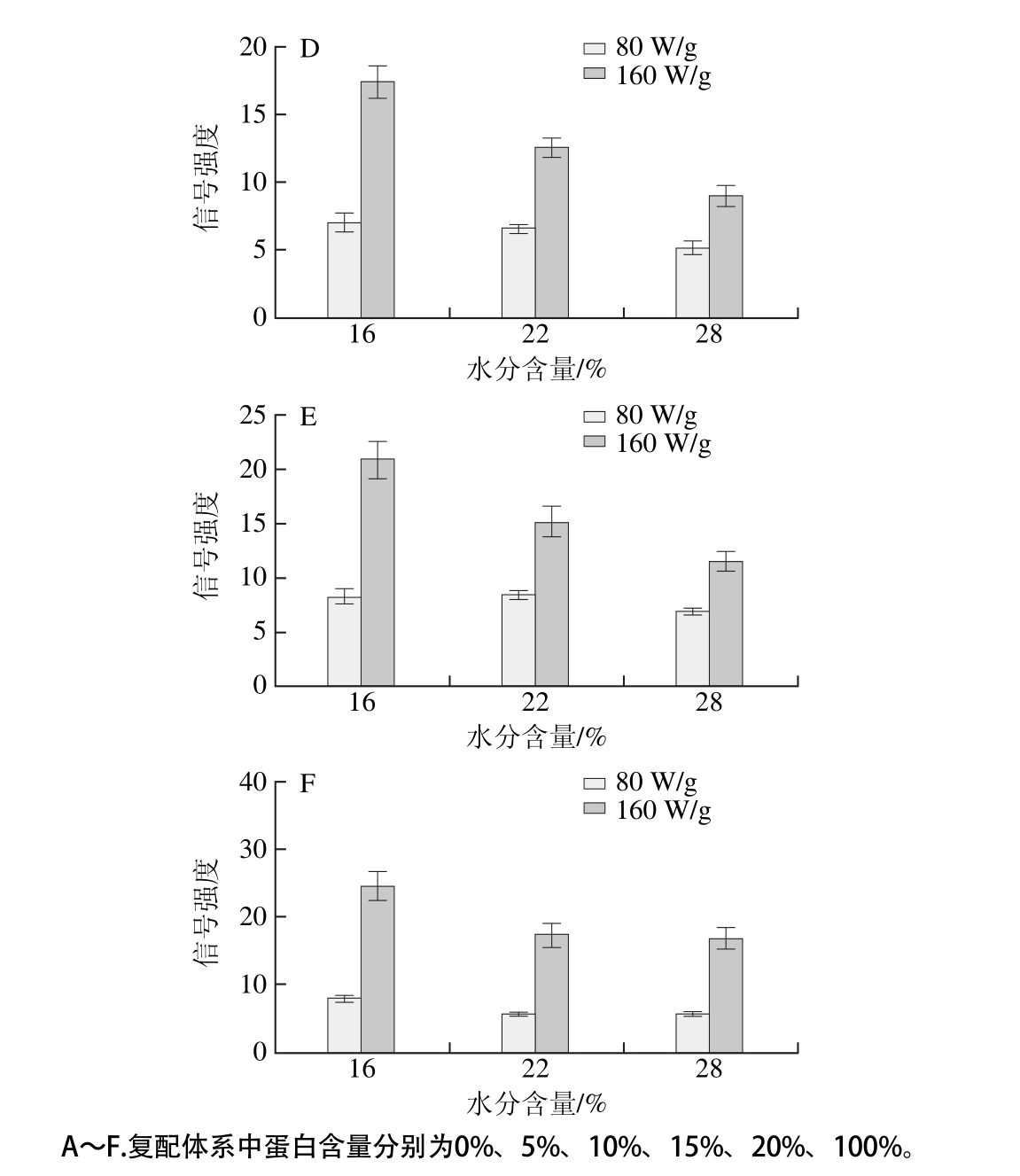
图5 不同水分含量的复配样品微波处理6 min后的自由基信号强度
Fig. 5 Free radical signal intensity of mixture samples with different water contents microwaved for 6 min
2.4 米蛋白-淀粉复配体系自由基对贮藏稳定性的影响
为了考察蛋白含量影响复配体系自由基在贮藏期的增长与衰减,将不同蛋白含量的样品于微波功率为160 W/g条件下加热6 min,对样品进行EPR检测,检测结果见表3。
表3 微波加热复配样品自由基信号强度的变化
Table 3 Changes in free radical signal intensity of mixture sample after microwave treatment

微波加热结束后,立即对样品的EPR进行测定,结果显示,在微波加热后的前1 h内,自由基的信号强度呈现衰减趋势,衰减较为缓慢,在1 h内自由基信号强度平均衰减8%。1 h后自由基信号强度逐渐上升,直至3~5 d左右,信号强度开始下降,且下降趋势持续且缓慢。蛋白含量不同,自由基信号强度有很大差异,但整体趋势基本一致。自由基信号强度随蛋白含量的增加而上升,微波加热后,米蛋白与米淀粉均产生自由基,且米蛋白产生的自由基较多,由表3可知,米淀粉生成的自由基对米蛋白微波加热后产生自由基并无抑制作用,同时,自由基信号强度在1 h后的上升趋势表明蛋白和淀粉生成的自由基也存在偶极-偶极相互作用,这种相互作用既可能是各自分子内的相互作用,即淀粉葡萄糖环分子内脱水和复水反应生成C1位置上的自由基之间的相互作用及蛋白表面氨基酸残基失去电子生成自由基的相互作用,也可能是蛋白与淀粉生成的碳自由基之间进一步耦合所致。总之,淀粉含量对米蛋白自由基的影响主要表现在自由基的产生数量不同,而对贮藏期自由基含量的变化趋势影响不大。
本研究模拟米粉中米蛋白与米淀粉的真实配比配制复配体系,通过微波处理探究复配体系自由基的生成规律及贮藏稳定性。结果得到复配体系产生的自由基是以碳为中心的自由基。微波加热不同水分含量复配体系,水对自由基具有一定猝灭作用;且随处理时间延长,样品体系温度升高,自由基信号强度呈增长的趋势,增长速率递增。随着大米蛋白比例的上升,自由基信号强度增加。大米蛋白生成的自由基数量较大米淀粉更多,并且还能与淀粉产生的碳自由基通过偶极-偶极协同作用增强稳定性。在贮藏期间,微波处理后的复配体系自由基信号强度先呈略微上升趋势,而后随时间的延长发生缓慢且持续的下降。
参考文献:
[1] KEHRER J P, KLOTZ L O. Free radicals and related reactive species as mediators of tissue injury and disease: implications for health[J]. Critical Reviews in Toxicology, 2015, 45(9): 765-798. DOI:10.3109/ 10408444.2015.1074159.
[2] B☒HM F, EDGE R, TRUSCOTT G. Interactions of dietary carotenoids with activated (singlet) oxygen and free radicals: potential effects for human health[J]. Molecular Nutrition & Food Research, 2012, 56(2): 205-216. DOI:10.1002/mnfr.201100222.
[3] RAHMAN S H, AMMORI B J, LARVIN M, et al. Increased nitric oxide excretion in patients with severe acute pancreatitis: evidence of an endotoxin mediated inflammatory response?[J]. Gut, 2003, 52(2): 270-274. DOI:10.1136/gut.52.2.270.
[4] DEVASAGAYAM T P, TILAK J C, BOLOOR K K, et al. Free radicals and antioxidants in human health: current status and future prospects[J]. Journal of the Association of Physicians of India, 2004, 52: 794-804.
[5] SARAVIA J, LEE G I, LOMNICKI S, et al. Particulate matter containing environmentally persistent free radicals and adverse infant respiratory health effects: a review[J]. Journal of Biochemical and Molecular Toxicology, 2013, 27(1): 56-68. DOI:10.1002/jbt.21465.
[6] ŁABANOWSKA M, FILEK M, KURDZIEL M, et al. Electron paramagnetic resonance (EPR) spectroscopy characterization of wheat grains from plants of different water stress tolerance[J]. Journal of Plant Physiology, 2012, 169(13): 1234-1242. DOI:10.1016/ j.jplph.2012.04.020.
[7] AHN J J, AKRAM K, KIM H K, et al. Electron spin resonance spectroscopy for the identification of irradiated foods with complex ESR signals[J]. Food Analytical Methods, 2013, 6(1): 330-308. DOI:10.1007/s12161-012-9440-4.
[8] BIDZIŃSKA E, MICHALEC M, PAWCENIS D. Effect of thermal treatment on potato starch evidenced by EPR, XRD and molecular weight distribution[J]. Magnetic Resonance in Chemistry, 2015, 53(12): 1051-1056. DOI:10.1007/s12161-012-9440-4.
[9] KRUPSKA A, WOJTOWICZ E, AUGUSTYNIAK-JABŁOKOW M. Electron paramagnetic resonance study of organic radicals in some herbal plants[J]. Acta Physica Polonica A, 2016, 129(6): 1201-1204. DOI:10.12693/APhysPolA.129.1201.
[10] VILLANUEVA M E, DIEZ A M, GONZ☒LEZ J A, et al. Antimicrobial activity of starch hydrogel incorporated with copper nanoparticles[J]. ACS Applied Materials & Interfaces, 2016, 8(25): 16280-16288. DOI:10.1021/acsami.6b02955.
[11] CIESIELSKI W. Starch radicals Part Ⅲ: semiartificial complexes[J]. European Food Research and Technology, 1998, 207(4): 292-298. DOI:10.1007/s002170050335.
[12] CIESIELSKI W, BACZKOWICZ M, ACHREMOWICZ B, et al. Starch radicals. Part Ⅱ: cereals-native starch complexes[J]. Carbohydrate Polymers, 1997, 34(4): 303-308. DOI:10.1016/S0144-8617(97)00115-X.
[13] CIESIELSKI W, TOMASIK P. Starch radicals Part Ⅳ: thermoanalytical studies[J]. European Food Research and Technology, 1998, 207(4): 299-303. DOI:10.1007/s002170050336.
[14] CIESIELSKI W, TOMASIK P. Starch radicals. Part I. thermolysis of plain starch[J]. Carbohydrate Polymers, 1997, 31(4): 205-210. DOI:10.1016/S0144-8617(96)00122-1.
[15] ŁABANOWSKA M, WESEŁUCHABIRCZyŃSKA A, KURDZIEL M, et al. The mechanism of thermal activated radical formation in potato starch studied by electron paramagnetic resonance and Raman spectroscopies[J]. Carbohydrate Polymers, 2013, 91(1): 339-347. DOI:10.1016/j.carbpol.2012.08.039.
[16] 刘意骁, 范大明, 王丽云, 等. 微波处理淀粉自由基的生长和衰减[J].食品科学, 2014, 35(13): 114-117. DOI:10.7506/spkx1002-6630-201413021.
[17] 胡博, 范大明, 乌斯嘎勒, 等. 微波致米蛋白的自由基生成及氧化特性研究[J]. 现代食品科技, 2015(4): 151-156. DOI:10.13982/ j.mfst.1673-9078.2015.4.024.
[18] N☒CHTER M, ONDRUSCHKA B, BONRATH W, et al. Microwave assisted synthesis: a critical technology overview[J]. Green Chemistry, 2004, 6(3): 128-141. DOI:10.1039/B310502D.
[19] WRAY D, RAMASWAMY H S. Novel concepts in microwave drying of foods[J]. Drying Technology, 2015, 33(7): 769-783. DOI:10.1080/ 07373937.2014.985793.
[20] CHANDRASEKARAN S, RAMANATHAN S, BASAK T. Microwave food processing: a review[J]. Food Research International, 2013, 52(1): 243-261. DOI:10.1016/j.foodres.2013.02.033.
[21] RESURRECCION F, LUAN D, TANG J, et al. Effect of changes in microwave frequency on heating patterns of foods in a microwave assisted thermal sterilization system[J]. Journal of Food Engineering, 2015, 150: 99-105. DOI:10.1016/j.jfoodeng.2014.10.002.
[22] TANG J M. Unlocking potentials of microwaves for food safety and quality[J]. Journal of Food Science, 2015, 80(8): 1776-1793. DOI:10.1111/1750-3841.12959.
[23] 刘意骁. 微波加热致大米淀粉自由基的生成及稳定性研究[D].无锡: 江南大学, 2014: 6-7.
[24] ŁABANOWSKA M, KURDZIEL M, BIDZIŃSKA E, et al. Influence of metal ions on thermal generation of carbohydrate radicals in native and modified starch studied by EPR[J]. Starch-St☒rke, 2013, 65(5/6): 469-482. DOI:10.1002/star.201200165.
[25] HU E, CHENG H F. Catalytic effect of transition metals on microwave-induced degradation of atrazine in mineral micropores[J]. Water Research, 2014, 57(12): 8-19. DOI:10.1016/ j.watres.2014.03.015.
[26] ŁABANOWSKA M, KURDZIEL M, FILEK M, et al. The influence of the starch component on thermal radical generation in flours[J]. Carbohydrate Polymers, 2014, 101(1): 846-856. DOI:10.1016/ j.carbpol.2013.10.005.
[27] MAUPOIL V, ROCHETTE L. Evaluation of free radical and lipid peroxide formation during global ischemia and reperfusion in isolated perfused rat heart[J]. Cardiovascular Drugs and Therapy, 1988, 2(5): 615-621. DOI:10.1007/BF00054201.
[28] HOGG N. Detection of nitric oxide by electron paramagnetic resonance spectroscopy[J]. Free Radical Biology and Medicine, 2010, 49(2): 122-129. DOI:10.1016/j.freeradbiomed.2010.03.009.
[29] LASSMANN G, KOLBERG M, BLEIFUSS G, et al. Protein thiyl radicals in disordered systems: a comparative EPR study at low temperature[J]. Physical Chemistry Chemical Physics, 2003, 5(11): 2442-2453. DOI:10.1039/B302601A.
[30] SHIMOYAMA Y, UKAI M, NAKAMURA H. ESR detection of wheat flour before and after irradiation[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2006, 63(4): 888-890. DOI:10.1016/j.saa.2005.10.022.
Effect of Water and Other Factors on the Formation of Free Radicals and Storage Stability of Rice Protein and Starch Mixture under Microwave Irradiation
HU Bo1,2, FAN Daming2,3,*, WU yejun2, TAO yuan2, GAO yishu2, LIAN Huizhang4, HUANG Luelue5, ZHAO Jianxin2,3, ZHANG Hao2
(1. National Engineering Research Center for Functional Food, Jiangnan University, Wuxi 214122, China; 2. State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, China; 3. Collaborative Innovation Center of Food Safety and Quality Control in Jiangsu Province, Wuxi 214122, China; 4. Wuxi Huashun Minsheng Food Co. Ltd., Wuxi 214218, China; 5. School of Applied Chemistry and Biological Technology, Shenzhen Polytechnic, Shenzhen 518055, China)
Abstract:Water is widely existed in materials, and it as a polar molecule has a strong response in microwave fi eld. The major components of rice (protein and starch) were chosen to prepare mixtures with different water contents depending on the proportion of rice fl our. The effect of microwave treatment conditions and mixing proportion on the generation of free radicals and storage stability of mixtures was investigated. Electron paramagnetic resonance (EPR) was applied to investigate the nature of free radicals in microwaved samples. The free radical content of mixtures with higher water content decreased, which showed that water had a quenching effect on free radicals. Comparison of mixtures of different proportions of rice protein and starch in microwave fi eld showed that rice protein produced more free radicals than starch, and the generation of free radicals from both components had no inhibitory effect on each other. A large number of free radicals were generated in microwaved samples during storage period, and then the EPR signal continued to decline at a slow rate with increasing time of storage.
Key words:microwave; water content; mixture of rice protein and starch; radical; electron paramagnetic resonance (EPR)
DOI:10.7506/spkx1002-6630-201711024
中图分类号:TS201.6
文献标志码:A
文章编号:1002-6630(2017)11-0148-07
收稿日期:2016-11-21
基金项目:江苏省自然科学基金青年基金项目(BK20130141);“十二五”国家科技支撑计划项目(2014BAD04B03);无锡市科技创新与产业升级引导资金项目(0302-B010504-130003-PB);江苏省科技计划项目(农业)省重点研发专项(BK2016309)
作者简介:胡博(1991—),女,硕士,研究方向为食品加工及生物技术。E-mail:hubo@jiangnan.edu.cn
*通信作者:范大明(1983—),男,副教授,博士,研究方向为食品加工及生物技术。E-mail:dmfan@jiangnan.edu.cn