表1 桉叶精油包埋前后对供试菌的抑菌圈直径(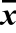 ±s)
±s)
Table 1 Inhibition zone diameters of eucalyptus essential oil before and after microencapsulation against tested microorganisms (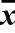 ±s)
±s)
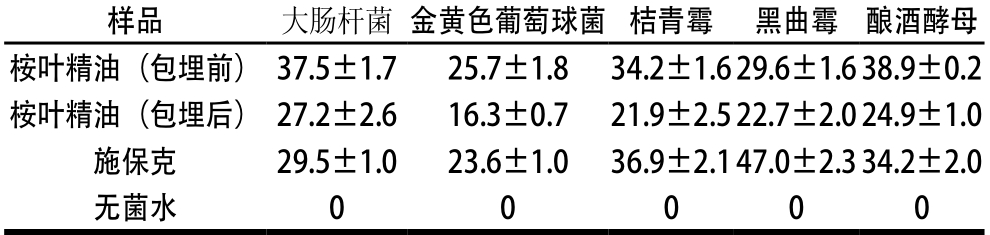
注:孔径(9 mm)包含在测量结果中,0表示无抑菌圈形成。
岳淑丽,任小玲,陈 霞,向 红,孙远明*,凌舒琦,刘荟雅
(华南农业大学食品学院,广东 广州 510642)
摘要:以包埋前后的桉叶精油为研究对象,采用平板打孔法和气相扩散法分别测定其对供试菌的抑菌活性和气相最低抑菌浓度(minimum inhibitory concentration,MIC)、气相最低杀菌浓度(minimum bactericidal concentration,MBC),探讨桉叶精油包埋前后抑菌性能差异。并用气相色谱-质谱联用技术对比分析桉叶精油包埋前后的化学成分。结果表明:桉叶精油包埋前后对供试细菌、酵母菌和霉菌均有一定的抑制作用。对酵母菌的抑制作用最强,其次为细菌,对霉菌的抑制效果稍差。桉叶精油包埋前后对供试菌的气相MIC和MBC未有太大差异。桉叶精油包埋前后主要成分大体相同,均以萜烯类和醇类化合物为主。包埋后桉叶精油中部分萜烯类化合物的消失或相对含量的减少导致抑菌性能稍有下降,但气相MIC不变,仅对酿酒酵母和桔青霉的气相MBC稍有上升。
关键词:桉叶精油;包埋;抑菌性能;气相扩散;化学成分
YUE Shuli, REN Xiaoling, CHEN Xia, et al. Comparative study of antimicrobial activity and composition of eucalyptus essential oil before and after encapsulation[J]. Food Science, 2017, 38(11): 155-160. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201711025. http://www.spkx.net.cn
桉树是桃金娘科(Myrtaceae)桉树属(Eucalyptus)植物,是世界上著名的速生树种,原产于澳大利亚,在我国广东、广西、海南、云南等地种植广泛[1-2]。从桉树枝叶中提取的桉叶精油对细菌、真菌、昆虫等均有不同程度的抑制作用,被广泛应用于食品、农业、化工、医药等各个行业,具有较大的应用价值和开发前景[3-5]。但桉叶精油易挥发、不便运输与贮藏,高浓度的纯精油具有腐蚀性,直接接触会对操作者造成一定的伤害[6]。采用微胶囊技术对桉叶精油进行包埋,可将液态的精油转变成固体粉末,提高其稳定性[7],同时利用壁材的透气性可实现桉叶精油的缓释抑菌效果[8],使其便于作为天然食品抑菌保鲜剂使用。但包埋过程中的温度、光、氧气等都会对精油造成一定程度的影响,导致其成分及各成分含量发生变化,这些变化是否显著,对精油的抑菌性能是否会造成较大影响的相关研究国内外还鲜有报道。葛昕等[9]在研究复合茶油微胶囊时发现微胶囊化工艺中的高温处理会对油脂的活性物质造成一定程度的破坏,但具体破坏程度如何并未涉及。黄国清等[10]在研究大蒜油微胶囊时发现与未包埋的大蒜油相比,包埋后大蒜油的主要成分仅损失了甲基烯丙基二硫醚,保留了大蒜油中的主要有效成分,且各成分含量变化不大,但未有涉及包埋前后大蒜油的抑菌性能差异。Leimann等[11]采用水蒸气蒸馏法提取包埋后的柠檬香茅精油,研究其抑菌性能和成分,并与包埋前的纯精油作对比,发现包埋后柠檬香茅精油的主要抑菌成分含量变化不大,对供试菌的最低抑菌浓度无影响,但对包埋前后柠檬香茅精油抑菌性能的研究不够全面,也未深入研究成分变化对抑菌性能的具体影响。
本实验对桉叶精油包埋前后的抑菌活性和气相最低抑菌浓度(minimum inhibitory concentration,MIC)、气相最低杀菌浓度(minimum bactericidal concentration,MBC)进行研究,并采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术测定桉叶精油包埋前后的化学组成,深入探讨成分变化对抑菌性能产生的影响。以期为利用桉叶精油开发天然食品抑菌保鲜剂提供一定的参考。
1.1 菌株、材料与试剂
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、桔青霉(Penicillium citrinum)、黑曲霉(Aspergillus niger)、酿酒酵母(Saccharomyces cerevisiae)均由华南农业大学食品学院生物工程系提供。
桉叶精油 广州市帕塞佳香精香料有限公司;β-环糊精 上海博奥生物科技有限公司;无水乙醇、氯化钠(均为分析纯) 南京化学试剂股份有限公司;营养琼脂培养基、马铃薯葡萄糖琼脂(PDA)培养基 广东环凯微生物科技有限公司;牛肉浸膏 国药集团化学试剂有限公司;蛋白胨 北京奥博星生物技术有限责任公司;施保克(咪鲜胺有效成分含量为250 g/L) 美国富美实公司。
1.2 仪器与设备
7890B-5977A气相色谱-质谱联用仪 安捷伦科技有限公司;SW-CJ-1F超净工作台 苏州安泰空气技术有限公司;LRH-250-Ⅱ生化培养箱 广东省医疗器械厂;DHG-9055A电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;SB-100DT超声波清洗机 宁波新芝生物科技股份有限公司;SYQ-DSX-280B手提式不锈钢压力蒸气灭菌锅 上海申安医疗器械厂。
1.3 方法
1.3.1 包埋后桉叶精油样品的提取
采用饱和水溶液法[12-13]制备桉叶精油β-环糊精微胶囊。参考2010版《中国药典》附录XD挥发油测定法(甲法)[12,14]蒸馏提取包埋后的桉叶精油。但为减少提取时长时间加热对精油成分的破坏,做如下修改:将制备的桉叶精油微胶囊置于锥形瓶中,在锥形瓶中加入适量去离子水,搅拌均匀,加盖密封,在超声波清洗机中于40 ℃超声振荡20 min。再将其转移至装有数粒玻璃珠的500 mL圆底烧瓶中,加水至圆底烧瓶中约含300 mL去离子水,连接挥发油测定器与回流冷凝管。自冷凝管上端加去离子水使充满挥发油测定器的刻度部分,并刚好溢流入烧瓶时为止。用调温电热器加热至微沸,此时烧瓶中振荡析出的桉叶精油很快冷凝至挥发油测定器中,立即停止加热,收集此时挥发油测定器中的桉叶精油作为包埋后的桉叶精油备用。
1.3.2 菌悬液的制备
参照文献[15]的方法,在超净工作台上用接种环挑取适量已活化的供试菌到装有9 mL无菌水的试管中,充分混合,用无菌移液枪吸取1 mL混合后的菌悬液于另一支装有9 mL无菌水的试管中,依次制成系列浓度的菌悬液。细菌采用平板计数法,霉菌和酵母菌采用显微镜直接计数法。根据计数结果,将菌悬液浓度调至106~107CFU/mL,备用[15]。
1.3.3 抑菌活性的测定
通过测定桉叶精油对供试菌的抑菌圈大小来考察桉叶精油的抑菌活性,采用平板打孔法[16-17]测定。待培养基(细菌用营养琼脂培养基,霉菌及酵母用PDA培养基)冷却至45 ℃左右,在直径为12 cm的玻璃培养皿内倒入约40 mL培养基。待培养基凝固后,用无菌移液枪吸取供试菌悬液100 μL于相应培养基上,并用无菌三角玻璃棒涂布均匀。待菌液被吸收后,用直径为9 mm的无菌枪头在培养基上均匀打4 个孔,用无菌镊子剔去孔内培养基,用无菌移液枪吸取一滴液体培养基封底。对于不同的菌,4 个孔中加入的供试液及添加量分别为:细菌及酵母菌在4 个孔内分别注入10 μL包埋前、后的桉叶精油、相同体积的施保克原液和无菌水;桔青霉在4 个孔内分别注入50 μL包埋前、后的桉叶精油、相同体积的体积分数为0.2%的施保克和无菌水;黑曲霉在4 个孔内分别注入100 μL包埋前、后的桉叶精油、相同体积的0.1%施保克和无菌水。其中施保克和无菌水分别作为阳性和阴性对照。每个菌种分别做3 次重复。
以上操作均在无菌条件下进行。然后将培养皿放入生化培养箱中培养(细菌在37 ℃条件下恒温培养20 h,酵母菌在28 ℃条件下恒温培养48 h,霉菌在28 ℃条件下恒温培养4~5 d)。培养结束,用十字交叉法测量各抑菌圈直径,结果取平均值,以抑菌圈大小来表示抑菌活性。
抑菌圈的判定标准[18-19]:直径>20 mm ,极敏;15~20 mm,高敏;10~14 mm,中敏;7~9 mm,低敏;直径<7 mm,不敏感。
1.3.4 气相MIC及MBC的测定
采用气相扩散法[20-21],在直径为9 cm的玻璃培养皿内倒入15 mL冷却至 45 ℃左右的培养基,待其完全冷却凝固后,将100 μL浓度为106~107CFU/mL的菌悬液均匀涂抹其上。菌液被吸收后倒置放置,用移液枪吸取不同量包埋前、后的桉叶精油到皿盖中央,使细菌和酵母菌培养皿中精油空间含量分别为12.5、25、50、100、200 μL/L,霉菌培养皿中精油空间含量分别为50、100、200、400、800 μL/L(9 cm培养皿去除培养基后的体积约为100 mL),以不添加桉叶精油的培养皿为空白对照。迅速盖好培养皿并用封口膜密封,置于生化培养箱中培养(细菌37 ℃、20 h,酵母菌28 ℃、48 h,霉菌28 ℃、4~5 d),每组3 个平行。以完全不长菌的培养皿所对应的含量为桉叶精油对该菌的气相MIC。之后,在无菌条件下,用灭菌过的皿盖替换完全不长菌的培养皿皿盖继续培养相同的时间,再以完全不长菌的培养皿所对应的含量为桉叶精油对该菌的气相MBC。
1.3.5 桉叶精油包埋前后成分测定
采用GC-MS技术对包埋前后的桉叶精油成分进行测定。其中包埋前的桉叶精油为不经任何处理的桉叶精油,包埋后的桉叶精油为1.3.1节中提取的桉叶精油。
气相色谱条件[22]:HP-5MS石英毛细管色谱柱(30 m×250 μm,0.25 μm);初始柱温60 ℃,以5 ℃/min的速率升至150 ℃,再以4 ℃/min的速率升至230 ℃(保持1 min);载气为高纯氦气,流速为1.0 mL/min;进样量0.2 μL;进样口温度250℃;分流比50∶1。
质谱条件[22]:EI离子源;离子源温度230 ℃;电子能量70 eV;接口温度250℃;质量扫描范围30~400 u,采用全扫描方式。
采用标准NIST14谱库进行相似度比对,参考标准图谱和相关文献确认各组分,利用峰面积归一化法计算各组分的相对含量。
2.1 桉叶精油包埋前后抑菌活性
表1 桉叶精油包埋前后对供试菌的抑菌圈直径(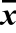 ±s)
±s)
Table 1 Inhibition zone diameters of eucalyptus essential oil before and after microencapsulation against tested microorganisms ( ±s)
±s)

注:孔径(9 mm)包含在测量结果中,0表示无抑菌圈形成。
由表1可知,桉叶精油包埋前后对供试菌均有一定的抑菌活性。包埋前的桉叶精油在10 μL时对大肠杆菌、金黄色葡萄球菌和酿酒酵母的抑菌圈直径均大于20 mm,属极敏感水平;在50 μL时对桔青霉的抑菌圈直径为34.2 mm,达到极敏感水平;在100 μL时对黑曲霉的抑菌圈直径为29.6 mm,达到极敏感水平。包埋后的桉叶精油在10 μL时对大肠杆菌和酿酒酵母的抑菌圈直径均有所下降,但都大于20 mm,仍为极敏感水平;在10 μL时对金黄色葡萄球菌的抑菌圈直径为16.3 mm,属高敏水平;在50 μL时对桔青霉的抑菌圈直径为21.9 mm,属极敏感水平;在100 μL时对黑曲霉的抑菌圈直径为22.7 mm,属极敏感水平。包埋后的桉叶精油对供试菌的抑菌活性有所下降,但仍具有较好的抑菌效果。阳性对照施保克对供试菌的抑菌圈直径均大于20 mm,属极敏感水平,但施保克作为果蔬保鲜剂使用时一般需稀释至500×10-6~1 000×10-6g/mL[23-24],而在此质量浓度下施保克对细菌和酵母菌几乎无抑菌效果。
总体来看,桉叶精油包埋前后均对酿酒酵母的抑制效果最好,其次是两种细菌,效果稍差的是霉菌,即桉叶精油对对细菌和酵母菌的抑制作用要好于霉菌,这与吴慧清等[25]的研究结果基本一致。桉叶精油包埋后抑菌效果稍有下降,但对供试菌的抑菌活性仍达到极敏或高敏水平,说明桉叶精油具有广谱抑菌性,其作为天然食品保鲜剂具有潜在优势。
2.2 桉叶精油包埋前后气相MIC及MBC
表2 桉叶精油包埋前后对供试菌的气相MIC和MBC
Table 2 MIC and MBC of eucalyptus essential oil before and after encapsulation against tested microorganisms
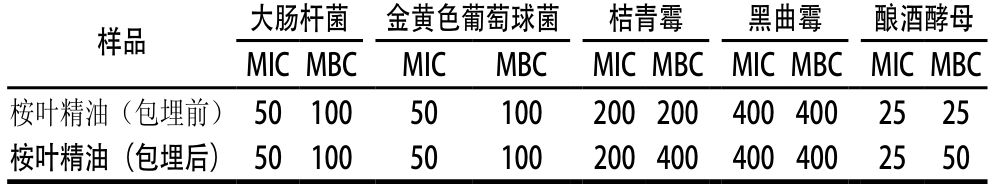
由表2可知,桉叶精油包埋前后对酿酒酵母的气相MIC最低,均为25 μL/L;对两种细菌的气相MIC和MBC均相同,分别为50 μL/L和100 μL/L;对霉菌的抑制效果稍差,尤其是黑曲霉,气相MIC及MBC达到了400 μL/L。包埋后的桉叶精油对供试菌的气相MIC不变,仅对酿酒酵母和桔青霉的气相MBC稍有上升。说明包埋过程并未对桉叶精油的抑菌性能造成明显影响,包埋后的桉叶精油仍具有较好的抑菌效果。较低剂量的桉叶精油即可杀死食品中常见的腐败菌,说明桉叶精油作为食品抑菌保鲜剂使用时不需要太大剂量,对食品风味不会造成太大影响。实验中桉叶精油不直接与供试菌接触,在密闭空间内以挥发性气体的形式即对供试菌起到抑菌及杀菌作用[26],说明可采用微胶囊缓释的方式发挥桉叶精油的抑菌保鲜作用,桉叶精油作为食品抑菌保鲜剂的安全性得到进一步的提高。
2.3 桉叶精油包埋前后成分
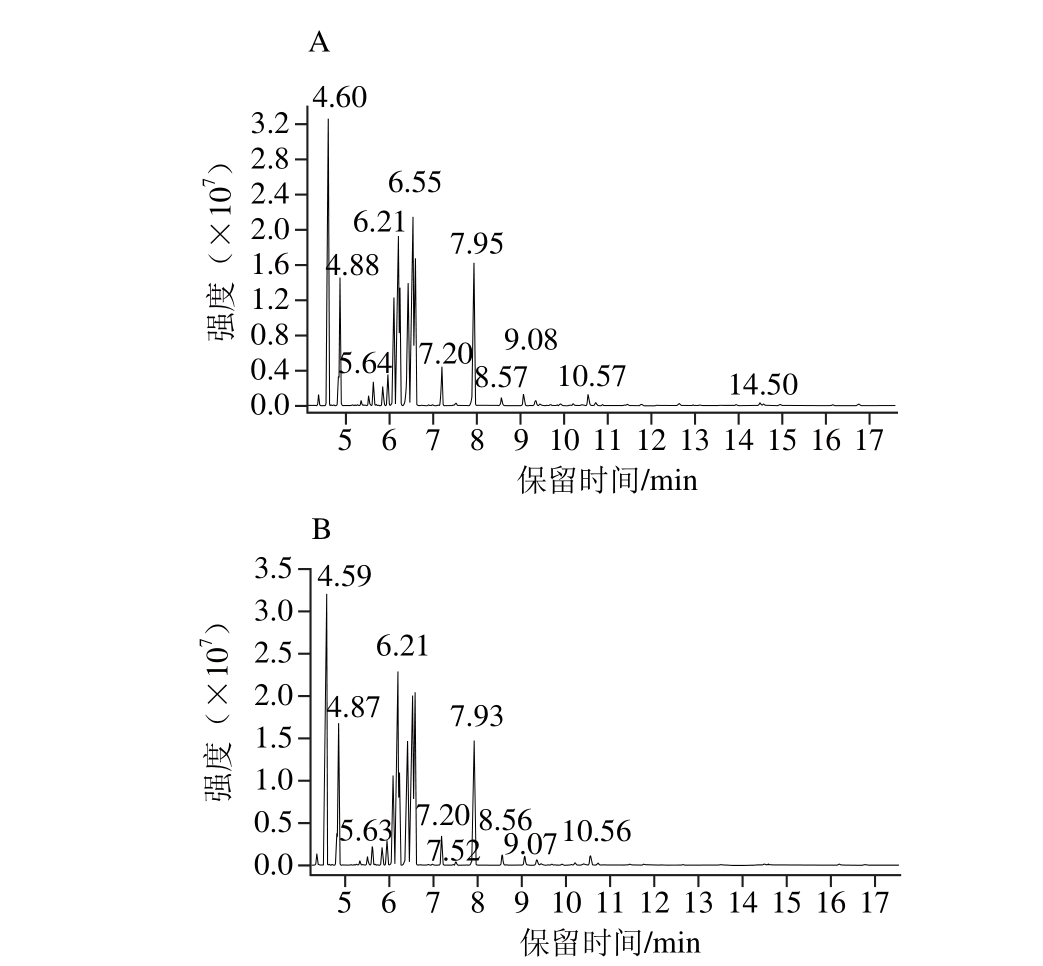
图1 包埋前(A)、后(B)桉叶精油的总离子流图
Fig. 1 Total ion current chromatograms of eucalyptus essential oil before (A) and after (B) microencapsulation
为明确桉叶精油的成分及包埋前后的成分差异,采用GC-MS技术对桉叶精油包埋前后的成分进行分析,得到桉叶精油包埋前后的总离子流图如图1所示。将图1中分离出的各组分提取质谱图,用NIST14标准谱库进行检索,参考标准图谱和相关文献确定各组分的化学结构,并采用峰面积归一化法确定各组分的相对百分含量[4,27-29],结果见表3。
包埋前的桉叶精油共检测出51 种物质,鉴定出其中39 种成分,占总离子流出峰面积的98.906 6%。其中萜烯类化合物(76.497 2%)22 种、醇类化合物(21.540 2%)13 种、烷烃类化合物(0.810 8%)3 种、酚类化合物(0.058 4%)1 种。含量较高的化合物有蒎烯(17.734 3%)、右旋柠檬烯(14.702 5%)、1,4-桉叶素(11.065 0%)、异松油烯(9.358 6%)、邻伞花烯(8.741 2%)、崁烯(7.497 5%)、1,8-桉叶素(7.417 5%)、(+)-3-蒈烯(6.308 7%)、α-松油烯(4.993 5%)、γ-松油烯(2.082 9%)、α-水芹烯(1.721 3%)、β-月桂烯(1.158 7%)。萜烯类和醇类化合物是桉叶精油的主要化学成分,这与前人研究结果[4,30-31]基本相符。
表3 包埋前、后桉叶精油的化学成分及相对含量
Table 3 Chemical components and their relative contents in eucalyptus essential oil before and after microencapsulation

包埋后的桉叶精油共检测出41 种物质,鉴定出其中32 种成分,占总离子流出峰面积的99.250 5%。其中萜烯类化合物(72.369 5%)18 种、醇类化合物(26.168 7%)11 种、烷烃类化合物(0.712 3%)3 种。其中,含量较高的化合物有蒎烯(17.099 6%)、右旋柠檬烯(14.015 2%)、1,4-桉叶素(13.729 6%)、1,8-桉叶素(9.759 8%)、邻伞花烯(9.410 8%)、崁烯(8.597 8%)、异松油烯(8.269 1%)、(+)-3-蒈烯(5.452 9%)、α-松油烯(3.572 1%)、γ-松油烯(1.610 0%)、α-水芹烯(1.425 5%)、4-甲基-1-(1-甲基乙基)-环己烯(0.972 7%)、β-月桂烯(0.946 5%)。
由表3可知,包埋过程并未对桉叶精油的主要成分造成明显影响,桉叶精油包埋前后均以萜烯类和醇类化合物为主。包埋后桉叶精油中有部分萜烯类、烷烃类和酚类化合物消失。萜烯类化合物的相对含量与包埋前相比有几种成分的含量减少,但也有几种成分的含量有所增加。部分醇类化合物如1,8-桉叶素、1,4-桉叶素的含量增加。植物精油的抑菌性能与其成分中的萜烯类、醇类、酚类、酮类、醛类等物质有关。本实验测得包埋前后的桉叶精油中均含有萜烯类、醇类、酚类等物质,因此包埋前后的桉叶精油对供试菌均有不同程度的抑制作用。
结合2.1节和2.2节的结果说明桉叶精油的抑菌性能与其成分及成分含量有一定的关系,其抑菌成分并非一种物质,而是多种物质协同作用的结果[3,30,32]。桉叶精油中的萜烯类、醇类、酚类物质均具有一定的抑菌作用[30,33]。桉叶精油对供试菌具有较好的抑菌效果与蒎烯、伞花烯、柠檬烯、松油烯、崁烯和桉叶素等抑菌成分有关[3]。其中萜烯类物质对桉叶精油抑菌性能的发挥有较大影响[3,30,34],包埋后的桉叶精油中部分萜烯类化合物的消失或相对含量的减少,使得包埋后的桉叶精油抑菌性能稍有下降,对酿酒酵母和桔青霉的气相MBC稍有上升,但对所有供试菌的气相MIC不变。包埋过程并未对桉叶精油的抑菌性能及成分造成明显影响。
桉叶精油包埋前后对供试细菌、酵母菌和霉菌均有一定的抑制作用。对酵母菌的抑制效果最好,其次为细菌,对霉菌的抑制效果稍差。包埋后的桉叶精油抑菌活性稍有下降。桉叶精油包埋前后对供试菌的气相MIC和MBC差别不大。包埋后的桉叶精油对供试菌的气相MIC不变,仅对酿酒酵母和桔青霉的气相MBC稍有上升。GC-MS分析结果表明,桉叶精油包埋前后主要成分大体相同,均以萜烯类和醇类化合物为主。桉叶精油的抑菌性能与蒎烯、伞花烯、柠檬烯、松油烯、崁烯和桉叶素等抑菌成分有关。包埋后桉叶精油中部分萜烯类化合物的消失或相对含量的减少,导致抑菌性能稍有下降。但包埋过程并未对桉叶精油的抑菌性能及成分造成明显影响,包埋后的桉叶精油仍具有较好的抑菌效果。本研究为利用桉叶精油开发天然食品抑菌保鲜剂提供一定的参考。
参考文献:
[1] 王俊亮, 肖苏尧, 陈运娇, 等. 广林9号桉叶多酚抗氧化活性研究[J].食品科学, 2012, 33(1): 20-24.
[2] 田玉红, 张祥民, 黄泰松, 等. 桉叶油的研究进展[J]. 食品与发酵工业, 2007, 33(10): 139-143. DOI:10.13995/j.cnki.11-1802/ ts.2007.10.043.
[3] 蓝亮美, 马丽, 郭占京, 等. 三种桂产桉叶油对常见致腐菌的抑制作用研究[J]. 食品工业科技, 2014, 35(22): 155-158. DOI:10.13386/ j.issn1002-0306.2014.22.025.
[4] 田玉红, 周琪, 颇俊华, 等. 广林九号桉叶精油的抑菌活性研究[J].湖北农业科学, 2013, 52(21): 5193-5196. DOI:10.14088/j.cnki. issn0439-8114.2013.21.022.
[5] TYAGI A K, MALIK A. Antimicrobial potential and chemical composition of Eucalyptus globulus oil in liquid and vapour phase against food spoilage microorganisms[J]. Food Chemistry, 2011, 126(1): 228-235. DOI:10.1016/j.foodchem.2010.11.002.
[6] HUYNH V T, CAFFIN N, DYKES G A, et al. Optimization of the microencapsulation of Lemon myrtle oil using response surface methodology[J]. Drying Technology, 2008, 26(3): 357-368. DOI:10.1080/07373930801898182.
[7] SUTAPHANIT P, CHITPRASERT P. Optimisation of microencapsulation of holy basil essential oil in gelatin by response surface methodology[J]. Food Chemistry, 2014, 150(2): 313-320. DOI:10.1016/j.foodchem.2013.10.159.
[8] ZHAO Q, HO C T, HUANG Q. Effect of ubiquinol-10 on citral stability and off-flavor formation in oil-in-water (O/W) nanoemulsions[J]. Journal of Agricultural and Food Chemistry, 2013, 61(31): 7462-7469. DOI:10.1021/jf4017527.
[9] 葛昕, 费学谦, 王亚萍, 等. 复合茶油微胶囊的开发及产品性能分析[J].中国粮油学报, 2014, 29(5): 75-79.
[10] 黄国清, 肖军霞, 孙燕婷. 大蒜油微胶囊的表征及在腊肠中的应用研究[J]. 中国调味品, 2014, 39(6): 32-35.
[11] LEIMANN F V, GON☒ALVES O H, MACHADO R A F, et al. Antimicrobial activity of microencapsulated lemongrass essential oil and the effect of experimental parameters on microcapsules size and morphology[J]. Materials Science and Engineering C, 2009, 29(2): 430-436. DOI:10.1016/j.msec.2008.08.025.
[12] 徐宁, 谭兴和, 王锋, 等. 椪柑皮精油微胶囊的制备方法研究[J].食品工业科技, 2014, 35(14): 321-325; 329. DOI:10.13386/ j.issn1002-0306.2014.14.062.
[13] 王芳, 淡小艳, 邓刚, 等. 橘皮精油微胶囊的制备及其稳定性研究[J]. 中国粮油学报, 2012, 27(12): 78-82. DOI:10.3969/ j.issn.1003-0174.2012.12.014.
[14] 岳淑丽, 任小玲, 向红, 等. 桉叶精油微胶囊包埋油含量测定方法的比较[J]. 包装工程, 2016, 37(15): 67-71.
[15] 陈林林, 米强, 辛嘉英. 柑橘皮精油成分分析及抑菌活性研究[J]. 食品科学, 2010, 31(17): 25-28.
[16] 李国林, 张忠, 毕阳, 等. 八种植物精油体外抑菌效果的比较[J]. 食品工业科技, 2013, 34(7): 130-133. DOI:10.13386/ j.issn1002-0306.2013.07.038.
[17] CAKIR A, KORDALI S, ZENGIN H, et al. Composition and antifungal activity of essential oils isolated from Hypericum hyssopifolium and Hypericum heterophyllum[J]. Flavour and Fragrance Journal, 2004, 19(1): 62-68. DOI:10.1002/ffj.1279.
[18] 刘光发, 王建清, 赵亚珠. 牛至精油微胶囊的制备及其抑菌效果研究[J]. 包装工程, 2012, 33(3): 19-22.
[19] ROTA M C, HERRERA A, MARTINEZ R M, et al. Antimicrobial activity and chemical composition of Thymus vulgaris, Thymus zygis and Thymus hyemalis essential oils[J]. Food Control, 2008, 19(7): 681-687. DOI:10.1016/j.foodcont.2007.07.007.
[20] 吴克刚, 赵欣欣, 谢佩文, 等. 植物精油及单离香料熏蒸控制生湿面制品腐败微生物研究[J]. 粮食与油脂, 2012, 25(6): 14-16. DOI:10.3969/j.issn.1008-9578.2012.06.004.
[21] LOPEZ P, SANCHEZ C, BATLLE R, et al. Solid and vapor-phase antimicrobial activities of six essential oils: susceptibility of selected foodborne bacterial and fungal strains[J]. Journal of Agricultural and Food Chemistry, 2005, 53(17): 6939-6946. DOI:10.1021/jf050709v.
[22] 付红军. 微波对山苍子油化学成分的影响及其抑菌活性研究[J]. 食品科学, 2016, 37(17): 65-69. DOI:10.7506/spkx1002-6630-201617011.
[23] 杨松夏, 吕恩利, 陆华忠, 等. 不同保鲜运输方式对荔枝果实品质的影响[J]. 农业工程学报, 2014, 30(10): 225-232. DOI:10.3969/ j.issn.1002-6819.2014.10.028.
[24] 刘锴栋, 袁长春, 敬国兴, 等. 外源草酸对采后番荔枝后熟及耐藏性的影响[J]. 食品科学, 2013, 34(14): 329-334. DOI:10.7506/spkx1002-6630-201314069.
[25] 吴慧清, 吴清平, 石立三, 等. 植物精油对微生物的抑菌效果评估研究[J]. 食品科学, 2008, 29(12): 83-86. DOI:10.3321/ j.issn:1002-6630.2008.12.012.
[26] 王步江, 刘金福, 樊秀花, 等. 肉桂精油抑菌活性研究[J].食品与机械, 2011, 27(6): 166-167; 182. DOI:10.3969/ j.issn.1003-5788.2011.06.043.
[27] KUMAR P, MISHRA S, MALIK A, et al. Compositional analysis and insecticidal activity of Eucalyptus globulus (family: Myrtaceae) essential oil against housefly (Musca domestica)[J]. Acta Tropica, 2012, 122(2): 212-218. DOI:10.1016/j.actatropica.2012.01.015.
[28] VILELA G R, ALMEIDA G S D, MORAES M H D, et al. Activity of essential oil and its major compound, 1,8-cineole, from Eucalyptus globulus Labill., against the storage fungi Aspergillus fl avus Link and Aspergillus parasiticus Speare[J]. Journal of Stored Products Research, 2009, 45(2): 108-111. DOI:10.1016/j.jspr.2008.10.006.
[29] MACIEL M V, MORAIS S M, BEVILAQUC M A, et al. Chemical composition of Eucalyptus spp. essential oils and their insecticidal effects on Lutzomyia longipalpis[J]. Veterinary Prasitology, 2010, 167(1): 1-7. DOI:10.1016/j.vetpar.2009.09.053.
[30] 叶舟. 大叶桉叶精油化学成分及其抑菌活性[J]. 福建林学院学报, 2007, 27(1): 48-51. DOI:10.3969/j.issn.1001-389X.2007.01.011.
[31] AIT-OUAZZOU A, LOR☒N S, BAKKALI M, et al. Chemical composition and antimicrobial activity of essential oils of Thymus algeriensis, Eucalyptus globulus and Rosmarinus officinalis from Morocco[J]. Journal of the Science of Food and Agriculture, 2011, 91(14): 2643-2651. DOI:10.1002/jsfa.4505.
[32] SKANDAMIS P N, NYCHAS G J E. Effect of oregano essential oil on microbiological and physico-chemical attributes of minced meat stored in air and modified atmospheres[J]. Journal of Applied Microbiology, 2001, 91(6): 1011-1022. DOI:10.1049/el:20030853.
[33] 胡林峰, 许明录, 朱红霞. 植物精油抑菌活性研究进展[J]. 天然产物研究与开发, 2011, 23(2): 384-391. DOI:10.16333/j.1001-6880.2011.02.043.
[34] LIN R M, TIAN J, HUANG G, et al. Analysis of menthol in three traditional Chinese medicinal herbs and their compound formulation by GC-MS[J]. Biomedical Chromatography, 2002, 16(3): 229-233. DOI:10.1002/bmc.131.
Comparative Study of Antimicrobial Activity and Composition of Eucalyptus Essential Oil before and after Encapsulation
YUE Shuli, REN Xiaoling, CHEN Xia, XIANG Hong, SUN Yuanming*, LING Shuqi, LIU Huiya
(College of Food Science, South China Agricultural University, Guangzhou 510642, China)
Abstract:The antibacterial activity of encapsulated and non-encapsulated eucalyptus essential oil (EEO) was determined by the agar well diffusion method, and the minimum inhibitory concentration (MIC) and minimum bactericidal concentration (MBC) were studied by vapor diffusion method. Besides, the chemical composition was analyzed by gas chromatography-mass spectrometry (GC-MS). The results showed that the EEO had antibacterial activity against all tested bacteria, yeast and mold irrespective of encapsulation. Its antimicrobial activity against yeast was the strongest followed by bacteria, and its antimold activity was weaker. The MIC and MBC of EEO did not significantly differ before and after encapsulation, and the major chemical components were identical, including terpenes and alcohols. The disappearance or decrease of some terpenes in the essential oil after encapsulation resulted in a slight decrease in its antibacterial activity; while its MIC remained unchanged, its MBC against Saccharomyces cerevisiae and Penicillium citrinum was slightly increased.
Key words:eucalyptus essential oil; encapsulation; antibacterial properties; vapor diffusion; chemical composition
DOI:10.7506/spkx1002-6630-201711025
中图分类号:TS201;O629.6
文献标志码:A
文章编号:1002-6630(2017)11-0155-06引文格式:
DOI:10.7506/spkx1002-6630-201711025. http://www.spkx.net.cn
收稿日期:2016-10-31
基金项目:航天营养与食品工程重点实验室开放基金资助项目(h2015631)
作者简介:岳淑丽(1979—),女,讲师,硕士,研究方向为食品包装、功能性包装材料。E-mail:ysl@scau.edu.cn
*通信作者:孙远明(1956—),男,教授,博士,研究方向为食品质量与安全。E-mail:ymsun@scau.edu.cn
岳淑丽, 任小玲, 陈霞, 等. 桉叶精油包埋前后抑菌性能及成分比较研究[J]. 食品科学, 2017, 38(11): 155-160.