曹荣安1,2,3,徐秀丽4,苗家尉1,郭增旺1,李良玉5,贾 建1,王长远1,*
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319;3.农业部农产加工品质量监督检验测试中心(大庆),黑龙江 大庆 163319;4.大庆市食品药品检验检测中心,黑龙江 大庆 163311;5.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319)
摘要:对龙胆多糖的结构和生物活性进行研究,采用甲基化分析多糖的链接方式。结果表明,龙胆多糖中存在(→1)末端和(1→5)-链接的呋喃阿拉伯糖基、(1→4)-链接的吡喃半乳糖基,同时也存在其他含量比较少的糖基和分支。龙胆多糖中糖醛酸是以(1→4)-链接的半乳糖醛酸方式存在,对龙胆多糖的生物活性起着重要的作用。龙胆多糖可以促进RAW264.7细胞增殖并产生NO,而且NO的产生是通过一氧化氮合成酶mRNA上调实现的,同时龙胆多糖可以上调细胞因子COX-2和TNF-α的mRNA表达水平。
关键词:龙胆;多糖;结构;免疫活性
曹荣安, 徐秀丽, 苗家尉, 等. 龙胆多糖的结构表征及其体外免疫活性[J]. 食品科学, 2017, 38(11): 168-173. DOI:10.7506/spkx1002-6630-201711027. http://www.spkx.net.cn
CAO Rong’an, XU Xiuli, MIAO Jiawei, et al. Structural characterization and in vitro immunomodulatory activity of polysaccharides from Gentiana scabra Bunge[J]. Food Science, 2017, 38(11): 168-173. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711027. http://www.spkx.net.cn
龙胆(Gentiana scabra Bunge)为龙胆科植物条叶龙胆、龙胆、三花龙胆或滇龙胆的干燥根及根茎[1],龙胆始载于《神农本草经》,列为中品[2],味苦、性寒,为清肝胆湿热,泻下焦郁火之常用中药[3],具有保肝护肝[4-5]、健胃[6]、降血脂[7]、抗炎[8-9]、抗甲亢[10]、升血糖[6]、抗氧化[11]、抗真菌[12]和降血压[13]的作用。目前对于龙胆中化学功效成分的研究主要集中在三萜类、黄酮类、环烯醚萜类、口山酮类、生物碱类等[14-17],对龙胆多糖(Gentiana scabra Bunge polysaccharide,GSP)的研究不深入。目前对于龙胆多糖的研究以提取方法为主,大多采用水提醇沉法,由于龙胆原料产地和提取条件的差异,不同研究者得到的最佳提取参数也不同,但大致范围是提取温度90~100 ℃、料液比1∶25~1∶30(m/V)、时间3 h、提取2~3 次,龙胆多糖得率为12.59%~14.00%,同时也有研究者利用超声波和微波辅助提取龙胆多糖[18-22]。对于龙胆多糖的生物活性也有部分研究,报道称其具有体内降血脂[7]、抗肿瘤[23-24]、免疫调节[25]、体外抗凝血[26]、抗氧化[20]作用。从以上可知,目前对于龙胆多糖的研究集中在提取工艺和生物活性上,鲜少有对其链接方式的研究,更缺乏对其免疫功能和机理的深入研究。本课题组经过前期研究提取得到了龙胆多糖,并分析了其分子特性[27],本实验对其进行链接方式和生物活性进行了研究,为龙胆多糖的研究利用提供理论参考。
1.1 材料与试剂
龙胆购自安徽亳州兹元堂,龙胆多糖为课题组自行提取(化学组成为59.0%总糖、12.8%蛋白质、6.8%硫酸根和26.7%糖醛酸)[27]。
R A W 2 6 4.7细胞 美国模式培养物集存库(ATCC);RPMI-1640细胞培养基、青霉素/链霉素、牛血白清蛋白 美国Lonza公司;脂多糖(lipopolysaccharide,LPS)、Griess(改良型) 美国Sigma-Aldrich公司;EZ-cytox细胞增殖及细胞毒性检测试剂盒(2-(4-碘苯)-3-(4-硝基苯)-5-(2,4-二磺基苯)-2H-四氮唑钠盐,WST-1) 韩国Daeillab公司;逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)所用试剂 美国Invitrgen Solgent公司;引物韩国Bioneer公司。其他化学试剂均为分析纯。
1.2 仪器与设备
Excella ECO-170细胞培养箱 英国New Brunswick Scientific公司;EL800酶标仪 美国Biotech公司;2720PCR扩增仪 美国Applied Biosystems公司;MP-300V电泳仪 美国Major Science公司;6890N/MSD5973气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪 美国Agilent公司。
1.3 方法
1.3.1 链接方式分析
参考Ciucanu等[28]的方法并稍作改动,样品处理全过程需要氮气保护。3 mg龙胆多糖样品溶解在0.5 mL二甲基亚砜中,加入碘甲烷进行甲基化,之后加入三氟乙酸,100 ℃水解6 h,分别加入硼氘化钠(NaBD4)和无水醋酸进行还原和乙酰化,制得部分甲基化的糖醇乙酸酯衍生物。1 μL衍生物注入到GC-MS联用仪中进行分析,采用的是HP-5MS石英毛细管色谱柱(30 m×0.25 mm,0.25 μm),载气氦气流速为1.2 mL/min,升温程序为160~210℃(10 min之内),之后10 min升温到240 ℃,速率为5 ℃/min,保持在250 ℃,进样口温度也保持在250 ℃。用电子轰击源分析,电子能量为70 eV,质量扫描范围为m/z 35~450,根据GC图的出峰时间和MS的离子峰与不同链接方式的多糖分别进行对比从而确定链接方式。
1.3.2 多糖中糖醛酸的还原
100 mg样品溶解在10 mL蒸馏水中,加入200 mg 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐,之后加入盐酸溶液调控pH值在4.76左右,反应1.5 h。加入10 mL 2 mol/L硼氢化钠溶液还原1.5 h,用盐酸溶液调节pH 7,室温条件下稳定1.5 h,3 500 D膜透析后冻干。
1.3.3 多糖对细胞毒性测定
细胞增殖采用WST-1细胞增殖及细胞毒性检测试剂盒,具体方法如下:100 μL RAW264.7细胞(1×106细胞/mL)加入96微孔板中,在37 ℃、5% CO2培养箱中预培养24 h,弃去上清液,细胞中加入200 μL不同质量浓度的多糖溶液(2、5、10 μg/mL),培养液作为空白组。培养24 h后弃去上清液,细胞中加入110 μL体积分数10% WST-1溶液,继续在培养箱中培养1 h,用酶标仪在450 nm波长处测定吸光度,按下式计算细胞增殖率。
式中:A样品为样品的吸光度;A空白为空白组的吸光度。
1.3.4 多糖激活巨噬细胞产生NO测定
多糖激活巨噬细胞RAW264.7产生NO的量利用巨噬细胞的上清液进行测定,具体方法如下:100 μL RAW264.7细胞(1×106细胞/mL)加入96微孔板中,在37 ℃、5% CO2培养箱中预培养24 h,弃去上清液,细胞中加入200 μL不同质量浓度的多糖溶液(2、5、10 μg/mL),1 μg/mL LPS作为阳性对照,培养24 h。上清液中NO含量按照Green等[29]的方法进行测定,即100 μL上清液加入100 μL Griess试剂,室温条件下避光反应10 min后在540 nm波长处用酶标仪测定吸光度,以亚硝酸钠溶液为标准品,将样品吸光度带入标准曲线中计算出NO产量。
1.3.5 RT-PCR检测细胞因子mRNA的表达
参考Cao Rong’an等[30]的方法进行,过程如下:1 mL RAW264.7细胞(1×106细胞/mL)加入到24 孔板中,37 ℃、5% CO2培养箱中预培养24 h,弃去上清液,细胞中分别加入1 mL LPS(2 μg/mL)和不同质量浓度的多糖样品溶液(2、5、10 μg/mL)培养18 h。之后用Trizol试剂对细胞进行裂解提取总RNA,调整质量浓度后以RNA为模板经逆转录合成cDNA,再以cDNA为模板加入引物后进行PCR扩增,采用的引物序列为:一氧化氮合成酶(inducible nitric oxide synthase,iNOS)为5’-CCCTTCCGAAGTTTCTGGCAGCAGC-3’(正)和5’-GGCTGTCAGAGCCTCGTGGCTTTGG-3’(反);环氧化酶-2(cyclooxygenase-2,COX-2)为5’-CCCCCACAGTCAAAGACACT-3’(正)和5’-GAGTCCATGTTCC AGGAGGA-3’(反);肿瘤坏死因子(tumor necrosis factor-α,TNF-α)为5’-A T G A G C A C A G A A A G C A T G A T C-3’(正)和5’-TACAGGCTTGTCACTCGAATT-3’(反);β-肌动蛋白(β-a c t i n)为5’-TGGAATCCTGTGGC ATCCATGAAAC-3’(正)和5’-TAAAACGCAGCTCAGTAACAGTCCG-3’(反)。扩增产物经过琼脂糖凝胶电泳后照相,得到的条带利用Quantity One 1-D Analysis Software进行分析,之后同β-肌动蛋白进行对比得到细胞因子mRNA表达的相对浓度。1.4 数据分析
实验重复3 次,数据采用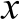 ±s表示,采用Sigmaplot 12.0作图。应用SAS 8.2软件对数据进行统计分析,各实验组之间的显著性差异分析采用单因素方差分析(oneway ANOVA)和邓肯氏复极差法。
±s表示,采用Sigmaplot 12.0作图。应用SAS 8.2软件对数据进行统计分析,各实验组之间的显著性差异分析采用单因素方差分析(oneway ANOVA)和邓肯氏复极差法。
2.1 龙胆多糖的链接方式
图1 龙胆多糖部分甲基化糖醇乙酸酯衍生物的总离子流色谱图和质谱图
Fig. 1 Total ion current chromatograms and mass spectra of partially methylated alditol acetates derivatives of the polysaccharides from Gentiana scabra Bunge
对龙胆多糖经过衍生化得到了部分甲基化的糖醇乙酸酯衍生物,利用GC-MS分析其链接方式,龙胆多糖衍生物的总离子流色谱图和质谱图见图1,可以得到13 个主要的色谱峰,同时给出了1、4、9三个主峰的质谱图。各碎片的质谱图与标准质谱NIST库和文献[31]进行比对分析,质谱解析结果列于表1。残基中主要存在2,3,5-tri-O-甲基呋喃阿拉伯糖醇乙酸酯、2,3-di-O-甲基呋喃阿拉伯糖醇乙酸酯、2,3,6-tri-O-甲基吡喃半乳糖醇乙酸酯,这3 种糖醇乙酸酯的相对峰面积分别为25.24%(峰1)、17.55%(峰4)和26.32%(峰9),说明龙胆多糖残基中存在(→1)和(1→5)-链接的呋喃阿拉伯糖基、(1→4)-链接的吡喃半乳糖基,同时也存在其他比例比较小的糖基和分支。
表1 龙胆多糖和还原后龙胆多糖的甲基化分析结果
Table 1 Methylation analysis of the polysaccharides and reduced polysaccharides from Gentiana scabra Bunge

注:RSGP. 还原后的龙胆多糖。
在分析龙胆多糖的化学组成时检测到有26.72%的糖醛酸,为了确定糖醛酸的类型和链接方式,首先对龙胆多糖进行糖醛酸的还原,RGSP中糖醛酸含量为9.96%,下降了16.76%,同时也对其进行甲基化分析,质谱解析结果见表1。还原后2,3,6-tri-O-甲基吡喃半乳糖醇乙酸酯的比例为38.34%,同还原前相比升高了12.02%,而且其他糖基的比例均降低,说明龙胆多糖中糖醛酸的类型是半乳糖醛酸,而且是(1→4)-链接。同时也测定了RGSP的单糖组成,同龙胆多糖相比仅半乳糖的含量升高,由43.72%升高到60.45%,其他单糖比例均降低,也证实了龙胆多糖中半乳糖醛酸的存在。
2.2 促进巨噬细胞增殖和产生NO
巨噬细胞同先天性免疫反应紧密相关,在机体抵抗外界微生物和侵入细胞方面扮演重要的作用,这种免疫调节作用是通过诱导NO产生或者细胞因子释放而实现的,所以其经常被当作体外实验模型中来评价一些物质的免疫调节作用。
首先测定龙胆多糖对巨噬细胞RAW264.7是否有毒性,方法是将龙胆多糖溶液加入到细胞中培养24 h后用WST-1试剂测定吸光度,同空白组相比较得到巨噬细胞的增殖率,结果见图2。

图2 龙胆多糖对巨噬细胞增殖的影响
Fig. 2 Effect of the polysaccharides from Gentiana scabra Bunge on the proliferation of RAW264.7 cells
由图2可知,2、5、10 μg/mL 3 个质量浓度的龙胆多糖溶液的细胞增殖率分别为107.39%、109.03%和113.45%,呈现剂量依赖关系,说明在所测定的质量浓度范围内龙胆多糖对于RAW264.7细胞无毒性,而且可以促进其增殖。同时,由图2可知,RGSP也能够促进RAW264.7细胞的增殖,呈现剂量依赖关系,同龙胆多糖相比不存在显著性差异(P>0.05),说明龙胆多糖中的糖醛酸对激活细胞增殖不起决定性作用。
之后进行龙胆多糖激活RAW264.7产生NO的研究,NO是重要细胞信使分子,广泛参与免疫应答在内的机体多系统的生理和病理过程,例如在生物体内参与神经系统、免疫系统和心血管系统的调节作用,NO合成是巨噬细胞非特异性免疫,涉及细胞溶解/细胞生长抑制的重要机制,所以NO常被用来检测一些化合物对于细胞的免疫情况,从而评价其生物活性。
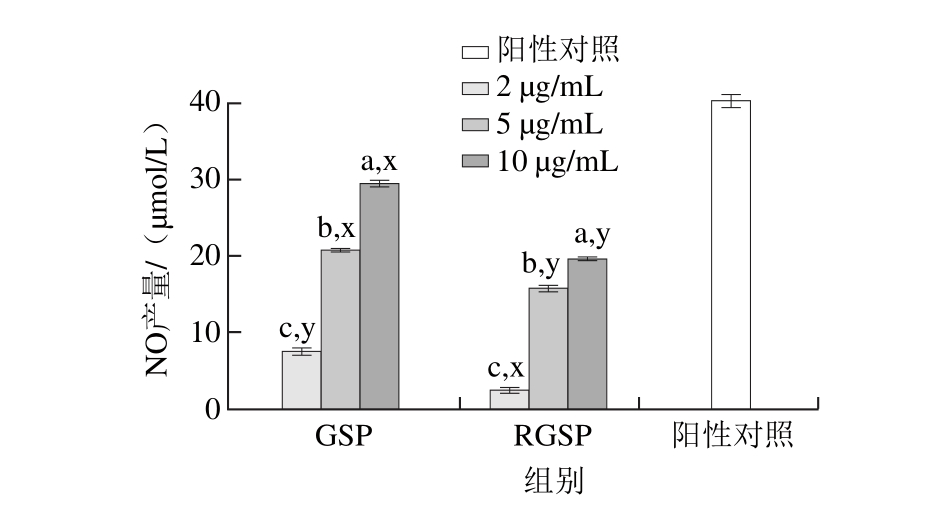
图3 龙胆多糖对RAW246.7细胞中NO产量的影响
Fig. 3 The amounts of NO produced by RAW264.7 cells treated with the polysaccharides from Gentiana scabra Bunge
由图3可知,2、5、10 μg/mL三个质量浓度的龙胆多糖溶液均可激活RAW264.7细胞产生NO,产量分别为7.44、20.83、29.63 μmol/L,呈现剂量依赖关系,且差异显著(P<0.05)。RGSP也可以激活RAW264.7细胞产生NO,产量分别为2.52、15.45、19.70 μmol/L,不同质量浓度处理之间差异显著(P<0.05),同质量浓度龙胆多糖的NO产量相比较存在显著性差异(P<0.05),从而可以说明糖醛酸对于龙胆多糖的生物活性起着重要的作用。Hidari等[32]从海藻(Cladosiphon okamuranus)中提取得到了含有葡萄糖醛酸的岩藻多糖,糖醛酸还原成葡萄糖之后其丧失了抵抗登革热病毒的活性,也说明了葡萄糖醛酸的存在对于多糖发挥生物活性起着重要的作用。
2.3 调控细胞因子mRNA的表达

图4 龙胆多糖对RAW264.7细胞因子mRNA表达的影响
Fig. 4 Effects of the polysaccharides from Gentiana scabra Bunge on cytokines mRNA expression in RAW264.7 cells
当巨噬细胞被多糖刺激活化后会产生相应的细胞因子,所以利用RT-PCR方法来检测细胞因子mRNA表达情况,扩增的产物经过琼脂糖凝胶电泳后照相得到相应的条带,见图4A,同时对于各细胞因子的相对表达浓度进行分析,见图4B~D。图4B为iNOS mRNA表达情况,可知随着多糖质量浓度的升高iNOS mRNA的相对表达浓度也显著升高(P<0.05),呈现剂量依赖关系,这一变化趋势同NO(图3)的变化是一致的,说明龙胆多糖激活巨噬细胞产生NO是通过iNOS调控而实现的。由图4C、D可知,2、5、10 μg/mL 3 个质量浓度的龙胆多糖溶液均可提高RAW264.7中COX-2和TNF-α mRNA表达的水平,随着质量浓度升高mRNA相对表达浓度显著升高(P<0.05),呈现剂量依赖关系。细胞因子是由免疫细胞和某些非免疫细胞经刺激而合成、分泌的一类具有广泛生物学活性的小分子蛋白质,通过结合相应受体调节细胞生长、分化和效应,调控免疫应答。TNF-α与COX-2都与肿瘤细胞抑制相关,可以通过直接或间接的方式抑制肿瘤细胞的生长或促进其凋亡[33-34]。龙胆多糖可以激活巨噬细胞中TNF-α和COX-2 mRNA的表达,说明了龙胆多糖可能有抑制肿瘤细胞的作用,其抑制活性和机理需要进一步的研究。目前国内外也有很多关于多糖生物活性的研究报道,例如从橘梗和海藻里提取得到的多糖可通过激活巨噬细胞产生细胞因子而起到免疫调节作用[35-36]。同时也有体内实验表明,龙胆多糖能增加小鼠和雏鸡的胸腺和脾脏指数,提高正常小鼠的吞噬指数,促进小鼠抗体生成,促进小鼠抗体生成,促进雏鸡免疫器官的发育,对小鼠和雏鸡的免疫功能有一定的促进作用[24-25],进一步研究表明龙胆多糖可不同程度地升高化疗后荷瘤小鼠的胸腺指数和脾指数,起到抗肿瘤作用[23]。
龙胆多糖残基中存在(→1)和(1→5)-链接的呋喃阿拉伯糖基、(1→4)-链接的吡喃半乳糖基,同时也存在其他糖基和分支。龙胆多糖中糖醛酸的存在形式是(1→4)-链接的半乳糖醛酸,其对龙胆多糖的生物活性起着重要的作用。龙胆多糖可促进RAW264.7细胞的增殖并产生NO,同时也能够上调COX-2和TNF-α mRNA表达的水平。本研究获得了龙胆多糖链接方式和体外生物活性的相关信息,这为龙胆多糖的进一步研究利用提供了理论参考。
参考文献:
[1] 国家药典编委会. 中华人民共和国药典2010年版一部[M]. 北京: 中国医药科技出版社, 2010: 89.
[2] 孔增科. 实用中药手册[M]. 天津: 天津科技出版杜, 1996: 83.
[3] 谢观. 中国医学大辞典第四册[M]. 北京: 中国书店出版杜, 1988: 199.
[4] 刘占文, 陈长勋, 金若敏, 等. 龙胆苦苷的保肝作用研究[J]. 中草药, 2002, 33(1): 47-50. DOI:10.3321/j.issn:0253-2670.2002.01.021.
[5] ORHAN D D, ASLAN M, AKTAY G, et al. Evaluation of hepatoprotective effect of Gentiana olivieri herbs on subacute administration and isolation of active principle[J]. Life Sciences, 2003, 72(20): 2273-2283. DOI:10.1016/S0024-3205(03)00117-6.
[6] 张勇, 蒋家雄, 李文明. 龙胆苦甙药理研究进展[J]. 云南医药, 1991, 12(5): 304-306.
[7] 江蔚新, 何文顺, 赵玺. 龙胆多糖的降血脂作用的研究[J]. 黑龙江医药, 2008, 21(4): 31-33. DOI:10.3969/j.issn.1006-2882.2008.04.022.
[8] 王德健, 李巧云, 徐世军, 等. 龙胆草水提物的抗炎解热作用研究[J].四川省卫生管理干部学院学报, 2007, 26(1): 3-5.
[9] 金香子, 徐明. 龙胆草提取物抗炎、镇痛、耐缺氧及抗疲劳作用的研究[J]. 时珍国医国药, 2005, 16(9): 842-843. DOI:10.3969/ j.issn.1008-0805.2005.09.005.
[10] 薛惠娟, 赵伟康. 龙胆草对甲亢大鼠肝匀浆类固醇△-4-还原酶活性的影响[J]. 中国中西医结合杂志, 1992, 12(4) : 230-231.
[11] AMIN A. Ketoconazole induced testicular damage in rats reduced by Gentiana extract[J]. Experimental and Toxicologic Pathology, 2008, 59(6): 377-384. DOI:10.1016/j.etp.2007.10.008.
[12] XU M, YANG C R, ZHANG Y J. Minor antifungal aromatic glycosides from the roots of Gentiana rigescens (Gentianaceae)[J]. Chinese Chemical Letters, 2009, 20(10): 1215-1217. DOI:10.1016/ j.cclet.2009.05.006.
[13] BARAGATTI B, CALDERONE V, TESTAI L, et al. Vasodilator activity of crude methanolic extract of Gentiana kokiana Perr. et Song. (Gentianaceae)[J]. Journal of Ethnopharmacology, 2002, 79(3): 369-372. DOI:10.1016/S0378-8741(01)00405-6.
[14] KAKUDA R, IIJIMA T, YAOITA Y, et al. Triterpenoids from Gentiana scabra[J]. Phytochemistry, 2002, 59(8): 791-794. DOI:10.1016/S0031-9422(02)00021-3.
[15] BERGERON C, MARSTON A, GAUTHIER R, et al. Iridoids and secoiridoids from Gentiana linearis[J]. Phytochemistry, 1997, 44(4): 633-637. DOI:10.1016/S0031-9422(96)00636-X.
[16] GUANG C, WEI S H, YU C Y. Secoiridoids from the roots of Gentiana straminea[J]. Biochemical Systematics and Ecology, 2009, 37(6): 766-771. DOI:10.1016/j.bse.2009.12.004.
[17] 沈涛, 金航, 王元忠, 等. 中药龙胆化学成分研究进展[J]. 安徽农业科学, 2010, 38(30): 16868-16870.
[18] 史伟国, 张玉, 吴宏斌, 等. 龙胆多糖最佳提取工艺研究[J]. 北方园艺, 2012(9): 181-183.
[19] 王晨瑜, 刘鑫, 张晶, 等. 水溶性龙胆多糖的提取工艺研究[J]. 北方园艺, 2013(10): 155-157.
[20] WANG C Y, WANG Y, ZHANG J, et al. Optimization for the extraction of polysaccharides from Gentiana scabra Bunge and their antioxidant in vitro and anti-tumor activity in vivo[J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(4): 1126-1132. DOI:10.1016/j.jtice.2013.12.004.
[21] 江蔚新, 朱正兰. 超声波提取龙胆多糖的研究[J]. 中草药, 2005, 36(6): 862-864. DOI:10.3321/j.issn:0253-2670.2005.06.028.
[22] 刘桓宇, 袁金田, 孙国峰, 等. 微波法提取龙胆多糖的工艺研究[J]. 中药材, 2007, 30(12): 1605-1607. DOI:10.3321/ j.issn:1001-4454.2007.12.041.
[23] 江蔚新, 江培, 张晓燕. 龙胆多糖的体内抗肿瘤作用研究[J]. 中成药, 2008, 30(10): 1530-1532. DOI:10.3969/j.issn.1001-1528.2008.10.040.
[24] 孟博, 王臣, 赵蔓, 等. 龙胆多糖对雏鸡免疫功能的影响[J]. 中国农村小康科技, 2010(4): 57-58. DOI:10.3969/j.issn.1007-7774.2010.04.025.
[25] 江蔚新, 张晓燕, 何文顺. 龙胆多糖对小鼠免疫功能的影响[J]. 黑龙江医药, 2008, 21(3): 17-18. DOI:10.3969/j.issn.1006-2882.2008.03.011.
[26] 江蔚新, 赵玺. 龙胆多糖的抗凝血作用的研究[J]. 黑龙江医药, 2008, 21(5): 31-32. DOI:10.3969/j.issn.1006-2882.2008.05.021.
[27] 肖健, 曹荣安, 贾建, 等. DEAE琼脂糖凝胶纯化龙胆多糖及其分子特性[J]. 食品科学, 2016, 37(15): 130-135. DOI:10.7506/spkx1002-6630-201615022.
[28] CIUCANU I, KERELK F. A simple and rapid method for the permethylation of carbohydrates[J]. Carbohydrate Research, 1984, 131(2): 209-217. DOI:10.1016/0008-6215(84)85242-8.
[29] GREEN L C, WAGNER D A, GLOGOWSKI J, et al. Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids[J]. Analytical Biochemistry, 1982, 126(1): 131-136. DOI:10.1016/0003-2697(82)90118-X.
[30] CAO Rongan, LEE Y J, YOU Sangguan. Water soluble sulfatedfucans with immune-enhancing properties from Ecklonia cava[J]. International Journal of Biological Macromolecules, 2014, 67: 303-311. DOI:10.1016/j.ijbiomac.2014.03.019.
[31] H☒KAN B, GUSTAF H C, BENGT L, et al. Gas-liquid chromatography and mass spectrometry in methylation analysis of polysaccharides[J]. Angewandte Chemie International Edition, 1970, 9(8): 610-619. DOI:10.1002/anie.197006101.
[32] HIDARI K I P J, TAKAHASHI N, ARIHARA M, et al. Structure and anti-dengue virus activity of sulfated polysaccharide from a marine alga[J]. Biochemical and Biophysical Research Communications, 2008, 376(1): 91-95. DOI:10.1016/j.bbrc.2008.08.100.
[33] 吕志敢, 郭政. 肿瘤坏死因子的研究进展[J]. 山西医科大学学报, 2006, 37(3): 311-314. DOI:10.3969/j.issn.1007-6611.2006.03.034.
[34] 贾志勇, 王家宏, 王莹, 等. 环氧合酶-2与肿瘤关系的研究进展[J].包头医学院学报, 2009, 25(4): 104-106. DOI:10.3969/j.issn.1006-740X.2009.04.053.
[35] YOON Y D, KANG J S, HAN S B, et al. Activation of mitogenactivated protein kinases and AP-1 by polysaccharide isolated from the radix of Platycodon grandif l orum in RAW 264.7 cells[J]. International Immunopharmacology, 2004, 4(12): 1477-1487. DOI:10.1016/ j.intimp.2004.06.012.
[36] KARNJANAPRATUM S, TABARSA M, CHO M L, et al. Characterization and immunomodulatory activities of sulfated polysaccharides from Capsosiphon fulvescens[J]. International Journal of Biological Macromolecules, 2012, 51(5): 720-729. DOI:10.1016/ j.ijbiomac.2012.07.006.
Structural Characterization and in Vitro Immunomodulatory Activity of Polysaccharides from Gentiana scabra Bunge
CAO Rong’an1,2,3, XU Xiuli4, MIAO Jiawei1, GUO Zengwang1, LI Liangyu5, JIA Jian1, WANG Changyuan1,*
(1. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 2. College of Animal Science and Technology, Heilongjiang Bayi Agricultural University, Daqing 163319, China; 3. Postdoctoral Research Station in Agricultural Products Processing Quality Supervision, Inspection and Testing Center (Daqing), Ministry of Agriculture, Daqing 163319, China; 4. Daqing Center for Food and Drug Control, Daqing 163311, China; 5. National Coarse Cereals Engineering Research Center, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
Abstract:As an extension of our previous work, where polysaccharides were extracted and purified from the rhizomes and roots of Gentiana scabra Bunge, this study was undertaken to investigate the structure and bioactivity of the polysaccharides. The type of glycosidic linkage was elucidated by methylation analysis. The backbones of the polysaccharides consisted of (→1) terminal and (1→5)-linked arabinofuranosyl, and (1→4)-linked galactopyranosyl residues with small amounts of other residues and branches. The uronic acid contained in the polysaccharides was composed of (1→4)-linked galacturonic acid residues, which played an important role in the bioactivity of the polysaccharides. The polysaccharides could enhance the proliferation of RAW264.7 cells to produce NO due to the increased mRNA expression of NO synthetase. The polysaccharides also could upregulate the mRNA expression of the cytokines COX-2 and TNF-α.
Key words:Gentiana scabra Bunge; polysaccharide; structure; immunomodulatory activity
DOI:10.7506/spkx1002-6630-201711027
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)11-0168-06引文格式:
收稿日期:2016-10-31
基金项目:黑龙江八一农垦大学2014年度校内培育课题(XZR2014-08);大庆市指导性科技计划项目(zd-2016-148);黑龙江八一农垦大学“青年创新人才”项目(XRC2016-11)
作者简介:曹荣安(1980—),男,讲师,博士,研究方向为生物活性天然产物。E-mail:racao@163.com
*通信作者:王长远(1976—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:byndwcy@163.com