
李媛媛,刘 骞,汪海棠,刘鹏雪,孔保华*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘要:研究不同质量分数阿拉伯树胶(arabic gum,AG)对肌原纤维蛋白(myofibrillar protein,MP)为乳化剂的乳化体系稳定性的影响。结果显示,乳化活性和乳化稳定性随着AG质量分数的增加呈先增加后降低的变化趋势。AG质量分数为0.3%时,MP-AG共建乳状液体系表现出最高的物理稳定性,显著地增加了ζ-电势,降低了粒径大小,表现出最低的乳析指数(P<0.05)。激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察结果表明,与单独以MP为乳化剂的样品相比,添加0.3% AG的乳状液样品液滴颗粒最小,这与粒径大小和分布的结果相一致。通过CLSM进一步观察MP在界面上的吸附行为,结果表明,与未添加AG的乳状液样品相比,添加0.3% AG的MP-AG共建乳状液体系所形成的界面膜更加坚固和致密。总之,AG可以促进蛋白质在油水界面上的吸附作用,提高MP乳化的水包油型乳状液的物理稳定性。
关键词:肌原纤维蛋白;阿拉伯树胶;乳化体系;物理稳定性
李媛媛, 刘骞, 汪海棠, 等. 阿拉伯树胶-肌原纤维蛋白共建乳状液体系的物理稳定性[J]. 食品科学, 2017, 38(11): 182-189. DOI:10.7506/spkx1002-6630-201711029. http://www.spkx.net.cn
LI Yuanyuan, LIU Qian, WANG Haitang, et al. Physical stability of complex emulsion systems containing myofibrillar protein and different concentrations of arabic gum[J]. Food Science, 2017, 38(11): 182-189. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711029. http://www.spkx.net.cn
食品乳状液体系分水包油(oil in water,O/W)和油包水(water in oil,W/O)两种类型[1]。O/W型乳状液能够通过絮凝、聚集、交联、分层等形式破坏整个体系的稳定性,因此在制备O/W型乳状液时需要加入表面活性剂来降低液面张力,增加油滴之间的斥力,防止聚集[2]。蛋白质和多糖是食品乳状液的重要组分,是两种常用的乳化剂,在提高乳状液产品稳定性方面起着重要作用[2-3]。
蛋白质具有亲水基和疏水基,可以吸附在油水界面上,形成界面蛋白膜,因而具有可以降低界面张力的能力,提高乳状液体系的物理稳定性的能力[3-4]。肌原纤维蛋白(myofibrillar protein,MP)为肉中具有重要生物学功能的蛋白质,其凝胶形成能力和乳化特性与肉制品加工质量密切相关。此外,已有研究证实在一个O/W型的系统或是肉类模拟体系中肌球蛋白可以作为乳化剂[4],但是MP作为乳化剂的O/W型乳状液在长期贮藏过程仍然会出现分层,因此食品制造商正在寻找各种可利用的成分进一步提高以MP为乳化剂的乳状液产品的物理稳定性。
多糖是高度亲水性分子,其分子质量通常相对较大(约为100~1 000 kD),因此吸附至液滴表面的速率相对较慢,但是其会围绕油相形成较厚的亲水界面层来提高乳状液体系的稳定性[5-6]。此外,大部分多糖倾向于通过增加水相的黏度来抑制乳状液中颗粒的运动,进一步起到稳定乳状液的作用[7]。由于阿拉伯树胶(arabic gum,AG)结构上带有部分蛋白物质及鼠李糖,使得AG有非常良好的亲水亲油性,是非常好的天然O/W型乳化稳定剂[8]。因此,本研究将AG添加到以MP为乳化剂的乳状液中,通过MP和AG在乳状液体系中的相互作用,改变体系的黏度,进而抑制MP乳状液在加工和贮藏过程中的分层行为。此外,在乳状液中,界面膜的结构与乳状液体系的稳定性具有一定的联系[9],因此本实验探讨AG对MP在油水界面上的吸附行为的影响,深入阐述不同质量分数AG与MP共建乳化体系界面相互作用与乳状液稳定性之间的内在联系。
1.1 材料与试剂
AG 哈尔滨市万太生物药品公司;猪肉 黑龙江北大荒肉业有限公司;一级大豆色拉油 哈尔滨九三油脂有限公司。
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、磷酸氢二钠、磷酸二氢钠、盐酸、氢氧化钠、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis (oxyethylenenitrilo) tetraacetic acid,EGTA)等均为国产分析纯试剂,实验中所用的水均为超纯水。
1.2 仪器与设备
AL-104型精密电子天平 上海精科实业有限公司;FE20K型pH计 上海梅特勒-托利多仪器设备有限公司;T18匀浆机 德国IKA公司;722可见光分光光度计 上海惊宏实验设备有限公司;Nano ZS型动态光散射仪、2000型激光粒度仪 英国马尔文公司;S-3400N型激光共聚焦电子显微镜(confocal laser scanning microscope,CSLM) 日本日立公司。
1.3 方法
1.3.1 MP及溶液的制备
选取猪里脊肉,切成小块后绞碎备用。MP提取依照Xia Xiufang等[10]的方法略加调整,将肉糜放入预冷的烧杯中称质量,加入4 倍体积的提取液(10 mmol/L磷酸盐、0.1 mol/L NaCl、2 mmol/L MgCl2和1 mmol/L EGTA,pH 7.0)匀浆60 s,4 ℃、3 000×g离心15 min,取沉淀,以同样方法再提取2 次,将沉淀中加入4 倍体积洗液(0.1 mol/L NaCl)匀浆60 s,4 ℃、3 000×g离心15 min,去上清液,重复洗1 次,去上清液后再加4 倍体积洗液,匀浆60 s,4 层纱布过滤,用0.1 mol/L HCl溶液调pH值至6.0,4 ℃、3 000×g离心15 min,即得到MP,双缩脲法测MP蛋白含量后[2],4 ℃保存备用,48 h内使用完毕。
MP溶液的制备[11]:采用0.6 mol/L NaCl溶液和50 mmol/L的pH 6.25的磷酸盐缓冲溶液,根据双缩脲法测定出的蛋白含量,调整MP的质量浓度为10 mg/mL。
1.3.2 MP-AG共建乳状液体系的制备
MP-AG共建乳状液体系按照Long Zhao等[5]的方法制备,并略作改动。取6 mL大豆油和24 mL 10 mg/mL MP溶液(起始温度为0~4 ℃)混合后加入AG,使AG的最终质量分数为0.0%、0.1%、0.2%、0.3%、0.4%,随后用高速乳化均质机在17 500 r/min乳化2 min,制备好的乳状液迅速转移到直径为30 mm、高为70 mm的称量瓶中,同时加入0.02 g/100 mL NaN3作为抑菌剂。
1.3.3 乳化活性和乳化稳定性的测定
参照Jiang Jiang等[3]的方法略作改动。从距离心管底0.5 cm处取50 μL制备的新鲜乳状液,加入到装有5 mL 0.1 g/100 mL SDS的离心管中,振荡混匀。0.1 g/100 mL SDS溶液作空白对照,在500 nm波长处测定吸光度记作A0;静置10 min后再次在相同位置取匀浆液50 μL,重复上述步骤记录A10。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别由公式(1)、(2)来计算。

式中:ρ为样品质量浓度/(g/mL);φ为乳状液中油相的比例(0.2);N为稀释倍数;A0为初始乳状液的吸光度;A10为10 min后乳状液的吸光度。
1.3.4 乳状液乳析指数的测定
参照Sun Changhui等[12]的方法略作改动。按照1.3.2节制备含有不同质量分数AG的乳状液,样品制备完成后将样品分装在直径为30 mm、高为70 mm带盖的称量瓶中(每瓶中液体体积相同,30 mL),用铝箔纸包裹玻璃瓶避光贮藏在室温条件下(大约22 ℃)。乳状液贮藏一段时间后,会析出底端的乳清层。底端的乳清层高度(HS)和总乳状液高度(HT)在第0、1、3、5、7、10天的同一时间进行测定。乳析指数计算见公式(3)。
1.3.5 ζ-电势的测定
参照Khouryieh等[13]的方法略作改动。按照1.3.2节制备含有不同质量分数AG的乳状液,在贮藏第10天后将含有不同质量分数AG的MP-AG乳状液体系样品稀释到油相质量分数为0.001%,在漩涡仪上混匀后取1 mL注入到弯曲毛细管中,使用Nano ZS型动态光散射仪在室温(大约22 ℃)条件下测定其ζ-电势,实验重复6 次。
1.3.6 粒径大小及分布的测定
参照Diao Xiaoqin等[14]的方法略作改动。按照1.3.2节制备含有不同质量分数AG的乳状液,在贮藏第10天将上述乳状液在室温条件下(大约22 ℃)使用2000激光粒度散射仪测定粒径大小及分布情况。为了避免多重衍射效应,制备好的含有不同质量分数AG的MP-AG共建乳状液体系样品使用超纯水进行稀释,直到遮蔽度达到15%后进行测定。连续相和分散相的折射率分别为1.330和1.475。测定结果以Dv10、Dv50、Dv90、d3,2和d4,3来表示。其中Dv10、Dv50和Dv90分别代表体积平均粒径小于或者等于整个乳状液体系颗粒大小的10%、50%和90%,d3,2表示体积-表面积平均粒径结果;d4,3表示体积平均粒径。计算见公式(4)、(5)。

式中:di表示颗粒的粒径;ni是粒径为di的颗粒数量粒径。
1.3.7 CLSM观察
参照Wang Lijun等[15]的方法略作改动。不同样品的乳状液在贮藏第10天将MP-AG乳状液样品在室温条件下(大约22 ℃)使用CSLM观察。在不同样品中分别加入蛋白染料0.1 g/100 mL尼罗蓝和油相染料0.1 g/100 mL尼罗红。混匀后,取约为2 μL染色后的乳状液滴加在载玻片的表面,盖上盖玻片,使用40 倍物镜观察并采集图像。尼罗蓝、尼罗红激发光波长分别为488 nm和633 nm。
1.4 统计分析
每个实验重复至少3 次,结果表示为 ±s。数据统计分析采用Statistix 8.1分析软件中线性模型程序进行,差异显著性分析使用Tukey HSD程序,采用Sigmaplot 12.5软件作图。
±s。数据统计分析采用Statistix 8.1分析软件中线性模型程序进行,差异显著性分析使用Tukey HSD程序,采用Sigmaplot 12.5软件作图。
2.1 AG质量分数对乳状液乳化活性和乳化稳定性的影响
乳化活性和蛋白质形成并稳定乳状液的能力有关,它代表蛋白质吸附在油水界面的能力,而乳化稳定性反映了乳化剂在一定时间内维持乳状液稳定的能力,因此乳化活性和乳化稳定性是衡量乳状液体系乳化性能的重要指标[3]。表1显示了不同质量分数AG对MP-AG共建乳状液体系乳状液乳化活性和乳化稳定性的影响。
表1 不同质量分数AG的MP-AG共建乳状液体系乳化能力和ζ-电势
Table 1 Emulsifying activity andζ-potential of myofibrillar protein oil-in-water emulsions with different concentrations of arabic gum
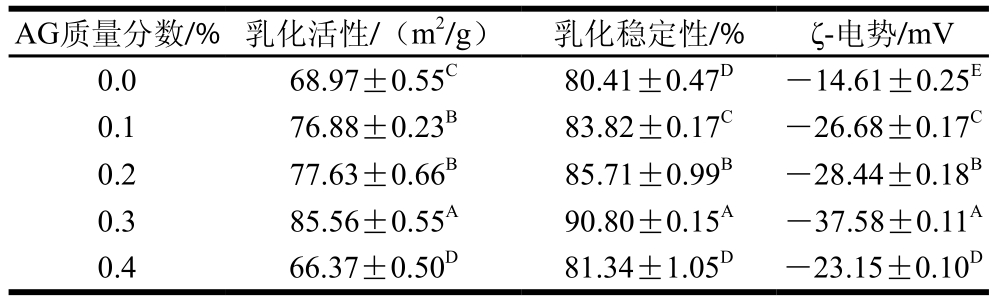
注:同列肩标大写字母不同代表差异显著(P<0.05)。表3同。
如表1所示,随着AG质量分数的增加,MP-AG共建乳状液体系的乳化活性和乳化稳定性呈现先上升后下降的变化趋势,并在AG质量分数为0.3%时,MP-AG共建乳状液体系的乳化活性和乳化稳定性显著高于对照(P<0.05)。Wong等[16]通过研究发现,蛋白质能够通过疏水作用力吸附在油水界面上,并且能够在油滴表面形成保护膜,从而维持乳化体系的稳定性。因此,本实验中单独以MP为乳化剂的乳状液样品(对照)表现出一定的乳化活性,并且乳化稳定性的值达到80.41%。添加AG后,MP-AG共建乳状液体系的乳化活性和乳化稳定性显著高于对照。胡国华[8]的实验表明AG是目前食品行业中应用最为广泛的天然多糖类乳化剂,特别是在饮料生产中应用较多。Sun Changhui等[12]研究表明,多糖都是高度亲水性分子,其分子质量通常相对较大,因此吸附至液滴表面的速率相对较慢,但是其会形成较厚的亲水界面层,起稳定乳状液的作用。此外,孙哲浩等[7]研究表明大部分多糖倾向于通过增加水相的黏度来抑制液滴运动,进而提高以蛋白质为乳化剂的乳状液的物理稳定性。因此,在本实验中AG质量分数为0.3%时,MP-AG共建乳状液体系表现出最大的乳化活性和乳化稳定性。这可能与MP和AG可以共同吸附到油滴表面,显著地增加了油水界面的界面膜厚度,有效地降低了油水界面张力,增加了水相的黏度有关[17]。
2.2 AG质量分数对乳状液ζ-电势的影响
ζ-电势是溶液中带电微粒双电层中剪切面的电势,反映乳状液颗粒表面的带电性质,进而能够反映出乳状液体系的稳定性[17]。yi Jianhua等[18]研究ζ-电势与乳化稳定性之间呈现正相关的关系,ζ-电势的绝对值越高,乳状液物理稳定性越高,即乳状液在贮藏期间可以抵抗聚集和絮凝的能力越强,因此,其可以作为一个重要的指标来评价乳状液的稳定程度。如表1所示,ζ-电势的变化范围为-14.61 mV到-37.58 mV,所有样品的ζ-电势为负值,说明MP-AG共建乳状液体系的颗粒表面带有负电荷。随着AG质量分数的增加,MP-AG共建乳状液体系的ζ-电势值呈现先上升后下降的变化趋势,显著性差异证明了AG质量分数对于ζ-电势绝对值有显著的影响。添加AG的乳状液样品的ζ-电势的绝对值均显著高于对照(P<0.05),当AG质量分数为0.3%时,MP-AG共建乳状液体系在贮藏10 d后有最高的ζ-电势绝对值(-37.58 mV)。
由于蛋白质表面带有电荷,通常情况下,在以蛋白质为乳化剂的乳状液中,乳状液的ζ-电势的绝对值相对较低时,则该O/W样品乳状液中水相的蛋白分子表面的有效电荷量较少,乳状液液滴较易发生凝聚形成絮凝;反之若ζ-电势绝对值较高,则粒子间的静电斥力较大,乳状液不易发生凝聚形成絮凝,整个体系较为稳定[19]。Hu Ming等[20]研究表明界面之间的斥力作用越强,表现出乳状液界面电位绝对值越大,一般来说,ζ-电势绝对值大于30 mV时,体系是稳定的。因此,添加AG后,MP-AG共建乳状液体系颗粒表面电荷量增加,同性电荷所引起的静电斥力促使乳状液颗粒之间不易发生相互靠近,使得贮藏期间液滴发生絮凝几率减小,进而增加了乳状液的物理稳定性[4]。此外,添加AG后,MP-AG共建乳状液体系连续相黏度增加,液滴在连续相中运动所受黏滞阻力增加,运动速率下降,所以乳状液分层行为被抑制,稳定性有所提高,表现出ζ-电势绝对值和对照相比显著增加[5]。因此综合上述两点原因在添加AG质量分数为0.3%时,其乳化活性和乳化稳定性较高,MP-AG共建乳状液体系在贮藏10 d后有最高的ζ-电势。然而,随着AG质量分数增加到0.4%时,MP-AG共建乳状液体系的ζ-电势下降。AG质量分数过高时,有更多的AG吸附在了油水界面上,使得MP和AG在油水界面上发生竞争性吸附,增加了乳化颗粒间的相互作用,因而降低了ζ-电势。
Zhu Lijun等[21]研究发现乳状液中颗粒越小,表现出ζ-电势的绝对值越大,乳化体系越稳定。S u n Changhui等[12]研究表明界面分子的吸附结构和性质与乳状液体系的稳定性,尤其是液滴的抗聚集稳定性关系紧密相关。蛋白质和多糖之间通过相互作用形成共价或非共价复合物,通过影响液滴界面层的厚度、黏弹性和电荷密度等,从而改善乳状液的稳定性,因此ζ-电势和粒径,界面膜的稳定性之间具有一定的关系,本实验通过接下来分析进一步证明。
2.3 AG质量分数对乳状液乳析指数的影响
表2 不同质量分数AG的MP-AG共建乳状液体系乳析指数
Table 2 Creaming index in myofibrillar protein oil-in-water emulsions with different concentrations of arabic gum

注:同列肩标大写字母不同表示不同贮藏时间差异显著(P<0.05);同行肩标小写字母不同表示不同质量分数差异显著(P<0.05)。n.d.未检测到分层。
贮藏期间0~10 d乳状液的乳析指数变化如表2所示。所有样品中,随着贮藏时间的延长,乳析指数逐渐增加。在单独以MP为乳化剂的乳状液样品中乳析是明显的,说明MP可以起到一定的乳化作用,但是不能在10 d贮藏时间内保持物理稳定性,因此,从0~10 d,乳析指数从16.28%增加到39.98%。AG质量分数过低的样品(0.1%、0.2%)中,在贮藏第3天时发生相分离,这证明了添加AG后的乳状液样品和对照相比可以延长乳析时间。在AG质量分数为0.3%时,MP-AG共建乳状液体系在第5天未曾发生相分离,贮藏10 d时,乳析指数仅为4.98%。
McClement等[22]研究表明乳状液中乳清层逐渐增加的原因是在乳状液中大的颗粒吸附到乳油层而小的颗粒分散到乳清层,因而发生相分离的现象。单独以MP为乳化剂的乳状液样品在贮藏期间表现出最大的相分离可以通过Stokes定律来解释,即在乳状液的样品中,水相黏度过低,颗粒表现出很大的流动性,因此容易发生分层行为[23]。MP-AG共建乳状液体系在贮藏期间的乳析指数测定证明了在所有样品中,随着贮藏时间的延长,乳析指数逐渐增大。在AG质量分数为0.3%时,MP-AG共建乳状液体系表现出最大的物理稳定性,这和上述乳化活性的结果是一致的。Khallouf i等[24]研究表明由于多糖具有大量可以进入到水相的亲水性基团,空间位阻是维持多糖类乳化剂吸附在液滴表面的主要作用力,通过空间位阻作用可以维持乳状液的物理稳定性,避免乳状液分层和聚集。Xu Duoxia等[6]研究表明由于添加多糖类物质,增加了乳状液黏度,降低了乳状液中颗粒运动速率,防止其发生絮凝和聚集,因而提高了乳状液的物理稳定性。然而,本实验中,在添加AG质量分数为0.4%时,MP-AG共建乳状液体系在贮藏期间乳析指数增加,这可能是由于多糖质量分数过高,使得AG和MP在油水界面膜上发生竞争性的吸附,加速乳状液中颗粒的交联和絮凝,因此导致乳状液稳定性降低,表现出乳析行为[25-26]。Sun Changhui等[12]研究表明如果亲水多糖和蛋白质的相互作用类似于相同聚合物间的相互作用,就会发生实质性的混合。但是如果随着蛋白质和亲水多糖质量分数的过高,乳状液体系贮藏一段时间后就会出现乳析的现象,这与本实验的研究结果一致。Khouryieh等[13]研究表明添加刺槐豆胶-黄原胶混合物于O/W乳状液中,在添加总质量分数为0.2%时乳状液表现出高度的物理稳定性和较低的乳析行为与较低的颗粒大小和高的ζ-电势有关。此外,Jiang Jiang等[3]研究表明在添加适当质量分数的豌豆蛋白水解物于O/W乳状液中,可以增加乳状液的黏度,减缓分散颗粒的运动速率,进而有助于增加油水界面膜的致密度和厚度,因此可能抑制乳析行为,提高乳状液的乳化稳定性。因此,根据乳析指数结果,为探讨不同AG质量分数提高MP-AG共建乳状液体系的物理稳定性的机制,本实验通过测定ζ-电势和粒径大小,分析CLSM结果,进一步阐述添加AG质量分数为0.3%时,MP-AG共建乳状液体系表现出最大物理稳定性的原因。
2.4 AG质量分数对对乳状液粒径大小和分布的影响
乳状液中液滴颗粒的大小会影响乳状液的物理稳定性。乳状液中液滴表现出颗粒越小,分布均一,则乳状液体系越稳定[19]。Cheng yu等[27]研究表明油滴粒径越小,对乳浊层有更高的抵抗力,可以保证乳状液的物理稳定性。因此研究MP-AG共建乳状液体系的粒径大小及分布对于理解其物理稳定性尤为重要。
表3 不同质量分数AG的MP-AG共建乳状液体系贮藏10 d后粒径大小
Table 3 Mean droplet diameter,d3,2andd4,3of myofibrillar protein oil-in-water emulsions with different concentrations of arabic gum after storage for 10 days

贮藏10 d后的MP-AG共建乳状液体系的粒径大小如表3所示,粒径分布图见图1。总体说来,MP-AG共建乳状液体系的平均粒径(Dv90、Dv50、Dv10)随着AG质量分数的增加而呈现先降低后增加的变化趋势,所有添加AG的样品,其平均粒径显著低于对照组(P<0.05)。对照的Dv90、Dv50、Dv10分别为232.88、43.11、11.82 μm,当添加AG质量分数为0.3%时,其Dv90、Dv50、Dv10则分别下降至52.68、3.41、0.96 μm(P<0.05)。d3,2和d4,3的大小变化也呈现同样的变化趋势。体积分布的变化和粒径大小呈现相一致的结果,如图1显示,单独以MP为乳化剂的样品粒径分布为正态分布,乳状液样品中颗粒体积平均粒径最大,由于絮凝和聚集的影响,发生相分离后颗粒大小分布比较集中,所以表现出单一的峰。添加AG后的4 组样品体积粒径分布均呈双峰形态,证明了上述乳析指数的结果,即贮藏后发生缔合型相分离。MP和AG属于大分子物质,在两者共混体系贮藏10 d后,由于热力学和动力学的不相容性,亲水多糖和MP之间的相互吸引,体系形成两相,其中一相中包含蛋白与多糖的复合凝聚物或者沉淀,而另一相中为单独的清液层,不含有大分子物质,因此在贮藏期间,MP-AG共建乳状液体系均发生相分离,分为乳油层和乳清层,所以粒径分布呈现双峰[12]。
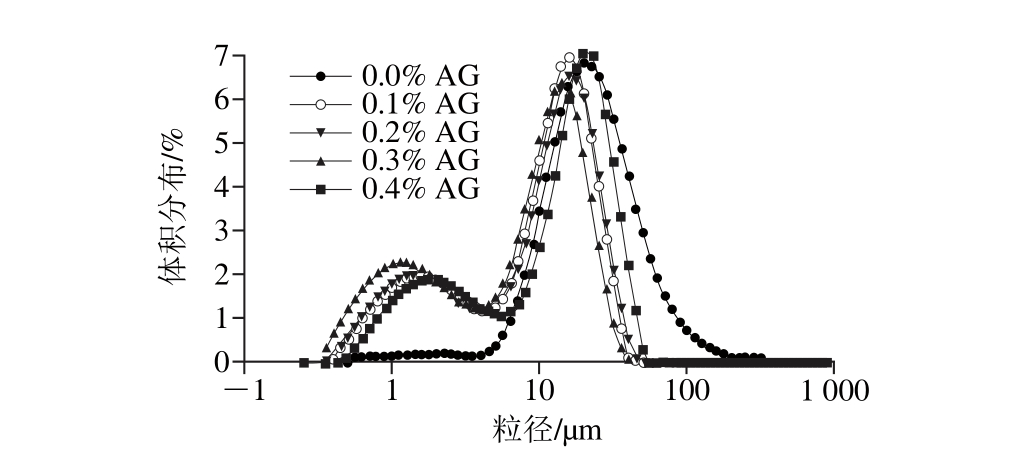
图1 不同质量分数AG的MP-AG共建乳状液体系贮藏10 d后体积-粒径分布
Fig. 1 Droplet size distributions of myofibrillar protein oil-inwater emulsions with different concentrations of arabic gum after 10 days of storage
Elias等[28]研究发现乳状液颗粒的粒径越小,其乳化活性越大,乳化稳定性越高,这与本实验的研究结果一致,MP-AG共建乳状液体系的乳化活性和乳化稳定性的测定结果和粒径大小和分布呈现负相关。Jiang Jiang等[3]研究表明乳状液平均粒径减小时会导致颗粒在油滴表面覆盖率增加,使得界面上吸附的蛋白质含量增加,从而所带电荷量也增加,因此整个乳状液的势能也增加,这也验证了ζ-电势的测定结果。Sun Changhui等[17]研究表明黄原胶与乳清蛋白的联合使用可以降低乳状液样品中的平均粒径大小,原因是更多的黄原胶-乳清蛋白形成复合物后吸附到液滴表面,导致液滴间形成了更大的空间位阻作用。Zhang Xin等[29]研究表明乳状液体系的粒径大小和界面膜上的网状结构致密性有关,界面膜越致密,则粒径越小,乳状液的物理稳定性越高。因此,在MP-AG共建乳状液体系中,当AG质量分数为0.3%时,可以有效地抑制其在贮藏期间的聚集和交联,除了和高的ζ-电势、较小的颗粒大小有关外,还可能与MP在界面上的吸附能力及油滴表面形成的保护性薄膜致密性有关。
2.5 CLSM分析颗粒大小及分布变化
CLSM可以通过多种荧光标记同时染色蛋白和油滴,因此可以更加直观地观察到乳状液中颗粒的分散情况,油水界面上乳化剂的吸附情况以及油-水界面膜的薄厚[24]。因此在MP-AG共建乳状液体系中MP和油滴在乳状液中的颗粒大小及分布变化和界面膜的差异采用CLSM进行测定,以研究不同质量分数AG对MP-AG共建乳状液体系物理稳定性的影响。
利用尼罗红染料对乳状液的油相进行染色,然后在633 nm激发波长下油相部分会呈现红色,利用尼罗蓝染料对乳状液的水相进行染色后在488 nm激发波长下水相的蛋白质部分呈现绿色(图未显示),之后将两种信号叠加可以看到水相和油相的结合状态。
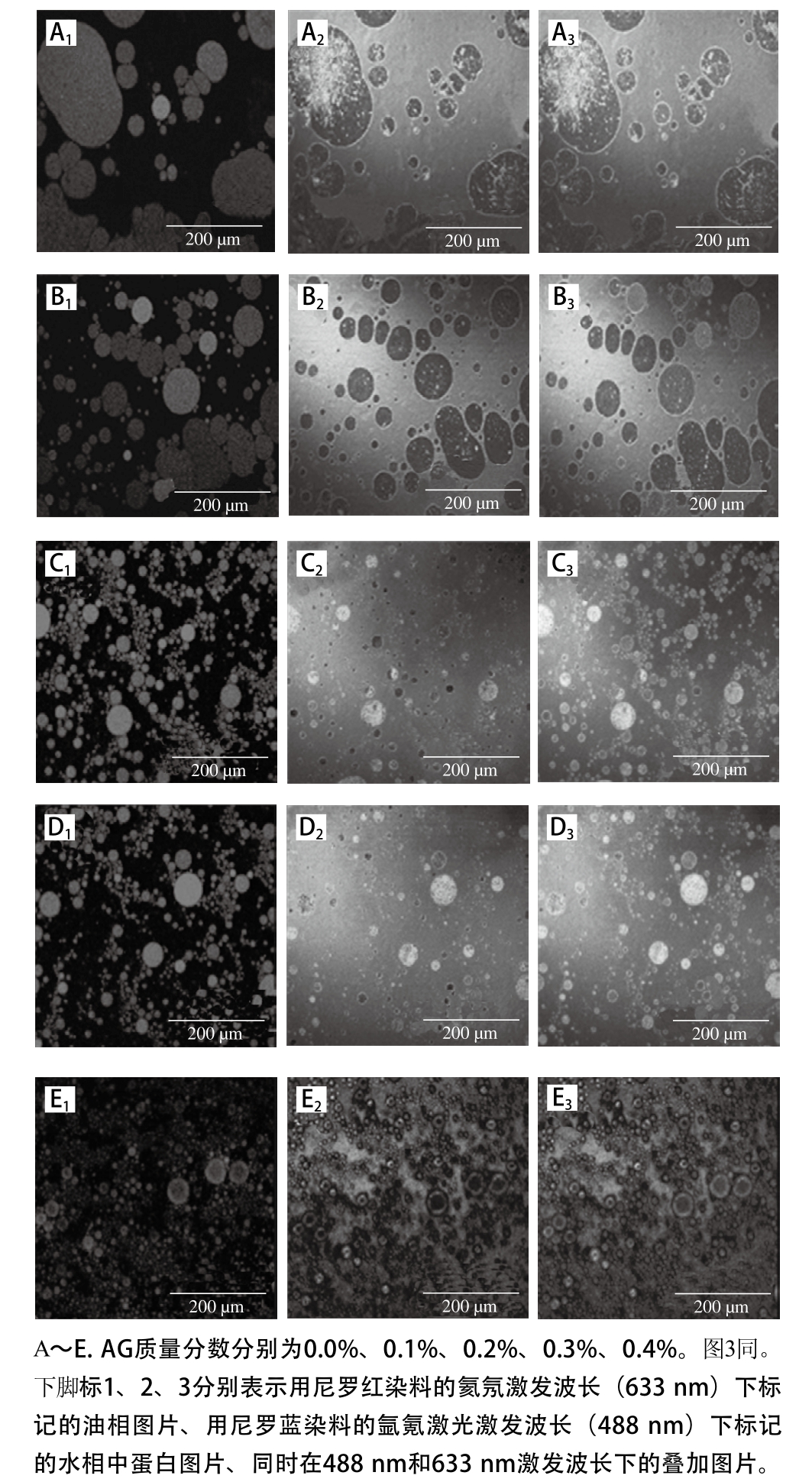
图2 MP-AG共建乳状液体系贮藏10 d后CLSM图
Fig. 2 CLSM micrographs of myofibrillar protein oil-in-water emulsions with different concentrations of arabic gum after 10 days of storage
如图2所示,单独以MP为乳化剂制备的乳状液液滴较大,发生了液滴的絮凝和聚集,油滴表面吸附的MP较少且不均匀。添加AG后,MP-AG共建乳状液体系液滴粒径大小明显小于对照,随着AG质量分数的增加(0.0%~0.3%),油滴颗粒大小明显降低,且MP在油水界面的吸附量逐渐增加。在质量分数0.3% AG的MP-AG共建乳状液体系中,油滴和MP颗粒聚集和絮凝程度降低,表现出最小的颗粒大小,颗粒分散均匀,油滴表面吸附的MP均匀致密,表现为红色的油相和绿色的MP水相叠加在一起后呈现为橘红色。Xu Duoxia等[6]研究发现蛋白-多糖在乳状液液滴界面上的吸附情况与液滴的抗聚结稳定性紧密相关,可显著影响乳状液体系的稳定性。Lee等[9]研究发现一般情况下,乳状液制备时需要有均质的过程,在这个过程中液滴频繁地相互碰撞,因而界面膜容易发生破裂,液滴出现聚集的状态。因此,界面膜的厚度及强度与乳状液物理稳定性之间存在一定的联系。若界面膜中吸附分子排列紧密,不易脱附,界面膜具有一定的强度与厚度,则能形成稳定的乳状液。在质量分数0.3% AG的MP-GA共建乳状液体系中界面膜上MP的吸附量多,排列紧密,形成了致密的界面结构,因此MP-AG共建乳状液体系表现出最高的乳化性,显著地增加了ζ-电势,降低了粒径大小,表现出最低的乳析指数。
2.6 AG质量分数对乳状液界面膜形成及致密性的影响
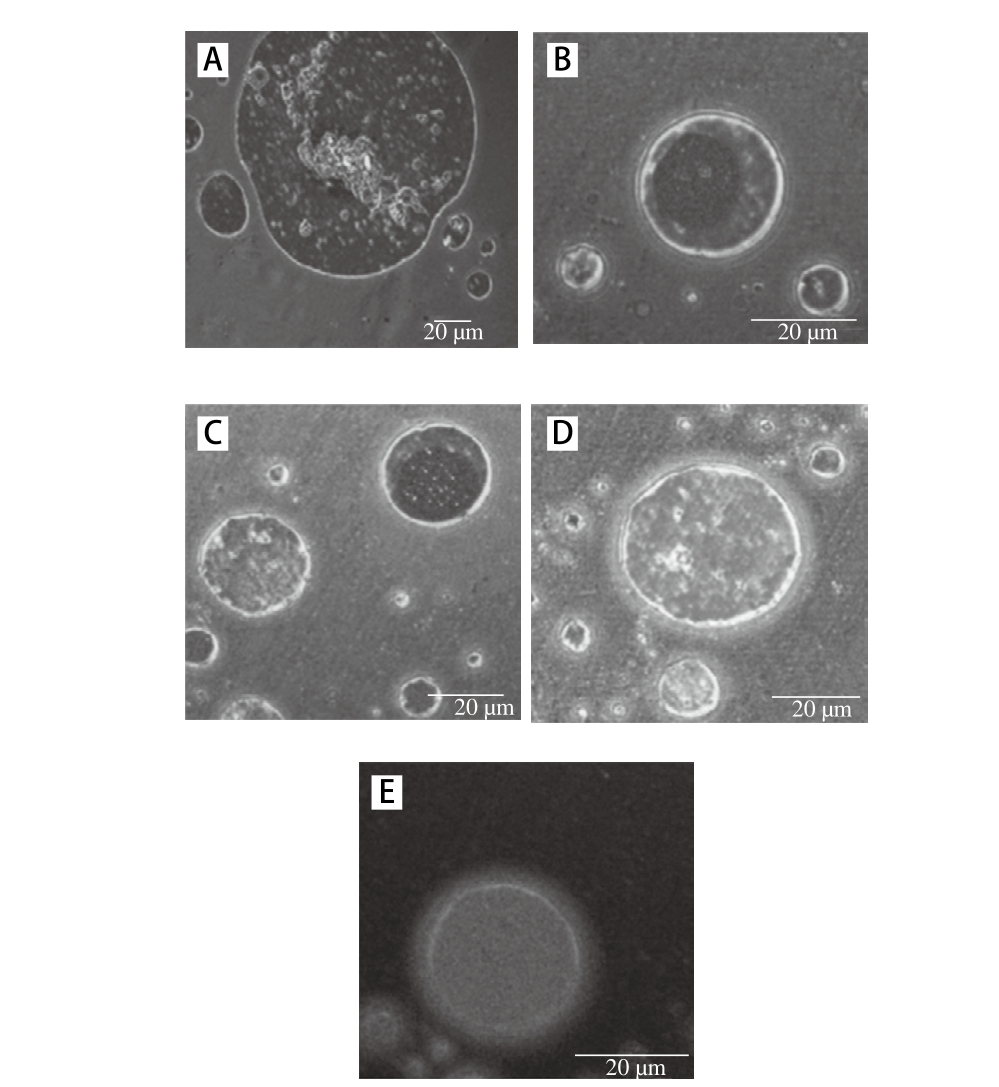
图3 不同质量分数AG的MP-AG共建乳状液体系贮藏10 d后CLSM放大图
Fig. 3 Enlarged CLSM images
为了研究AG质量分数对于MP-AG共建乳状液体系中油水界面膜的影响,将图2的CLSM在488 nm和633 nm激发波长下的叠加图片中随机区域液滴进行放大,可以更加清晰地观察共建乳状液体系中水相和油相结合情况。如图3所示,未添加AG的乳状液液滴表面吸附的MP不均匀,液滴边缘的界面膜较薄。而添加AG以后,AG质量分数从0.0%增加到0.3%,在MP-AG共建乳状液体系中吸附在界面上的MP含量逐渐增多,液滴表面形成的界面膜逐渐致密且均匀,CLSM图像进一步支持AG质量分数影响乳状液的界面膜致密性及薄厚。Wong等[16]研究发现在乳化体系中水相的蛋白作为一种乳化剂会与油相形成油水界面膜,而界面膜上吸附的蛋白含量越高则说明蛋白的乳化性能越好,界面性质更好,而乳化体系也就越稳定。Khouryieh等[13]研究表明多数多糖和蛋白质倾向于通过增加水相的黏度来抑制液滴运动,因此添加多糖进入蛋白质为乳化剂的乳状液中可以通过增加乳状液的黏度提高蛋白质在界面上的吸附,进一步提高乳状液的物理稳定性。Jia Xuejuan等[23]分别以乳清分离蛋白和乳清分离蛋白-羧甲基纤维素钠的复合物为乳化剂制备乳化体系,并通过离子共振技术测定膜的厚度。研究结果表明乳清分离蛋白-羧甲基纤维素钠形成的预乳化体系的稳定性明显高于单独以乳清分离蛋白为乳化剂的乳状液,其原因是乳清分离蛋白吸附到油滴表面后,羧甲基纤维素钠依然可以阻止油滴间的聚集并在其外侧形成一层更厚的界面膜,因此乳清分离蛋白-羧甲基纤维素钠的复合物能够形成双层膜,进而表现出更高的稳定性。Khalloufi等[24]研究表明乳清蛋白可与亚麻籽胶通过静电作用发生吸附,形成比蛋白质和多糖更具优良功能特性的乳清蛋白-亚麻籽胶复合物,从而改变乳清分离蛋白在界面上的吸附能力及整个乳状液体系的流动性,降低油水界面张力进而改善乳状液的物理稳定性。Zhu Lijun等[21]研究发现芦丁可以与大豆分离蛋白通过疏水相互作用形成芦丁-大豆分离蛋白复合物吸附到油水界面上,复合物在界面上的富集增加了乳化体系的物理稳定性,和单独一种物质添加到乳状液样品相比,显著地降低了颗粒大小。在本实验中AG质量分数为0.3%时,MP-AG共建乳状液体系液滴吸附的蛋白量较大(表现为液滴呈现橘色)且十分均匀,所形成的界面膜明显厚于其他各处理组,表现出最致密的界面吸附。根据上述分析可能原因为质量分数0.3% AG增加了乳状液的黏度,抑制乳状液中颗粒的流动速率,因此增加了MP在界面上的吸附;此外可能存在AG-MP复合物吸附到油水界面上,即形成了双层界面膜,显著增加了界面膜的厚度和强度,进一步提高了乳状液的物理稳定性。然而,AG质量分数为0.4%时,MP-AG共建乳状液体系中MP在界面上的吸附量的下降,界面膜变薄,且在油滴表面吸附的MP含量较少,证明了随着AG质量分数的增高,有更多的多糖吸附在了界面上,原本吸附在界面上的MP会被部分取代下来,MP和AG在界面上的竞争性吸附,导致乳状液的稳定性下降[17]。
本实验研究了AG对于提高以MP为乳化剂的O/W型乳状液物理稳定性的作用机制。结果表明,AG质量分数为0.3%时,可以显著提高MP-AG共建乳状液体系的乳化性和ζ-电势,改变了粒径大小和分布,降低了乳析指数和聚集行为,显著降低了液滴颗粒大小,增加了所形成的界面膜的致密程度,这可能与油水界面上形成MP-AG复合物有关。本研究后续实验中应深入探讨流变特性及界面上MP-AG复合物形成与共建乳状液体系稳定性之间的关系。总之,AG可以促进MP在油水界面上的吸附作用,提高MP乳化的O/W乳状液的物理稳定性。
参考文献:
[1] JOYE I J, McCLEMENTS D J. Emulsifying and emulsion-stabilizing properties of gluten hydrolysates[J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2623-2630. DOI:10.1021/jf5001343.
[2] KONG Baohua, XIONG Youling L.. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal of Agricultural and Food Chemistry, 2006, 54(16): 6059-6068.
[3] JIANG Jiang, ZHU Bo, LIU Yuanfa, et al. Interfacial structural role of pH-shifting processed pea protein in the oxidative stability of oil/ water emulsions[J]. Journal of Agricultural and Food Chemistry, 2014, 62(7): 1683-1691. DOI:10.1021/jf405190h.
[4] JIANG Jiang, XIONG Youling L.. Role of interfacial protein membrane in oxidative stability of vegetable oil substitution emulsions applicable to nutritionally modified sausage[J]. Meat Science, 2015, 109: 56-65. DOI:10.1016/j.meatsci.2015.05.011.
[5] LONG Zhao, ZHAO Mouming, LIU Ning, et al. Physicochemical properties of peanut oil-based diacylglycerol and their derived oil-inwater emulsions stabilized by sodium caseinate[J]. Food Chemistry, 2015, 184(1): 105-113. DOI:10.1016/j.foodchem.2015.03.052.
[6] XU Duoxia, AIHEMAITI Z, CAO Yanping, et al. Physicochemical stability, microrheological properties and microstructure of lutein emulsions stabilized by multilayer membranes consisting of whey protein isolate, flaxseed gum and chitosan[J]. Food Chemistry, 2016, 202(1): 156-164. DOI:10.1016/j.foodchem.2016.01.052.
[7] 孙哲浩, 赵谋明, 彭志英. 蛋白质与多糖类交互作用对食品乳状液稳定性的影响[J]. 食品与发酵工业, 2000, 14(16): 314-318.
[8] 胡国华. 阿拉伯胶在食品工业中的应用[J]. 粮油食品, 2003, 11(2): 46-48.
[9] LEE S H, LEFEVRE T, SUBIRADE M, et al. Effects of ultra-high pressure homogenization on the properties and structure of interfacial protein layer in whey protein-stabilized emulsion[J]. Food Chemistry, 2009, 113(2): 191-198. DOI:10.1016/j.foodchem.2009.06.031.
[10] XIA Xiufang, KONG Baohua, LIU Qian, et al. Physicochemical change and protein oxidation in porcine longissimus muscle as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83(2): 239-245. DOI:10.1016/j.meatsci.2009.05.003.
[11] WU M G, XIONG Youling L., CHEN J, et al. Rheological and microstructural properties of porcine MP-lipid emulsion composite gels[J]. Journal of Food Science, 2009, 74(4): E207-E217. DOI:10.1111/j.1750-3841.2009.01140.x.
[12] SUN Changhui, GUNASEKARAN S. Rheology and oxidative stability of whey protein isolate-stabilized menhaden oil-in-water emulsions as a function of heat treatment[J]. Journal of Food Science, 2010, 75(1): 1270-1282. DOI:10.1111/j.1750-3841.2009.01387.x.
[13] KHOURYIEH H, PULI G, WILLIAMS K, et al. Effects of xanthanlocust bean gum mixtures on the physicochemical properties and oxidative stability of whey protein stabilised oil-in-water emulsions[J]. Food Chemistry, 2015, 167(15): 340-348. DOI:10.1016/ j.foodchem.2014.07.009.
[14] DIAO Xiaoqin, GUAN Haining, ZHAO Xinxin, et al. The properties and oxidation stability of emulsions prepared with myofibrillar protein and lard diacylglycerols[J]. Meat Science, 2016, 115: 16-23. DOI:10.1016/j.meatsci.2016.01.001.
[15] WANG Lijun, XIE Hongen, QIAO Xiuying, et al. Interfacial rheology of natural silk fibroin at air/water and oil/water interfaces[J]. Langmuir, 2012, 28(1): 84-93. DOI:10.1021/la2041373.
[16] WONG B T, ZHAI J, HOFFMANN S V, et al. Conformational changes to deamidated wheat gliadins and β-casein upon adsorption to oilwater emulsion interfaces[J]. Food Hydrocolloid, 2012, 27(1): 91-101. DOI:10.1016/j.foodhyd.2011.08.012.
[17] SUN Changhui, SUNDARAM G, MARK R P. Effect of xantham gum on physiochemical properties of whey protein isolate stabilized oilin-water emulsion[J]. Journal of Food Engineering, 2014, 122: 15-27. DOI:10.1016/j.jfoodeng.2013.08.034.
[18] YI Jianhua, ZHU Zhenbao, McCLEMENTS D J, et al. Influence of aqueous phase emulsifiers on lipid oxidation in water-in-walnut oil emulsions[J]. Journal of Agricultural and Food Chemistry, 2014, 62(9): 2104-2111. DOI:10.1021/jf404593f.
[19] QIU C Y, ZHAO M M, DECKER E A, et al. Influence of protein type on oxidation and digestibility of fish oil-in-water emulsions: Gliadin, caseinate, and whey protein[J]. Food Chemistry, 2015, 175(15): 249-257. DOI:10.1016/j.foodchem.2014.11.112.
[20] HU Ming, McCLEMENTS D J, DECKER E A. Lipid oxidation in corn oil-in-water emulsions stabilized by casein, whey protein isolate, and soy protein isolate[J]. Journal of Agricultural and Food Chemistry, 2003, 51(6): 1696-1700.
[21] ZHU Lijun, CHEN Jie, TANG Xueyan, et al. Reducing, radical scavenging, and chelation properties of in vitro digests of alcalasetreated zein hydrolysates[J]. Journal of Agricultural and Food Chemistry, 2008, 56(8): 2714-2721. DOI:10.1021/jf703697e.
[22] McCLEMENT D J, DECKER E A. Spruce galactoglucomannans inhibit lipid oxidation in rapeseed oil-in-water emulsions[J]. Food Hydrocolloid, 2016, 58(1): 255-266. DOI:10.1016/ j.foodhyd.2016.03.006.
[23] JIA Xuejuan, XU Ranran, SHEN Wei, et al. Stabilizing oil-in-water emulsion with amorphous cellulose[J]. Food Hydrocolloids, 2015, 43: 275-282. DOI:10.1016/j.foodhyd.2014.05.024.
[24] KHALLOUFI S, ALEXANDER M, DOUGLAS G H, et al. Physicochemical properties of whey protein isolate stabilized oilin-water emulsions when mixed with flaxseed gum at neutral pH[J]. Food Research International, 2011, 41(10): 964-972. DOI:10.1016/ j.foodres.2011.07.019.
[25] KARGAR M, FAYAZMANESH K, ALAVI M, et al. Investigation into the potential ability of pickering emulsions (food-grade particles) to enhance the oxidative stability of oil-in-water emulsions[J]. Journal of Colloid and Interface Science, 2012, 366(1): 209-215. DOI:10.1016/ j.jcis.2011.09.073.
[26] FRANKEL E N, HUANG S W, KANNER J, et al. Interfacial phenomena in the evaluation of antioxidants: bulk oils vsemulsions[J]. Journal of Agricultural and Food Chemistry, 2004, 42(1): 1054-1059. DOI:10.1021/jf5001023.
[27] CHENG Yu, XIONG Youling L., CHEN Jie. Antioxidant and emulsifying properties of potato protein hydrolysate in soybean oilin-water emulsions[J]. Food Chemistry, 2010, 120(1): 101-108. DOI:10.1016/j.foodchem.2009.09.077.
[28] ELIAS R J, McCLEMENTS D J, DECKER E A. Nanocomplexes arising from protein-polysaccharide electrostatic interaction as a promising carrier for nutraceutical compounds[J]. Food Hydrocolloids, 2015, 50: 16-26. DOI:10.1016/j.foodhyd.2015.04.006.
[29] ZHANG Xin, XIONG Youling L., CHEN Jie, et al. Synergy of licorice extract and pea protein hydrolysate for oxidative stability of soybean oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2014, 62(32): 8204-8213. DOI:10.1021/jf5016126.
Physical Stability of Complex Emulsion Systems Containing Myofibrillar Protein and Different Concentrations of Arabic Gum
LI Yuanyuan, LIU Qian, WANG Haitang, LIU Pengxue, KONG Baohua*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:This study investigated the effects of adding different amounts of arabic gum (AG) on the improving the physical stability of oil-in-water (O/W) emulsions prepared with myof i brillar protein (MP). It was demonstrated that the emulsifying activity index and emulsion stability index increased firstly and then decreased with the increase of AG concentrations. Emulsions with 0.3% AG had the highest physical stability and ζ-potential, smallest particle size, and lowest creaming index (P < 0.05). Confocal laser scanning microscopy (CLSM) observation proved that emulsions with 0.3% AG possessed relatively small droplets compared with the ones without AG, which was coincident with the results of droplet size distribution. The micrographs demonstrated that the interfacial membrane in emulsions with 0.3% AG was more compact and stronger than that in the ones without AG. In general, our results revealed that AG promoted the adsorption of protein at the O/W interface and improved physical stability of the MP O/W emulsion.
Key words:myof i brillar protein; arabic gum; oil-in-water emulsions; physical stability
DOI:10.7506/spkx1002-6630-201711029
中图分类号:TS251.1
文献标志码:A
文章编号:1002-6630(2017)11-0182-08引文格式:
收稿日期:2016-05-17
基金项目:黑龙江省应用技术研究与开发重点计划项目(GA15B302);东北农业大学“青年才俊”计划项目(14QC40)
作者简介:李媛媛(1992—),女,硕士研究生,研究方向为畜产品加工。E-mail:liyuanyuan.1992@163.com
*通信作者:孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh@163.com