程明明,黄 苇*
(华南农业大学食品学院,广东 广州 510640)
摘要:目的:本研究探讨西番莲果皮中湿法改性膳食纤维的降脂保肝及润肠通便功能。方法:利用高脂饲料构建高脂小鼠模型,以湿法改性膳食纤维灌胃给药6 周,测定高、中、低不同给药剂量组的相关指标。结果:与模型对照组相比,阳性对照组、高剂量组和中剂量组小鼠血清总胆固醇水平、甘油三酯水平和丙二醛含量都有所下降,高密度脂蛋白胆固醇水平、谷丙转氨酶、谷草转氨酶、谷胱甘肽过氧化物歧化酶和超氧化物歧化酶活性都有所提升,高剂量组和中剂量组的低密度脂蛋白胆固醇水平下降,且都差异显著。结论:西番莲果皮膳食纤维具有较好的降血脂和保肝功能,并且功效和剂量呈现一定的依赖关系。各灌胃组的小鼠排便量差异不显著,但粪便含水率都显著增加,说明该改性纤维具有一定预防便秘的功效。
关键词:西番莲果皮;膳食纤维;降血脂;保肝;润肠通便
西番莲(Passiflora caerulea L.)又名百香果、鸡蛋果,属西番莲科西番莲属的藤本植物,有“果汁之王”的美誉[1],世界多地都有种植。据有关研究报道[2],我国在2008年西番莲种植面积已经达到4.5万亩,种植面积大且逐年增加,到2015年仅广西桂林的种植面积就达到8 000 hm2。在西番莲鲜果中,果皮占总质量50%左右且含有丰富的膳食纤维。文良娟等[3]对西番莲果皮的组成成分进行了分析,结果表明西番莲果皮中其中果胶和粗纤维含量分别为12.5%和22.1%。膳食纤维主要由水不溶性膳食纤维(insoluble dietary fi ber,IDF)和水溶性膳食纤维(soluble dietary fiber,SDF)组成,被称为第七营养素。大量研究表明,膳食纤维具有降血脂、降血糖、降血压、预防便秘、减肥、抗氧化等作用[4-5],并且能促进肠道蠕动及有毒物质的排出[6]。
高脂血症是指脂肪代谢或运转异常使血液中血脂含量高于正常范围的一种症状,伴随血脂异常也常会影响肝脏功能[7]。目前认为,高脂血症的病因除了遗传因素、药物所致和疾病诱发等外,主要和膳食纤维摄入量的不足有极大的关系[8]。国内外研究表明,膳食纤维具有降血脂的功效。在临床上,经常利用他汀类、贝特类等药物降脂,虽说效果明显,但成本昂贵且长期服用副作用较大,因此越来越多研究人员都致力于寻找天然物质来降低机体的血脂水平,多项研究报告已表明,以食物为基础的膳食干预疗法被公认为对防治高脂血症至关重要[9],其机理之一为膳食纤维分子的表面具有很多活性基团,对胆固醇、胆汁酸等具有很强的吸附螯合能力,可以降低人体对过度供给的甘油三酯、胆固醇、胆酸盐的吸收利用,从而能抑制总胆固醇浓度提高,降低血清及肝脏中的胆固醇含量,起到降血脂的作用[10]。
程明明等[11]在研究体外吸附实验过程中,发现湿法改性膳食纤维对脂肪酸、胆固醇和胆酸钠等具有很好的吸附效果。本研究在前期肠胃模拟实验的基础上,结合相关文献报道,以真空冷冻干燥湿法改性膳食纤维为原料,通过建立高脂小鼠模型,探究了该膳食纤维的降脂保肝和润肠通便功效,旨在为功能产品的开发提供一定的借鉴与依据。
1.1 材料与试剂
SPF(specific pathogen free)级昆明(KM)小鼠72 只,雄性,体质量为(20±2) g(成年后能到40 g左右),均由广东医学实验动物中心提供。
SPF级高脂动物模型饲料(生产许可证号:SCXK(粤)2013-0002),总能量4.5 kcal/g。配方为:蔗糖20%、猪油15%、胆固醇1.2%、胆酸钠0.2%、酪蛋白10%、磷酸氢钙0.6%、石粉0.4%、预混料0.4%、基础饲料52.2%(均为质量分数,下同),其中蛋白质19%、脂肪18.5%、碳水化物50.5%;热量比:蛋白质17.5%,脂肪37%,碳水化物45.5%。
总胆固醇(total cholesterol,TC)检测试剂盒、甘油三酯(triglyceride,TG)检测试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)检测试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)检测试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、谷丙转氨酶(alanine aminotransferase,ALT)试剂盒、谷草转氨酶(aspertate aminotransferase,AST)试剂盒南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
TU-1800紫外-可见分光光度计 北京普析通用仪器有限公司;12-ND真空冷冻干燥机 宁波新芝生物科技股份有限公司;5424小型高速离心机 Eppendorf中国有限公司。
1.3 方法
1.3.1 湿法改性膳食纤维的制备
西番莲果皮→干燥粉碎(过40 目筛)→α-淀粉酶水解(60 ℃、45 min)→木瓜蛋白酶(60 ℃、30 min)→碱解(3 g/100 mL碱液)、60 ℃、60 min→过滤、洗涤至中性→干燥粉碎→IDF。然后利用胶体磨对IDF进行湿法超微粉碎,料液比为1∶30(m/V),齿轮间隙10 μm,反复处理3 次,进行真空冷冻干燥得到湿法改性样品。
1.3.2 湿法改性膳食纤维的扫描电子显微镜分析
将样品置于烘箱中干燥至恒质量,利用戊二醛进行固定,采用溅射镀膜法进行表面镀金,对其进行扫描电子显微镜观察,得到不同倍数的电子显微镜扫描图(×800和×4 000)。
1.3.3 高脂动物模型的建立
小鼠高脂模型的建立参考《保健食品检测与评价技术规范(2003版)》[12]。雄性昆明小鼠72 只,随机分成6 组,每组12 只,喂食普通饲料,适应性饲养1 周。1 周后,随机选出5 组,喂食高脂饲料,剩余1 组为空白组(阴性对照组),喂食普通饲料,期间小鼠自由饮食饮水,小鼠垫料3 d换1 次,所有实验均在屏障环境中完成。12 d后,对小鼠眼眼内眦取血,快速离心得到血清,测定TC和TG含量。
高脂小鼠血清中TC((7.442±0.921) mmol/L)、TG((1.756±0.217) mmol/L)含量均高于空白对照组小鼠的TC((2.917±0.813) mmol/L)、TG((1.242±0.267) mmol/L)含量,呈显著性差异,说明小鼠高脂模型建立成功,且判定为混合型高脂血症动物模型。
1.3.4 小鼠饲养实验
将喂食普通饲料的12 只小鼠归为阴性对照组,将造模成功的60 只小鼠随机分成5 组,12 只一组,每4 只一笼,做好标记。其中3 组分别为高剂量组、中剂量组和低剂量组,另外两组分别为模型对照组和阳性对照组(添加同膳食纤维中剂量组等量的麦麸),参照中国膳食指南中成人日均膳食纤维的摄入量(以60 kg成年人日均摄入量30 g为基准),设置小鼠给药剂量(其中阳性对照组和中剂量组的给药量为0.018 g/(kg·d)、高剂量组为0.036 g/(kg·d)、低剂量组为0.009 g/(kg·d)),以10 mL/kg的量进行灌胃,其中阴性对照组和模型对照组都给予等量的生理盐水,其他组别将膳食纤维用生理盐水配成不同质量浓度的溶液进行灌胃给药。在灌胃期间,阴性对照组小鼠继续喂食普通饲料,其余组均喂食高脂饲料,各组小鼠均自由饮食饮水。
1.3.5 降血脂功能的指标测定
自适应性喂养结束后,每一周记录一次小鼠体质量;灌胃到第4周和第6周,小鼠眼眶静脉丛取血,10 000 r/min的转速进行分离,快速取得血清,参照试剂盒上的操作方法,测定血清中的TC、TG、LDL-C和HDL-C的含量,并且计算小鼠的动脉硬化指数(atherogenic index,AI)[13]。
1.3.6 保肝功能的指标测定
第五周末将所有小鼠取血之后,全部解剖,取出肝脏和肾脏,用生理盐水洗净,再用滤纸吸干表层的水分,称质量,计算小鼠的肝脏系数和肾脏系数[14]。
取一定的肝组织,加入9 倍体积的生理盐水,配成10 g/100 mL的匀浆,按试剂盒操作说明,测定肝脏的MDA含量、SOD、GSH-Px、AST、ALT活力。
利用10%的中性福尔马林溶液将肝脏进行固定、浸蜡、包埋、脱蜡、染色等,在显微镜下观察肝组织的病理学变化[14]。
1.3.7 润肠通便功能的指标测定
自灌胃开始,每隔3 d后,连续3 d收取小鼠粪便,称质量,并且测定粪便的含水率,计算公式按式(3)。
1.4 数据处理
所有数据用 ±s表示,用SPSS统计软件进行统计分析处理,利用OriginPro 8软件对数据进行处理。
±s表示,用SPSS统计软件进行统计分析处理,利用OriginPro 8软件对数据进行处理。
2.1 扫描电子显微镜观察结果
超微粉碎是指将3 mm以上的物料颗粒粉碎至10~25 μm以下的过程,其原理是强剪切力使物料的粒度减小、比表面积增大,并且暴露更多基团,可以使物料具有高的溶解性、吸附性和水合性质[15-16]等,并且能使SDF含量增加。由图1A可知,未经改性的DF呈现一定的网络结构,并且具有比较完整的细胞壁组织;由图1B可知,DF经湿法改性后,组织纤维网络结构破坏得很严重,几乎看不到完整的细胞壁,且重构成多层褶皱状的蓬松结构,内部比表面积和孔隙率显著增大,该结构可能有利于提高DF对胆固醇、脂肪酸等物质的吸附能力。

图1 膳食纤维的形貌表征
Fig. 1 Effect of the modification on the morphology of DF
2.2 小鼠的生长曲线
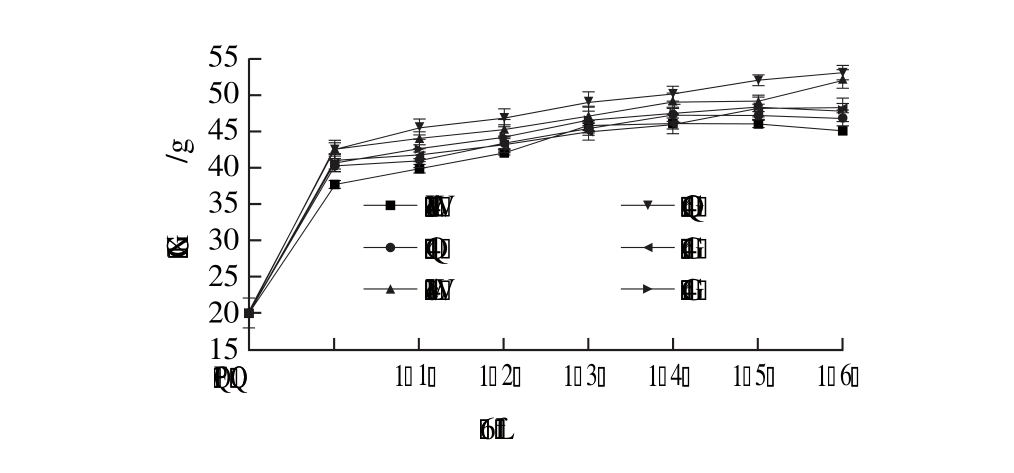
图2 小鼠的生长曲线
Fig. 2 Weight gain curves of mice
由图2可知,整体上其他组小鼠体质量均高于阴性对照组,这是饲喂高脂饲料引起小鼠肥胖的缘故,而其他组间体质量差异可能是小鼠个体差异造成的;在造模期间,小鼠体质量从20 g左右增加到40 g左右,达到成年小鼠体质量水平;在灌胃膳食纤维的几周内,小鼠体质量基本呈现一个平缓递增的趋势,每组小鼠每周平均净增2 g左右,灌胃给药并没有给小鼠的体质量减轻带来明显效果,推测西番莲果皮膳食纤维没有减肥的功效,而后续小鼠体质量的增加可能是由于高脂饲料和鼠龄增大共同作用的结果。
2.3 西番莲果皮膳食纤维对小鼠血清血脂水平的影响
表1 湿法改性膳食纤维对小鼠血清血脂水平的影响
Table 1 Effect of modified DF on serum lipid levels in mice
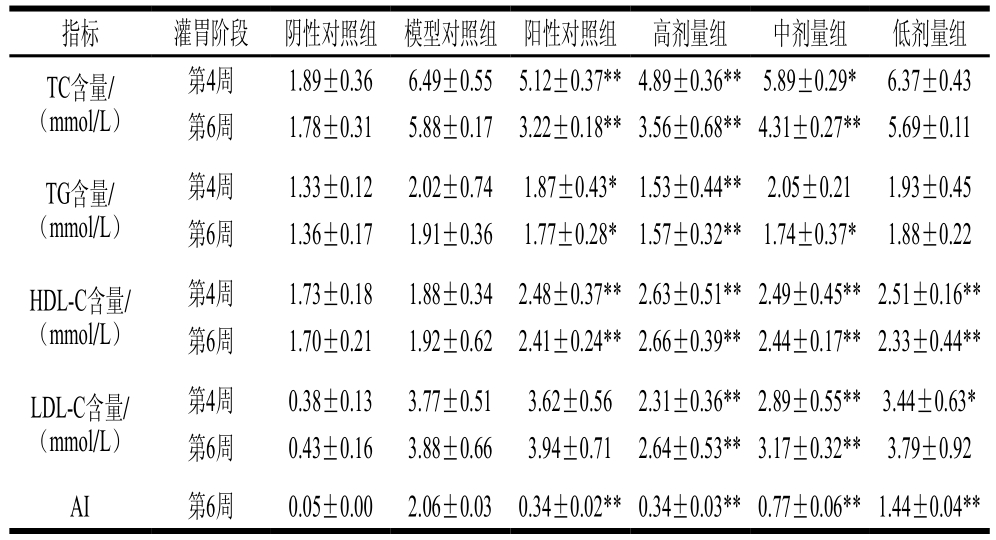
注:*.与模型对照组相比差异显著(P<0.05);**.与模型对照组相比差异极显著(P<0.01)。下同。测定波长:TC和TG为510 nm;HDL-C和LDL-C为546 nm。
从表1可以看出,灌胃第6周,与模型对照组相比,高剂量组和中剂量组TC含量极显著降低(P<0.01)、TG含量显著降低(P<0.05,P<0.01)、HDL-C含量极显著升高(P<0.01),LDL-C含量极显著降低(P<0.01),相应指标的升降与灌胃膳食纤维呈剂量-效应关系;由灌胃麦麸的阳性对照组可以看出,小鼠血清中的TC含量极显著降低(P<0.01)、TG含量显著降低(P<0.05)、HDL-C水平极显著升高(P<0.01),但LDL-C水平变化不明显。以上结果表明,湿法改性膳食纤维和麦麸都具有一定的降血脂功效,并且湿法改性膳食纤维在降低TG和LDL-C水平上更具优势,这与膳食纤维改性后良好的吸附性能和持水性有关,能够吸附结合胆固醇、脂肪酸和胆汁酸等物质,并且能加快粪便的排出速率和排出量,减少了肠道的重吸收,促进肝脏中胆汁酸的代谢,也会伴随胆固醇代谢的加快起到降血脂的效果[17]。
AI常被用做医学界衡量动脉硬化程度,其数值越大,动脉硬化程度越高,越容易引发心脑血管疾病。由表1可知,模型对照组的AI与阴性对照组存在明显差异,说明高脂血症的小鼠动脉硬化的程度较严重,一般而言,动脉硬化程度越高,患心脑血管类疾病的危险性就越高。与模型对照组相比,各灌胃组的AI都呈极显著降低(P<0.01),说明该膳食纤维在一定程度上能降低心脑血管类疾病的危险性。
2.4 湿法改性膳食纤维的保肝功能
2.4.1 湿法改性膳食纤维对小鼠肝(肾)脏系数、ALT和AST活力的影响
在医学上,ALT和AST活力经常被用来判断肝脏功能优劣的指标。一般而言,AST和ALT主要存在于肝脏的肝细胞内,当肝脏受损时,转氨酶会释放到血液中去,所以血液检测中转氨酶值会偏高[18]。由表2可知,与阴性对照组相比,模型对照组的ALT和AST活力极显著升高(P<0.01),说明小鼠肝脏受损严重,这可能是由于喂食高脂饲料引起的肝脏功能下降;较模型对照组而言,阳性对照组、高剂量组和中剂量组的ALT活力都极显著降低(P<0.01),低剂量组显著降低(P<0.05);高剂量组的AST活力极显著降低(P<0.01),阳性对照组和中剂量组显著降低(P<0.05)。肝(肾)脏系数在一定程度上也反映了肝(肾)脏受损伤的程度,脂质代谢紊乱时肝(肾)脏易发生脂肪变性,质量增加,因此,通过观察肝(肾)系数的变化能看出该物质是否具有抑制肝(肾)脏脂肪变性的功效[19]。较阴性对照组相比,模型对照组的肾脏系数差异不显著,但肝脏系数极显著升高(P<0.01),说明小鼠的肾脏并未受损,肝脏受损严重。与模型对照组相比,阳性对照组肝脏系数极显著降低(P<0.01),高剂量组和低剂量组显著降低(P<0.05),中剂量组效果却不显著,这可能和个体差异有关。综上可见,西番莲果皮膳食纤维在预防肝脏受损具有一定的功效。
表2 湿法改性膳食纤维对小鼠肝(肾)脏系数、ALT和AST活力的影响
Table 2 Effect of modified DF on liver (kidney) index, ALT and AST in mice
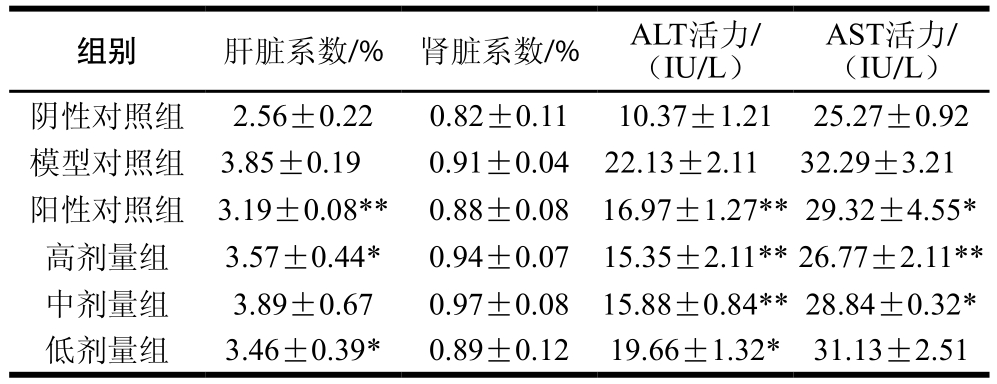
注: .与阴性对照组相比差异显著(P<0.05);
.与阴性对照组相比差异显著(P<0.05);
 .与阴性对照组相比差异极显著(P<0.05)。测定波长:ALT和AST为505 nm。
.与阴性对照组相比差异极显著(P<0.05)。测定波长:ALT和AST为505 nm。
2.4.2 湿法改性膳食纤维对小鼠肝脏抗氧化活性的影响在饮食过程中,高脂物质会使机体内的自由基水平显著增加[20-21],从而影响体内的氧化应激性,且在代谢过程中,胆固醇会被运至肝脏中,以脂质过氧化物的形式产生大量的氧化产物[22]。MDA是膜脂过氧化最重要的产物之一,主要存在于细胞浆内,当细胞的通透性改变或者细胞膜受损时,其含量往往会增加;SOD是一种新型酶制剂,在生物体内分布广泛,它能对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,复原因自由基对细胞造成的伤害;GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,它的活性中心成分是硒半胱氨酸,因此其机体水平可反映硒水平,硒能催化GSH
变为氧化型谷胱甘肽,使有毒的过氧化物还原成无毒的羟基化合物,并且保护细胞膜的结构及功能不受过氧化物的损害[23];以上3 个指标反映机体在对抗过氧化物攻击时机能的强弱,也可反映肝细胞的受损程度。从表3可以看出,与模型对照组相比,各灌胃组的MDA含量都呈极显著降低(P<0.01),SOD活力只有高剂量组极显著升高(P<0.01),GSH-Px活力只有高剂量组显著升高(P<0.05)。综上所述,该膳食纤维能一定程度上提高肝脏的抗氧化活性。
表3 湿法改性膳食纤维对小鼠MDA含量、SOD和GSH-Px活力的影响(n=5)
Table 3 Effect of modified DF on MDA, SOD and GSH-Px levels in mice (n= 5)

注:测定波长:MDA:532 nm;SOD:450 nm;GSH-Px:412 nm。
2.4.3 湿法改性膳食纤维对小鼠肝脏的病理学影响

图3 小鼠肝脏图
Fig. 3 Pictures of mouse livers

图4 小鼠肝脏切片(×40)
Fig. 4 Biopsy of mouse liver (× 40)
小鼠肝脏如图3(图中未能显示颜色)所示,阴性对照组小鼠肝脏体积大小适中,颜色暗红,表面光滑,并且质地紧密,组织结构弹性好;模型对照组小鼠肝脏体积明显肿大,颜色淡黄,表面有少量突出细小颗粒物,且缺乏色泽,弹性较差,触碰易碎,组织结构呈现一定的纤维化现象;阳性对照组、高剂量组和中剂量组小鼠肝脏颜色明显好转,弹性也部分恢复,但低剂量组表观差异不明显。小鼠肝脏切片从图4可以看出,阴性对照组的肝小叶结构相对完整,肝窦明显,中央静脉排列较致密、整齐,并且肝细胞围绕中央静脉呈放射状排列。模型对照组肝细胞充满大小不等的泡沫样脂肪滴,散布在整个胞浆中,占据整个胞浆位置,将细胞核挤压至一边,肝细胞排列紊乱,颗粒细胞弥漫肿胀并且呈现一定的变性和坏死,说明肝脏受损严重[24]。阳性对照组和各给药组细胞内脂肪滴颗粒明显减少,并且呈一定的剂量-效应关系,其中高剂量组肝构架基本完整,有清晰可见的中央静脉,和阴性组最为接近,效果最佳。说明该膳食纤维能够改善小鼠肝脏的纤维化现象,并且对肝脏中脂肪的变性具有一定的抑制作用。
2.5 湿法改性膳食纤维对小鼠润肠通便功能的影响

图5 湿法改性膳食纤维对小鼠排便量的影响
Fig. 5 Effect of modified DF on defecation in mice
实验过程中,各组小鼠生长状况良好,无腹泻等不良反应产生。由图5可知,随着灌胃时间的延长,小鼠每天的排便量基本呈现平缓增加的趋势,这可能是由于小鼠体质量增加的缘故。在同一灌胃周内,各组与阴性对照组相比,排便量都有所增加,这可能是不同组小鼠体质量差异所致,也可能是因为IDF本身不被消化吸收,增加摄入量就可能增加排便量。灌胃组小鼠的组间排便量差异和剂量-效应关系比较紊乱,这可能是由于高脂血症引起的脂质代谢混乱影响排便所致。
表4 湿法改性膳食纤维对小鼠粪便含水率的影响
Table 4 Effect of modified DF on fecal water content in mice %

由表4可知,从灌胃1周到6周,阳性对照组、高剂量组、中剂量组和低剂量组较模型对照组而言,小鼠粪便的含水率都呈现极显著上升(P<0.01),说明膳食纤维能显著提高粪便的含水率,这可能是由于IDF和SDF自身强大持水力的缘故;高、中、低剂量组较阳性对照组含水率也有所增加,这可能是麦麸和改性膳食纤维SDF含量的差异所致。有关研究表明,同时含有SDF和IDF的复合物,较单一种类的膳食纤维在改善肠道功能方面更有效果[25]。由此推理,该膳食纤维可能具有良好的预防便秘功能。
临床研究表明[26-27],血清中TC、TG含量升高及HDL-C含量降低是导致心血管疾病的诱发因子,高浓度的LDL-C则是动脉硬化的易患因子。与阴性对照组相比,高脂模型组小鼠血清TC、TG及LDL-C含量均升高,说明本实验中饲喂高脂饲料可成功构建高脂动物模型;与模型组相比,高剂量组和中剂量组TC含量极显著降低(P<0.01)、TG含量显著降低(P<0.05,P<0.01)、HDL-C含量极显著升高(P<0.01),LDL-C含量极显著降低(P<0.01),相应指标的升降与灌喂膳食纤维呈剂量-效应关系;以上结果表明,湿法改性膳食纤维和具有一定的降血脂功效。
药理研究表明,脂质过氧化的主要作用是降低细胞膜的流动性,从而改变细胞膜的特性和破坏膜的结合蛋白[28]。一般而言,脂质过氧化在细胞膜中发生,破坏了细胞膜对脂肪的转运机制,为大量脂肪在肝细胞内的堆积提供了条件。与模对照型组相比,阳性对照组、高剂量组和中剂量组的ALT活力都极显著降低(P<0.01),低剂量组显著降低(P<0.05);高剂量组的AST活力极显著降低(P<0.01),阳性对照组和中剂量组显著降低(P<0.05);各灌胃组的MDA含量都极显著降低(P<0.01);SOD活力只有高剂量组极显著升高(P<0.01);GSH-Px活力只有高剂量组显著升高(P<0.05);结果表明,模型对照组小鼠肝脏受到一定的损伤,灌胃给药6周后,能一定程度预防肝脏变性,具有很好的保肝作用,并且功效和剂量呈现一定的依赖关系,这可能与提高抗氧化能力和脂质代谢酶的活性等方面有关。
润肠通便与膳食纤维的关系密切,除了与其极强的持水性有关外,膳食纤维被酵解可产生短链脂肪酸,降低大肠pH值,刺激肠道蠕动,SDF发酵后产生的二氧化碳、氢气、甲烷等气体,亦能刺激肠黏膜[29-30]。与模型对照组相比,从排便量来看,各灌胃小组的小鼠排便量差异不显著,但粪便含水率都极显著增加(P<0.01),说明该膳食纤维可能具有一定预防便秘的功效。上述结果表明,西番莲果皮湿法改性膳食纤维具有一定的降脂保肝及润肠通便的功效。
参考文献:
[1] ZERAIK M L, YARIWAKE J H. Quantification of isoorientin and total flavonoids in Passif i ora edulis fruit pulp by HPLC-UV/DAD[J]. Micro-Chemical Journal, 2010, 96(1): 86-91. DOI:10.1016/j.microc.2010.02.003.
[2] HUXLEY R R, WOODWARD M, CLIFTON P. The epidemiology evidence and potential biological mechanisms for a protective effect of dietary fiber on the risk of colorectal cancer[J]. Current Nutrition Reports, 2013, 2(1): 63-70. DOI:10.1007/s13668-012-0030-2.
[3] 文良娟, 毛慧君, 张元春, 等. 西番莲果皮成分分析及其抗氧化活性的研究[J]. 食品科学, 2008, 29(11): 54-58. DOI:10.3321/ j.issn:1002-6630.2008.11.005.
[4] OWENS T J, LARSEN J A, FARCAS A K, et al. Total dietary fiber composition of diets used for management of obesity and diabetes mellifluous in cats[J]. Journal of the American Veterinary Medical Association, 2014, 245(1): 99-105. DOI:10.2460/javma.245.1.99.
[5] 李来好, 李刘冬, 石红, 等. 4 种海藻膳食纤维清除自由基的比较研究[J]. 中国水产科学, 2005, 12(4): 471-476. DOI:10.3321/ j.issn:1005-8737.2005.04.017.
[6] BROWNLEE I A. The physiological roles of dietary fiber[J]. Food Hydro-Colloids, 2011, 25(2): 238-250.
[7] 郑琼莉, 祝炜. 高血脂症[M]. 北京: 中国医药科技出版社, 2008: 1.
[8] 郑文武, 郑颂, 刘华. 我国西番莲生产现状及发展探讨[J]. 中国热带农业, 2008(6): 8-9. DOI:10.3969/j.issn.1673-0658.2008.06.002.
[9] 刘兰涛, 杨小兰. 复合型海藻膳食纤维功能食品的降血脂作用[J].食品科学, 2014, 35(17): 222-223. DOI:10.7506/spkx1002-6630-201417042.
[10] HAMAUZU y, MIZUNO y. Non-extract able proclamations and lining are important factors in the bile acid binding and radical scavenging properties of cell wall material in some fruits[J]. Plant Foods for Human Nutrition, 2011, 66(1): 70-77. DOI:10.1007/s11130-010-0207-z.
[11] 程明明, 黄苇. 两种超微粉碎法对西番莲果皮水不溶性膳食纤维改性效果的研究[J]. 现代食品科技, 2016, 32(12): 247-253.
[12] 卫生部卫生监督司. 保健食品的功能学评价程序和检验方法[S]. 北京:中国卫生出版社, 2003: 709-711.
[13] 熊霜. 海藻膳食纤维复方辅助降血脂实验研究[D]. 泉州: 华侨大学, 2014: 35-44.
[14] 阿依姑丽·艾合麦提, 张华, 韩海霞, 等. 野山杏水不溶性膳食纤维的降血脂和保肝作用的研究[J]. 时珍国医国药, 2012, 23(4): 928-929. DOI:10.3969/j.issn.1008-0805.2012.04.063.
[15] EBIHARA K, NAKAMOTO y. Comparative effect of watersoluble and insoluble dietary fiber on bowel function in rats fed a liquid elemental diet[J]. Nutrition Research, 1998, 18(5): 883-891. DOI:10.1016/S0271-5317(98)00073-6.
[16] 王跃, 李梦琴. 超微粉碎对小麦麸皮物理性质的影响[J]. 现代食品科技, 2011, 27(3): 271-274. DOI:10.3969/j.issn.1673-9078.2011.03.008.
[17] 魏伟, 吴希美, 李元建. 药理实验方法学[M]. 4版. 北京: 人民卫生出版社, 2010: 1011-1029.
[18] RIMCHEY S S, POLIKA M N, VALSTA L M, et al. Glycemic load affection fasting and post-prandial serum glucose, insulin, IGF-1 and IGFBP-3 in a randomized,controlled feeding study[J]. Metabolism, 2012, 66(10): 1146-1152. DOI:10.1038/ejcn.2012.107.
[19] 卫生部. 保健食品检验与评价技术规范(2003年版)[EB/OL]. (2003-02-14)[2014-05-17]. http://www.sdfda.gov.cn/f i ledown/adm in/12671467264375794242367161.pdf.
[20] 俸家富, 涂植光. 肝功能相关的血清酶学研究进展[J]. 医学综述, 2007, 13(3): 225-231. DOI:10.3969/j.issn.1006-2084.2007.03.029.
[21] SLIM R M, TOBOREK M, WATKINS B A, et al. Susceptibility to hepatic oxidative stress in rabbits fed different animal and plant fats[J]. Journal of the American College of Nutrition, 1996, 15(3): 289-294. DOI:10.1080/07315724.1996.10718600.
[22] DOBRIAN A D, DAVIES M J, PREWITT R L, et al. Development of hypertension in a rat model of diet-induced obesity[J]. Hypertension, 2000, 35(4): 1009-1015. DOI:10.1161/01.HyP.35.4.1009.
[23] 马森.谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J]. 动物医学进展, 2008, 29(10): 53-56. DOI:10.3969/ j.issn.1007-5038.2008.10.015.
[24] 陈路, 方红城, 张志杰, 等. 血脂康对高血压合并高血脂患者血管内皮功能的影响[J]. 中国医药导报, 2011, 8(24): 72-74. DOI:10.3969/ j.issn.1673-7210.2011.24.030.
[25] HUANG C C, CHEN Y F, WANG C R. Effects of micronization on the physicochemical properties of peels of three root and tuber crops[J]. Journal of the Science of Food and Agriculture, 2010, 90: 759-763.
[26] MURSU J, VOUTILAINEN S, NURMI T, et al. Dark chocolate consumption increases HDL cholesterol concentration and chocolate fatty acids may inhibit lipid peroxidation in healthy humans[J]. Free Radical Biology and Medicine, 2004, 37: 1351-1359. DOI:10.1016/ j.freeradbiomed.2004.06.002.
[27] WOOD P J. Evaluation of oat bran as a soluble fiber source characterization of oat β-glucan and its effects on glycaemic response[J]. Carbohydrate Polymer, 1994, 25: 331-336. DOI:10.1016/0144-8617(94)90059-0.
[28] 张卓, 李道本. 脂肪肝与脂质过氧化[J]. 中国中西医结合消化杂志, 2003, 11(4): 251-252. DOI:10.3969/j.issn.1671-038X.2003.04.029.
[29] 黄才欢, 欧仕益, 张宁, 等. 膳食纤维吸附脂肪、胆固醇和胆酸盐的研究[J]. 食品科技, 2006, 31(5): 133-136. DOI:10.3969/ j.issn.1005-9989.2006.05.044.
[30] 韩俊娟, 木泰华, 张柏林. 膳食纤维生理功能研究现状[J]. 食品科技, 2008, 33(6): 243-245. DOI:10.3969/j.issn.1005-9989.2008.06.075.
Hypolipidemic, Hepatoprotective and Laxative Effects of Dietary Fiber from Passif l ora edulis Fruit Peel
CHENG Mingming, HUANG Wei*
(College of Food Science, South China Agricultural University, Guangzhou 510640, China)
Abstract:Objective: To discuss the hypolipidemic, hepatoprotective and laxative effects of dietary fi ber from Passif l ora edulis fruit peel. Methods: An animal model of hyperlipidemia was established by feeding mice with a high-fat diet in this study, and the mice were gavaged with the dietary fiber modified by the wet method at low, medium and high doses for six weeks. Parameters of interest were measured in the blood and viscera of the mice were measured during the period. Results: The serum levels of total cholesterol (TC), triglyceride (TG), and malondialdehyde (MDA) activity in the positive control group, high dose group, and middle dose group decreased compared with the model group. Moreover, the levels of alanine aminotransferase (ALT), aspertate aminotransferase (AST), high-density lipoprotein (HDL-C), glutathione peroxidase (GSH-Px), and superoxide dismutase (SOD) were improved to some extent. The levels of low-density lipoprotein (LDL-C) in the high dose group and middle dose group were signif i cantly reduced in contrast to the model group. Conclusion: The dietary fi ber has good capacity to reduce blood fat and protect liver function in a dose-dependent manner. Although not signif i cant different from each other in terms of the stool quantity, the various dose groups presented a signif i cant increase in the fecal moisture content, indicating that the modif i ed fi ber to be effective in preventing constipation.
Key words:Passif l ora edulis peel; dietary fi ber; hypolipidemic; liver protection; laxative
DOI:10.7506/spkx1002-6630-201711032
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)11-0202-06
引文格式:
程明明, 黄苇. 西番莲果皮中膳食纤维的降脂保肝及润肠通便功能[J]. 食品科学, 2017, 38(11): 202-207. DOI:10.7506/
spkx1002-6630-201711032. http://www.spkx.net.cn
CHENG Mingming, HUANG Wei. Hypolipidemic, hepatoprotective and laxative effects of dietary fiber from Passif l ora edulis fruit peel[J]. Food Science, 2017, 38(11): 202-207 (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711032. http://www.spkx.net.cn
收稿日期:2016-05-24
基金项目:公益性行业(农业)科研专项(201303077)
作者简介:程明明(1988—),男,硕士研究生,研究方向为农产品加工及贮藏工程。E-mail:1021451037@qq.com
*通信作者:黄苇(1967—),女,教授,硕士,研究方向为食品加工工艺及质量控制。E-mail:weih007@scau.edu.cn