曹雪莲1,2,赵玉星1,2,郭俊霞1,2,张 静1,2,陈 文1,2,张艳贞1,2,*
(1.北京联合大学生物化学工程学院,北京 100023;2.北京市生物活性物质与功能食品重点实验室,北京 100191)
摘要:目的:探讨发酵麦胚对高脂模型大鼠胆固醇水平的调节及可能的作用机制。方法:雄性SD大鼠,根据体质量和血清胆固醇水平随机分组,每组10 只,空白组自由取食基础饲料和饮水,模型组、液低组、液中组、液高组、渣低组、渣中组、渣高组自由取食高脂饲料和饮水,每天固定时间灌胃,空白组和模型组灌胃同体积水,其他组分别灌胃221、442、884 mg/(kg·d)的发酵液冻干粉和沉淀物冻干粉。60 d后测血清总胆固醇(total cholesterol,TC)含量、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)含量、肝脏TC含量、胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CyP7A1)活性、排便量和粪便胆汁酸含量。结果:模型组血清TC含量极显著高于空白组(P<0.01),高胆固醇血症模型构建成功;液低组、渣中组大鼠血清TC含量分别显著(P<0.05)和极显著(P<0.01)低于模型组;各受试组肝脏TC含量、排便量和粪便胆汁酸排出量均高于模型组,但未达显著水平(P>0.05)。结论:发酵麦胚降血清胆固醇效果明确,且具有时间效应和剂量效应关系;其作用途径可能与促进血清胆固醇向肝脏转运、增加胆固醇向胆汁酸转化以及增加排便量有关。
关键词:发酵麦胚;胆固醇;高胆固醇血症;胆汁酸
曹雪莲, 赵玉星, 郭俊霞, 等. 发酵麦胚对高脂模型大鼠胆固醇水平的调节[J]. 食品科学, 2017, 38(11): 208-213.
DOI:10.7506/spkx1002-6630-201711033. http://www.spkx.net.cn
CAO Xuelian, ZHAO Yuxing, GUO Junxia, et al. Effect of fermented wheat germ on cholesterol levels in rats with hypercholesterolemia[J]. Food Science, 2017, 38(11): 208-213. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711033. http://www.spkx.net.cn
随着人们生活水平的提高及饮食习惯的改变,人群平均血清总胆固醇(total cholesterol,TC)水平显著升高[1],而高胆固醇血症(hypercholesterolemia,HC)又是引发心脑血管类疾病,如冠心病、心肌梗死、脑卒中等的主要危险因素[2]。改善膳食结构和生活方式是预防或降低高胆固醇血症患病风险的基本措施之一[3]。已有实验证实,日粮营养素种类和水平如蛋白质[4]、维生素、矿物质[5]、膳食纤维[6-10]和生物活性物质[11]可有效调节高胆固醇血症模型脂质代谢,显著改善模型动物血脂水平[4-11]。
麦胚又称小麦胚芽,占整个麦粒的2%~3%,是小麦干法磨粉加工的主要副产物,麦胚营养丰富,含有多种营养素和生物活性物质,被誉为天然的人类“营养宝库”和“生命之源”[12-13]。有报道称类似麦胚的玉米胚芽,可在短期内阻抑实验性大、小鼠血清TC含量的升高,并显著升高小鼠高密度脂蛋白含量,对高脂血症患者的食疗观察结果与动物实验结果相似[14]。王才立[15]研究了小麦胚芽多肽降胆固醇的活性,一定浓度下的小麦胚芽多肽对胆固醇具有对应的抑制率,一般在50%~60%之间,最高可以达到57.3%;而且分子质量越低,对胆固醇的抑制作用越明显。实验还发现麦胚经发酵后可有效降解大分子成活性小分子,表现出更强的生理活性[16]。
本实验旨在研究发酵麦胚对高脂模型大鼠胆固醇水平的调节及作用,以期为深度开发和利用麦胚这一优质食品资源提供参考。
1.1 材料与试剂
1.1.1 实验动物和饲料
70~90 g SD雄性大鼠(合格证号11400700113513)北京维通利华实验动物技术有限公司;基础饲料和高脂饲料 北京联合大学应用文理学院保健食品功能检测中心。
高脂饲料配方为:蔗糖20%、猪油15%、蛋黄粉5%、胆固醇1.2%、脱氧胆酸钠0.2%、酪蛋白5%、磷酸氢钙0.6%、石粉0.4%,基础饲料(维持饲料)52.6%。
1.1.2 麦胚和菌种
麦胚(100 目粉剂) 济南友康生物科技有限公司;植物乳杆菌(Lactobacillus plantarum) 中国工业微生物菌种保藏管理中心。
1.1.3 试剂
总胆固醇测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒 浙江东瓯诊断产品有限公司;总胆汁酸测定试剂盒 南京建成生物工程研究所;大鼠胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CyP7A1)酶联免疫分析试剂盒南京迅亚飞生物科技有限公司;BCA蛋白浓度测定试剂盒 北京鼎国昌盛生物技术有限责任公司。
1.2 仪器与设备
TL2010S高通量组织研磨仪、MC22-R台式微量高速微量冷冻离心机、HWS24型电热恒温水浴锅 北京鼎昊源科技有限公司;WFZ UV-2000型紫外-可见分光光度计尤尼柯(上海)仪器有限公司;酶标仪 海门市其林贝尔仪器制造有限公司;HZQ-F160全温振荡培养箱 哈尔滨市东联电子技术开发有限公司;FD-1C-50冷冻干燥机北京博医康实验仪器有限公司;高温蒸汽灭菌锅 日本Sanyo公司;BSC-1360LII型生物安全柜 北京东联哈尔仪器制造有限公司;液氮容器 查特生物医疗(成都)有限公司;氮吹仪 美国Organomation Associates公司。
1.3 方法
1.3.1 发酵麦胚受试物制备
参考文献:[17-19]的麦胚发酵和前期工作基础,麦胚发酵条件为:发酵温度38 ℃、发酵时间21 h、菌液接种量6%、料液比1∶8(m/V)。发酵结束,将发酵液4 ℃、12 000 r/min离心15 min,分离发酵液和沉淀物,分别冷冻干燥、密封保存备用,并进行成分分析。
1.3.2 大鼠分组及造模
大鼠适应环境7 d,根据血清TC含量和体质量随机分组,每组10 只,空白组饲喂基础饲料,模型组、液低组、液中组、液高组、渣低组、渣中组和渣高组饲喂高脂饲料,每天固定时间灌胃,空白组和模型组灌胃同体积的水,其他受试组分别灌胃221、442、884 mg/(kg·d)的发酵液冻干粉和沉淀物冻干粉,剂量设定参照发酵麦胚商品制剂Avemar®的推荐剂量[20],受试大鼠分别取其2.5、5.0、10.0 倍进行换算。受试时长60 d,每周一、周四称体质量以便调整灌胃剂量。
1.3.3 取材
实验期间根据需要采用眼眶静脉取血随时检测血清TC水平,实验结束前3 d开始,按笼收集粪便,-20 ℃冰箱冷冻48 h以上,冷冻干燥,称质量,密封,-20 ℃冰箱保存备用[21]。实验结束后,4%水合氯醛麻醉大鼠,股动脉放血致死,3 000 r/min、4 ℃离心10 min分离血清,-80 ℃冰箱保存备用;取肝脏右叶液氮速冻,密封,-80 ℃冰箱保存备用。
1.3.4 血清胆固醇和肝组织胆固醇含量测定
按照试剂盒说明书,测定血清TC、HDL-C含量。准确称取大鼠肝组织,按1∶9(m/V)加入匀浆介质(V(三氯甲烷)∶V(甲醇)=2∶1),组织研磨仪机械匀浆,匀浆参数:1 950 r/min 60 s、3 次循环、每次间隔5 s。匀浆滤纸过滤,取出滤液1 mL,氮吹仪吹干后溶解于500 μL的含10% TritonX-100的异丙醇中[22],然后按照试剂盒说明书步骤操作,根据公式求得血清TC含量/(mmol/L)、HDL-C含量/(mmol/L)和动脉硬化指数(atherogenic index,AI)。AI按下式计算:
1.3.5 肝组织胆固醇7α-羟化酶免疫学分析
准确称取大鼠肝组织质量,按1∶9(m/V)加入冰浴匀浆介质(0.9%生理盐水),采用组织研磨仪按1.3.4节参数进行机械匀浆,将匀浆液于4 ℃、2 500 r/min离心10 min,取上清液。按照试剂盒说明书进行肝组织胆固醇含量测定和CyP7A1酶联免疫分析,并通过标准曲线计算单位质量肝组织蛋白中酶的活力。
1.3.6 排便量及粪便胆汁酸含量测定
称取冷冻干燥过的粪便,按1∶9(m/V)加入无水乙醇,采用组织研磨仪按1.3.4节参数进行机械匀浆,2 500 r/min离心10 min,取上清液,然后按照试剂盒说明书测定并计算匀浆液胆汁酸的浓度,最终换算成每千克体质量每天粪便胆汁酸含量。
1.4 数据处理
用Excel和SPSS 19.0软件对各组数据进行统计分析(t检验),结果以 ±s表示,P<0.05具有统计学意义。
±s表示,P<0.05具有统计学意义。
2.1 发酵麦胚成分分析
由表1可知,植物乳杆菌发酵后,发酵液和沉淀物主要成分含量均有变化,二者相比,沉淀物冻干粉蛋白质、脂肪、总膳食纤维含量基本是发酵液冻干粉的2 倍以上。发酵液冻干粉其碳水化合物、灰分和总黄酮含量则高于沉淀物冻干粉。
表1 发酵麦胚发酵液和沉淀物冻干粉成分
Table 1 Proximate compositions of freeze-dried supernatant and precipitate from fermented wheat germ
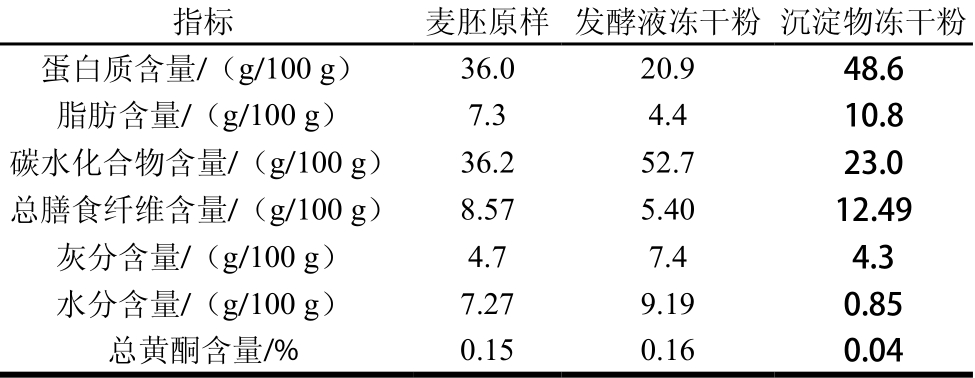
注:总黄酮含量按芦丁计。
2.2 发酵麦胚对大鼠体质量的影响由表2可知,各组大鼠尽管摄入饲料和灌胃物质的剂量不同,但在饲喂期间其体质量均稳步增长,组间未见显著差异(P>0.05)。
表2 不同受试时间各组大鼠体质量
Table 2 Body weight in rats in different groups g

2.3 发酵麦胚对大鼠血清胆固醇含量的影响
表3 受试30 d和60 d各组大鼠血清TC、HDL-C含量和AI
Table 3 Serum TC, HDL-C contents and AI values in each group of rats administered for 30 or 60 days
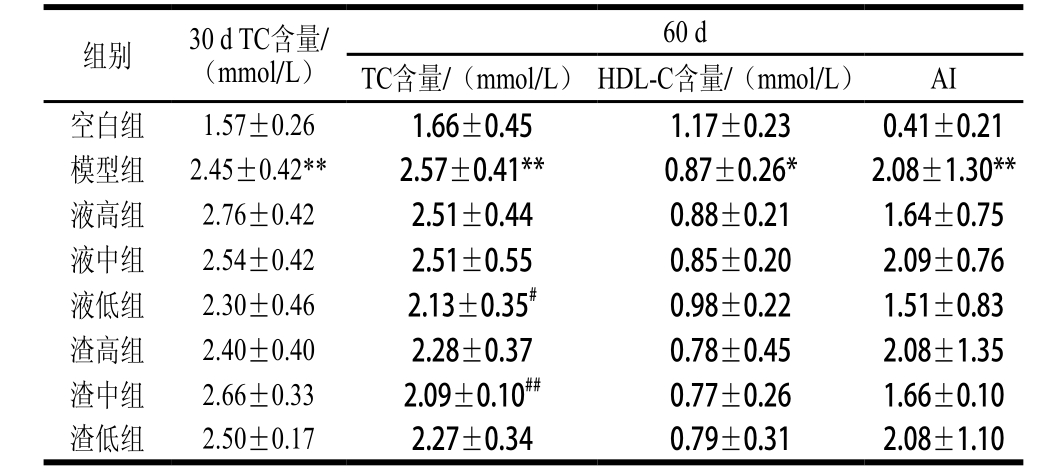
注:**.与空白组相比差异极显著(P<0.01);*.与空白组相比差异显著(P<0.05)。##.与模型组相比差异极显著(P<0.01);#.与模型组相比差异显著(P<0.05)。下同。
由表3可知,受试30 d时,模型组大鼠血清TC含量较空白组极显著升高(P<0.01),高胆固醇血症模型构建成功。各受试组中,相比模型组,液低组和渣高组血清TC含量有一定程度下降,但未达到显著差异。受试60 d时,模型组TC含量极显著高于空白组(P<0.01),液低组显著低于模型组(P<0.05)、渣中组极显著低于模型组(P<0.01),其他各剂量受试组较之模型组均有一定程度降低,但未达显著差异(P>0.05)。可见,高脂饮食尤其是长期高脂饮食确实可以显著升高血清TC水平,发酵麦胚对受试大鼠血清TC含量的影响既有剂量效应又有时间效应。
HDL可与外周细胞接触摄取其中的胆固醇,并在血浆胆固醇脂酰转移酶催化下将游离胆固醇酯化生成胆固醇酯进入HDL内核,最后形成新的HDL球,从而降低血浆中游离胆固醇的比例[23]。由表3可知,受试60 d,模型组HDL-C含量显著低于空白组(P<0.05),液低组和液高组高于模型组,其他各受试组均低于模型组,但均未达显著差异(P>0.05)。考虑受试60 d各受试组TC含量较模型组均有下降,尤其液低组和渣中组更是达到显著(P<0.05)和极显著(P<0.01)差异。液低组HDL-C含量高于模型组,而渣中组低于模型组,因此推测发酵麦胚降血清TC含量的作用并不单纯通过HDL的升高而实现。
AI是国际医学界制定的一个衡量动脉硬化程度的指标,数值越小动脉硬化的程度就越轻,引发心脑血管病的危险性就越低。由表3可知,实验结束时高脂饮食已导致模型组60 d时AI较空白组极显著增高(P<0.01),心脑血管疾病风险很高。发酵麦胚受试组AI有不同程度的降低,尤其是液高、液低和渣中组,AI有较大程度的下降,而液低组和渣中组60 d时血清TC含量较模型组也达到了显著和极显著下降,因此在一定程度上印证血浆胆固醇水平是动脉硬化和心脑血管疾病的风险因子。
2.4 发酵麦胚对肝脏TC含量和CyP7A1活力的影响
2.4.1 对肝脏TC含量的影响
表4 肝组织TC含量和CYP7A1活力测定结果
Table 4 TC and CYP7A1 levels in liver
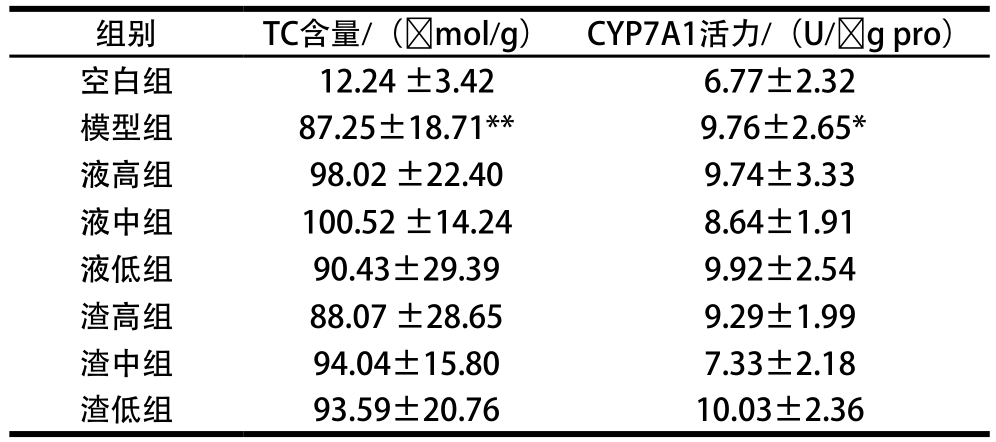
由表4可知,模型组TC含量极显著高于空白组(P<0.01),其他各受试组均高于模型组但未达到显著差异(P>0.05),各受试组之间均无显著差异(P>0.05)。结合血清TC含量结果推测,机体优先调控并维持血清TC的内稳态,血清TC含量超过一定水平,将选择将血清TC转运到肝脏进行重加工和重分配,因此,取食高脂饲料的模型组和实验组,肝脏TC含量均升高,模型组较空白组有极显著差异(P<0.01);而各实验组肝脏TC水平高于模型组、60 d血清TC含量低于模型组,可能提示发酵麦胚有促使血清TC向肝脏转运的潜力。
2.4.2 对肝脏CyP7A1活力的影响
由表4可知,模型组CyP7A1活力显著高于空白组(P<0.05),液低组、渣低组高于模型组,渣中组、渣高组、液中组、液高组低于模型组,但都未达到显著差异(P>0.05);各受试组之间没有明显差异。CyP7A1是胆固醇代谢经典途径的限速酶,人体内近50%的胆固醇由CyP7A1催化转化为胆汁酸排出体外[24];本实验中,高脂饮食(模型组和各受试组)较空白组(基础饲料),CyP7A1活力均有上调,说明高脂饮食会影响机体胆固醇代谢,其重要的代谢方向就是在CyP7A1的作用下转化为胆汁酸排出到肠道。由于在小肠下端,大部分胆汁酸又通过重吸收进入肝脏构成胆汁的肠肝循环,其余胆汁酸则随粪便排出体外[25],胆汁酸又可通过法尼醇X受体反馈抑制CyP7A1的转录、表达或活性[26-27],所以受试组CyP7A1可能受体内胆汁酸的反馈作用相较于模型组有升有降;同时由于胆固醇水平内稳态受机体状况、基因位点和环境因素的互作和影响,是多途径协同作用的结果,如自身胆固醇平衡态、参与细胞膜的结构组成、转运到其他腺体细胞生成类固醇激素等,因此组内个体之间CyP7A1活力差异较大,组间很难出现显著性差异。
2.5 发酵麦胚对大鼠排便量和粪便胆汁酸含量的影响
表5 大鼠排便量及粪便胆汁酸含量测定结果
Table 5 Stool quantity and fecal bile acid level
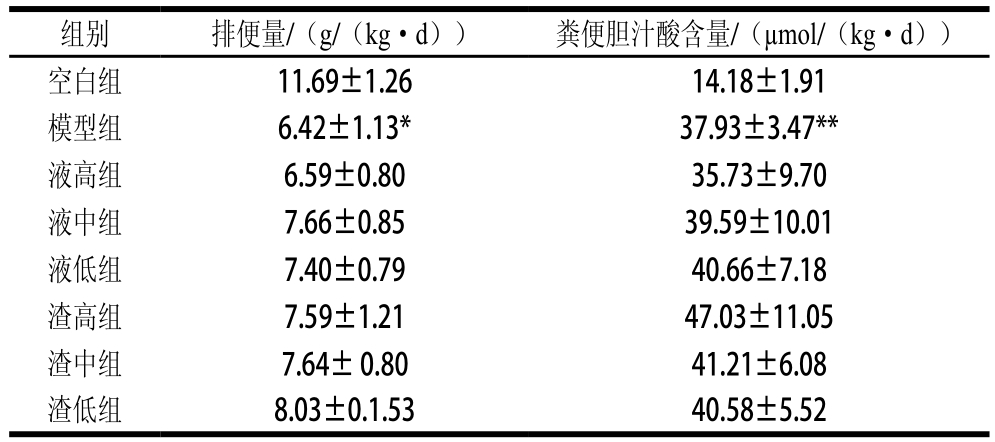
由表5可知,模型组大鼠排便量显著低于空白组(P<0.05),各受试组大鼠排便量均高于模型组,但未达到显著差异。可见发酵麦胚可在一定程度上促进排便,可能减少胆固醇的吸收。
模型组粪便胆汁酸含量极显著高于空白组(P<0.01),其他各受试组(除液高组外)均高于模型组,但均未达到显差异著(P>0.05),各受试组之间也无显著差异(P>0.05)。进一步验证发酵麦胚调控胆固醇代谢的一个重要方向是促进其转化为胆汁酸并随粪便排出。
3.1 膳食结构与血清TC水平
目前学界关于膳食胆固醇摄入对TC水平影响的研究结果仍存在极大争议。一方面,在动物性实验、代谢病研究及某些西方人群的流行病学研究中,证实了膳食胆固醇摄入与血清TC水平有显著的关联性[28],另一方面也有专家认为胆固醇摄入量不会直接反映血胆固醇水平[29]。本实验中,饲喂高脂饲料的模型组大鼠血清TC水平在第30天时已极显著高于饲喂基础饲料的空白组,且随着饲喂时间的延长,到实验结束时的第60天,血清TC水平仍有持续小幅增长,模型组极显著高于空白组。考虑高脂饲料是在基础饲料(52.6%)的基础上,添加蔗糖20%、猪油15%、蛋黄粉5%、胆固醇1.2%而成(猪油和蛋黄粉也含有一定量的胆固醇),可见,高胆固醇摄入确实与血清胆固醇升高有一定相关性;但也不可否认,其中的糖、猪油(含有的饱和脂肪酸)也有一定贡献,因为当它们增多且没有多余的去路时会转化为合成胆固醇的原料。
有研究显示,膳食胆固醇的过量摄入是HC的重要危险因素,血清TC水平的升高可导致心脑血管疾病的发生如冠心病的发病率明显增加[30];而一项前瞻性队列研究却显示,即使胆固醇摄入量达到768 mg/d,也未发现胆固醇摄入与冠心病发病和死亡有关[31]。一项对我国成年居民膳食胆固醇摄入量与血清TC水平关系的研究证实,膳食胆固醇摄入量超标的人群高胆固醇血症的患病率风险更大。因此控制人群膳食胆固醇的过量摄入仍然重要[28]。由于无法确定胆固醇增加慢性病危险的阈值摄入量,2013版《中国居民膳食营养素参考摄入量》已经去掉了对膳食胆固醇的上限值(2000年版是300 mg/d),但长期研究显示,高胆固醇血症和血脂异常都是心血管疾病的危险因素[2],因此,高胆固醇血症患者和心血管疾病患者仍然需要控制膳食胆固醇。
3.2 发酵麦胚降胆固醇功效及途径
本实验发现,麦胚发酵物,第60天时低剂量的发酵液和中剂量的沉淀可显著(P<0.05)或极显著(P<0.01)降低高脂模型大鼠血清TC水平,并表现出一定的时间效应和剂量效应。
成分分析显示发酵液冻干粉碳水化合物、灰分(矿物质)和总黄酮含量较高,实验发现麦胚经发酵后可有效降解大分子成活性小分子[16],推测麦胚乳酸发酵后多糖类物质多被降解为单糖或寡(聚)糖,而某些寡糖具有较强的润肠通便和降胆固醇能力[32-33];还有研究指出,饲喂营养素的种类、水平如矿物质[5]及其他生物活性物质如异黄酮[11]等对动物脂类代谢具有很强的影响和调节作用,有的还具有显著或极显著降血清胆固醇、升高HDL水平的效果。因此推测发酵液冻干粉中降胆固醇成分可能主要有活性糖、矿物质和黄酮类化合物。另外,有研究报道,麦胚乳酸菌发酵可释放抗肿瘤物质2,6-二甲氧基对苯醌和2-甲氧基对苯醌,该醌类物质还具有抗菌、免疫调节、清除自由基等活性[20,34],这些醌类物质是否具有降胆固醇潜力,还需进一步研究。
沉淀物冻干粉中,膳食纤维和蛋白质的量约为发酵液冻干粉的2 倍以上,可能与其降胆固醇作用有关。多项研究报道,膳食纤维有通便和增加排便量[6-7]、影响脂质和胆固醇吸收[10]、增加粪便胆汁酸含量[8]、降低血清TC水平[10]的作用;也有研究指出植物蛋白具有抗HC和动脉硬化以及降血清胆固醇的作用,其可能原因有降低自由胆固醇的酯化、提高肝细胞低密度脂蛋白受体(low density lipoprotein receptor,LDL-R)表达以增加对血液胆固醇的摄取、增强胆固醇向胆汁酸的转化,以及抑制或降低肠道胆固醇和脂质吸收等[35-36]。本实验中,受试组大鼠尤其是各沉淀物组排便量和粪便胆汁酸含量均比模型组增多,推测可能是沉淀中的膳食纤维和/或高蛋白影响了胆固醇的吸收、促进了胆汁酸的排放从而起到降胆固醇的作用。
机体胆固醇水平涉及到胆固醇的吸收、胆固醇在血液中的循环以及胆固醇的合成、降解和转化等方面。血浆中的脂类与载脂蛋白结合以脂蛋白的形式存在和运输,据其密度不同分为极低密度脂蛋白(very low density lipoprotein,VLDL)、LDL和HDL等。VLDL由肝脏合成,进入血液循环后富载胆固醇形成LDL,LDL通过LDL-R介导的胞吞作用将其内容物(主要是胆固醇)转运至外周组织溶酶体中降解或将其返回肝脏,在CyP7A1的作用下转化为胆汁酸;而HDL在肝脏和小肠中合成,它的主要生理功能是接受并酯化周围组织细胞(包括动脉硬化斑块)外排的游离胆固醇,逆向转运至肝脏进行代谢,所以HDL水平的升高将有利于组织和血液胆固醇的清除[23]。本实验中60 d受试麦胚液低组和渣中组可显著或极显著降低高脂模型大鼠血清TC含量。而HDL-C含量差异不显著,与模型组相比,液低组血清HDL-C和肝脏TC较高,其他组肝脏TC也较高,可能暗示血清胆固醇有向肝脏转运、但可能不仅仅向肝脏转运,也可能转运到各个类固醇源腺体细胞合成类固醇激素,而转运过程,可能还有LDL和LDLR的作用。胆固醇也可能参与组成细胞生物膜结构或者经脱氢和紫外线照射转化为VD。但从以上分析看,血清胆固醇转运到肝脏并转化为胆汁酸随粪便排出是一条主要途径。
综上所述,发酵麦胚发酵液和沉淀物降胆固醇成分和作用机制可能有所不同,降胆固醇作用靶点及深层机制还需要进一步研究。不过,发酵麦胚降血清胆固醇效果明确,有望开发为特殊医疗辅助用功能食品,在HC的预防和控制中发挥一定作用。
参考文献:
[1] Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Excecutive summary of third report of the national cholesterol eduation program(NCEP) expert panel on detection, evaluation and treatment of high blood cholesterol in adults (adult treament panel Ⅲ)[J]. The Journal of the American Medical Association, 2001, 285(19): 2486-2497. DOI:10.1001/ jama.285.19.2486.
[2] ANUM E A, ADERA T. Hypercholesterolemia and coronary heart disease in the elderly: a meta-analysis[J]. Annals of Epidemiology, 2004, 14(9): 705-721. DOI:10.1016/j.annepidem.2003.10.009.
[3] CHOI W H, GWON S Y, AHN J, et al. Cooked rice prevents hyperlipidemia in hamsters fed a high-fat/cholesterol diet by the regulation of the expression of hepatic genes involved in lipid metabolism[J]. Nutrition Research, 2013(33): 572-579. DOI:10.1016/ j.nutres.2013.04.006.
[4] 杨明华, 李永能, 黄英. 日粮蛋白质水平对乌金猪肝脏组织脂类代谢相关基因表达的影响[J]. 中国畜牧兽医, 2013, 40(2): 108-112.
[5] 任志华, 刘晋生, 邓慧丹, 等. 复方微量元素注射液“生命元”对波尔山羊生产性能、血液生理生化指标、免疫球蛋白和细胞因子的影响[J]. 中国兽医学报, 2012, 32(6): 906-912.
[6] DAHLW J, WHITING S J, HEALEY A, et al. Increased stool frequency occurs when finely processed pea hull fiber is added to usual foods consumed by elderly residents in long term care [J]. Journal of the American Dietetic Association, 2003, 103(9): 1199-1202. DOI:10.1053/jada.2003.50570.
[7] RUSHDI T A, PICHARD C, KHATER Y H. Control of diarrhea by fiber-enriched diet in ICU patients on enteral nutrition:a prospective randomized controlled trial[J]. Clinical Nutrition, 2004, 23(6): 1344-1352. DOI:10.1016/j.clnu.2004.04.008.
[8] BARTLEY G E, YOKOYAMA W, YOUNG S A, et al. Hypocholesterolemic effects of hydroxypropyl methylcellulose are mediated by altered gene expression in hepatic bile and cholesterol pathways of male hamsters[J]. The Journal of Nutrition, 2010, 140(7): 1255-1260. DOI:10.3945/jn.109.118349.
[9] HECTOR E M F, YOON K C, FERNANDO M B, et al. Effect of high fiber products on blood lipids and lipoproteins in hamsters[J]. Nutrition Research, 2004, 24: 85-93. DOI:10.1016/j.nutres.2003.08.016.
[10] KACZMARCZYK M M, MILLER M J, FREUND G G. The health benefits of dietary fiber: beyond the usual su spects of type 2 diabetes mellitus, cardiovascular disease and colon cancer[J]. Metabolism Clinical and Experimental, 2012, 61: 1058-1066. DOI:10.1016/ j.metabol.2012.01.017.
[11] CHEN L, MA X B, LIANG y H, et al. Effects of persimmon leaf total fl avonoid on enzyme of lipoprotein metabolism and antioxidation in hyperlipidemia rats[J]. Chinese Journal of Natural Medicines, 2011, 9(1): 74-77. DOI:10.1016/S1875-5364(11)60024-1.
[12] 张婷, 刘婉, 张艳贞, 等. 小麦胚芽生物活性物质及其功能特性研究进展[J]. 食品科学, 2011, 32(3): 281-285.
[13] 张艳贞, 高燕, 张静, 等. 5 品种小麦胚芽胚乳蛋白质、赖氨酸和谷胱甘肽的比较研究[J].食品科学, 2013, 34(21): 96-102.
[14] 董文彦, 马熙媛, 张东平, 等. 玉米胚芽降血脂作用的研究[J]. 生物化学杂志, 1992, 8(4): 457-461.
[15] 王才力. 复合酶法制备小麦胚芽多肽的生物活性研究[D]. 济南: 齐鲁工业大学, 2013: 1-55.
[16] NIU L y, JIANG S T, PAN L J. Preparation and evaluation of antioxidant activities of peptides obtained from defatted wheat germ by fermentation[J]. Journal of Food Science and Technology, 2013, 50(1): 53-61. DOI:10.1007/s3197-011-0318-z.
[17] HARDING S V, SAPIRSTEIN H D, RIDEOUT T C, et al. Consumption of wheat bran modif i ed by autoclaving reduces fat mass in hamsters[J]. European Journal of Nutrition, 2013, 53(3): 793-802. DOI:10.1007/s00394-013-0583-x.
[18] RIZZELLO C G, NIONELLI L, CODA R, et al. Effect of sourdough fermentation on stabilization and chemical and nutritional characteristics of wheat germ[J]. Food Chemistry, 2010, 119(3): 1079-1089. DOI:10.1016/j.foodchem.2009.08.016.
[19] RIZZELLO C G, NIONELLI L, CODA R, et al. Use of sourdough fermented wheat germ for enhancing the nutritional, texture and sensory characteristics of the white bread[J]. European Food Research and Technology, 2010, 230: 645-654. DOI:10.1007/s00217-009-1204-z.
[20] TELEKES A, HEGEDŰS M, CHAE C H, et al. Avemar (wheat germ extract) in cancer prevention and treatment[J]. Nutrition and Cancer, 2009, 61(6): 891-899. DOI:10.1080/01635580903285114.
[21] SALE F O, MARCHESINI S, AHN J Y, et al. Cooked rice prevents hyperlipidemia in hamsters fed a high-fat/cholesterol diet by the regulation of the expression of hepatic genes involved in lipid metabolism[J]. Nutriton Research, 2013, 33(7): 572-579. DOI:10.1016/j.nutres.2013.04.006.
[22] SALE F O, MARCHESINI S, FISHMAN P H, et al. A sensitive enzymatic assay for determination of cholesterol in lipid extracts[J]. Analytical Biochemistry, 1984, 142(2): 347-350. DOI:10.1016/0003-2697(84)90475-5.
[23] KWITEROVICH P O Jr. The metabolic pathways of high-density lipoprotein, low-density lipoprotein, and triglycerides: a current review[J]. American Journal of Cardiology, 2000, 86(12): 5-10. DOI:10.1016/S0002-9149(00)01461-2.
[24] 中国成人血脂异常防治指南制定联合委员会. 中国成人血脂异常防治指南[J]. 中华心血管病杂志, 2007, 35(5): 390-419.
[25] 申婷婷, 花尔并, 马娜, 等. 根皮苷对饲喂高脂高胆固醇饲料仓鼠肝脏中胆固醇代谢调控基因表达的影响[J]. 营养学报, 2014, 36(2): 159-163.
[26] LEFEBVRE P, CARIOU B, LIEN F, et al. Role of bile acids and bile acid receptors in metabolic regulation[J]. Physiological Reviews, 2009, 89(1): 147-191. DOI:10.1152/physrev.00010.2008.
[27] JONES R D, REPA J J, RUSSELL D W, et al. Delineation of biochemical, molecular, and physiological changes accompanying bile acid pool size restoration in CyP7A1−/−mice fed low levels of cholic acid[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2012, 303(2): 263-274. DOI:10.1152/ ajpgi.00111.2012.
[28] 苏畅, 贾小芳, 王志宏, 等. 我国成年居民膳食胆固醇摄入量与血清总胆固醇水平关系的研究[J]. 中华流行病学杂志, 2015, 36(8): 842-845.
[29] BUJO H, TAKAHASHI K, SAITO y, et al. Clinical features of familial hypercholesterolemia in Japan in a database from 1996-1998 by the research committee of the ministry of health, labour and welfare of Japan[J]. Journal of Atherosclerosis and Thrombosis, 2004, 11(3): 146-151. DOI:10.5551/jat.11.146.
[30] 王军波, 肖颖, 闫少芳, 等. 膳食脂质对中老年高胆固醇血症患者血清胆固醇的影响[J]. 卫生研究, 2000, 29(3): 162-164.
[31] TRUMBO P R, SHIMAKAWA T. Tolerable upper intake levels for trans fat, saturated fat, and cholesterol[J]. Nutrition Reviews, 2011, 69(5): 270-278. DOI:10.1111/j.1753-4887.2011.00389.x.
[32] 何东, 王晓雨, 程玉刚, 等. D-木糖对高脂血症大鼠脂代谢调节的作用机制[J]. 动物学杂志, 2012, 47(6): 105-111.
[33] WANG J, CAO Y, WANG C, et al. Wheat bran xylooligosaccharides improve blood lipid metabolism and antioxidant status in rats fed a high-fat diet[J]. Carbohydrate Polymers, 2011, 86(3): 1192-1197. DOI:10.1016/j.carbpol.2011.06.014.
[34] RIZZELLO C G, MUELLER T, CODA R, et al. Synthesis of 2-methoxy benzoquinone and 2,6-dimethoxybenzoquinone by selected lactic acid bacteria during sourdough fermentation of wheat germ[J]. Microbial Cell Factories, 2013, 12: 105-113. DOI:10.1186/1475-2859-12-105.
[35] PADMAKUMARANNAIR K G, RAJAMOHAN T, KURUP P A. Coconut kernel protein modifies the effect of coconut oil on serum lipids[J]. Plant Foods for Human Nutrition, 1998, 53: 133-144. DOI:10.1023/A:1008078103299.
[36] LAMMI C, ZANONI C, SCIGLIUOLO G M, et al. Lupin peptides lower low-density lipoprotein (LDL) cholesterol through an upregulation of the LDL receptor/sterol regulatory element binding protein 2 (SREBP2) pathway at HepG2 cell line[J]. Journal of Agricultural and Food Chemistry, 2014, 62(29): 7151-7159. DOI:10.1021/jf500795b.
Effect of Fermented Wheat Germ on Cholesterol Levels in Rats with Hypercholesterolemia
CAO Xuelian1,2, ZHAO Yuxing1,2, GUO Junxia1,2, ZHANG Jing1,2, CHEN Wen1,2, ZHANG Yanzhen1,2,*
(1. College of Biochemical Engineering, Beijing Union University, Beijing 100023, China; 2. Beijing Key Laboratory of Bioactive Substances and Functional Foods, Beijing 100191, China)
Abstract:Objective: To investigate the effect of fermented wheat germ on cholesterol levels in rats with hypercholesterolemia and to elucidate the underlying molecular mechanism. Methods: Male Sprague-Dawley (SD) rats were randomly divided into 8 groups by cholesterol level and body weight. The rats in the control group were fed a normal diet and water, while those in the model were given a high-fat diet and water. The other groups were intragastrically administrated with lyophilized powder of the fermented supernatant at low (LS group, 221 mg/(kg·d)), medium (MS group, 442 mg/(kg·d)) and high (HS group, 884 mg/(kg·d)) doses, and with lyophilized powder of the precipitate at low (LP group, 221mg/(kg·d)), medium (MP group, 442 mg/(kg·d)) and high (HP group, 884 mg/(kg·d)) doses, respectively, all of which were also given a high-fat diet and water. Both the control and model groups
received:an identical volume of water. The administration lasted for 60 days and at the end of this period, all rats were sacrif i ced for analysis of serum total cholesterol (TC) and high density lipoprotein cholesterol (HDL-C), liver TC and cholesterol 7α-hydroxylase (CyP7A1), and stool quantity and fecal bile acids (BA). Results: Serum TC level in the rats fed the high-fat diet were signif i cantly increased compared with those fed the normal diet. A rat model of hypercholesterolemia was established successfully. Serum TC levels of the rats in the LS and MP groups were signif i cantly reduced in contrast to those in the model group (P < 0.05 and P < 0.01, respectively). Liver TC concentrations, stool quantity and fecal bile acid levels in all treatment groups were increased, but the differences were not signif i cant statistically compared with the model group (P > 0.05). Conclusion: Fermented wheat germ can time-dependently and dose-dependently reduce serum TC by transferring TC from the serum to the liver, promoting BA formation from TC and increasing stool quantity.
Key words:fermented wheat germ; cholesterol; hypercholesterolemia; bile acids
DOI:10.7506/spkx1002-6630-201711033
中图分类号:中图分类号:TS201.4 文献标志码:A 文章编号:1002-6630(2017)11-0208-06引文格式:
收稿日期:2016-07-28
基金项目:北京市自然科学基金资助项目(5153025)
作者简介:曹雪莲(1990—),女,硕士研究生,研究方向为食品营养与功能。E-mail:594892979@qq.com
*通信作者:张艳贞(1972—),女,教授,博士,研究方向为食品营养与生化作用。E-mail:yanzhen@buu.edu.cn