高锦锦1,郭宇星1,*,潘道东1,2
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.宁波大学海洋学院,浙江 宁波 315211)
摘要:通过建立并验证Caco-2细胞模型,分析血管紧张素转化酶(angiotensin-I converting enzyme,ACE)抑制肽LL、LPEW在小肠中的转运量,研究LL、LPEW的小肠吸收机制。从细胞形态、跨膜电阻和碱性磷酸酶活性3 个方面验证Caco-2细胞模型可用性。分析ACE抑制肽LL、LPEW的Caco-2细胞转运量,LL的表观渗透系数(Papp)为(275.17±8.28)×10-7cm/s,肠道吸收良好;LPEW的Papp为(5.13±1.49)×10-7cm/s,相比于LL,肠道吸收量较低。加入旁路转运促进剂去氧胆酸钠、内吞抑制剂渥曼青霉素(Wortmannin)、肽转运载体竞争性抑制剂Gly-Pro,对比无抑制剂时LL的转运量,分析得到LL的跨膜转运机制可能为内吞途径。加入ATP能量生成抑制剂叠氮化钠、多药耐药蛋白抑制剂MK-571、P-糖蛋白抑制剂维拉帕米,对比无抑制剂时肽LL的转运量,得出LL没有外排作用,所以LL肠道吸收较好。
关键词:ACE抑制肽;Caco-2细胞模型;小肠吸收
高锦锦, 郭宇星, 潘道东. Caco-2细胞模型用于乳源ACE抑制肽LL、LPEW的小肠吸收研究[J]. 食品科学, 2017, 38(11): 214-219. DOI:10.7506/spkx1002-6630-201711034. http://www.spkx.net.cn
GAO Jinjin, GUO Yuxing, PAN Daodong. Intestinal absorption of milk-derived ACE inhibitory peptides LL and LPEW using Caco-2 cell model[J]. Food Science, 2017, 38(11): 214-219. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201711034. http://www.spkx.net.cn
乳源血管紧张素转化酶(angiotensin-I converting enzyme,ACE)抑制肽来源于乳蛋白,氨基酸序列和肽链长度各不相同,具有抗人体血压升高功效。ACE是一种羧二肽酶,能使血管紧张素Ⅰ转变成血管紧张素Ⅱ,血管紧张素Ⅱ具有血管收缩调节功能,使人体血压升高;同时ACE能水解缓激肽,使之失去活性,使人体血压升高[1]。乳源ACE抑制肽通过抑制ACE的活性来减少血管紧张素Ⅱ的生成和抑制缓激肽的水解,进而抵抗人体血压升高。近些年,在乳蛋白水解物和一些发酵乳制品中已发现了多种ACE抑制肽,如Nakamura[2]、yamamoto[3-4]等从乳中分离出2 种ACE抑制肽(VPP、IPP),VPP和IPP都有体外ACE抑制活性,并可降低原发性高血压大鼠的血压。
Caco-2细胞(human colon adenocarcinoma cell lines)首次于20世纪70年代从人类结肠腺癌细胞中分离得到,在聚碳酸酯膜或聚酯膜上,37 ℃、5% CO2培养箱内,培养约21 d后Caco-2细胞可自发的分化为小肠单层上皮细胞,用来模拟体内小肠上皮单层细胞[5]。目前Caco-2细胞模型已成为药物吸收研究的一种快速筛选工具,与其他用于研究吸收的模型相比,重复性较好,稳定并且应用广泛,可在细胞水平上提供受试物穿过小肠黏膜的吸收、代谢、转运的综合信息[6]。
乳源ACE抑制肽无副作用、安全可靠,有巨大的开发应用前景。然而,许多ACE抑制肽在体外生理活性验证时活性很强,而进行体内实验时活性很弱,甚至失去活性,这是因为乳源ACE抑制肽必须克服肠道黏膜、消化道酶系等一系列障碍,以活性形式转运至体液循环才有生理作用。小肠是物质吸收的主要场所,也是ACE抑制肽吸收的最大屏障,多肽的小肠吸收机制已有相关报道,已报道的主动转运、胞饮作用转运及细胞旁路途径转运是多肽在小肠内的转运途径主要的3 种形式[7]。另外有些报导显示,氨基酸序列、多肽链长度等因素会影响多肽的小肠转运途径,如成功克隆人和哺乳动物的小肠上皮细胞刷状缘侧的寡肽转运蛋白(hPepT1),揭示出哺乳动物的肠腔内存在特殊转运系统来介导二肽三肽的吸收[8]。南京师范大学乳品加工技术研发分中心从牛乳中分离提取得到了2 种乳源ACE抑制肽LL(Leu-Leu)[9]、LPEW(Leu-Pro-Glu-Trp)[10],但二者的小肠吸收机制尚不明确,因此本实验构建Caco-2细胞模型研究LL,LPEW的小肠吸收机制,旨在为ACE抑制肽应用于功能性食品市场和药品市场提供理论依据。
1.1 材料与试剂
LL、LPEW(来源于乳清蛋白的ACE抑制肽)由南京师范大学国家乳品加工技术研发分中心分离纯化并测序,由上海楚肽生物科技有限公司合成,纯度为90%。
胎牛血清(特优级Gibco)、不完全DMEM培养基(原装Gibco干粉配制,含1%双抗)、Caco-2细胞 南京凯基生物科技有限公司;非必需氨基酸、二甲基亚砜(dimethylsulfoxide,DMSO)、0.25%胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液、青霉素-链霉素混合液 南京丁贝生物科技有限公司;渥曼青霉素(Wortmannin)、去氧胆酸钠、维拉帕米抑制剂、MK-571抑制剂 美国Sigma公司;Gly-Pro(纯度>95%) 上海楚肽生物科技有限公司;叠氮化钠 浙江省东阳市天宇化工有限公司;碱性磷酸酶(alkaline phosphatase,AKP)测定试剂盒南京建成生物工程研究所。
1.2 仪器与设备
25 cm2卡式培养瓶 丹麦NUNC公司;MCO-15AC型CO2培养箱 日本三洋电器集团;Transwell培养板(孔径0.4 μm,膜面积1.12 cm2、12 孔的聚酯膜)美国C o s t a r公司;M i l l i c e l l E R S-2电阻仪美国Millipore公司;XD-202型倒置生物显微镜南京江南永新光学有限公司;1100高效液相色谱(high performance liquid chromatography,HPLC)仪、C18反相色谱柱(4.6 mm×250 mm) 美国安捷伦科技公司;754紫外-可见分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 Caco-2细胞模型的建立
细胞培养参考文献[7],在25 cm2卡氏培养瓶中,Caco-2细胞培养在含有10%胎牛血清、1%的100 U/mL青霉素-链霉素配制DMEM(Dulbecco’s modified Eagle medium)培养液中,然后放在37 ℃、5% CO2培养箱中培养。一般培养液1~2 d更换1 次,3~4 d传代1 次。
参考文献:[7]建立Caco-2细胞模型:当细胞在卡氏培养瓶中达到80%~90%汇合时,倒掉旧的培养液,加入0.25%胰蛋白酶消化,调整细胞浓度以2×105个/mL接种于12 孔Transwell板的滤膜上。在Transwell板的上室和下室分别加入0.5 mL的细胞悬液和1.5 mL的DMEM培养液。接种后第一周隔天换液,第二周和第三周每天换液,培养21~24 d待用。每天倒置显微镜观察细胞形态及细胞间的紧密度变化,同时2 d测一次Caco-2细胞的跨膜电阻(trans epithelial electric resistance,TEER)。
1.3.2 Caco-2单层细胞模型完整性评价
1.3.2.1 Caco-2单层细胞模型完整性评价指标
Caco-2单层细胞的完整性决定此Caco-2细胞模型能否用于研究待测样的小肠转运机制,评价指标为细胞形态学指标、TEER和AKP活性[11]。
1.3.2.2 细胞形态学观察
用倒置光学显微镜,按照低倍镜到高倍镜的顺序观察细胞的生长状况及细胞间的紧密度并记录。
1.3.2.3 细胞单层完整(紧密)性测定
Caco-2细胞的TEER隔天用细胞电阻仪测定,以记录Caco-2单层细胞的完整性和紧密性的动态形成过程[12]。TEER按照式(1)计算。
式中:R1为实验组(接种Caco-2细胞)电阻测量值/Ω;R0为空白组(没有接种细胞)电阻测量值/Ω;S为膜面积/cm2。
Caco-2细胞TEER>500 Ω·cm2,说明细胞已形成紧密的单层,可用于研究待测样的小肠转运机制,TEER值介于200~1 000 Ω·cm2时,电阻值越大,单层细胞越致密[13]。
1.3.2.4 AKP活性检测
参考文献[14],在Caco-2细胞不同生长时间段内,按试剂盒要求测定Caco-2细胞顶侧(apical side, AP侧)和基底侧(baso lateral side,BL侧)的AKP活性。
1.3.3 LL、LPEW跨膜转运量的测定
采用反相高效液相色谱(reverse phase-HPLC,RP-HPLC)法在Transwell板进行操作。HBSS(Hank’s balanced salt solution)缓冲液(pH 7.4)小心冲洗Caco-2细胞3 次,Caco-2细胞在37 ℃、5% CO2培养箱中孵育30 min后,轻轻吸去孔内HBSS[13]。在Transwell板上室(AP侧)分别加入含有ACE抑制肽(LL、LPEW)的HBSS 0.5 mL,两种肽的浓度为1 mmol/L,在Transwell板下室(BL侧)加入HBSS 1.5 mL,转运1 h后,用RPHPLC法测定下室的肽含量。
RP-HPLC检测方法:样品150 μL,经0.22 μm膜过滤,取滤液20 μL进样。色谱条件[5]为:检测波长202 nm;流速1 mL/min;流动相:V(乙腈)∶V(水)=22∶78,0.05%三氟乙酸;柱温30 ℃。以表观渗透系数Papp/(cm/s)表示ACE肽的转运量,计算公式见式(2)。
式中:dQ×dt-1为渗透速率/(μmol/s),根据样品在不同时间转运至BL侧转运量对时间回归得到的直线斜率;A是Transwell膜表面积/cm2;C0为Caco-2细胞AP侧初始质量浓度/(μg/mL)。
1.3.4 ACE抑制肽LL跨细胞膜转运机制
1.3.4.1 LL的跨膜转运机制
LL的小肠转运机制实验方法同1.3.3节。在Transwell板的AP侧分别加入100 μmol/L的旁路转运促进剂去氧胆酸钠、500 nmol/L的内吞抑制剂Wortmannin、10 mmol/L的肽转运载体竞争性抑制剂Gly-Pro[15-16], 转运1 h后,在BL侧取样,RP-HPLC分析肽浓度。
1.3.4.2 LL的外排机制
LL的小肠转运机制实验方法同1.3.3节。在AP侧分别加入10 mmol/L的ATP能量生成抑制剂叠氮化钠、50 μmol/L多药耐药蛋白抑制剂MK-571、100 μmol/L的P-糖蛋白抑制剂维拉帕米[17],转运1 h后,在BL侧取样,RP-HPLC分析肽浓度。
1.4 数据分析处理
实验数据用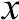 ±s表示,并采用SPSS数据处理系统软件分析;采用t检验和单因素方差分析分别分析组间差异显著性。
±s表示,并采用SPSS数据处理系统软件分析;采用t检验和单因素方差分析分别分析组间差异显著性。
2.1 Caco-2单层细胞模型完整性评价结果
2.1.1 Caco-2细胞形态观察

图1 Caco-2细胞的形态图(×20)
Fig. 1 Micrograph images of Caco-2 cells (× 20)
图1 为倒置光学显微镜下观察到的Caco-2细胞生长状况。培养1~2 d后,可清楚地辨认出细胞的边缘轮廓,第21天时观察成熟的Caco-2细胞均匀、致密,边界清晰,可见细胞间的致密接触,表明Caco-2细胞形成了完整致密单细胞层。
2.1.2 细胞单层完整(紧密)性

图2 不同生长时间Caco-2细胞的TEER
Fig. 2 Transepithelial electrical resistance of Caco-2 monolayers at different growth times
电阻值是由离子经细胞旁间隔的流动而形成的,而且一般在200~1 000 Ω·cm2范围内TEER与细胞单层的紧密度成呈相关。由图2可知,随着培养时间的延长,TEER逐渐变大,推知Caco-2细胞单层越来越紧密。第1周Caco-2细胞的TEER增加缓慢,但是第二周跨膜电阻快速增加,第14天时已增加到300 Ω·cm2左右。第三周TEER增长速率逐渐变小, 20~24 d跨膜电阻开始稳定,基本维持在500 Ω·cm2,说明细胞紧密连接,形成了致密的细胞单层。一般培养21 d后,TEER介于400~700 Ω·cm2的Caco-2细胞可用于吸收和代谢研究[18]。2.1.3 AKP的活性
AKP是Caco-2细胞极化的标志性酶,主要表达在刷状缘,可根据刷状缘上碱性磷酸酶的活性来判断细胞是否形成极性。经检测可知AKP活力比(AP/BL)随时间的延长而增长,24 d后,两侧酶活性比扩大为1.00∶1.84,说明Caco-2细胞膜极化特征显现。综合Caco-2细胞形态、TEER和AKP活性3 个指标来看,本实验建立的Caco-2细胞模型可用于ACE抑制肽的肠道吸收研究。
2.2 ACE抑制LL、LPEW经Caco-2细胞转运结果

分析图
Fig. 3 RP-HPLC analysis of LL
图3 LL的RP-HPLC
图3 中保留时间3.972 min为LL的色谱峰。a、b两图比较得出Caco-2细胞转运后BL侧LL的转运量较大,LL的Papp为(275.17±8.28)×10-7cm/s。图4中保留时间7.161 min为LPEW的色谱峰,LPEW的Papp为(5.13±1.49)×10-7cm/s,转运量较少。以Caco-2细胞模型来判定药物吸收难易程度的一般标准为:Papp<1×10-7cm/s为吸收不良的药物,吸收率在0%~20%;Papp在1×10-7~10×10-7cm/s范围为吸收中等的药物,吸收率在20%~70%;Papp>10×10-7为吸收良好的药物,吸收率在70%~100%[19]。参考此标准,LL的吸收较好,LPEW属于吸收中等。
分析图
Fig. 4 RP-HPLC analysis of LPEW
图4 LPEW的RP-HPLC
ACE抑制肽的跨细胞转运量可能与肽链长度有关[20]。有报导显示半径大于11~15 Å的分子是不能透过肠道上皮细胞的紧密连接[21]。另一方面肠道中存在肽酶构成的生化屏障,也影响着肽最终的转运情况。Rieko等[22]研究发现,肽在刷状缘膜上可被肽酶酶解,肽链长度与水解率相关,一般肽链越长被酶解的可能性越大。例如,二肽酶解率只有10%,三肽酶解率达到10%~60% ,四肽或肽链更长的肽酶解率超过90%。Quirós等[23]发现了LHLPLP可被细胞刷状缘肽酶水解为HLPLP片段。另外,ACE抑制肽的转运机制也可能与肽的疏水性有关。Rieko等[22]通过人工脂质膜渗透通道模型研究肽的结构和透过量时,发现亲水性越大,氢键越强,渗透量越小。本实验中,LL为二肽,LPEW为四肽,LL与LPEW的平均疏水性(grand average of hydropathy,GRAVy)分别为3.8和-0.55[24],LL的转运量要高于LPEW。另外,祝倩[24]报道了VPP和IPP的GRAVy分别为0.33、0.43,但由于存在C端脯氨酸,脯氨酸能抵御消化酶酶解,所以,VPP和IPP的跨膜转运量也较大。后续实验将进一步研究ACE抑制肽LL的跨膜转运机制和外排机制。
2.3 LL的Caco-2细胞转运机制
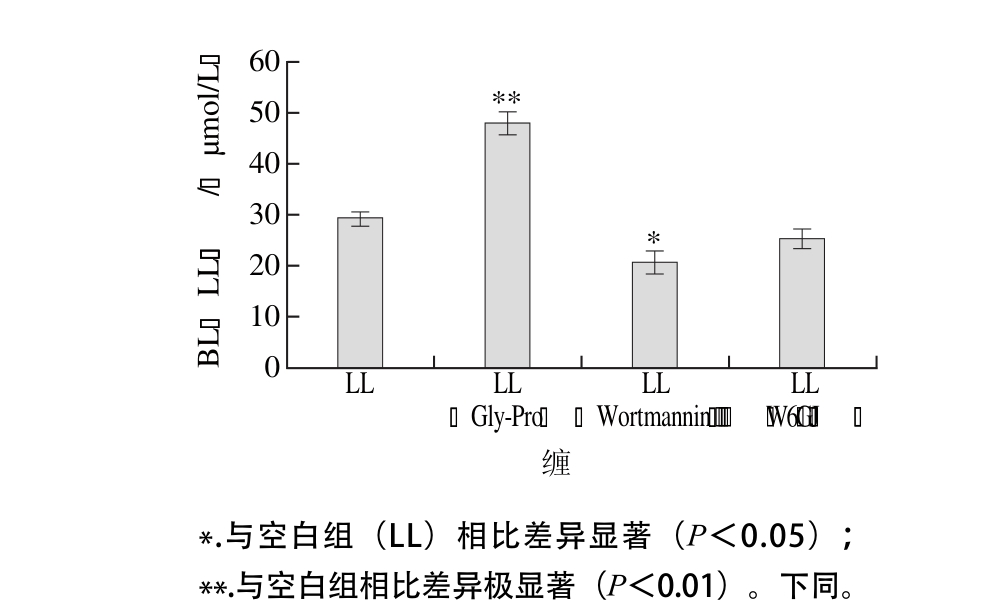
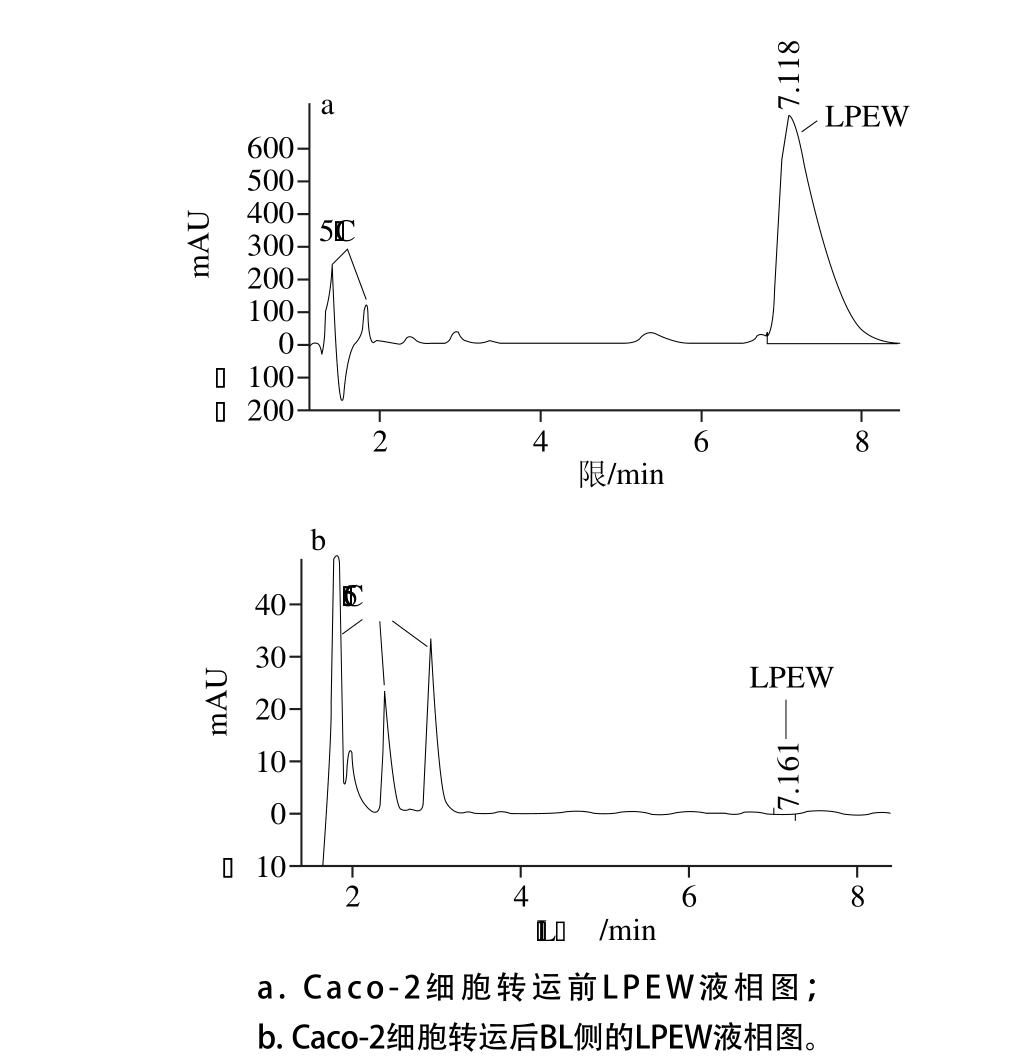
图5 Gly-Pro、Wortmannin和去氧胆酸钠对LL转运的影响
Fig. 5 Effect of Gly-Pro, Wortmannin and sodium deoxycholate on the transepithelial transport of LL across Caco-2 cell monolayer
物质经小肠转运分为跨上皮细胞途径(transcellular transport)和跨上皮细胞间隙途径(paracellular transport)两大类。跨上皮细胞途径又根据具体不同的吸收机制分为3 类:载体介导的主动转运:营养物质需载体蛋白传运;内吞作用:物质被包在囊泡中并内化进入细胞;被动扩散:一般具有很强脂溶性和疏水性的物质根据物质的溶解性即可通过细胞膜[25]。跨上皮细胞间隙途径主要指细胞旁路转运机制,肽类物质经过上皮细胞紧密连接的间隙被人体吸收[26]。实验选用肽转运载体竞争性抑制剂Gly-Pro、内吞抑制剂Wortmannin和旁路转运促进剂去氧胆酸钠研究ACE抑制肽LL的跨膜转运途径,结果见图5。Gly-Pro可极其显著地促进LL的小肠吸收(P<0.01),PepT1是二肽和三肽的特定转运载体[27],如果LL吸收受载体转运的影响,Gly-Pro会和LL竞争转运载体,从而减少LL的转运量,但实验结果与此相反,说明LL的吸收机制不是PepT1载体介导的主动转运;去氧胆酸钠属于胆酸盐类的吸收促进剂,溶解磷脂的能力较高,具有增强旁路转运能力[28]。但去氧胆酸钠对LL吸收作用不显著(P>0.05),表明LL吸收的主要方式不是旁路转运。内吞抑制剂Wortmannin具有抑制药物跨细胞过程中的内吞作用,会抑制肽的吸收,本实验显示肽吸收显著减少,推测LL的吸收机制可能为内吞作用。Shimizu等[29]研究发现,肽的内吞作用依赖肽的疏水性,肽的疏水性越强,越有可能通过内吞作用被小肠吸收。祝倩[24]报道了ACE抑制肽VPP和IPP的GRAVY分别为0.33、0.43,VPP、IPP的转运途径为旁路转运。LL的GRAVY为3.8,疏水性很强,有可能通过内吞作用被小肠转运。
2.4 LL的外排研究
图6 维拉帕米、MK-571和叠氮化钠对LL转运的影响
Fig. 6 Effect of verapamil , MK-571 and sodium azideon on the transepithelial transport of LL across Caco-2 cell monolayer
Caco-2细胞AP侧存在两种主要的外排蛋白,P-糖蛋白和多药耐药蛋白(multi-drug resistant protein,MRP),其主要功能是把细胞中的营养物质排到细胞外,不利于细胞对营养物质吸收,并且这两种外排蛋白需要消耗能量[30]。维拉帕米是P-糖蛋白抑制剂,MK-571特异性抑制MRP的外排,实验中添加抑制剂,限制两种外排蛋白的外排作用,会提高LL在BL侧转运量。而本实验结果相反,如图6所示,加入MK-571和维拉帕米后,BL侧LL的转运量减少,说明LL的外排与P-糖蛋白和MRP两种外排转运蛋白无关。叠氮化钠是能量抑制剂,可以非特异性地抑制细胞能量代谢[31],如果LL有能量依赖的外排蛋白参与外排作用,加入叠氮化钠后,将增加BL侧LL的转运量,但图6显示加入叠氮化钠后BL侧LL的转运量极显著减少(P<0.01),说明LL并没有外排蛋白参与的外排作用,这也可以说明为何LL的小肠转运量较高。ACE抑制肽VPP的外排机制为P-糖蛋白介导,IPP可能存在外排作用[24],但是具体机制还不了解,LL没有外排作用的原因也还需进一步研究。
本实验建立并验证了Caco-2细胞模型,对ACE抑制肽LL、LPEW小肠吸收机制进行了研究,实验结果发现,ACE抑制肽LL的Papp为(275.17±8.28)× 10-7cm/s,小肠吸收良好,ACE抑制肽LPEW的Papp为(5.13±1.49)×10-7cm/s,小肠吸收中等;不同的ACE抑制肽肠道转运量不同,可能与其肽链长度及亲疏水性有关,肽链长度小,强疏水性多肽,如ACE抑制肽LL的肠道转运量较高;对LL的肠道吸收机制和外排机制进行了研究,发现LL的肠道吸收机制可能为内吞机制,并且无外排作用。
参考文献:
[1] 郭慧青, 毛慧, 赵波, 等. 两种血管紧张素转化酶抑制肽作用于靶标的分子机理[J] 食品科学, 2010, 31(23): 1-2.
[2] NAKAMURA y, yAMAMOTO N, SAKAI K, et al. Purification and characterization of angiotensin-Ⅰconverting enzyme inhibitors from sour milk[J]. Journal of Dairy Science, 1995, 78(4): 777-783. DOI:10.3168/jds.S0022-0302(95)76689-9.
[3] yAMAMOTO N, TAKANO T. Antihypertensive peptides derived from milk proteins[J]. Nahrung, 1999, 43(3): 159-164. DOI:10.1002/ (SICI)1521-3803(19990601)43:3<159.
[4] yAMAMOTO N, AKINO A, TAKANO T. Purif i cation and specif i city of a cell-wall-associated proteinase from Lactobacillus helveticus CP790[J]. Journal Biochemistry, 1993, 114(5): 740-745.
[5] 刘冬, 孙海燕, 雷林, 等. 降血压肽Val-Leu-Pro-Val-Pro在Caco-2细胞模型中的吸收机制[J]. 营养学报, 2008, 30(4): 354-358. DOI:10.3321/j.issn:0512-7955.2008.04.008.
[6] 谢社平, 谭晓婧, 毕开顺, 等. 盐酸巴马汀在Caco-2细胞中的吸收机制[J]. 中国实验方剂学杂志, 2011, 17(3): 209-213. DOI:10.3969/ j.issn.1005-9903.2011.03.066.
[7] 祝倩, 郭宇星, 潘道东. 利用Caco-2细胞模型评价乳源ACE抑制肽小肠吸收机制的研究进展[J]. 食品科学, 2013, 34(9): 330-335. DOI:10.7506/spkx1002-6630-201309066.
[8] 孙勇兵, 孙进, 何仲贵. 小肠寡肽转运蛋白及其在提高药物口服吸收中的应用[J]. 中国新药与临床杂志, 2006, 25(10): 776-782. DOI:10.3969/j.issn.1007-7669.2006.10.015.
[9] PAN D, CAO J, GUO H, et al. Studies on purification and the molecular mechanism of a novel ACE inhibitory peptide from whey protein hydrolysate[J]. Food Chemistry, 2012, 130(1): 121-126. DOI:10.1016/j.foodchem.2011.07.011.
[10] 吕卉卉. 乳清蛋白ACE抑制肽的发酵法制备及分离纯化[D]. 南京:南京师范大学, 2010: 51-60.
[11] 杨海涛, 王广基. Caco-2单层细胞模型及其在药学中的应用[J]. 药学学报, 2000, 35(10): 797-800. DOI:10.3321/j.issn:0513-4870.2000.10.019.
[12] 鄢良春, 刘青春, 赵军宁, 等. 鼠尾胶原对Caco-2细胞模型建立的影响[J]. 中药药理与临床, 2010, 26(5): 155-157.
[13] 祝倩, 郭宇星, 潘道东, 等. Caco-2细胞模型构建及抗高血压肽VPP和IPP小肠吸收机制研究[J]. 食品科学, 2014, 35(15): 226-231. DOI:10.7506/spkx1002-6630-201415046.
[14] 马燕, 李沛波, 苏薇薇, 等. 药理实验中Caco-2细胞模型建立的评价指标[J]. 中药材, 2006(9): 946-948. DOI:10.3321/ j.issn:1001-4454.2006.09.026.
[15] 刘志伟, 陈秉衡. Caco-2 细胞单层模型及其在毒理学中的应用[J]. 卫生研究, 2005, 33(6): 756-759. DOI:10.3969/j.issn.1000-8020.2004.06.038.
[16] SATAKE M, ENJOH M, NAKAMURA Y, et al. Transepithelial transport of the bioactive tripeptide, Val-Pro-Pro, in human intestinal Caco-2 cell monolayers[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(2): 378-384. DOI:10.1271/bbb.66.378.
[17] NAKAGAMI T, yASUI-FURUKORI N, SAITO M, et al. Effect of verapamil on pharmacokinetics and pharmacodynamics of risperidone: in vivo evidence of involvement of P-glycoprotein in risperidone disposition[J]. Clinical Pharmacology Therapeutics, 2005, 78(1): 43-51. DOI:10.1016/j.clpt.2005.03.009.
[18] yEE S. In vitro permeability across Caco-2 cells (colonic) can predict in vivo (small intestinal) absorption in man-fact or myth[J]. Pharmaceutical Research, 1997, 14(6): 763-766.
[19] 慈小燕, 夏媛媛, 曾勇, 等. 3-乙酰基-11-羰基-β-乙酰乳香酸在Caco-2和MDCK细胞模型中的吸收研究[J]. 中草药, 2013(9): 1162-1167. DOI:10.7501/j.issn.0253-2670.2013.09.018.
[20] 余兵, 任国谱. 高蛋白肽奶粉的技术与市场前景[J]. 食品与机械, 2009(2): 157-159.
[21] PAULETTI G M, GANGWAR S, SIAHAAN T J, et al. Improvement of oral peptide bioavailability: peptidomimetics and prodrug strategies[J]. Advanced Drug Delivery Reviews, 1997, 27(2/3): 235-256. DOI:10.1016/S0169-409X(97)00045-8.
[22] RIEKO A, yUKITAKA K, MOTOHIRO S, et al. Relationships between structure and high-throughput screening permeability of peptide derivatives and related compounds with artif i cial membranes: application to prediction of Caco-2 cell permeability[J]. Bioorganic & Medicinal Chemistry, 2004, 12(1): 257-264. DOI:10.1016/ j.bmc.2003.10.002.
[23] QUIRÓS A, DÁVALOS A, LASUNCIÓN M A, et al. Bioavailability of the antihypertensive peptide LHLPLP: transepithelial flux of HLPLP[J]. International Dairy Journal, 2008, 18(3): 279-286. DOI:10.1016/j.idairyj.2007.09.006.
[24] 祝倩. 利用Caco-2细胞模型研究乳源ACE抑制肽的小肠吸收机制[D].南京: 南京师范大学, 2014.
[25] 丁龙. 蛋清源ACE抑制肽的结构与完整吸收关系研究[D]. 长春: 吉林大学, 2015: 5-12.
[26] 高坤, 孙进, 何仲贵. Caco-2 细胞模型在口服药物吸收研究中的应用[J]. 沈阳药科大学学报, 2006, 22(6): 469-474. DOI:10.3969/ j.issn.1006-2858.2005.06.018.
[27] LEHMANN T, KÖHLER C, WEIDAUER E, et al. Expression of MRP1 and related transporters in human lung cells in culture[J]. Toxicology, 2001, 167(1): 59-72. DOI:10.3748/wjg.v7.i2.193.
[28] 文爱东, 蒋永培. 吸收促进剂在口服制剂中增强药物生物利用度的作用[J]. 国外医学: 药学分册, 2000(6): 354-357.
[29] SHIMIZU M, TSUNOGAI M, ARAI S. Transepithelial transport of oligopeptides in the human intestinal cell, Caco-2[J]. Peptides, 1997, 18(5): 681-687. DOI:10.1016/S0196-9781(97)00002-8.
[30] 关溯, 陈孝, 黄民. Caco-2细胞模型: 药物吸收研究的有效“工具”[J]. 中国药理学通报, 2004, 20(6): 609-614. DOI:10.3321/ j.issn:1001-1978.2004.06.003.
[31] 黄志巧, 邢建国, 王新春, 等. 田蓟苷在Caco-2细胞模型中的吸收特性研究[J]. 中国中药杂志, 2012, 37(9): 1315-1318. DOI:10.4268/ cjcmm20120930.
Intestinal Absorption of Milk-Derived ACE Inhibitory Peptides LL and LPEW Using Caco-2 Cell Model
GAO Jinjin1, GUO Yuxing1,*, PAN Daodong1,2
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China; 2. School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract:Caco-2 cell model was established and verified to analyze the transport capacity of ACE inhibitory peptides LL and LPEW and to explore their transport mechanism across intestinal epithelial cells. Morphology, transepithelial electrical resistance and alkaline phosphatase activity were measured to verify the validity of the Caco-2 cell model. Apparent permeability coefficient (Papp) of LL and LPEW were (275.17 ± 8.28) × 10-7and (5.13 ± 1.49) × 10-7cm/s, respectively in Caco-2 transport experiments, suggesting that LL displayed much better intestinal absorption than LPEW. The transportation route of LL may be endocytosis, as demonstrated by comparing the transport capacity of LL with and without transport inhibitors including the paracellular transport accelerator sodium deoxycholate, the endocytosis inhibitor Wortmannin, and the competitive inhibitor of the peptide transports Gly-Pro. LL had no efflux activity, as suggested by comparing the transport capacity with and without efflux inhibitor including the P-glycoprotein inhibitor verapamil, the multidrug resistance protein inhibitor MK-571, and the ATPase inhibitor sodium azide. In conclusion, LL showed good intestinal absorption. Key words: angiotensin-I converting enzyme (ACE) inhibitory peptides; Caco-2 cell model; intestinal absorption
DOI:10.7506/spkx1002-6630-201711034
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2017)11-0214-06引文格式:
收稿日期:2016-04-27
基金项目:江苏省自然科学基金项目(BK20151544;BK20141447);国家自然科学基金面上项目(31571852;31471598)
作者简介:高锦锦(1989—),女,硕士研究生,研究方向为乳品科学。E-mail:1533140040@qq.com
*通信作者:郭宇星(1981—),女,副教授,博士,研究方向为乳品科学。E-mail:guoyuxing1981@163.com