韦 诚1,李成龙1,2,朱丽娟1,谢月英1,周才琼1,*
(1.西南大学食品科学学院,重庆 400715;2.重庆啤酒股份有限公司,重庆 401555)
摘要:本实验对发酵酸肉胆酸盐结合肽(分子质量范围265~1 400 D,肽含量75.7%)的化学抗氧化作用及其对血管内皮细胞的影响进行研究。结果表明,发酵酸肉胆酸盐结合肽化学抗氧化活性随处理浓度升高而增加,对•OH、O2-•和1,1-二苯基-2-三硝基苯肼自由基的半清除浓度分别为2.04、2.79、2.50 mg/mL,表明其对•OH有更好的清除效果。对大鼠胸主动脉血管内皮细胞的影响研究结果显示,在实验质量浓度范围内,样品肽对血管内皮细胞不具有明显毒性,可刺激血管内皮细胞NO的释放和6-酮-前列腺素F1α的分泌,高剂量组刺激分泌效果显著高于空白组。实验表明酸肉胆酸盐结合肽可通过抗氧化活性和对血管内皮细胞的作用预防心血管疾病。
关键词:发酵酸肉;胆酸盐结合肽;化学抗氧化作用;血管内皮细胞;前列环素
韦诚, 李成龙, 朱丽娟, 等. 发酵酸肉胆酸盐结合肽的化学抗氧化作用及对大鼠胸主动脉血管内皮细胞的影响[J]. 食品科学, 2017, 38(11): 225-230. DOI:10.7506/spkx1002-6630-201711036. http://www.spkx.net.cn
WEI Cheng, LI Chenglong, ZHU Lijuan, et al. Chemical antioxidant effect of bile acid salt binding peptide from fermented sour meat and its effect on rat thoracic aorta endothelial cells[J]. Food Science, 2017, 38(11): 225-230. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711036. http://www.spkx.net.cn
高脂血症是当前社会极其常见的一种疾病,中国健康调查报告(2015)显示我国现有高脂血症患者约1亿多人,其直接引起的心脑血管疾病如动脉粥样硬化等已对人类健康构成了严重威胁。目前对于高血脂症的治疗以药物为主,像辛伐他汀、考来烯胺、普伐他汀等都是降血脂的常用药物,虽具有一定的效果,但难免有一定的副作用。因此,天然降血脂剂的研发引起广泛重视。大量研究发现,多种膳食蛋白的酶解产物中含有能有效降低机体血脂水平的肽,其中降胆固醇的活性肽主要通过阻断体内胆固醇的生物合成、抑制胆固醇的吸收以及对胆固醇7α-羟化酶表达的调节发挥作用[1-3]。
发酵食品由于风味独特、耐贮藏,有的还含有降胆固醇、抗衰老、免疫调节等生理功效的活性物质,深受人们喜爱。酸肉是西部少数民族地区以猪肉为原料,添加米粉和食盐后经厌氧发酵而成的自然乳酸发酵食品,酸肉在发酵过程微生物大量生长繁殖,肌原纤维蛋白、肌浆蛋白等发生了降解,非蛋白氮增加[4-5],并有降血脂作用[6]。此外,也有一些文献报道猪肉及其制品含有辅助降血脂的功能肽[7-8]。为此,本研究对发酵酸肉降血脂肽进行了分离纯化,得到有胆酸盐结合能力的肽——胆酸盐结合肽,为酸肉有关降血脂的功能化开发提供支持。
氧化应激的增强在动脉粥样硬化起始阶段起关键性作用,自由基和脂质过氧化是其主要原因,进而增加动脉粥样硬化风险[9-12],因此具有一定自由基清除活性的物质也具有一定的调节血脂紊乱和抗动脉粥样硬化病变的作用。血管内皮细胞(vascular endothelial cell,VEC)的功能损伤是动脉粥样硬化形成的始动环节。胆酸盐结合肽通过结合胆固醇起到降胆固醇效果,考虑生物活性肽可能具有多种重要的生 物学功能,如抗氧化活性、降血脂、免疫调节、抗微生物活性及抗高血压活性等[13]。为此,通过从发酵酸肉中分离纯化的胆酸盐结合肽作为实验材料,研究其化学抗氧化作用及对大鼠胸主动脉血管内皮细胞的影响,以拓宽胆酸盐结合肽可能对心血管影响的抗氧化机制具有重要意义。
1.1 材料与试剂
发酵酸肉胆酸盐结合肽由课题组自制,分子质量范围265~1 400 D,肽含量75.7%(其余主要为游离氨基酸)。
DMEN培养基、胰蛋白酶、胎牛血清(fetal bovine serum,FBS) 美国Hyclone公司;青霉素-链霉素溶液碧云天生物技术研究所;N-1-萘乙二胺盐酸盐、对氨基苯磺酸、邻苯三酚、邻菲罗啉等(均为分析纯) 成都市科龙化工试剂厂;前列环素测定试剂盒 南京建成生物工程研究所。
Griess试剂:超纯水配制的0.1%氮-1-萘乙二胺盐酸盐、5%磷酸溶液配制1%对氨基苯磺酸,两种溶液以体积比1∶1的比例混合即为Griess试剂,限3 h内使用。1.2 仪器与设备
UV-2450紫外分光光度计 日本岛津公司;全波长酶标仪 美国基因公司;CO2细胞培养箱 美国赛默费世尔科技公司;超净工作台 苏州安泰空气技术有限公司;生物显微镜 奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 胆酸盐结合肽的制备
按照文献[5]的方法制备发酵酸肉:取发酵20 d酸肉剔除脂肪和筋膜,生理盐水洗净→加pH 7.2磷酸盐缓冲液→匀浆(18 000 r/min)→静置20 min,离心(8 000 r/min,20 min),取上清液并过滤→加入约3 倍体积的40%乙醇溶液,4 ℃放置12 h→离心(8 000 r/min,20 min)取上清液→真空浓缩→真空冻干制成干粉→酸肉粗肽→纯水配成5 mg/mL溶液→加入0.01 mol/L HCl溶液于37 ℃恒温振荡1 h→调pH值为6.3,加入胆酸盐再次恒温振荡1 h→离心(4 000 r/min,20 min)取上清液,冻干→酸肉胆酸盐结合肽。
1.3.2 胆酸盐结合肽化学抗氧化作用
1.3.2.1 对☒OH的清除作用
采用邻菲罗啉法[14]进行测定。样品冻干粉用超纯水配成质量浓度为1.0、2.0、3.0、4.0、5.0 mg/mL的样品液。取5 mmol/L邻菲罗啉溶液0.6 mL加入试管中,加入0.4 mL磷酸盐缓冲液(0.2 mol/L,pH 7.4),混匀,加入0.6 mL样品溶液和0.6 mL乙二胺四乙酸二钠,混匀后加入5 mmol/L硫酸亚铁溶液0.6 mL和0.1%的H2O20.8 mL,37 ℃水浴60 min,536 nm波长处测定吸光度(A1),以超纯水代替样品液测定吸光度(A2),以超纯水替代H2O2测定吸光度(A3),重复3 次,取平均值。•OH清除率按公式(1)计算。
采用邻苯三酚自氧化法[15]进行测定。样品冻干粉用超纯水配成质量浓度1.0、2.0、3.0、4.0、5.0 mg/mL样品液。取3 mL 50 mmol/L pH 8.2的Tris-HCl缓冲液于试管中,加入不同质量浓度样品液1 mL,混匀,25 ℃恒温10 min,然后加入25 ℃恒温保存10 min的30 mmol/L的邻苯三酚1 mL,反应5 min,加入HCl终止反应,320 nm波长处测定吸光度(A1),以超纯水代替样品溶液测定吸光度(A2)。O2-☒清除率按公式(2)计算。
式中:A1为样品吸光度;A2为空白吸光度。
1.3.2.3 对1,1-二苯基-2-三硝基苯肼自由基的清除作用
参照文献[16]的方法略作修改。样品用超纯水配成质量浓度1.0、2.0、3.0、4.0、5.0 mg/mL的溶液。在10 mL具塞试管中加入4 mL 0.1 mmol/L的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH,无水乙醇配制)溶液和1 mL无水乙醇,混匀,避光放置30 min后,以无水乙醇为参比,517 nm波长处测吸光度(A0)。在10 mL具塞试管中加入4 mL 0.1 mmol/L的DPPH溶液和1 mL待测样品液,混匀,避光放置30 min,以无水乙醇作为参比,517 nm波长处测定吸光度(A1)。在10 mL具塞试管中加入4 mL无水乙醇和1 mL待测样品溶液,混匀,避光放置30 min,以无水乙醇作参比,517 nm波长处测定吸光度(A2)。DPPH自由基清除率按公式(3)计算。
式中:A0为对照组吸光度;A1为粗肽样品吸光度;A2为空白组吸光度。
1.3.3 胆酸盐结合肽对血管内皮细胞的影响
1.3.3.1 血管内皮细胞原代与传代培养
原代培养参考文献[17-18]略作修改:取健康雄性SD大鼠一只,体质量约200 g,断颈处死,无菌条件下取出胸主动脉立即放入无菌磷酸盐缓冲液(phosphate buffered saline,PBS)并转移至无菌工作台,用眼科镊子小心去除血管外结缔组织和脂肪,PBS冲洗血管管腔3~4 次,用眼科剪剪去细小血管分支,转入另一个无菌培养皿中。纵向剪开血管并将其剪成约2 mm×2 mm大小的血管块,血管块内皮向下转入25 cm2培养瓶中,每个培养瓶放置10~15 个血管块,加入适量DMEM培养液(20% FBS、青霉素100 U/mL、链霉素100 μg/mL)至刚好没过血管块为宜。培养瓶置37 ℃、5% CO2、饱和湿度的培养箱中静置培养4 d,弃掉血管块,并更换新的培养液,以后2~3 d换液一次。传代培养:原代细胞培养12~14 d,约80%原代细胞融合时即可进行传代培养。弃掉培养液,用PBS冲洗培养瓶2 次,加入0.25%的胰蛋白酶消化1 min,立即加入等体积含FBS的DMEM培养液终止消化,吸管轻轻吹打并混匀,转至离心管,于1 000 r/min条件下离心5 min,弃上清液,加入适量新的DMEM培养液制成细胞悬液,按细胞数量1∶3进行传代培养。
1.3.3.2 实验处理及分组
选用3 代细胞,用培养液调整细胞浓度为1.0×105个/mL,接种于24 孔板中,每孔1 mL,细胞生长至80%融合时,吸弃培养液,加入无血清培养液,待细胞同步生长后,再加入含样品肽(无血清培养液溶解)的培养液,培养12、24、48 h,然后用0.4%台盼蓝进行细胞计数,用血球计数板计数蓝染的死细胞数和拒染的活细胞数,细胞存活率按式(4)计算。
分组:将培养已融合的血管内皮细胞分成4 组。空白对照组:不添加肽样品;低剂量组:肽终质量浓度0.20 mg/mL;中剂量组:肽终质量浓度0.60 mg/mL;高剂量组:肽终质量浓度1.0 mg/mL;各组重复3 个孔,分别培养6、12、24 h后吸取上清液,进行测定。
1.3.3.3 NO含量的测定
参照文献[16]采用Griess试剂显色法。吸取各组上清液100 ☒L于96 孔板中,各加入100 ☒L Griess试剂,30 ℃条件下反应10 min,用酶标仪540 nm波长处测定吸光度。各取100 ☒L浓度分别为0、5、10、20、40、60 μmol/L NaNO2标准液于96 孔板中,各加入100 ☒L Griess试剂,30 ℃反应10 min,测吸光度。以NaNO2浓度为横坐标,吸光度为纵坐标绘制标准曲线,回归方程为y=0.006 8x+ 0.012 1,R2=0.993 1。
1.3.3.4 前列环素含量的测定
采用6-酮-前列腺素F1α试剂盒检测,按指示步骤进行。
1.4 数据处理
实验重复3 次,采用Origin 8.6软件处理,实验数据以 ±s表示。
±s表示。
2.1 胆酸盐结合肽对化学抗氧化作用的影响
2.1.1 对☒OH的清除作用
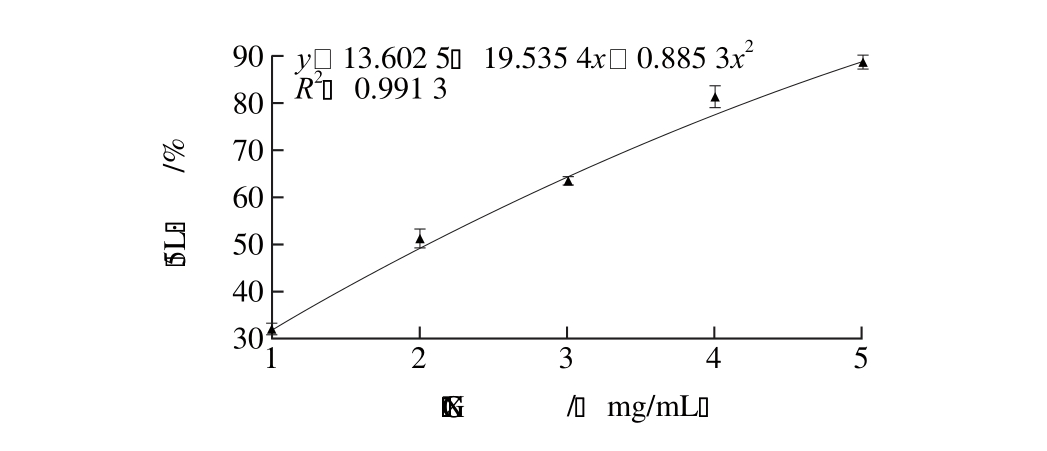
OH清除作用的影响
Fig. 1 Scavenging effect of bile acid salt binding peptide on hydroxyl radicals
图1 胆酸盐结合肽对·
由图1可知,随着样品质量浓度增加,其对☒OH的清除率逐渐升高,相关性分析显示清除率与处理质量浓度显著正相关(P<0.05),当质量浓度达到5 mg/mL时,胆酸盐结合肽对•OH的清除率最高达88.7%。
2.1.2 对O2-☒的清除作用
由图2可知,样品对O2-☒的清除率随样品质量浓度增加显著增强,相关性分析显示O2-☒清除率与处理质量浓度显著正相关(P<0.05),当质量浓度达到5 mg/mL时,清除率最高达到72.7%。

的清除效果
Fig. 2 Scavenging effect of bile acid salt binding peptide on superoxide anion radicals
图2 酸肉胆酸盐结合肽对O-2•
2.1.3 对DPPH自由基的清除作用

图3 酸肉胆酸盐结合肽对DPPH自由基的清除效果
Fig. 3 Scavenging effect of bile acid salt binding peptide on DPPH radicals
由图3可知,随着样品质量浓度升高,其对DPPH自由基清除效果逐渐增强,相关性分析显示清除率与处理质量浓度显著正相关(P<0.05),当达到5 mg/mL时最高,为78.3%。经计算胆酸盐结合肽对☒OH、O-2☒、DPPH
自由基的半清除浓度(half inhibitory concentration,IC50)分别为2.04、2.79、2.50 mg/mL,表明在相同质量浓度下,样品对☒OH有更好的清除效果,其次是对DPPH自由基。
2.2 胆酸盐结合肽对大鼠胸主动脉血管内皮细胞的影响
2.2.1 内皮细胞形态学观察及对细胞存活率的影响

图4 血管内皮细胞形态(×100)
Fig. 4 Morphology of cultured endothelial cells (× 100)
主动脉血管块于培养箱中培养4 d后,于倒置显微镜下观察可发现有少量细胞迁出并贴壁生长,细胞形状呈短梭或多角形。培养12~14 d后,迁出生长的细胞覆盖培养瓶面积2/3左右,可看到血管内皮细胞典型的“铺路石”样特征(图4)。加入含样品肽的培养液培养12、24、48 h,以台盼蓝染色计算细胞存活率,结果如图5所示,各组细胞存活率均在80%以上,说明在此质量浓度范围内,样品肽对血管内皮细胞不具有明显毒性。

图5 血管内皮细胞存活率
Fig. 5 Effect of bile acid salt binding peptide on viability of endothelial cells as a function of culture time

图6 各剂量组细胞培养液中NO含量
Fig. 6 Effect of bile acid salt binding peptide on NO release as a function of culture time
2.2.2 对血管内皮细胞NO释放的影响如图6可知,随着培养时间延长,血管内皮细胞NO释放增加,不同剂量样品肽处理均能使血管内皮细胞NO释放增加。在不同培养时间条件下,各剂量组内皮细胞NO释放不存在显著差异(P>0.05);相同培养时间条件下,高剂量组与空白组比较,细胞NO释放量存在显著性差异(P<0.05)。说明样品肽对血管内皮细胞NO的释放有一定促进作用。
2.2.3 对血管内皮细胞前列环素的影响
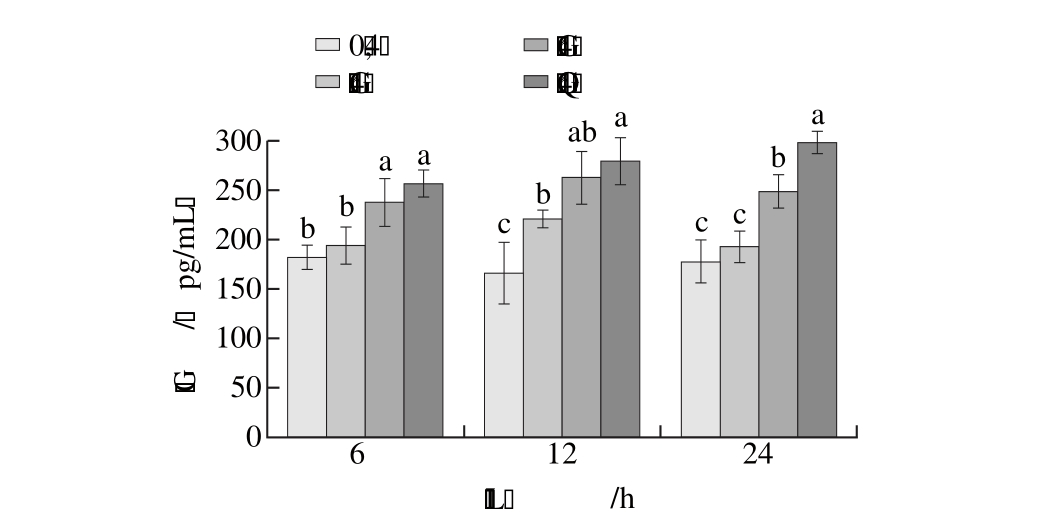
含量
Fig. 7 Effect of bile acid salt binding peptide on 6-keto-PG F1 secretion as a function of culture time
secretion as a function of culture time
图7 各剂量组细胞培养液中6-酮-前列腺素F1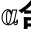
由图7可知,各剂量组样品肽处理的血管内皮细胞培养液中6-酮-前列腺素F1α含量均高于同时间条件下的空白组。低、中、高剂量组处理的内皮细胞,其细胞培养液上清液中6-酮-前列腺素F1α含量分别在培养12、12、24 h时达峰值,与相应空白组比较存在极显著差异(P<0.01)。相同空白培养时间条件下,中、高剂量组中6-酮-前列腺素F1α含量与空白组比较差异显著(P<0.05)。说明样品肽可促使血管内皮细胞分泌前列环素。
通常采用清除自由基法、还原力法、金属离子螯合力法及脂质过氧化抑制能力来评价抗氧化肽体外抗氧化活性[19]。鉴于氧化产生的根本原因在于自由基过剩,自由基清除力可最直接反映肽的抗氧化能力[20],因此本研究采用☒OH、O2-☒、DPPH自由基清除实验以评价酸肉中胆酸盐结合肽的抗氧化能力。实验结果表明,胆酸盐结合肽对•OH、O2-☒、DPPH自由基具有一定的清除效果,且清除率与质量浓度呈一定的剂量-效应关系。在5 mg/mL时,对3 种自由基的清除效果分别为88.7%、72.7%、78.3%,略高于相同质量浓度的泰和乌骨鸡活性肽[21];高于花生活性肽对DPPH自由基的清除能力[22];稍高于草鱼蛋白源抗氧化肽对O2-☒的清除能力[20];与红松松仁抗氧化肽对☒OH、O2-☒的清除能力相当[23];低于大米活性肽[24]或螺旋藻抗氧化肽[25]对☒OH、DDPH自由基的清除能力。这可能与原料蛋白和蛋白酶种类有关,因为抗氧化活性多取决于肽段的氨基酸序列、氨基酸侧链基团、相对分子质量大小和空间构象[26-27],同时所选取的清除能力方法,肽的分离方法也会造成结果的差异性。
在对大鼠胸主动脉血管内皮细胞功能因子的影响研究发现,胆酸盐结合肽对大鼠胸主动脉血管内皮细胞不具有明显毒性,对血管内皮细胞的NO释放有一定的促进作用,可促使血管内皮细胞前列环素I2(prostaglandin I2,PGI2)的分泌,由于其不稳定,其含量在本实验中以其稳定的代谢产物6-酮-前列腺素F1α表示。而研究已证实,NO是内皮依赖性血管舒张因子,NO合成分泌减少,会致使动脉依赖性血管舒张功能障碍,引发动脉粥样硬化的早期病变[28-29];PGI2是强的血管舒张剂,具有抑制凝血和血栓形成的功效,同时还可保护细胞,调节胆固醇代谢等作用[30-31]。由此说明,酸肉胆酸盐结合肽通过结合胆酸盐以及清除自由基,达到降血脂及预防动脉粥样硬化的效果。
综上,酸肉胆酸盐结合肽通过结合胆固醇、较好的抗氧化保护作用以及促进血管内皮细胞对NO、PGI2等生物活性物质的分泌,进而可能对动脉粥样硬化、降低胆固醇具有一定功效,可为传统发酵食品发酵酸肉的功能化及产业化开发提供参考。
参考文献:
[1] LOVATI M R, MANZONI C, GIANAZZA E, et al. Soy protein peptides regulate cholesterol homeostasis in Hep G2 cells[J]. Journal of Nutrition, 2000, 130(10): 2543-2549.
[2] HOSOMI R, FUKUNAGA K, ARAI H, et al. Fish protein decreases serum cholesterol in rats by inhibition of cholesterol and bile acid absorption[J]. Journal of Food Science, 2011, 76(4): 116-121. DOI:10.1111/j.1750-3841.2011.02130.x.
[3] MORIKAWA K, KONDO I, KANAMARU Y, et al. A novel regulatory pathway for cholesterol degradation via lactostatin[J]. Biochemical and Biophysical Research Communications, 2007, 352(3): 697-702. DOI:10.1016/j.bbrc.2006.11.090.
[4] 周才琼, 李艳芳, 杜木英. 渝黔地区传统酸肉发酵过程中微生物区系研究[J]. 食品工业科技, 2010, 31(4): 171-175.
[5] 周才琼, 陈东华, 杜木英. 酸肉发酵中蛋白质降解及影响因素的研究[J]. 食品科学, 2009, 30(7): 127-130. DOI:10.3321/ j.issn:1002-6630.2009.07.029.
[6] 孙文静, 卫飞, 袁军, 等. 酸肉发酵中脂肪的变化及对小鼠血脂的影响[J]. 食品科学, 2013, 34(11): 263-267. DOI:10.7506/spkx1002-6630-201311057.
[7] KAGAWA K, MATSUTAKA H, FUKUHAMA C, et al. Globin digest, acidic protease hydrolysate, inhibits dietary hypertriglyceridemia and Val-Val-Tyr-Pro, one of its constituents, possesses most superior effect[J]. Life Sciences, 1996, 58(20): 1745-1755. DOI:10.7506/spkx1002-6630-201311057.
[8] 方俊, 田云, 卢向阳, 等. 猪血多肽辅助降血脂功能研究[J]. 中国食品学报, 2010, 10(4): 147-151. DOI:10.3969/j.issn.1009-7848.2010.04.023.
[9] MARTIN S, FAVOT L, MATZ R, et al. Delphinidin inhibits endothelial cell proliferation and cell cycle progression through a transient activation of ERK-1/-2[J]. Biochemical Pharmacology, 2003, 65(4): 669-675. DOI:10.1016/S0006-2952(02)01568-X.
[10] NETZEL M, STRASS G, KAUL C, et al. In vivo antioxidative capacity of a composite berry juice[J]. Food Research International, 2002, 35(2/3): 213-216. DOI:10.1016/S0963-9969(01)00186-7.
[11] YOUDIM K A, SHUKITT-HALE B, MACKINNON S, et al. Polyphenolics enhance red blood cell resistance to oxidative stress: in vitro and in vivo[J]. Biochimica et Biophysica Acta, 2000, 1523(1): 117-122. DOI:10.1016/S0304-4165(00)00109-4.
[12] ZDUNCZYK Z, FREJNAGEL S, WR☒BLEWSKA M, et al. Biological activity of polyphenol extracts from different plant sources[J]. Food Research International, 2002, 35(2/3): 183-186. DOI:10.1007/s00066-009-1979-7.
[13] SILVA S V, MALCATA F X. Caseins as source of bioactive peptides[J]. International Dairy Journal, 2005, 15(1): 1-15. DOI:10.1016/j.idairyj.2004.04.009.
[14] 王海凤, 王常青, 许洁, 等. 葵花籽粕多肽抗氧化与延缓衰老作用的研究[J]. 食品工业科技, 2010, 31(7): 92-94.
[15] 牛广俊, 朱思, 陈清英, 等. 金花茶不同部位多糖的测定及体外抗氧化活性[J]. 中国实验方剂学杂志, 2014, 20(20): 168-172. DOI:10.13422/j.cnki.syfjx.2014200168.
[16] 叶春, 马顺强, 张倩, 等. 酸肉肽抗氧化活性的研究[J]. 食品科学, 2010, 31(7): 94-97.
[17] 瞿海龙, 陈晓春. 大鼠胸主动脉内皮细胞培养方法的改进[J].内蒙古医学院学报, 2007, 29(3): 164-166. DOI:10.3969/ j.issn.1004-2113.2007.03.003.
[18] 胡少勃, 宋自芳, 郑启昌, 等. 大鼠主动脉内皮细胞和平滑肌细胞的原代培养及生物学特性比较[J]. 中国组织化学与细胞化学杂志, 2009, 18(4): 349-353. DOI:10.3870/zgzzhx.2009.04.001.
[19] DECKER E A, WARNER K, RICHARDS M P, et al. Measuring antioxidant effectiveness in food[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4303-4310.
[20] 任娇艳, 赵谋明, 崔春, 等. 草鱼蛋白源抗氧化肽的分离及鉴定[J]. 食品科学, 2009, 30(13): 13-17. DOI:10.3321/ j.issn:1002-6630.2009.13.001.
[21] 刘建华. 泰和乌骨鸡活性肽抗氧化与降血压及其补血作用研究[D].南昌: 南昌大学, 2011: 33-37. DOI:10.7666/d.y1942765.
[22] 刘洪对, 于丽娜, 高俊安, 等. 五种花生抗氧化肽体外抗氧化活性比较[J]. 核农学报, 2013, 27(8): 1162-1167.
[23] 綦蕾, 王振宇. 红松松仁抗氧化肽的制备及体外抗氧化活性评价[J].食品与发酵工业, 2010, 36(7): 78-82. DOI:10.13995/j.cnki.11-1802/ ts.2010.07.005.
[24] 梁盈, 鲁倩, 方婧杰, 等. 大米活性肽的抗氧化作用及其对HUVEC细胞增殖的影响[J]. 中国粮油学报, 2014, 29(7): 1-6.
[25] 欧赟, 乔燕燕, 王维有, 等. 螺旋藻抗氧化肽的制备及其体外活性研究[J]. 食品与生物技术学报, 2014, 33(1): 22-26.
[26] 刘建华, 田颖刚, 王勇, 等. 泰和乌骨鸡活性肽的分离及其体外抗氧化作用[J]. 食品科学, 2010, 31(19): 79-83.
[27] CHEN H M, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from soybean β-conglycinin[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578. DOI:10.1021/ jf00051a004.
[28] 冯莉莉, 霍亚南. 血管内皮依赖性舒张功能障碍[J]. 江西医药, 2008, 43(2): 172-174. DOI:10.3969/j.issn.1006-2238.2008.02.043.
[29] 杨琪, 刘维军. 高血压患者血管内皮功能障碍与血压变异性[J]. 医药前沿, 2015, 5(35): 5-6 .
[30] 吴俊兰, 罗张兴. 复方丹参滴丸对动脉粥样硬化患者血管内皮细胞分泌功能的影响[J]. 中国现代药物应用, 2011, 5(8): 1-2. DOI:10.3969/j.issn.1673-9523.2011.08.001.
[31] NICHOLSON W T, VAA B, HESSE C, et al. Aging is associated with reduced prostacyclin-mediated dilation in the human forearm[J]. Hypertension, 2009, 53(6): 973-978. DOI:10.1161/ HYPERTENSIONAHA.108.121483.
Chemical Antioxidant Effect of Bile Acid Salt Binding Peptide from Fermented Sour Meat and Its Effect on Rat Thoracic Aorta Endothelial Cells
WEI Cheng1, LI Chenglong1,2, ZHU Lijuan1, XIE Yueying1, ZHOU Caiqiong1,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Beer Company, Chongqing 401555, China)
Abstract:The chemical antioxidant effect of bile acid salt binding peptide (with molecular weights of 265• 1 400 D and peptide content of 75.7%) from fermented sour meat was studied as well as its influence on rat thoracic aorta endothelial cells. The results showed that the antioxidant activity of the bile acid salt binding peptide was enhanced with the increase in its concentration. The IC50for scavenging hydroxyl, superoxide anion and 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radicals were 2.04, 2.79 and 2.50 mg/mL, respectively, indicating that the peptide had better scavenging effect against hydroxyl radical. Cytotoxicity studies showed that in the concentration range used in this study, the peptide had no obvious toxicity on rat aortic endothelial cells and it could stimulate the release of NO and the secretion of 6-keto-prostaglandin F1α especially at high concentration in comparison with the blank control group. All these results showed that the bile acid salt binding peptide may be beneficial in the prevention of cardiovascular diseases through its antioxidant activity and its effects on vascular endothelial cells.
Key words:fermented sour meat; bile acid salt binding peptide; chemical antioxidant effect; vascular endothelial cell; prostacyclin
DOI:10.7506/spkx1002-6630-201711036
中图分类号:TS218
文献标志码:A
文章编号:1002-6630(2017)11-0225-06引文格式:
收稿日期:2016-05-23
基金项目:重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001)
作者简介:韦诚(1992—),男,硕士研究生,研究方向为食品化学与营养学。E-mail:648950178@qq.com
*通信作者:周才琼(1964—),女,教授,博士,研究方向为食品营养化学。E-mail:zhoucaiqiong@swu.edu.cn