史智佳,张睿梅,杨 震,刘 梦,贡 慧,王守伟*
(中国肉类食品综合研究中心,北京 100068)
摘要:为探讨单色光照对金枪鱼生食产品脂质氧化和肌红蛋白(myoglobin,Mb)氧化的影响,优化其陈列展示光照条件,实验以大目金枪鱼(Thunnus obesus)赤身肉为研究对象,使用红、黄、绿和蓝4 种单色LED(lightemitting diode)灯,以等功率、等光照强度和梯度光照强度3 种方式施加光照,测定贮藏过程中金枪鱼肉硫代巴比妥酸反应产物值和高铁肌红蛋白含量变化。结果表明:贮藏期内,相较于暗室贮藏,单色光照显著促进了大目金枪鱼的脂质氧化,加速了Mb氧化;在相同光照强度下,单色光照的促氧化作用随波长减小而增大,但黄色光促氧化作用小于红色光;光照强度影响单色光促氧化作用,蓝色光和绿色光促氧化作用受光照强度的影响程度大于黄色光和红色光;脂质氧化和Mb氧化反应符合0级模式。因此,建议金枪鱼生食产品的陈列展示使用长波长的红、黄色光,避免短波长的绿、蓝色光。
关键词:金枪鱼;光照;脂质氧化;高铁肌红蛋白;动力学模型
史智佳, 张睿梅, 杨震, 等. 单色光照金枪鱼脂质和肌红蛋白氧化动力学研究[J]. 食品科学, 2017, 38(11): 237-242. DOI:10.7506/spkx1002-6630-201711038. http://www.spkx.net.cn
SHI Zhijia, ZHANG Ruimei, YANG Zhen, et al. Kinetic studies of lipid and myoglobin oxidation in bigeye tuna muscle under monochromatic light conditions[J]. Food Science, 2017, 38(11): 237-242. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201711038. http://www.spkx.net.cn
冷藏展柜展示销售是商家推销食品的重要方式,而LED(light-emitting diode)灯因其体积小、光电效率高、寿命长、坚固耐用等优点,正逐渐取代传统的白炽灯、荧光灯等光源。光照会对贮藏食品品质产生不同影响[1-12]。对于新鲜绿色蔬菜,光照有利于其营养成分的保持,减缓品质劣化进而延长货架期;而对于果蔬加工制品和动物源食品,光照对食品品质造成的不利影响更为突出。目前,有关光照对食品品质影响的研究报道包括蔬菜及制品[1-3]、食用油类[4]、乳及乳制品[5-6]、肉及肉制品[7-10]、淡水鱼[11-12]等。但研究报道关注于光源种类、光照强度和光照时间3 个方面,鲜有研究不同波长的光照对食品品质的影响。
金枪鱼生食产品天然无污染、口感圆润鲜美、营养丰富,日益受到国内消费者的青睐。金枪鱼不饱和脂肪酸和高度不饱和脂肪酸含量双高,分别约占总脂肪酸含量的61%和43%[13],因此极易发生脂质氧化。肉类色泽对消费者的购买行为产生重要影响,受肉中高铁肌红蛋白(metmyoglobin,metMb)含量的影响。而metMb含量变化又与脂类氧化显著相关[14]。光氧化是脂质非酶促氧化的重要途径。王建辉等[12]报道了光照对冷藏条件下草鱼肌肉脂肪酸组成及含量的影响,但目前尚少见到有关不同波长光照对金枪鱼品质变化影响的研究报道。为此,本实验以大目金枪鱼(Thunnus obesus)为对象,开展LED单色灯光照对其脂类氧化和肌红蛋白(myoglobin,Mb)氧化动力学研究,旨在为金枪鱼生食产品冷藏展柜陈列光照条件优化提供参考。
1.1 材料与试剂
大目金枪鱼由北京市北水嘉伦水产品市场有限责任公司提供。
三氯乙酸、硫代巴比妥酸、磷酸钠缓冲液等试剂均购于国药集团化学试剂有限公司。
1.2 仪器与设备
Sorvall LYNX-6000型离心机 美国赛默飞世尔科技公司;UV-2800型紫外-可见分光光度计 美国尤尼柯仪器有限公司;HH-S2恒温水浴锅 上海况胜实业发展有限公司;BSA822-CW型电子天平 德国赛多利斯科学仪器有限公司;HT-1300型照度计 广州市宏诚集业电子科技有限公司。
光照实验使用自行设计的光照箱,由硬纸板搭建而成的箱体,尺寸为:长45 cm×宽25 cm×高35 cm。箱体内壁附着锡箔纸,LED灯管紧固于箱体顶部,金枪鱼样品放置于托盘后用箱体罩住,进行光照实验。
1.3 方法
1.3.1 样品预处理
冷冻条件下将大目金枪鱼赤身肉切块,每块质量为(150±5) g,冻贮于-50 ℃以下的超低温冰箱中备用。
1.3.2 实验设计
金枪鱼肉中含有的血红素分子是一个具有卟啉结构的小分子,是一种卟吩衍生物,具有光敏产生单线态氧和自由基能力。卟吩环c→c*能级差大约位于波长400~700 nm对应的可见光范围,具有特殊的紫外-可见吸收光谱,主要包括Soret带和Q带。其中,Soret带为单峰吸收一般在420 nm左右,Q带一般在波长500~700 nm之间。通常Soret带吸收峰的吸光系数约是Q带的10~20 倍[15],相应的光促氧化能力也显著高于后者。因此,本研究避开Soret带对应的420 nm,选取对应波长分别为630、590、530 nm和460 nm的红色、黄色、绿色和蓝色光照。
1.3.2.1 等功率LED灯单色光照
自超低温冰箱中取出大目金枪鱼赤身肉块,每4 块为一组随机分为25 组。其中1 组作为对照组在(4±1)℃条件下贮藏于暗室中,其余各组进行LED灯单色光照处理。单色LED灯的实测功率为(6.0±0.4) W,与金枪鱼肉样距离为35 cm。单色光照持续10 d,期间每2 d取样测定硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)值和metMb含量。
1.3.2.2 等光照强度LED灯单色光照
自超低温冰箱中取出大目金枪鱼赤身肉块,每4 块为一组随机分为5 组。其中1 组作为对照组在(4±1) ℃条件下贮藏于暗室中,其余各组进行光照强度均为(700±10) Lux的单色光照。光照强度的调整通过在LED灯和金枪鱼样品之间增加遮挡物实现。单色光照持续4 d,之后取样测定TBARS值和metMb含量。
1.3.2.3 同一单色光不同光照强度光照
自超低温冰箱中取出大目金枪鱼赤身肉块,每4 块为一组随机分为12 组。取3 组进行红色光光照。光照强度为原始光强、1/4原始光强和1/16原始光强。其余黄色、绿色和蓝色单色光照操作方法与红光相同。光照强度的调整通过在LED灯和金枪鱼样品之间增加遮挡物实现。单色光照持续4 d,之后取样测定TBARS值和metMb含量。
1.3.3 脂类氧化程度的测定
脂类氧化程度以金枪鱼肉样中丙二醛(malondialdehyde,MDA)含量表示。MDA含量测定采用TBARS法,具体参照苏辉等[16]所述方法。取10 g剁碎后的金枪鱼样品,加入50 mL 7.5%三氯乙酸混合液(含0.1%乙二胺四乙酸),振荡30 min,过滤2 次。取10 mL滤液加入10 mL 0.02 mol/L硫代巴比妥酸(thiobarbituric acid,TBA)水溶液,90 ℃水浴40 min,取出冷却至室温,于2 000×g离心5 min,取上清液加入10 mL三氯甲烷摇匀,待分层后,取上层液体测定532 nm和600 nm波长处吸光度,记为A532nm、A600nm,按公式(1)计算TBARS值,通过每100 g鱼肉中MDA的毫克数来表示。
1.3.4 Mb氧化程度的测定
Mb的氧化程度以金枪鱼肉样中metMb含量表示,具体测定方法参照尚艳丽等[17]的方法。取金枪鱼样品10 g,加入20 mL 0.04 mol/L的磷酸钠缓冲液,均质,将均质液于冰浴中静置1 h,与5 000×g离心10 min。过滤得上清液,测其在525、545、565、572 nm波长处的吸光度,记为A525nm、A545nm、A565nm、A572nm,按公式(2)计算metMb含量。
1.4 数据处理
使用Statistics SPSS 12.0和Excel 2010软件对实验数据进行处理。
2.1 LED灯的实测功率和光照强度
表1 LED灯的实测功率及光照强度
Table 1 Measured power and light intensity of LED lamps

如表1所示,蓝色光(460 nm)的光照强度和单位光照强度最大,分别为3 040 Lux和490 Lux/W,其次依次为绿色(530 nm)、红色(630 nm)和黄色(590 nm)。
2.2 单色光照对金枪鱼脂质氧化的影响
脂类氧化初级产物对人体的毒性受其摄入方式影响很大,静脉注射时毒性很大,但口服时一般认为其毒性较小[18]。初级产物不稳定,会进一步分解、聚合形成相对稳定的次级产物。脂类氧化次级产物更容易被吸收进入循环系统诱发疾病进而危害人体健康[19-20]。同时,脂类氧化产生的醛、酮、醇等化合物还会导致食品营养和感官品质下降[21-23]。
脂类氧化可分为酶促氧化和非酶促氧化[24],后者又可分为光敏氧化和自动氧化。光敏氧化是由食品中存在的光敏剂,如卟啉等在光照条件下被激发并使基态氧生成单线态氧,进而直接与基态含烯物的不饱和双键发生非酶促、非自由基的氧化反应[25-26]。由于单线态氧能量高、反应活性大、所以光氧化反应速率比自动氧化快1 500 倍[25]。此外,光敏剂在光照作用下还可产生·OH、O2-·等自由基,进而促进脂类氧化。金枪鱼肉中含有Mb和血红蛋白,两者均含有约为3.8%血红素辅基[27]。血红素分子是一个具有卟啉结构的小分子,加之其他光敏成分的存在,因此光照不可避免的会对金枪鱼脂类氧化产生影响。
MDA是四甲基乙缩醛衍生物[28],是脂类氧化次级产物中最主要的醛类单体[29],相较于脂类过氧化物更稳定。两分子TBA可与一分子MDA在酸性高温条件下生成MDA-TBA粉红色复合物,该复合物可在532~535 nm波长范围内被检测到[30-31]。TBA检测MDA含量方法简单易行,尤其适用于富含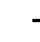 -3脂肪酸的脂类氧化检测[32]。金枪鱼
-3脂肪酸的脂类氧化检测[32]。金枪鱼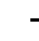 -3脂肪酸含量高达43%[15],故采用此法测定金枪鱼脂质氧化。
-3脂肪酸含量高达43%[15],故采用此法测定金枪鱼脂质氧化。
2.2.1 等功率单色光照对TBARS值的影响
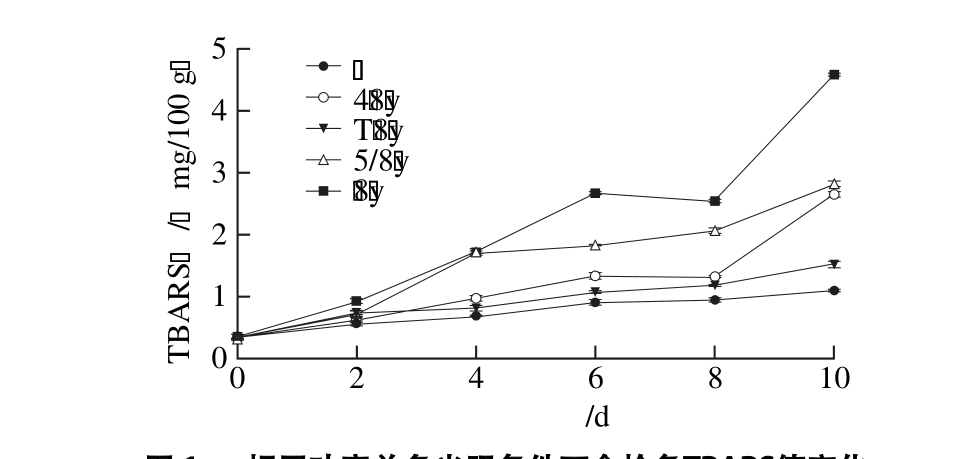
图1 相同功率单色光照条件下金枪鱼TBARS值变化
Fig. 1 Change in TBARS value in tuna illuminated with different monochromatic lights at same power
在(4±1) ℃条件下,单色光照条件下金枪鱼脂类氧化变化由图1可知,相同功率的LED灯产生的单色光照促进了金枪鱼的脂质氧化,且各单色光照促进脂质氧化的能力有所差异。蓝色光对金枪鱼脂质氧化的促进作用最大,其第2天TBARS值为0.92 mg/100 g,显著高于暗室贮藏的0.57 mg/100 g,且在之后几天的TBARS值差距不断拉大。至第10天,蓝色光照的金枪鱼TBARS值为4.57 mg/100 g,而对照组(暗室贮藏)仅为1.09 mg/100 g。其次是绿色光,再者是红色光。黄色光照对金枪鱼脂类氧化的促进作用最小。黄色光光照条件下,金枪鱼TBARS值缓慢上升,第10天时达到1.51 mg/100 g,低于其他光照条件,但却显著高于暗室贮藏(P<0.05)。光照2 d,红色、黄色、绿色光照对金枪鱼脂类氧化的促进作用较小,TBARS值增幅分别为0.27、0.39 mg/100 g和0.396 mg/100 g,而同期暗室贮藏升高了0.23 mg/100 g。
2.2.2 等光照强度单色光照对TBARS值的影响
如表1所示,功率相同的LED灯产生的单色光的光照强度有所不同。日本工业标准的照度标准推荐食品展示柜光照强度为700 Lux。在700 Lux光照强度条件下,单色光照对金枪鱼脂类氧化的影响如图2所示。与暗室贮藏相比,单色光照显著促进了金枪鱼脂类氧化,且除黄色光照外,脂类氧化程度随着波长的减小而增大。绿色和蓝色光照对金枪鱼脂肪氧化的促进作用最大,TBARS值分别为1.09 mg/100 g和1.20 mg/100 g;其次为红色光照。黄色光照影响最小,但与红色光差异不显著(P>0.05),但相较于暗室贮藏极显著提高了金枪鱼的脂肪氧化程度(P<0.01)。李娜等[33]研究了相同光照强度下不同颜色光照对猪肉脂质氧化的影响,发现蓝色和绿色光照下脂类氧化速率大于红色光照,光照促氧化作用随着光波长减小而增大,光的波长越短,其促进氧化的能力越强,其原因可能是光的波长越短,光的频率就越高,相应的光子的能量就越大。
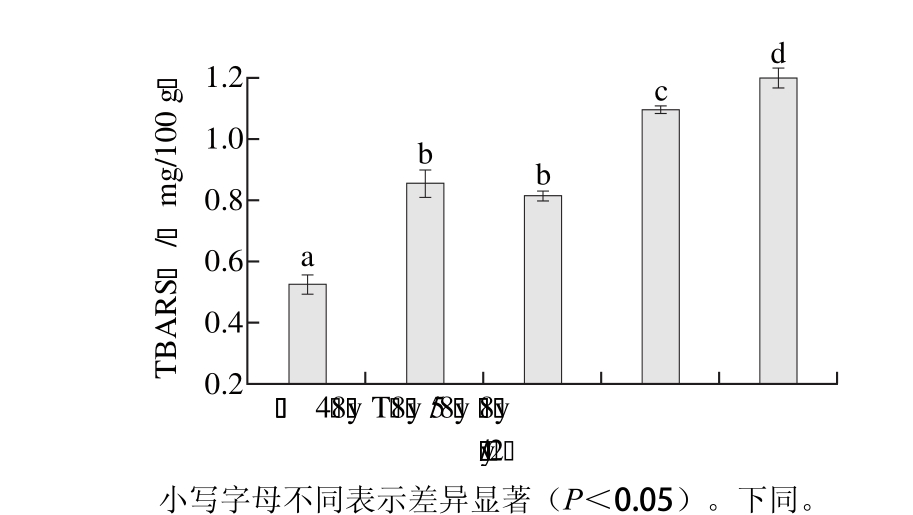
图2 等光照强度单色光照条件下金枪鱼TBARS值变化
Fig. 2 Change in TBARS value in tuna illuminated with different monochromatic lights at the same light intensity
2.2.3 不同光照强度单色光照TBARS值的影响

图3 不同光照强度的单色光照条件下金枪鱼TBARS值变化
Fig. 3 Change in TBARS value in tuna illuminated with different monochromatic lights at gradient light intensities
单色光不同光照强度对金枪鱼脂质氧化的影响如图3所示,脂类氧化程度随其光照强度的降低而减弱。蓝色和绿色光照的促脂类氧化作用受其光照强度的影响大于红色光和黄色光。蓝色光照强度降至原来的1/16时,金枪鱼TBARS值降低了40.9%,绿色光降低了47.3%。光照强度变化对红色光和黄色光促进脂类氧化的作用影响相对较小,光照强度降为原来的1/16时,TBARS值分别降低了29.2%和22.2%。由此可见,光照强度是影响单色光照促进脂类氧化作用的一个重要影响因素。
2.3 单色光照对金枪鱼Mb氧化的影响
Mb是一种水溶性金属蛋白,由一个多肽链组成的珠蛋白和一个血红素辅基构成。血红素辅基中心为一个铁离子。当Fe2+配位键结合O2时,为鲜红色的氧合肌红蛋白(oxymyoglobin,oxyMb);而当Fe2+氧化为Fe3+价时,变成褐色的metMb;当铁离子配位键不连接其他分子并且为Fe2+时,为脱氧肌红蛋白,呈紫红色[34]。
肉色是评价是大目金枪鱼生食产品品质的重要指标。金枪鱼肉色泽由肉中metMb含量决定。研究表明,金枪鱼肉中metMb含量为20%时肉呈鲜红色,30%时呈红色,50%时呈褐红色,70%以上呈褐色[35-36]。
2.3.1 相同功率单色光照对金枪鱼Mb氧化的影响
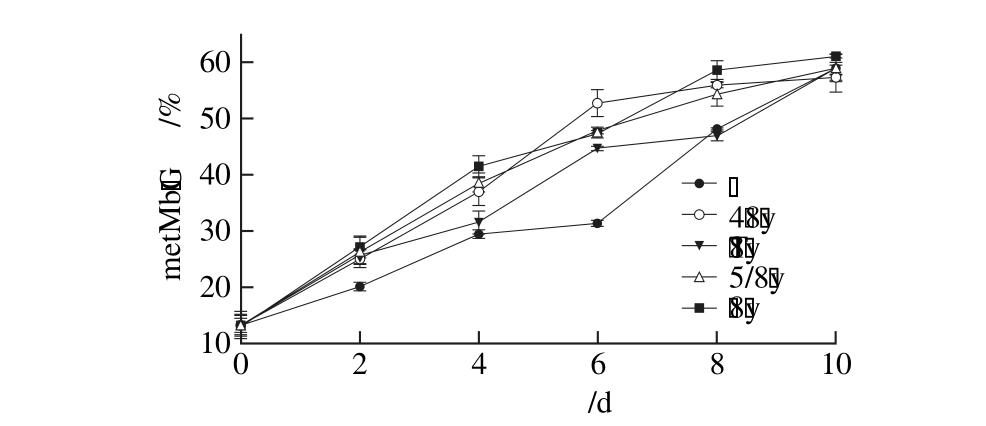
图4 相同功率单色光照条件下金枪鱼metMb含量变化
Fig. 4 Change in metMb content in tuna illuminated with different monochromatic lights at the same power
在(4±1)℃条单色光照条件下,金枪鱼肉中metMb含量变化见图4。单色光照对金枪鱼Mb氧化具有促进作用,贮藏第2天,红色、黄色、绿色和蓝色光照条件下金枪鱼的metMb含量分别为24.96%、25.38%、26.47%、27.24%,均显著高于暗室贮藏(P<0.05)。贮藏第6天后,单色光照条件下metMb生成速率趋缓,低于暗室贮藏条件下。单色光照对贮藏期间metMb生成总量影响不显著,第10天时metMb含量均约为60%。霍晓娜等[8]研究发现,日光灯光照可加速猪肉猪metMb的生成,使猪肉色泽劣化加速。陈聘[35]研究发现,oxyMb的氧化速率随脂质氧化产物积累而加快,两者显著相关。光照加速metMb生成的原因主要有3 个方面:一是由于脂肪氧化过程中产生的自由基会进攻Mb的血红素辅基部分,使血红素辅基中心的Fe2+氧化成Fe3+;二是自由基还会破坏肉中一些酶的活性,其中包括metMb还原酶,使得肉在贮存过程中产生的metMb不能及时被还原[8];三是脂质氧化次级产物通过改变oxyMb结构促进其氧化[35]。相较于光照,暗室贮藏条件下单线态氧、自由基生成速率以及脂质氧化产物积累都相对较慢,因而贮藏前期metMb生成速率相对较慢,而后期快速上升。
2.3.2 等光照强度单色光照对金枪鱼Mb氧化的影响
在700 Lux光照强度条件下,单色光照对金枪鱼Mb氧化的影响如图5所示,单色光照条件下,金枪鱼肉中metMb含量高于暗室贮藏,整体呈现随波长减小而增大的趋势。蓝色光照的影响最大,实验条件下metMb含量达到40.42%,这可能与其波长最短,光子能量最大,诱发单线态氧和自由基能力强有关。其次依次是红色光、绿色光和黄色光。黄色光照对金枪鱼Mb氧化的影响最小,metMb含量为32.63%。红色光和绿色光、绿色光和黄色光、黄色光与暗室之间无显著差异(P>0.05),这可能与metMb的生成受多种因素影响,光照因素的影响相对弱化有关系。但霍晓娜等[8]研究发现,在(4±2)℃贮存温度条件下采用日光灯照明时,光照强度低于750 Lux的情况下不会对猪肉的metMb含量变化产生显著影响,与实验研究结果有所差异。究其原因可能与光源的不同和金枪鱼肉与猪肉理化特性的差异有关。

图5 等光照强度单色光照条件下金枪鱼metMb含量变化
Fig. 5 Change in metMb content in tuna illuminated with different monochromatic lights at the same light intensity
2.3.3 不同光照强度单色光照对金枪鱼Mb氧化的影响
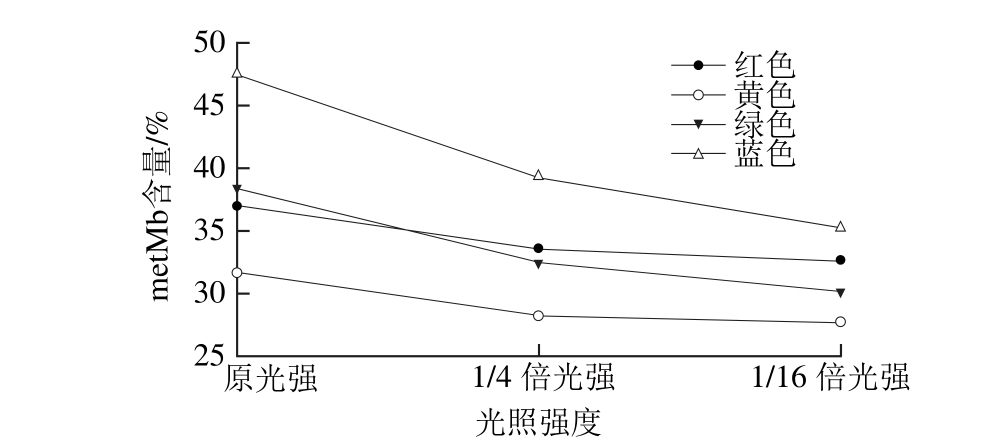
图6 不同光照强度的单色光条件下金枪鱼metMb含量变化
Fig. 6 Change in metMb content in tuna illuminated with different monochromatic lights at gradient light intensities
单色光不同光照强度对金枪鱼Mb氧化的影响如图6所示,单色光促进Mb氧化的作用随其光照强度的降低而减弱。蓝色和绿色光光照的促进Mb氧化作用受其光照强度的影响大于红色光和黄色光。蓝色光光照强度降至原来的1/16时,金枪鱼metMb含量降低了25.8%,而绿色光则降低了21.4%。光照强度变化对红色光和黄色光促进脂类氧化的作用影响较小,光强降为原来的1/16时,metMb含量分别降低了11.7%和12.6%。由此可见,光照强度是影响单色光照促进Mb氧化作用的一个重要影响因素。
2.4 脂类和Mb氧化动力学模型
一般而言,食品成分在贮藏过程中的反应动力学大多遵循0级或1级模式[36-37]。0级模式采用线性坐标可得到一条直线,1级模式则需要通过半对数坐标才能得到一条直线[38-39]。黄鳍金枪鱼和蓝鳍金枪鱼脂质和Mb氧化符合0级模式[38-39],其反应方程可以表示为:
式中:[A]和[B]为贮藏t天后理化指标含量;[A0]和[B0]为理化指标初始含量;t为贮藏时间;k0为反应速率常数。
将相同功率单色光照条件下,金枪鱼的TBARS值和metMb含量按照0级模式进行回归分析,结果如表2所示。
表2 单色光照条件下金枪鱼肉品质变化动力学模型的参数
Table 2 Parameters of kinetics models for quality changes of tuna under monochromatic light conditions
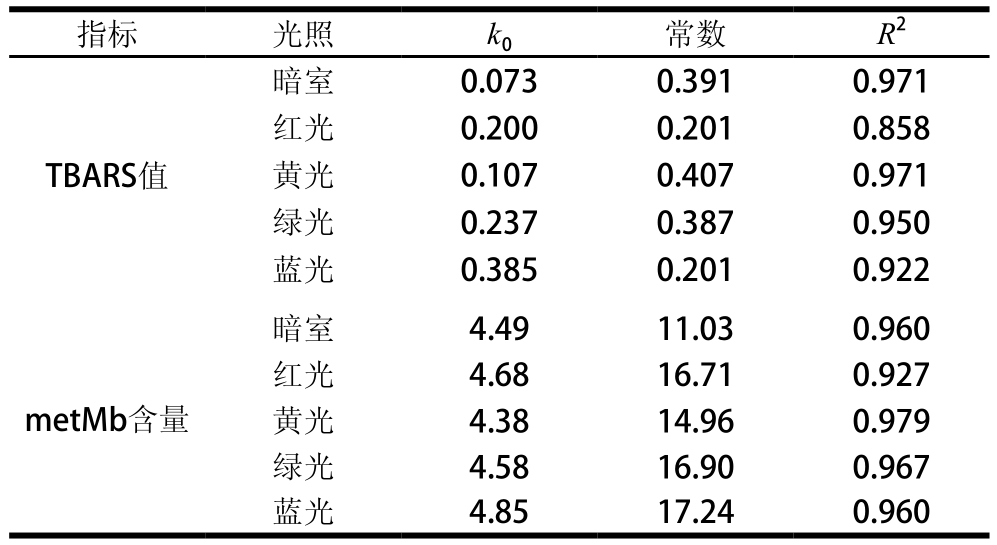
由表2可知,0级反应模式很好地反映了脂质氧化和Mb氧化的动力学特性。相较于metMb,脂质氧化受光照影响更为显著。暗室贮藏时,脂质氧化速率常数k0仅为0.073,而红色、黄色、绿色和蓝色光照条件下分别是其2.73、1.47、3.24 倍和5.28 倍。相同实验条件下,metMb含量变化速率与暗室差异相对较小,这可能与Mb氧化受多种因素影响,光照因素作用相对弱化有关。单色光照对Mb和脂质的促氧化作用与波长成反比,与已有报道相一致[33]。
本实验在(4±1)℃条件下研究不同单色光照条件下对大目金枪鱼的脂质氧化和Mb氧化的影响,结果表明:不同单色光照加速了大目金枪鱼脂质氧化和Mb的氧化,其原因与具有卟啉结构的血色素等光敏剂在光照条件下产生单线态氧、·OH有关;在700 Lux光照强度下连续照射4 d,各单色光的促进脂质氧化作用顺次为:蓝色光>绿色光>红色光>黄色光,促氧化作用整体呈现随波长减小而增大的趋势,但黄色光和红色光差异不显著;各单色光促进Mb氧化作用顺次为:蓝光>红光>绿光>黄光,但光照对Mb氧化的影响小于脂质氧化;降低光照强度会弱化各单色光的促氧化作用,其中蓝色光和绿色光的促氧化作用受光照强度影响较大,而红光和黄光相对较小;单色光照条件下,贮藏期间大目金枪鱼脂质氧化和Mb氧化反应符合0级模式。
总之,不同波长的单色光照对金枪鱼的脂质氧化和Mb氧化产生了不良影响,建议在其陈列展示中使用长波长的红色、黄色单色光,避免使用短波长的绿色、蓝色单色光。
参考文献:
[1] 詹丽娟, 魏国强, 乔明武, 等. 光照处理提高鲜切西兰花贮藏品质[J].食品科学, 2012, 33(14): 296-300.
[2] B☒CHERT A M, G☒MEZ L M E, VILLARREAL N M, et al. Effect of visible light treatments on postharvest senescence of broccoli (Brassica oleracea L.)[J]. Journal of the Science of Food and Agriculture, 2011, 91(2): 355-361. DOI:10.1002/jsfa.4193.
[3] 潘梦垚, 卢立新, 唐亚丽, 等. 光照影响下真空包装水煮笋的品质变化动力学[J]. 食品工业科技, 2013, 34(12): 312-315; 321. DOI:10.13386/j.issn1002-0306.2013.12.045.
[4] 易志, 吴雪辉, 沈冰, 等. 温度及光照对亚麻籽油贮藏稳定性影响研究[J]. 粮食与油脂, 2016, 29(6): 17-21. DOI:10.3969/ j.issn.1008-9578.2016.06.005.
[5] 任龙梅, 张超, 杨晓清. 光源和光照度对UHT奶脂氧化程度和感官品质的影响[J]. 食品科技, 2011, 36(8): 73-76. DOI:10.13684/j.cnki. spkj.2011.08.045.
[6] ALVES R M V, DENDER A G F V, JAIME S B M, et al. Effect of light and packages on stability of spreadable processed cheese[J]. International Dairy Journal, 2007, 17(4): 365-373. DOI:10.1016/ j.idairyj.2006.04.004.
[7] 水旭亭, 唐善虎, 王柳, 等. 光照对低温牦牛肉香肠保藏过程中品质的影响[J]. 食品工业科技, 2015, 36(19): 322-327. DOI:10.13386/ j.issn1002-0306.2015.19.057.
[8] 霍晓娜, 李兴民, 刘毅, 等. 光源和光照度对猪肉脂肪氧化程度和色泽变化的影响[J]. 中国农业大学学报, 2006, 11(4): 47-50. DOI:10.3321/j.issn:1007-4333.2006.04.010.
[9] 杨新磊, 丁武. 紫外处理对冷却猪肉品质的影响[J]. 肉类研究, 2012, 26(4): 8-11. DOI:10.3969/j.issn.1001-8123.2012.04.003.
[10] 王桂桢, 占锋. 不同阻隔包装猪肉光照下品质变化[J]. 山东化工, 2015, 44(21): 34-36. DOI:10.3969/j.issn.1008-021X.2015.21.014.
[11] 张钦发, 许霞, 刘显威, 等. 光照对包装鲜鱼肉品质动态变化的影响[J].食品与机械, 2012, 28(2): 155-157.
[12] 王建辉, 刘冬敏, 刘永乐, 等. 自然光照对冷藏条件下草鱼肌肉脂肪酸组成及含量的影响[J]. 食品科学, 2013, 34(16): 336-340. DOI:10.7506/spkx1002-6630-201316069.
[13] 罗殷, 王锡昌, 刘源. 黄鳍金枪鱼食用品质的研究[J]. 食品科学, 2008, 29(9): 476-480. DOI:10.3321/j.issn:1002-6630.2008.09.111.
[14] 赵巧灵, 廖明涛, 刘书臣, 等. 蓝鳍金枪鱼脂肪氧化和鱼肉色泽的变化研究[J]. 中国食品学报, 2014, 14(7): 79-86.
[15] 王慢想,李强. 卟啉及其衍生物的紫外-可见光谱[J]. 光谱实验室, 2011, 28(3): 1165-1169. DOI:10.3969/j.issn.1004-8138.2011.03.044.
[16] 苏辉, 谢晶, 黎柳, 等. 不同温度下鲳鱼品质及微观组织的变化研究[J].现代食品科技, 2014, 30(8): 106-111.
[17] 尚艳丽, 杨金生, 霍健聪, 等. 运输过程中金枪鱼生鱼片色泽变化的模拟[J]. 食品工业, 2012, 33(11): 60-62.
[18] BERGAN J G, DRAPER H H. Absorption and metabolism of 1-C-methyl linoleate hydroperoxide[J]. Lipids, 1969, 5(12): 976-982. DOI:10.1007/BF02533200.
[19] HEADLAM H A, DAVIES M J. Cell-mediated reduction of protein and peptide hydroperoxides to reactive free radicals[J]. Free Radical Biology and Medicine, 2003, 34(1): 44-55. DOI:10.1016/S0891-5849(02)01181-4.
[20] VALKO M, RHODES C J, MONCOL J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions, 2006, 160(1): 1-40. DOI:10.1016/ j.cbi.2005.12.009.
[21] ANGELO A J, VERCELLOTTI J, JACKS T, et al. Lipid oxidation in foods[J]. Critical Reviews in Food Science & Nutrition, 1996, 36(3): 175-224. DOI:10.1080/10408399609527723.
[22] LEE C W, CHOI H M, KIM S Y, et al. Influence of Perilla frutescens var. acuta water extract on the shelf life and physicochemical qualities of cooked beef patties[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(3): 389-397. DOI:10.5851/kosfa.2015.35.3.389. [23] FRANKEL E N. Antioxidants in lipid foods and their impact on food quality[J]. Food Chemistry, 1996, 57(1): 51-55. DOI:10.1016/0308-8146(96)00067-2.
[24] 谢笔钧. 食品化学[M]. 2版. 北京: 科学出版社, 2004: 92.
[25] 张明成. 油脂氧化机理及抗氧化措施的介绍[J]. 农业机械, 2011(8): 49-52. DOI:10.16167/j.cnki.1000-9868.2011.08.008.
[26] 孙月娥, 王卫东. 国内外脂质氧化检测方法研究进展[J]. 中国粮油学报, 2010, 25(9): 123-128.
[27] 张亚娟. 从猪血中酶法制取血红素的研究[D]. 无锡: 江南大学, 2007: 2. DOI:10.7666/d.y1398364.
[28] FRANKEL E N, NEFF W E. Formation of malonaldehyde from lipid oxidation products[J]. Biochimica et Biophysica Acta-Lipids and Lipid Metabolism, 1983, 754(3): 264-270. DOI:10.1016/0005-2760(83)90141-8.
[29] ADAMS A, de KIMPE N, van BOEKEL M A. Modification of casein by the lipid oxidation product malondialdehyde[J]. Journal of Agricultural and Food Chemistry, 2008, 56(5): 1713-1719. DOI:10.1021/jf072385b.
[30] ULU H. Evaluation of three 2-thiobarbituric acid methods for the measurement of lipid oxidation in various meats and meat products[J]. Meat Science, 2004, 67(4): 683-687. DOI:10.1016/ j.meatsci.2003.12.014.
[31] SINNHUBER R O, YU T C. Characterization of red pigment formed in the 2-thiobarbituric acid determination of oxidative rancidity[J]. Journal of Food Science, 2006, 23(6): 626-634. DOI:10.1111/j.1365-2621.1958.tb17614.x.
[32] 吴娜, 王锡昌, 陶宁萍, 等. 动物源食品中脂质氧化降解产物检测的研究进展[J]. 食品安全质量检测学报, 2014, 5(10): 3042-3046.
[33] 李娜, 李兴民, 刘毅, 等. 血红素和原卟啉光敏作用的研究[J]. 食品科技, 2007, 28(11): 132-134. DOI:10.13684/j.cnki.spkj.2007.11.031. [34] 戴瑞彤. 冷却牛肉表面变色现象的控制及其机理研究[D]. 北京: 中国农业大学, 2002: 7-9. DOI:10.7666/d.y451768.
[35] 陈聘. 脂质氧化和抗氧化因子对牦牛肉肌红蛋白稳定性及高铁肌红蛋白还原能力的影响[D]. 兰州: 甘肃农业大学, 2016: 4.
[36] BEKHIT A E, FAUSTMAN C. Metmglobin reducing activity[J]. Meat Science, 2005, 71(3): 407-439. DOI:10.1016/j.meatsci.2005.04.032. [37] LABUZA T P, RIBOH D. Theory and application of Arrhrnius kinetics to the prediction of nutrient losses in food[J]. 横浜商大論集, 1982, 20(21): 52.
[38] 徐坤华, 廖明涛, 林森森, 等. 蓝鳍金枪鱼脂质和肌红蛋白的氧化动力学研究[J]. 中国食品学报, 2015, 15(2): 64-71. DOI:10.16429/ j.1009-7848.2015.02.010.
[39] 路昊, 包建强. 在不同冻藏温度下黄鳍金枪鱼腹部肌肉的脂质氧化和肌红蛋白氧化的动力学研究[J]. 食品科学, 2007, 28(11): 63-66. DOI:10.3321/j.issn:1002-6630.2007.11.009.
Kinetic Studies of Lipid and Myoglobin Oxidation in Bigeye Tuna Muscle under Monochromatic Light Conditions
SHI Zhijia, ZHANG Ruimei, YANG Zhen, LIU Meng, GONG Hui, WANG Shouwei*
(China Meat Research Centre, Beijing 100068, China)
Abstract:The effect of monochromatic light on the oxidation of lipid and myoglobin in raw ready-to-eat tuna was studied for optimizing the lighting condition during display. Tuna akami samples were illuminated by light-emitting diode (LED) lamps with four different monochromatic lights (red, yellow, green and blue) under three different modes, i.e., the same power, the same light intensity, and gradient light intensities. Changes in thiobarbituric acid reactive substances (TBARS) value and methemoglobin content in tuna akami muscle during subsequent storage were measured. The results showed that monochromatic light significantly promoted lipid oxidation and accelerated myoglobin oxidation in tuna samples compared with dark conditions during storage. At the same light intensity, this effect increased with decreasing wavelength, but yellow light was less effective than red light; there was also dependence upon light intensity, especially for blue and green lights in comparison with yellow and red lights. Furthermore, both lipid and myoglobin oxidation followed a zero-order kinetic equation. Therefore, red and yellow lights with long wavelengths rather than green and blue lights with short wavelengths are recommended for raw ready-to-eat tuna products during display.
Key words:tuna; illumination; lipid oxidation; metmyoglobin; kinetic model
DOI:10.7506/spkx1002-6630-201711038
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2017)11-0237-06引文格式:
收稿日期:2016-10-31
基金项目:北京市科技计划项目(Z151100001215007);“十三五”国家重点研发计划重点专项(2016YFD0400703)
作者简介:史智佳(1982—),男,高级工程师,研究方向为畜禽水产加工应用技术及基础理论研究。E-mail:szj2006@sina.com
*通信作者:王守伟(1961—),男,教授级高级工程师,研究方向为食品加工技术。E-mail:cmrcwsw@126.com