
图1 黄酮化合物基本结构
Fig. 1 Basic structure of flavonoid compounds
王丽颖1,李福香1,杨雅轩1,唐 宇1,李 瑶1,石 芳1,明 建1,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
摘要:随着多酚、多糖营养和功能特性研究的日益深入,多酚与多糖间相互作用及其机制引起食品学术界的广泛关注。本文对多酚与多糖间的非共价相互作用和共价相互作用及机制、影响因素及其对多酚理化特性、功能特性的影响进行综述,并对两者相互作用在食品加工中的应用进行展望。
关键词:多酚;多糖;相互作用;作用机制
王丽颖, 李福香, 杨雅轩, 等. 多糖与多酚相互作用机制及其对多酚特性的影响研究进展[J]. 食品科学, 2017, 38(11): 276-282. DOI:10.7506/spkx1002-6630-201711044. http://www.spkx.net.cn
WANG Liying, LI Fuxiang, YANG Yaxuan, et al. Interaction mechanism between polyphenols and polysaccharides and effect on polyphenolic properties: a review[J]. Food Science, 2017, 38(11): 276-282. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711044. http://www.spkx.net.cn
食品加工过程中,多酚与多糖、蛋白质等分子间易发生物理化学反应,改变多酚的功能特性,进而影响食品的感官品质和营养价值。通过探究多酚与大分子间的相互作用,调控食品品质成为食品科学的研究热点。多酚与多糖间的相互作用包括非共价和共价相互作用两种方式,当多酚和多糖进行物理混合时,体系主要以氢键、疏水相互作用、离子作用等非共价相互作用为驱动力,诱导两者形成可逆或不可逆多酚-多糖复合物,而共价相互作用是由酶促或非酶促氧化的邻醌机制介导[1]。近年来,国内外对多酚与多糖分子间相互作用的研究报道日益增多,本文就多酚与环糊精、固体多糖(果胶、纤维素、壳聚糖、细胞壁多糖)之间的相互作用及机制、影响因素及对多酚性能的影响进行综述,以期为系统研究食品组分相互作用关系奠定基础。
植物多酚是一类以苯酚为基本骨架,苯环的多羟基取代为特征的植物次生代谢产物的总称[2]。广泛存在于蔬菜、水果、豆类、谷物类、茶等植物中,具有抗氧化、抗肿瘤、保护肝脏等多种生理功能[3-4]。目前已经分离鉴定的多酚类物质达8 000多种[5]。植物多酚的生物活性与其某些特殊结构密切相关,像具有C6—C3—C6基本碳骨架的多酚化合物(图1),其酚羟基取代数目及位置、C2=C3、C4=O双键结构、羟基成苷等。有研究表明,酚羟基数目越多,清除自由基的能力越强,且B环的抗氧化活性优于A环[6-7]。另外,具有C3—OH、C5—OH、3′,4′-邻二羟基、C2=C3、C4=O结构的多酚化合物的抗氧化[8-9]、抗肿瘤[10-11]、抗炎[12-14]、降血糖[15]等生物活性明显增强。但也有研究表明芹菜素的C2=C3位双键经过氢化后会降低其抗氧化活性,这可能是氢化后的C2=C3双键缩短了共轭体系,改变了分子的平面结构,阻止了酚羟基发挥作用[16]。

图1 黄酮化合物基本结构
Fig. 1 Basic structure of flavonoid compounds
多糖是多羟基醛或多羟基酮及其缩聚物和衍生物的总称。根据其糖链组成单元可分为单一多糖和杂多糖两大类,在抗肿瘤、抗炎、抗病毒、降血糖、抗衰老、抗凝血、免疫促进等方面发挥着重要的生物功能作用,其功能活性与结构密切相关,例如不同聚合度的多糖抗肿瘤活性不同[17-18]。研究发现,通过β-(1→3)-D-糖苷键连接的多糖具有明显的抗肿瘤活性[19],且硫酸化、乙酰化等化学修饰和改性能提高多糖的生物活性[20-21]。
有研究证实,多糖能够增强多酚的抗氧化[22-23]、降血糖[24]、预防心血管疾病/抗凝血[25]、抗癌[26]等生物活性,并影响多酚生物利用率[27],改善食品品质[28]。这主要是由于多酚和多糖间发生非共价和共价交联导致的,其相互作用受多酚、多糖结构、分子质量、相对浓度、溶剂、酶、蛋白质、温度、pH值等因素的影响。因此,探讨多酚和多糖之间相互作用机制、影响因素对调控和改善食品品质具有重要意义。
在食品加工过程中,多酚和多糖的相互作用不可避免,其结果将会导致混合体系内部形成不同微观结构形态,改变食品体系的理化性质,进而影响食品的感官品质、营养特性及功能活性[29]。多酚与多糖之间的相互作用以非共价相互作用和共价相互作用两种形式存在,但许多研究集中在多酚和多糖的非共价作用,尤其是多酚与多糖模型化合物环糊精、葡聚糖、壳聚糖、果胶、纤维素等的非共价相互作用[30]。而共价相互作用的研究主要通过酶氧化、碳二亚胺交联、自由基诱导等制备多酚多糖共价复合物,并采用紫外(ultraviolet,UV)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、差示扫描量热(differential scanning calorimetry,DSC)等方法进行化学表征[1]。
2.1 多酚与多糖之间的非共价相互作用
非共价相互作用是指生物大分子通过氢键、疏水、静电等作用力与特异性生物活性小分子结合,形成具有特异性强、可逆等特点的复合物的一类反应。多酚与多糖间的非共价作用力包括氢键、静电作用(离子作用)、疏水相互作用等[29]。研究发现香兰素与β-葡聚糖之间的相互作用主要以非共价作用相互吸附结合,而茶多酚与β-葡聚糖之间的结合力主要为氢键[31-32]。Renard等[33]也证实多酚与葡聚糖结合形成低聚物的过程中,是单纯由氢键等非共价相互作用引起的黏度、相排斥的物理混合,并没有发生化学反应。多酚还能够与果胶、纤维素或膳食纤维等植物细胞壁多糖通过非共价作用形成复合物,并通过氢键和疏水相互作用实现与果胶糖侧链的吸附[27,34-35]。
2.1.1 非共价相互作用机制
多酚与多糖间的非共价作用主要是由氢键、疏水相互作用和离子相互作用等介导的。多酚与不同的多糖结合机理不同,如芳香族化合物多酚与葡聚糖凝胶的结合是通过多酚酚羟基上的氢和葡聚糖醚键上的氧原子之间形成氢键,苯环作为交联葡聚糖凝胶羟基的电子供体,使多糖形成包封多酚的结构从而包埋多酚[30]。
也有研究认为多酚与多糖的相互作用是通过两步实现的。首先多糖表面的羟基与水形成刚性结构,多糖内部形成疏水空腔或间隙,接着通过疏水相互作用驱使难溶或不溶性多酚进入空腔或间隙。疏水相互作用被认为是多酚-多糖结合的主要驱动力,氢键能够增强其结合效果。该机制主要存在于具有疏水空腔或空隙的结构中,像环糊精的内部空腔、具有封装疏水化合物适当形状的物质等(果胶凝胶、胞壁多糖及纤维素)[33]。
β-环糊精是具有高度对称性的立体“截锥体”环形结构,其分子上亲水葡萄糖残基C6上的伯羟基和C2、C3上的仲羟基均排列在环外侧,疏水基C—H和C—O—C排列在环内侧,从而形成“内疏水、外亲水”的特殊结构[36]。该结构易与脂溶性多酚等形成包结物,改善多酚的理化性质,提高其水溶性和稳定性[37-38]。
β-环糊精与多酚结合的机理可能是β-环糊精空腔由于疏水作用促使高焓值水的释放而打破多酚溶液的相平衡,呈现出环糊精外部高能量内部低能量的状态,为维持相平衡,难溶水或水溶性低的多酚由高能区进入低能疏水空腔,直至达到新的相平衡,之后通过分子间氢键、环张力等形成多酚-β-环糊精结合物(图2)。
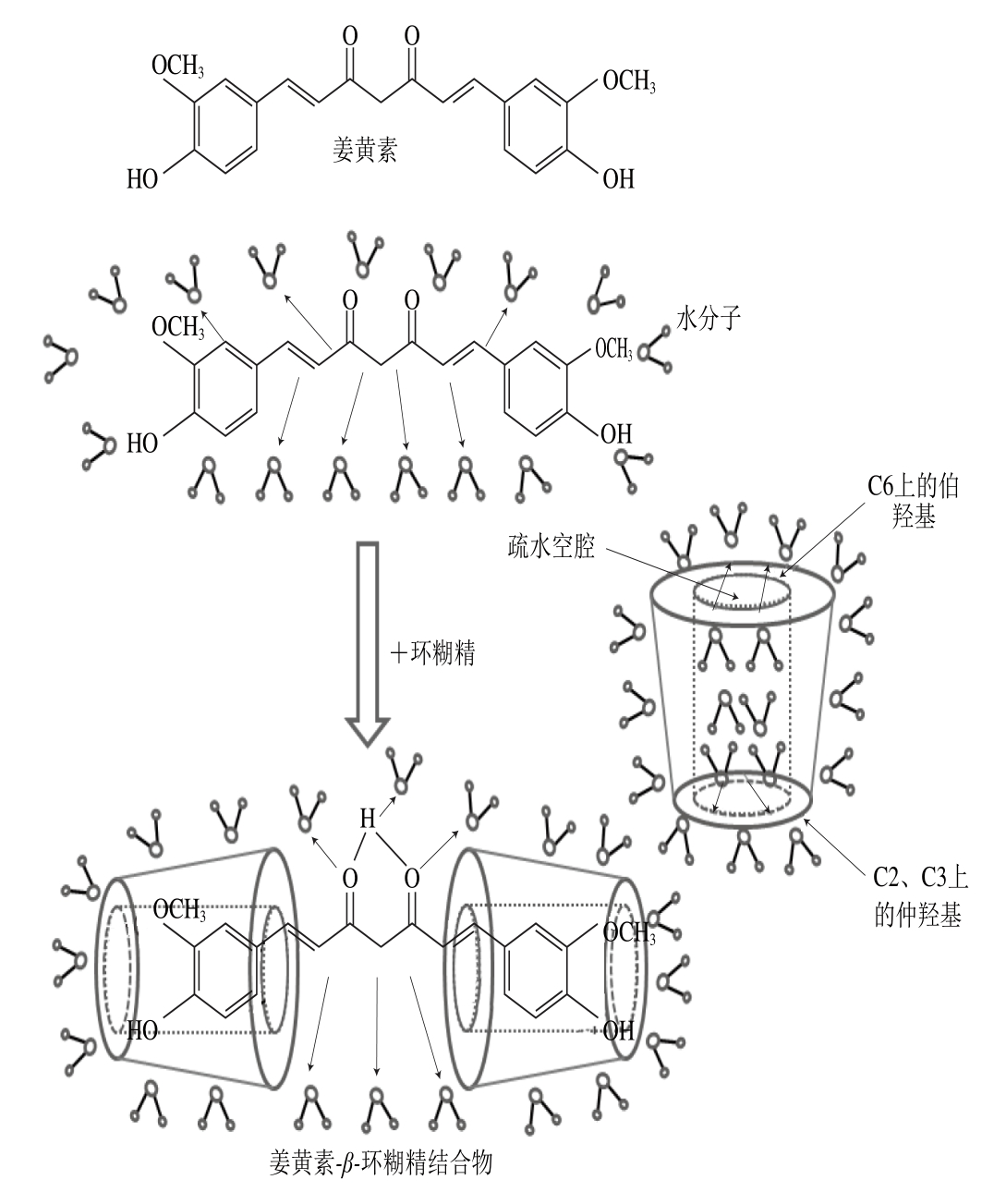
图2 姜黄素与β-环糊精的非共价结合过程[39]
Fig. 2 Non-covalent bonding interactions between curcumin and β-cyclodextrin[39]
细胞壁多糖的主要成分为纤维素、果胶,细胞壁多糖与多酚形成复合物的主要机制为果胶和纤维素分别通过离子相互作用和疏水相互作用结合。相互作用分两个阶段完成,依次为快速的初始阶段和慢速的扩展阶段[40]。在初始阶段一部分多酚先快速通过酰基等官能团与纤维素、果胶结合。在扩展阶段,随着时间的延长、多酚分子浓度的增加,结合位点也随之暴露,多糖逐步增加对多酚的结合[34]。Padayachee等[35]采用高效液相色谱(high performance liquid chromatography,HPLC)和电喷雾电离-液相色谱/质谱联用(electrospray ionization-liquid chromatography/mass spectrometry,ESI-LC/MS)分析研究柑橘果胶与花青素的结合机制,发现二者之间主要以离子作用和疏水相互作用直接结合或通过连接位点堆积结合。
2.1.2 非共价相互作用的影响因素
多酚和多糖之间的非共价相互作用因多酚和多糖的种类不同而有差异,这主要由多酚和多糖的结构特征以及物理化学参数决定的,其中结构特征包括聚合度、羟基化、甲基化、甲氧基化、酯化以及酰基化等,物理化学参数包括pH值、离子强度、温度以及溶剂等[41-42]。
2.1.2.1 多酚分子质量的影响
多酚分子质量大小是影响两者相互作用的重要因素,当多酚分子质量过大时,不利于多酚-多糖复合物的形成,在环糊精等包结主体中,当客体分子质量大时,其无法将客体全部包结,降低了多酚和多糖间的相互作用及其复合物的稳定性[43]。多酚分子质量增大,能够增强吸附能力,主要原因可能是随着分子质量的增加,产生多个形成氢键的邻位酚组和疏水相互作用的芳基环结合位点[42]。在果胶和原花青素的结合中,原花青素分子聚合度越大,两者间的亲和性越强,低聚合度的多酚分子更容易发生自交联,从而限制与多糖间的相互作用[44]。
多酚分子的构象甲基化、甲氧基化会降低对多糖分子的吸附能力,而酰基化却能增加对多糖分子的吸附,有研究表明羟基化作用有利于对低于3 个羟基基团的多酚的吸收,对于含有4 个及以上的羟基基团则相反[41]。多酚分子的灵活构象能促进聚合物氢键和疏水相互作用的形成。多酚分子构象的灵活性能够增加在主体分子中的位移,促使多酚与多糖之间的结合更加牢固[45-46]。羟基增多会增加分子间的空间位阻,不利于多酚与多糖的聚合,而且多酚与多糖两者间的聚合具有饱和效应,随着多酚浓度的增大,多糖分子的结合位点数量随之降低,当多酚浓度到一定程度时,多糖与多酚的结合达饱和,从而阻碍多糖与多酚的进一步结合。
2.1.2.2 多糖结构的影响
多糖的构象是一重要因素,经过甲基化、羟基化、羧基化等化学修饰的多糖更易于与多酚结合形成稳定的复合物,并发挥协同效应。经羟基化改性的葡聚糖较未改性的葡聚糖更易于与多酚结合形成稳定复合物[31]。甲基化程度越高的果胶,与原花青素间的疏水作用越强,结合时间也越长[44]。不同的多糖侧链,对多酚与多糖间的相互作用影响程度不同,具有中性糖侧链的果胶,其与多酚关联能力大小依次为:鼠李糖>阿拉伯聚糖+半乳聚糖Ⅰ+木糖半乳聚糖>半乳聚糖Ⅰ>阿拉伯聚糖+半乳聚糖Ⅱ>阿拉伯聚糖[27]。
不同的细胞壁多糖对多酚的选择性吸附能力不同,果胶对多酚的吸附效果显著优于木质纤维素对多酚的吸附效果[47]。Bourvellec等[48]研究发现多酚优先与细胞壁上的果胶结合,果胶酶的降解是影响果胶对多酚吸附力的重要因素。且细胞壁多糖经酶降解后,会减弱多酚和多糖分子间的相互作用,增加多酚分子的释放[49]。而果胶和纤维素两者复合能更好地发挥对多酚的吸附作用[50]。另外,不同的多糖能够竞争多酚-蛋白质络合物中的多酚,破坏蛋白质和多酚之间的分子缔合,并通过氢键和疏水相互作用形成多酚-多糖刚性聚集体[51-53]。
2.1.2.3 其他外界因素的影响
在多酚和多糖形成非共价化合物的过程中,温度和离子强度也是非共价相互作用的重要影响因素。随着温度的升高,两者间的相互作用越弱;但随着离子强度的增加,两者间的相互作用增强。可能是因为温度会削弱氢键作用,而离子强度会增加静电作用。pH 2.2~7.0之间时两者间的相互作用不受影响,加入尿素和乙醇等溶剂后相互作用减弱[42]。
2.2 多酚与多糖之间的共价相互作用
2.2.1 共价相互作用机制
随着对多糖与多酚间相互作用研究的逐渐深入,多糖与多酚间的共价相互作用逐渐引起了研究者的关注。多酚与多糖能够通过酶促、自由基诱导和碳二亚胺交等方法产生相互作用,其中两者氧化共价反应机理类似于多酚与蛋白质的邻醌机制[22]。
多酚与多糖的氧化结合机制主要分为两步,第一步是将多酚氧化成相应的醌类,多酚的氧化分为酶促氧化和自由基诱导两种方式:酶促氧化是在漆酶[54]或酪氨酸酶[55-56]作用下将多酚氧化成邻醌或半醌;自由基诱导是利用活性氧或羟自由基促使多酚氧化形成邻苯半醌[23,57];第二步是氧化生成的醌与多糖分子间发生希夫碱(Schiff base)反应或迈克尔加成(Michael addition)反应,最终生成C=N和C—N多酚-多糖共价复合物。另外,漆酶还可以诱导多酚与多糖间发生C—C偶联和C—O—C偶联,图3为漆酶诱导的咖啡酸与壳聚糖共价结合的邻醌机制[58]。

图3 漆酶诱导的壳聚糖与咖啡酸的共价反应推测机制[ 58]
58]
Fig. 3 Proposed functionalization mechanisms of chitosan with CA obtained by laccase catalyzed reactions[58]
碳二亚胺交联法共价结合机理是通过对多酚羧基的活化,促进与多糖分子羟基的酯化反应,从而生成多酚-多糖共价复合物[59-60]。
2.2.2 共价相互作用的影响因素
共价相互作用与酶、底物、蛋白质、pH值等有关,酶和蛋白质的存在能够加强多酚多糖间的共价相互作用,多酚和多糖能够通过氨基酸残基(—NH、—NH2)与蛋白质或酶形成三元共价复合物[29]。在不同pH值条件下,多酚和多糖间的结合强度不同,如在pH 6.5条件下,壳聚糖与没食子酸和咖啡酸更容易发生迈克尔加成和席夫碱反应[59]。酶还能降解果胶、纤维素等多糖,破坏多酚与多糖之间的相互作用,分解多酚-多糖共价复合物,促进多酚的释放。
多酚与多糖的相互作用对多酚的理化特性、功能特性及生物学特性均有明显影响。
3.1 对多酚生物利用率的影响
多糖与多酚的相互作用既能降低多酚的生物利用率,也可以增加其生物利用率。有研究表明,谷物纤维素会降低阿魏酸的生物利用率,原因可能是谷物纤维素中的阿拉伯木聚糖和木质素与阿魏酸发生交联[61],当谷物纤维素结构被破坏后,阿魏酸的生物利用率提高[62]。原花青素和膳食纤维相互作用可以减少多糖的发酵,增加原花青素的代谢[27,63]。体内研究发现,增加面包中多糖的含量能够显著增加人体对黄酮的吸收[64]。
3.2 对多酚理化特性的影响
多酚作为生物活性物质要求具有良好的溶解性与稳定性,但由于多酚化合物的低溶解性与稳定性而无法充分发挥其功能特性。因此,研究人员通过多糖包埋的方法来提高多酚的水溶性与稳定性。多酚-多糖复合物中由于多糖链的引入,多羟基的亲水特性可使得整个分子的溶解性显著提高。研究表明,通过多糖包埋的槲皮素、白藜芦醇、阿魏酸等多酚化合物的水溶性和稳定性显著提高[65-67]。而在含有多酚和蛋白质的食品中,多糖通过阻止多酚与蛋白质的缔合,从而改变蛋白-单宁聚合物的溶解特性。同时有研究证实果胶的添加能改善饮料和酒的色泽及稳定性,主要是通过改变蛋白-单宁聚合物的溶解特性实现的[68-69]。
3.3 对多酚功能特性的影响
多酚、多糖相互作用能够提高多酚抗氧化活性、预防心血管疾病、抗肿瘤、抑菌等功能特性。多糖与白藜芦醇、原花青素、咖啡酸、儿茶素等多酚混合后具有协同多酚抗氧化的效果[70-71]。壳聚糖槲皮素共价复合物和壳聚糖单宁酸共价复合物,由于具有抑菌作用的壳聚糖的接枝增强了多酚对单增李斯特菌和大肠杆菌等食源性致病菌的生长抑制作用[54]。而经麦芽糊精包埋的绿茶多酚较未包埋的绿茶多酚预防心血管疾病的效果更好[72]。Kale等[73]制备的槲皮素环糊精包合物不但可以降低老鼠黑素瘤内肿瘤,还能够抑制人类白血病和子宫颈癌细胞的增殖,原因可能是环糊精对槲皮素的增溶效果,减少了槲皮素的结晶,使槲皮素功能特性有效发挥。运用酪氨酸酶制备的多糖-多酚共价复合物较单独多酚化合物的抗氧化活性更强,可能是由于多酚的结构发生改变导致的[55-56]。
食品加工过程中,多酚和多糖因接触发生相互作用不可避免,近年来,对多酚与多糖之间相互作用的研究也日渐增多,但由于检测技术的局限性,某些多酚、多糖分子结构的未知性,分子间相互作用的复杂性,使得对两者之间相互作用机制的研究进展缓慢,多数仍停留在某些常见的多酚和多糖的氢键、疏水、静电等非共价相互作用上,而对多酚-多糖共价复合物的制备条件、相互作用的影响因素以及相互作用机制的了解还不够全面,对其结合位点以及连接方式仍需进一步深入研究。此外,多酚与多糖之间的相互作用能够改善多酚的理化特性、功能特性及生物学特性,并将其广泛应用于食品工业、医药、化妆品等领域,但如何合理利用两者之间的相互作用,确保在不破坏食品品质的基础上,充分发挥多酚的功能特性仍是值得探讨的话题。
参考文献:
[1] 魏子淏. 乳蛋白-EGCG和壳聚糖-绿原酸复合物的制备、结构表征及功能评价[D]. 北京: 中国农业大学, 2015: 15-16.
[2] FRAGA C G, GALLEANO M, VERSTRAETEN S V, et al. Basic biochemical mechanisms behind the health benefits of polyphenols[J]. Molecular Aspects of Medicine, 2010, 31(6): 435-445. DOI:10.1016/ j.mam.2010.09.006.
[3] PAPANDREOU M, DIMALKOPOULOU A, LINARDAKIL Z P, et al. Effect of a polyphenol-rich wild blueberry extract on cognitive performance of mice, brain antioxidant markers and acetylcholinesterase activity[J]. Behavioural Brain Research, 2009, 198(2): 352-358. DOI:10.1016/j.bbr.2008.11.013.
[4] RODRIGO R, MIRANDA A, VERGARA L. Modulation of endogenous antioxidant system by wine polyphenols in human disease[J]. Journal of Education Policy, 2010, 16(6): 585-595. DOI:10.1016/j.cca.2010.11.034.
[5] BRAVO L. Polyphenols: chemistry, dietary sources, metabolism and nutritional significance[J]. Nutrition Reviews, 1998, 56(11): 317-333. DOI:10.1111/j.1753-4887.1998.tb01670.x.
[6] HUSAIN S R, CILLARD J, CILLARD P. Hydroxyl radical scavenging activity of flavonoids[J]. Phytochemistry, 1987, 26(9): 2489-2491. DOI:10.1016/S0031-9422(00)83860-1.
[7] PROCHAZKOVA D, BOUSOVA I, WILHELMOVA N. Antioxidant and prooxidant properties of flavonoids[J]. Fitoterapia, 2011, 82(4): 513-523. DOI:10.1016/j.fitote.2011.01.018.
[8] WANG H, JOSEPH J A. Structure-activity relationships of quercetin in antagonizing hydrogen peroxide-induced calcium dysregulation in PC12 cells[J]. Free Radical Biology and Medicine, 1999, 27(5/6): 683-694. DOI:10.1016/S0891-5849(99)00119-7.
[9] 赵静, 李玉琴, 王芳乔, 等. 6 种黄酮类化合物清除超氧阴离子自由基能力及其构效关系[J]. 中国医药导报, 2014, 11(29): 7-10.
[10] HABTEMARIAM S. Flavonoidsas inhibitorsorenhances of the cytotoxicity of tumornecrosis factor-α in L-929 tumor cells[J]. Journal of Natural Products, 1997, 60(8): 775-778. DOI:10.1021/np960581z.
[11] JOYEUX M, LOBSTEIN A, ANTON R, et al. Comparative antilipoper oxidant, antinecrotic and scravenging properties of terpanes and bilavones from Ginkgo and flavonoids[J]. Planta Medica, 1995, 61(2): 126-129. DOI:10.1055/s-2006-958030.
[12] ZHANG C F. The separation and structure-activity relationship research progress of flavone glycosides[J]. Contemporary Medicine, 2012, 18(14): 14. DOI:10.3969/j.issn.1009-4393.2012.14.102.
[13] XIANG Y, SUN M, WANG H Y. The function of COX-2 and its inhibitors in tumor prevention and treatment[J]. Chinese Bulletin Life Science, 2008, 20: 81-84. DOI:10.3969/j.issn.1004-0374.2008.01.013.
[14] LI Y D, CHRISTOPHER M F, CHEN M H, et al. Primary virtual and in vitro bioassay screening of natural inhibitors from flavonoid sagainst COX-2[J]. Chinese Journal Natural Medicines, 2011, 9(2): 156-160. DOI:10.3724/SP.J.1009.2011.00156.
[15] GAO H, KAWABATA J. α-Glucosidase inhibition of 6-hydroxyflavones. Part 3: synthesis and evaluation of 2,3,4-trihydroxy-benzoylcontaining flavonoid analogs and 6-amino flavones as α-glucosidase inhibitors[J]. Bioorganic Medicinal Chemistry, 2005, 13: 1661-1671. DOI:10.1016/j.bmc.2004.12.010.
[16] MORA A. Structure-activity relationship of polymethoxy flavones and other flavonoids as inhibitors of non-enzymic lipid peroxidation[J]. Biochemical Pharmacology, 1990, 40(4): 793-797. DOI:10.1016/0006-2952(90)90317-E.
[17] LEVER R, LO W T, FRARIDOM M, et al. Size-fractionated heparins have differential effects on human neutrophil function in vitro[J]. British Journal of Pharmacology, 2007, 151(6): 837-843. DOI:10.1038/ sj.bjp.0707298.
[18] YE H, WANG K Q, ZHOU C H, et al. Purification, antitumor and antioxidant activities in vitro of polysaccharides from the brown seaweed Sargassumpallidum[J]. Food Chemistry, 2008, 111(2): 428-432. DOI:10.1016/j.foodchem.2008.04.012.
[19] OLAFSDOTTIR E S, INGOLFSDOTTIR K. Polysaccharides from lichens: structural characteristics and biological activity[J]. Planta Medica, 2001, 67(3): 199-208. DOI:10.1055/s-2001-12012.
[20] VERKATPURWAR V, POKHARKAR V. Green synthesis of silver nanoparticles using marine polysaccharide: study of in vitro antibacterial activity[J]. Materials Letters, 2011, 65(6): 999-1002. DOI:10.1016/j.matlet.2010.12.057.
[21] ARAUJO I W F D, RODRIGUES J A G, COURA C O, et al. Effects of a sulfated polysaccharide isolated from the red seaweed Solieria fi liformis on models of nociception and inflammation[J]. Carbohydrate Polymers, 2011, 86(3): 1207-1215. DOI:10.1016/ j.carbpol.2011.06.016.
[22] KOLODZIEJCZYK-CZEPAS J, BIJAK M, SALUK J, et al. Radical scavenging and antioxidant effects of Matricaria chamomilla polyphenolic-polysaccharide conjugates[J]. International Journal of Biological Macromolecules, 2015, 72: 1152-1158. DOI:10.1016/ j.ijbiomac.2014.09.032.
[23] LEE D S, WOO J Y, AHN C B, et al. Chitosan-hydroxycinnamic acid conjugates: preparation, antioxidant and antimicrobial activity[J]. Food Chemistry, 2014, 148: 97-104. DOI:10.1016/j.foodchem.2013.10.019.
[24] 李星亚, 汪东风, 王林戈, 等. 茶多糖和茶多酚对糖尿病的协同防治作用[J]. 食品研究与开发, 2013, 34(11): 72-76. DOI:10.3969/ j.issn.1005-6521.2013.11.019.
[25] PAWLACZYK I, CZERCHAWSKI L. Polyphenolic-polysaccharide compounds from selected medicinal plants of asteraceae and rosaceae families: chemical characterization and blood anticoagulant activity[J]. Carbohydrate Polymers, 2009, 77(3): 568-575. DOI:10.1016/ j.carbpol.2009.01.030.
[26] 陈金娥, 张海容. 红茶、绿茶和乌龙茶多糖及多酚对DNA的保护作用研究[J]. 分子科学学报, 2011, 27(6): 407-409. DOI:10.3969/ j.issn.1000-9035.2011.06.008.
[27] WATRELOT A A, BOURVELLEC C L, IMBERTY A, et al. Neutral sugar side chains of pectins limit interactions with procyanidins[J]. Carbohydrate Polymers, 2014, 99(1): 527-536. DOI:10.1016/ j.carbpol.2013.08.094.
[28] 陶永元, 舒康云, 吴加美, 等. 茶多酚与壳聚糖复配对草莓保鲜效果的影响[J]. 中国食品添加剂, 2012(5): 224-226. DOI:10.3969/ j.issn.1006-2513.2012.05.030.
[29] 张曼, 王岸娜, 吴立根, 等. 蛋白质、多糖和多酚间相互作用及研究方法[J]. 粮食与油脂, 2015(4): 42-46. DOI:10.3969/ j.issn.1008-9578.2015.04.012.
[30] BOUWELLEC C L, RENARD C. Interactions between polyphenols and macromolecules: quantification methods and mechanisms[J]. Critical Reviews in Food Science and Nutrition, 2012, 52(1/2/3): 213-248. DOI:10.1080/10408398.2010.499808.
[31] SIMONSEN H, NIELSEN M, CHRISTENSEN N, et al. Molecular interactions between barley and oat β-glucans and phenolic derivatives[J]. Journal of Agricultural and Food Chemistry, 2009, 57(5): 2056-2064. DOI:10.1021/jf802057v.
[32] WU Z, MING J, GAO R P, et al. Characterization and antioxidant activity of the complex of tea polyphenols and oat β-glucan[J]. Journal of Agricultural and Food Chemistry, 2011, 59(19): 1073-1074. DOI:10.1021/jf202722w.
[33] RENARD C M, BARON A, GUYOT S, et al. Interactions between apple cell walls and native apple polyphenols: quantification and some consequences[J]. International Journal of Biological Macromolecules, 2001, 29(2): 115-25. DOI:10.1016/S0141-8130(01)00155-6.
[34] PADAYACHEE A, NETZAL G, NETZEL M, et al. Binding of polyphenols to plant cell wall analogues-Part 1: anthocyanins[J]. Food Chemistry, 2012, 134(1): 155-161. DOI:10.1016/ j.foodchem.2012.02.082.
[35] PADAYACHEE A, NETZAL G, NETZEL M, et al. Binding of polyphenols to plant cell wall analogues-Part 2: phenolic acids[J]. Food Chemistry, 2012, 135(4): 2287-2292. DOI:10.1016/ j.foodchem.2012.07.004.
[36] SZEJTLI J. Introduction and ceneral overview of cyclodextrin chemistry[J]. Chemical Review, 1998, 98(5): 1743-1754. DOI:10.1021/cr970022c.
[37] BAGLOLE K N, BOLAND P G, WAGNER B D. Fluorescence enhancement of curcumin upon inclusion into parent and modified cyclodextrins[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2005, 173(3): 230-237. DOI:10.1016/ j.jphotochem.2005.04.002.
[38] MEJRI M, SOUISSI A B, AROULMOJI V. Hydration and selfassociation of caffeine molecules in aqueous solution: comparative effects of sucrose and β-cyclodextrin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2009, 73(1): 6-10. DOI:10.1016/j.saa.2009.01.009.
[39] ASTRAY G, GONZALEZ-BARREIRO C, MEJUTO J C, et al. A review on the use of cyclodextrins in foods[J]. Food Hydrocolloids, 2009, 23(7): 1631-1640. DOI:10.1016/j.foodhyd.2009.01.001.
[40] JAKOBERK L. Interactions of polyphenols with carbohydrates, lipids and proteins[J]. Food Chemistry, 2015, 175: 556-567. DOI:10.1016/ j.foodchem.2014.12.013.
[41] WANG Y X, LIU J, CHEN F, et al. Effects of molecular structure of polyphenols on their noncovalent interactions with oat β-glucan[J]. Journal of Agricultural and Food Chemistry, 2013, 61(19): 4533-4538. DOI:10.1021/jf400471u.
[42] LE B C, GUYOT S, RENARD C M. Non-covalent interaction between procyanidins and apple cell wall material: Part I. Effect of some environmental parameters[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2004, 1672(3): 192-202. DOI:10.1016/ j.bbagen.2004.04.001.
[43] TEREKHOVA I V, TIKHOVA M N, VOLKOVA T V, et al. Inclusion complex formation of α- and β-cyclodextrins with riboflavin and alloxazine in aqueous solution: thermodynamic study[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2011, 69(1/2): 167-172. DOI:10.1007/s10847-010-9827-z.
[44] WATRELOT A A, BOURVELLEC C L, IMBERTY A, et al. Interactions between pectic compounds and procyanidins are influenced by methylation degree and chain length[J]. Biomacromolecules, 2013, 14(3): 709-718. DOI:10.1021/bm301796y.
[45] McMANUS J P, DAVIS K, BEAM J E, et al. Polyphenol interactions: Part I. Introduction; some observation on the reversible complexation of polyphenols with proteins and polysaccharides[J]. Journal of the Chemical Society Perkin Transactions, 1985, 9(9): 1429-1438. DOI:10.1039/P29850001429.
[46] DEFREITAS V, MATEUS M. Structural features of procyanidin interactions with salivary proteins[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 940-945. DOI:10.1021/jf000981z.
[47] RUIZ-GARCIA Y, SMITH P A, BINDON K A. Selective extraction of polysaccharide affects the adsorption of proanthocyanidin by grape cell walls[J]. Carbohydrate Polymers, 2014, 114: 102-114. DOI:10.1016/j.carbpol.2014.07.024.
[48] BOURVELLEC C L, GUYOT S, RENARD C M G C. Interactions between apple (Malus × domestica Borkh.) polyphenols and cell walls modulate the extractability of polysaccharides[J]. Carbohydrate Polymers, 2009, 75(2): 251-261. DOI:10.1016/j.carbpol.2008.07.010.
[49] PINELO M, ARNOUS A, MEYER A S. Upgrading of grape skins: significance of plant cell-wall structural components and extraction techniques for phenol release[J]. Trends in Food Science and Technology, 2006, 17(11): 579-590. DOI:10.1016/j.tifs.2006.05.003.
[50] AGODA-TANDIAWA G, DURAND S, GAILLARD C, et al. Properties of cellulose/pectins composites: implication for structural and mechanical properties of cell wall[J]. Carbohydrate Polymers, 2012, 90(2): 1081-1091. DOI:10.1016/j.carbpol.2012.06.047.
[51] MILAGRO M, ANH V, TERRI B, et al. Location and quantification of biological foulants in a wet membrane structure by cross-sectional confocal laser scanning microscopy[J]. Journal of Membrane Science, 2014, 453(1): 282-291. DOI:10.1016/j.memsci.2013.11.011.
[52] 綦菁华, 蔡同一, 庞美霞, 等. 影响蛋白质-酚类聚合物形成的因素研究[J]. 中国食品学报, 2009, 9(6): 78-82. DOI:10.3969/ j.issn.1009-7848.2009.06.013.
[53] THONGKAEW C, GIBIS M, HINRICHS J, et al. Polyphenol interactions with whey protein isolate and whey protein isolate-pectincoacervates[J]. Food Hydrocolloids, 2014, 41: 103-112. DOI:10.1016/ j.foodhyd.2014.02.006.
[54] BOZIC M, GORGIEVA S, KOKOL V, et al. Homogeneous and heterogeneous methods for lactase-mediated functionalization of chitosan by tannic acid and quercetin[J]. Carbohydrate Polymers, 2012, 89(3): 854-864. DOI:10.1016/j.carbpol.2012.04.021.
[55] CHEN T H, KUMAR G, HARRIS M T, et al. Enzymatic grafting of hexyloxyphenol onto chitosan to alter surface and rheological properties[J]. Biotechnology and Bioengineering, 2000, 70(5): 564-573. DOI:10.1002/1097-0290(20001205)70:5<564::AIDBIT11>3.0.CO;2-N.
[56] SOUSA F, GUEBITZ G M, KOKOL V, et al. Antimicrobial and antioxidant properties of chitosan enzymatically functionalized with favonoids[J]. Process Biochemistry, 2009, 44(7): 749-756. DOI:10.1016/j.procbio.2009.03.009.
[57] CURCIO M, PUOCI F, TEMMA F, et al. Covalent insertion of antioxidant molecules on chitosan by a free radical grafting procedure[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5933-5938. DOI:10.1021/jf900778u.
[58] BOZIC M, GORGIEVA S, KOKOL V, et al. Lactase-mediated functionalization of chitosan by caffeic and gallic acids for modulating antioxidant and antimicrobial properties[J]. Carbohydrate Polymers, 2012, 87(4): 2388-2398. DOI:10.1016/j.carbpol.2011.11.006.
[59] AYTEKIN A O, MORIMURA S, KIDA K. Synthesis of chitosancaffeic acid derivatives and evaluation of their antioxidant activities[J]. Journal of Bioscience and Bioengineering, 2011, 111(2): 212-216. DOI:10.1016/j.jbiosc.2010.09.018.
[60] PASANPHAN W, BUETTNER G R, CHIRACHANCHAI S. Chitosan gallate as a novel potential polysaccharide antioxidant: an EPR study[J]. Carbohydrate Research, 2013, 345(1): 132-140. DOI:10.1016/j.carres.2009.09.038.
[61] ADAM A, CRESPY V, LEVRAT-VERNEY M A, et al. The bioavailability of ferulic acid is governed primarily by the food matrix rather than its metabolism in intestine and liver in rats[J]. The Journal of Nutrition, 2002, 132(7): 1962-1968.
[62] ZHENG Y, HAWORTH I S, ZUO Z, et al. Physicochemical and structural characterization of quercetin-β-cyclodextrin complexes[J]. Journal of Pharmaceutical Sciences, 2005, 94(5): 1079-1089. DOI:10.1002/jps.20325.
[63] SERRA A, MACIA A, ROMERO M P, et al. Bioavailability of procyanidin dimers and trimers and matrix food effects in in vitro and in vivo models[J]. British Journal of Nutrition, 2010, 103(7): 944-952. DOI:10.1017/S0007114509992741.
[64] SCHRAMM D D, KARIM M, SCHRADER H R, et al. Food effects on the absorbtion and pharmacohinetics of cocoa flavanols[J]. Life Sciences, 2003, 73(7): 857-869. DOI:10.1016/S0024-3205(03)00373-4.
[65] JULLIAN C, MOYANO L, YARIEZ C, et al. Complexation of quercetin with three kinds of cyclodextrins: an antioxidant study[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2007, 67(1): 230-234. DOI:10.1016/j.saa.2006.07.006.
[66] WANG J, CAO Y P, SUN B G, et al. Characterisation of inclusion complex of transferulic acid and hydroxypropyl-β-cyclodextrin[J]. Food Chemistry, 2011, 124(3): 1069-1075. DOI:10.1016/ j.foodchem.2010.07.080.
[67] LU Z, CHENG B, HU Y L, et al. Complexation of resveratrol with cyclodextrins: solubility and antioxidant activity[J]. Food Chemistry, 2009, 113(1): 17-20. DOI:10.1016/j.foodchem.2008.04.042.
[68] FREITAS V D, CARVALHO E, MATEUS N. Study of carbohydrate influence on protein-tannin aggregation by nephelometry[J]. Food Chemistry, 2002, 81(4): 503-509. DOI:10.1016/S0308-8146(02)00479-X. [69] 赵光远, 刁华娟, 荆利强, 等. 果胶对果胶-麦醇溶蛋白-儿茶素模拟体系稳定性的影响[J]. 食品科学, 2011, 32(18): 68-71.
[70] BAI H N, WANG Z Y, ZHANG H, et al. Study on synergistic effect of polyphenols and an auricularia auricular polysaccharides combination on antioxidant activity[J]. Science and Technology of Food Industry, 2013, 34(22): 123-124. DOI:10.13386/j.issn1002-0306.2013.22.023.
[71] BAI H N, WANG Z Y, LI H et al. Effect of five berry polyphenols and auricularia auricular polysaccharides combination on radiation protection[J]. Science and Technology of Food Industry, 2013, 34(16): 113-117. DOI:10.13386/j.issn1002-0306.2013.16.026.
[72] JUNG M H, SEONG P N, KIM M H, et al. Effect of green tea extract microencapsulation on hypertriglyceridemia and cardiovascular tissues in high fructose-fed rats[J]. Nutrition Research and Practice, 2013, 7(5): 366-372. DOI:10.4162/nrp.2013.7.5.366.
[73] KALE R, SARAF M, JUVEKA A, et al. Decreased B16F10 melanoma growth and impaired tumour vascularization in BDF1 mice with quercetin-cyclodextrin binary system[J]. Journal of Pharmacy & Pharmacology, 2006, 58(10): 1351-1358. DOI:10.1211/ jpp.58.10.0008.
Interaction Mechanism between Polyphenols and Polysaccharides and Effect on Polyphenolic Properties: A Review
WANG Liying1, LI Fuxiang1, YANG Yaxuan1, TANG Yu1, LI Yao1, SHI Fang1, MING Jian1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Chongqing Engineering Research Center of Regional Foods, Chongqing 400715, China)
Abstract:As increasing research efforts have been made on the nutritional and functional properties of polyphenols and polysaccharides, the interaction between polyphenols and polysaccharides and the underlying mechanism have aroused extensive interest in the food field. This article is aimed to review the non-covalent and covalent interactions between polyphenols and polysaccharides and the underlying mechanisms, the factors affecting these interactions, and their effects on the physicochemical and functional properties of polyphenols. Meanwhile, the prospects for future applications of the interactions in food processing are discussed.
Key words:polyphenols; polysaccharides; interaction; interaction mechanism
DOI:10.7506/spkx1002-6630-201711044
中图分类号:R282.7
文献标志码:A
文章编号:1002-6630(2017)11-0276-07引文格式:
收稿日期:2016-08-13
基金项目:“十三五”国家重点研发计划重点专项(2016YFD0400203-2);国家自然科学基金面上项目(31471576;31271825)
作者简介:王丽颖(1993—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:1617191435@qq.com
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com