朱明明1,樊明涛2,何鸿举1,*
(1.河南科技学院食品学院,河南 新乡 453003;2.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘要:类胡萝卜素是一类由植物和某些光合微生物产生的亲脂性异戊二烯类色素,广泛存在于自然界中。根据其种类和化学键断裂位置不同,可生成多种在生物体内有重要功能的衍生物,包括类维生素A、色素、植物激素和香气物质。目前,类胡萝卜素的降解方式有多种,如物理降解、化学降解和生物降解等,其中生物降解又分为特异性酶降解和非特异性酶降解。本文对类胡萝卜素降解产物的种类和功能进行介绍,并对其降解方式进行全面综述,重点阐述生物降解的优势,对特异性酶和非特异性酶及其作用位点进行详细介绍,指出筛选高活性类胡萝卜素降解酶及其在食品加工工业上的应用为今后研究的方向。
关键词:类胡萝卜素;降解产物;降解途径;生物酶;微生物
朱明明, 樊明涛, 何鸿举. 类胡萝卜素降解方式的研究进展[J]. 食品科学, 2017, 38(11): 308-317. DOI:10.7506/spkx1002-6630-201711048. http://www.spkx.net.cn
ZHU Mingming, FAN Mingtao, HE Hongju. Advances in methods for the degradation of carotenoids[J]. Food Science, 2017, 38(11): 308-317. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711048. http://www.spkx.net.cn
类胡萝卜素是一类由植物和某些光合微生物生成的呈红色、橘黄色或者黄色的亲脂性异戊二烯类色素,一般在波长300~600 nm之间有吸收峰[1]。在自然界中已鉴定出天然类胡萝卜素的种类超过700 种,广泛存在于食物中,如蔬菜、水果和海鲜。由于种类繁多,所以分类方式也有多种。若类胡萝卜素按长链C原子数量分类可分为:C30、C40、C50三大类,其中绝大部分类胡萝卜素是C40类,而在甲基杆菌和葡萄球菌等细菌中会产生一些C30类[2]。若类胡萝卜素按长直链含有六元环的数目分类可分为:番茄红素的直链类、β-阿朴-8’-胡萝卜醛的单环类以及β-胡萝卜素的双环类胡萝卜素。如按照构成元素可分为两大类:一类是由C、H两种元素组成的环状或非环状结构的化合物,将其称为胡萝卜素类,这类化合物极性较小,典型代表为β-胡萝卜素和番茄红素;一类是由C、H、O三大元素构成的化合物,称之为含氧类胡萝卜素,分子中含有氧原子,可形成羟基、甲氧基、羰基和环氧化物等[3],极性较大,典型代表为叶黄素类[2,4]。
在自然状态下,类胡萝卜素的典型结构特点是高度不饱和,其最显著特征为含有3~15 个共轭双键[5],共轭双键存在的位置决定类胡萝卜素的功能特性,包括在光合生物中可起到光吸收和光保护的作用[6-7];可作为细胞膜的抗氧化保护剂[8];具有抗氧化和抗癌特性[6,9-10];对眼睛具有保护功能等[11-12]。但类胡萝卜素除上述功能外,还可作为一些派生物的重要底物。根据类胡萝卜素种类和降解位点、降解方式的不同,可生成多种衍生物,其在生物体中具有重要的功能,如可作为维生素、植物激素及芳香类化合物等。因此利用类胡萝卜素降解生成活性物质,尤其是香气物质已经成为近年来食品、果酒、化妆品等学科的研究热点之一。本文简要介绍类胡萝卜素降解产物的种类与功能,并重点对类胡萝卜素的降解方式进行综述,以期揭示类胡萝卜素的降解机理、类胡萝卜素的代谢途径,并为类胡萝卜素更加合理、高效地应用于食品加工业提供一定的参考。
类胡萝卜素根据其种类和化学键断裂位置的不同,可生成多种衍生物,其在生物体中具有重要的功能,如可作为维生素、色素、植物激素及芳香类化合物等[13]。1.1 类维生素A
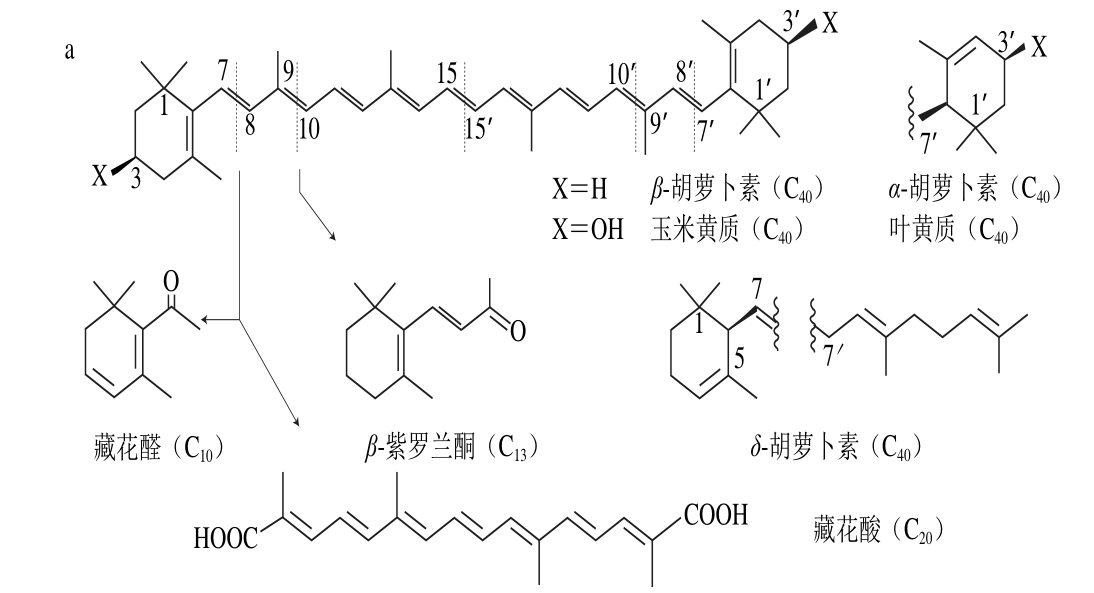
类维生素A是一类重要的类胡萝卜素降解产物,由含有一个及以上β-末端基团的C40类胡萝卜素或含足够长的异戊二烯链的阿朴类胡萝卜素(如β-阿朴-8’-胡萝卜醛和β-阿朴-10’-胡萝卜醛)在C15—C15’双键位置断裂生成的化合物[13],如图1a、d[14]所示。

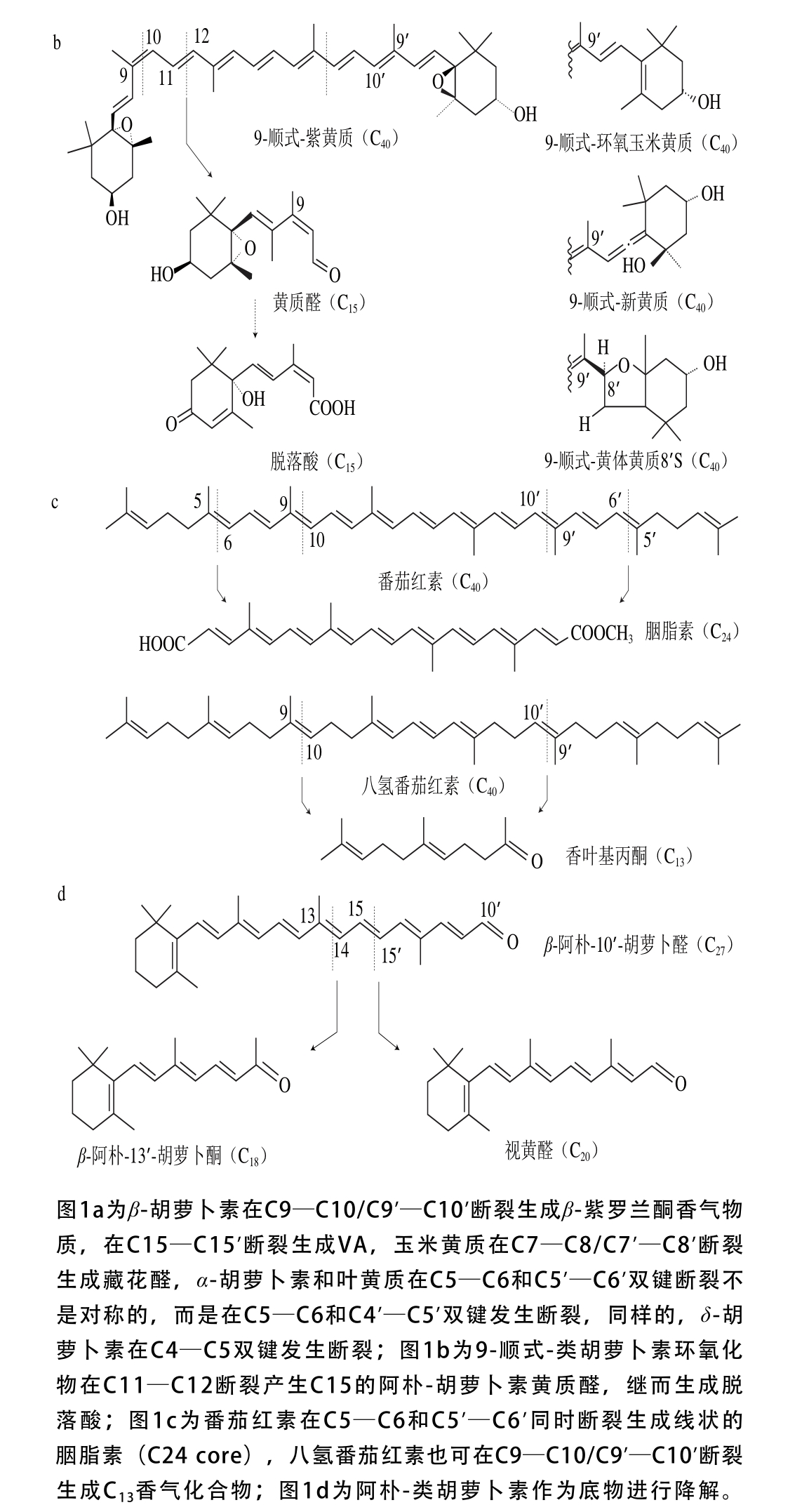
图1 类胡萝卜素底物的断裂位置及其对应生成的产物[14]
Fig. 1 Educts, products and cleavage positions of the substrates[14]
VA在脊椎动物及细菌的视循环中有着至关重要的作用,可促进感光蛋白视紫红质的形成[15]。在脊椎动物中,其他的类维生素A如(3,4)-二脱氧VA、(3R)-3-OH-VA、(3S)-3-OH-VA、(4R)-4-OH-VA等也可作为视循环中的发色团[16]。当类维生素A含量不足时,会引发视力障碍、角膜软化及夜盲症等疾病[17]。所有的反式视黄醇可氧化为反式视黄酸,从而转化为9-顺式异构体,这类物质是核视黄酸和视黄酸X的重要组成成分,因此在免疫缺陷病及癌症治疗中有着重要的作用[18-19]。
另外,类维生素A还可促进食物中铁元素的吸收,并保持正常的上皮组织形态和功能,使皮肤保持湿润,避免粗糙、干燥及毛囊角质化[20]。
1.2 色素
若类胡萝卜素降解产物保留有较多的共轭双键,则这类阿朴-类胡萝卜素可保有原类胡萝卜素色素的性质。如藏红花呈现出亮橘红色的原因主要是:1)C20阿朴-类胡萝卜素藏花酸可降解生成配糖体(图1a);2)C24阿朴-类胡萝卜素胭脂素可生成橘红色的胭脂红(图1c)[21]。番茄红素在C5—C6和C5’—C6’双键位置同时断裂是合成色素胭脂素的第一步。所以从胭脂树(Bixa orellana)种子中提取的胭脂素可广泛用作食品和化妆品的色素添加剂。
1.3 植物激素
类胡萝卜素氧化降解生成的多种阿朴-类胡萝卜素中,有些可作为调节植物生长的激素[22]。目前研究最多的是脱落酸(abscisic acid,ABA),由9-顺式环氧类胡萝卜素氧化降解生成。如图1b所示,9-顺式环氧类胡萝卜素在C11—C12氧化降解生成黄质醛,这是合成脱落酸的第一步也是关键的步骤,然后黄质醛被氧化生成一种酮,继而转变为ABA-醛,最终氧化形成ABA[23]。脱落酸在植物生长过程中有极其重要的作用,除了能够诱导植物休眠、促进种子中贮藏蛋白的合成、促进光合产物运往发育的种子等功能外,在植物抗旱、糖感应等方面也有着重要的调节作用[24]。
另外,已有研究表明反式类胡萝卜素降解生成的阿朴-类胡萝卜素在调控顶端优势中有重要的作用[25]。在拟南芥(Arabidopsis thaliana)的突变体中发现了两类新型类胡萝卜素降解酶,分别是类胡萝卜素加双氧酶7(carotenoid cleavage dioxygenase 7,CCD7)和CCD8,可催化类胡萝卜素降解生成一种抑制分枝发育的阿朴-类胡萝卜素,即独脚金内酯[26]。
1.4 降异戊二烯类香气物质
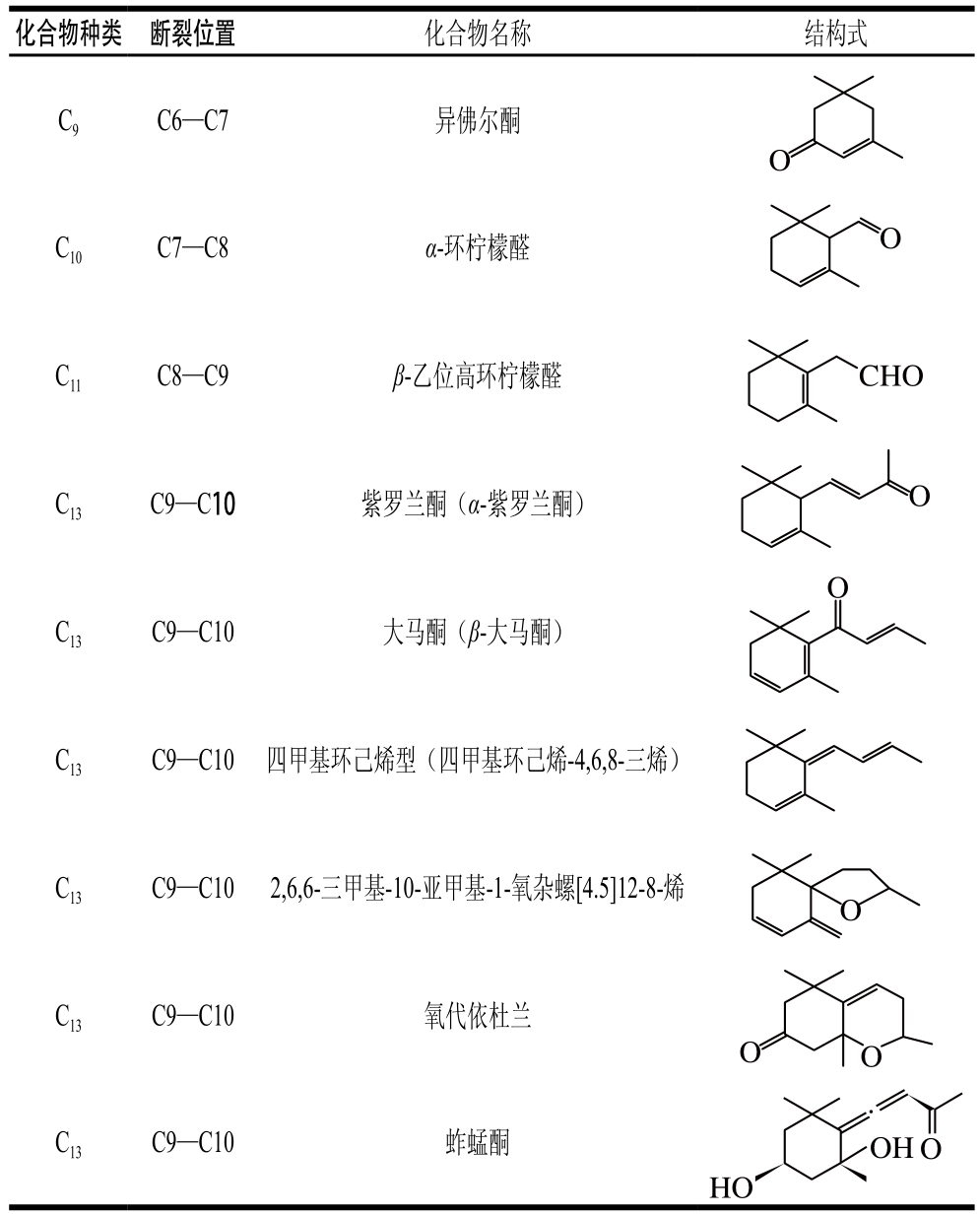
类胡萝卜素氧化降解生成的另一类重要产物是C9~C13类的降异戊二烯香气物质。这种降解的途径主要有:1)直接氧化裂解;2)先形成糖基化的中间产物,再水解。根据类胡萝卜素化学键断裂位置的不同,可生成多种含碳数不同的香气物质,具体如表1所示。其中类胡萝卜素在C9—C10/C9’—C10’双键位置降解生成的C13类的类胡萝卜素衍生物(图1a、c),由于在水中有极低的香气阈值及特殊的香气特征而成为茶叶、葡萄、玫瑰、洋葱及果酒香气物质必不可少的成分[28-29],同时也成为食品和化妆品中最具潜力的商业添加剂。如Bolt等[30]首次在玫瑰精油中检测到β-大马酮,接着Kotseridis等[31]在葡萄和葡萄酒中也检测到该化合物的存在。β-大马酮呈现出热带水果的香气和花香,存在于所有葡萄品种中,是形成葡萄酒香气的重要的降异戊二烯化合物。而β-紫罗兰酮于1929年首次被发现,随后有研究表明在白葡萄酒中也存在此化合物[32],呈现典型的紫罗兰香,阈值极低,是果酒香气的重要物质。环柠檬醛则是由类胡萝卜素在C7—C8/C7’—C8’双键位置断裂生成的,是合成香料最重要的中间物质之一[33]。而类胡萝卜素在C6—C7/C6’—C7’双键位置断裂可生成异氟尔酮类香气物质,典型代表是2,2,6-三甲基环己酮,在水中的阈值为44.3 μg/L,具有岩蔷薇脂的特殊香味[34]。类胡萝卜素降解生成的降异戊二烯化合物及其衍生物是形成果酒香气的重要物质,与其他挥发性化合物共同作用可显著影响果酒的香气品质。
已有研究表明,C13类的类胡萝卜素衍生物不仅具有特殊香味,还具有对人体有益的生物活性功能,如β-紫罗兰酮可抑制癌细胞、调控癌细胞的增殖,并具有降血脂等功能[35-36]。
表1 C
[27]
—C异戊二烯类化合物断裂位置及其典型代表和化学结构式
913
Table 1 Number of carbon atoms, cleavage positions, examples, and chemical structures of C—Cnorisoprenoids[27]913
由于从植物中直接提取上述活性物质,尤其是香气物质,其工序繁琐、成本高且含量极低[37],故而越来越多的人们关注研究类胡萝卜素的降解方式。类胡萝卜素易受光照、温度、氧气等影响,所以类胡萝卜素的降解方式有多种,可分为物理降解[38]、化学降解[39]和生物降解[40]。
2.1 物理降解
图2 β-胡萝卜素在加热过程中形成香气物质和非香气物质的反应顺序[38]
Fig. 2 Reaction sequence for the formation of nonvolatile and volatile compounds during heating of β-carotene[38]
物理降解主要包括光降解和热降解。由于在大多数的食品加工中光降解是不可避免的,也无法控制,所以研究光降解途径意义不大,在此不多做赘述。而热降解根据处理温度的不同可分为高温降解和中低温降解。由于类胡萝卜素是非极性物质,所以氧化降解环境可分为两种,即水相和有机相。然而,类胡萝卜素大多存在于食品的水相体系中,因此研究水相中类胡萝卜素的热降解能更好地反映其在食品热加工中的降解过程。图2显示了β-胡萝卜素在97 ℃的水相环境中加热3 h的降解路径[38]。
由图2可知,β-胡萝卜素在高温下首先发生环氧化,破坏其稳定的结构形成中间物,从而导致碳链断裂生成香气物质。但Crouzet等[41]在后续研究中发现随着加热时间的延长,生成的产物含量逐步减少。同样的,新黄质在加热条件下可产生β-大马酮;9’-cis-新黄质则在加热条件下经过氧乙酸氧化后生成β-大马酮[42]。Zepka等[43]发现加热是引起果汁中类胡萝卜素降解的主要因素,可导致果汁中的5 种叶黄素类全部降解,生成5 种环氧化物以及两种新的同分异构体和呋喃衍生物。上述研究结果表明水相类胡萝卜素在加热过程中可发生异构化和氧化反应,破坏类胡萝卜素的原本结构,从而生成降异戊二烯香气物质。当加热温度高于600 ℃时,形成的芳香化合物种类迅速减少且含量降低,而萘、蒽、菲等化合物含量迅速增加[44]。
相较于高温降解,关于类胡萝卜素中低温降解的研究较少,可能是在温和条件下类胡萝卜素降解缓慢,耗时长所致。Handelman等[45]报道了β-胡萝卜素在37 ℃条件下的自氧化,其氧化产物主要为阿朴-胡萝卜素如β-阿朴-13-胡萝卜素,阿朴-胡萝卜醛如阿朴-14’-胡萝卜醛、阿朴-12’-胡萝卜醛、阿朴-10’-胡萝卜醛,这表明在温和条件下,β-胡萝卜素可在多个双键位置同时发生断裂。Henry等[46]在温和条件下(30 ℃)采用含饱和氧气和臭氧的纯水氧化C18柱上吸附的β-胡萝卜素、β-隐黄质及番茄红素,可生成阿朴-胡萝卜酮、阿朴-胡萝卜醛及胡萝卜素环氧化物等。
2.2 化学降解
化学氧化降解方面,国内外都有较多的研究。Rodriguez等[39]检测得到经高锰酸钾氧化剂作用后的β-胡萝卜素降解产物有8’、10’、12’、14’、15-胡萝卜醛及阿朴-胡萝卜酮类物质和胡萝卜素环氧化物等;经间氯过氧苯甲酸氧化剂作用后的产物主要是胡萝卜素-5,6-环氧化物、5,8-环氧化物及双环氧化物等。孙力等[47]研究了β-胡萝卜素经臭氧氧化-NaBH4还原后的生成物,检测到β-紫罗兰酮、2,3-环氧-β-紫罗兰酮、3-氧-β-紫罗兰酮、二氢猕猴桃内酯及2,6,6-三甲基环己烯-1-乙醛等香气物质。张成敏等[48]分别采用了5 种化学方法(O3氧化-NaBH4还原、O3氧化-Zn粉醋酸还原、有机过氧酸-高碘酸氧化、K2Cr2O7氧化、紫外光下空气氧化)作用于天然类胡萝卜素,测得其降解产物为香气物质混合物。张连富等[49]则选择NaClO、紫外光照射、OsO4和偶氮二异丁腈等氧化β-胡萝卜素,采用薄层层析法分离得到产物,并对产物进行体外细胞培养,观察发现经OsO4处理后得到的产物可有效抑制SGC27901癌细胞的增殖。
分析现有文献可知,已有许多研究致力于叶黄素的化学降解,主要采用AgNO3、H2O2、K2Cr2O7、KMnO4等化学氧化剂作用于叶黄素,其氧化降解产物种类和数目略有不同,但大多数为C9~C13类的降异戊二烯香气物质,包括二氢猕猴桃内酯和环氧紫罗兰酮等[50-51]。
2.3 生物降解
热降解需在处理过程中进行高温处理,不利于实际生产应用;化学降解则需加入化学试剂催化降解,而化学试剂难去除,且有的对人体有害。另外,上述两种降解方法都存在降解效率低、降解产物难以控制、产生的目标产物含量低等缺点,而生物降解具有降解效率高、专一性强、催化条件温和、产物中目标化合物含量高的特点,所以近年来,生物降解受到越来越多的关注。生物降解主要指酶催化降解,包括特异性酶[52]及非特异性酶[53]的催化作用。
2.3.1 类胡萝卜素降解氧合酶
目前所指的特异性酶为类胡萝卜素降解氧合酶(carotenoid cleavage oxygenases,CCOs)家族。CCOs是一类非血红素铁加氧酶,虽然该酶家族的氨基酸序列多样化,可随机作用于类胡萝卜素的共轭双键,但其具有一致的绝对保守区域,包括4 个完全保守的、与铁结合的组氨酸残基[14]。该家族酶存在于除古生菌(Archacea)外的所有生物中。
2.3.1.1 CCOs种类
表2 CCOs的功能特点[14,27,54]
Table 2 Functionally characterized carotenoid cleavage oxygenases[14,27,54]
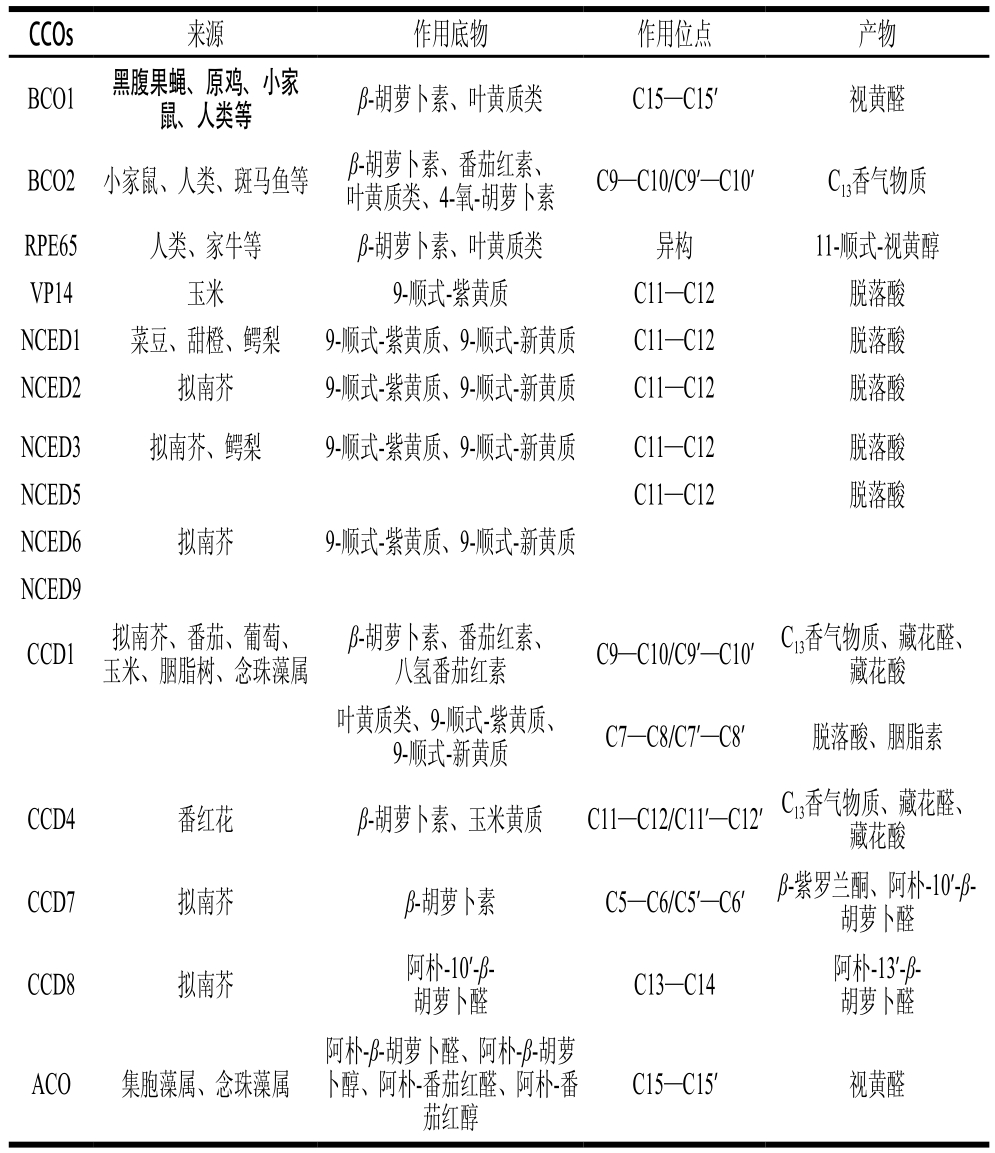
根据CCOs的来源及催化类胡萝卜素的作用位点不同,可将CCOs分为VP14(viviparous 14)、CCDs、9-顺式-环氧化-类胡萝卜素加双氧酶(9-cis-epoxy-carotenoid dioxygenases,NCEDs)、β,β-类胡萝卜素氧合酶(β,βcarotene oxygenase,BCO)、视黄醛色素上皮蛋白65(retinal pigment epithelium 65,RPE65),其分子质量为65 kD、阿朴-类胡萝卜素氧合酶(apocarotenoid oxygenase,ACO)[54]。表2列出了这些CCOs的类型、来源及作用位点、催化产物。
VP14是发现的第一个类胡萝卜素氧合酶,可催化9-顺式-紫黄质在C11—C12双键位置断裂生成脱落酸[55]。随后学者对VP14序列的同源性进行研究,在植物中发现了CCDs家族和NCEDs家族[54]。NCEDs家族包括6 种酶,即NCED1、NCED2、NCED3、NCED5、NCED6、NCED9,由表1可知其与VP14具有很高的同源性和相同的活性[56-57]。而CCDs家族包括4 种酶,即CCD1、CCD4、CCD7和CCD8,与NCEDs家族的同源性较低,且底物特异性不同。该家族酶可对称性或非对称性的催化降解类胡萝卜素的双键,不仅存在于植物中,也存在于某些微生物中[58-59]。目前而言,CCD1可催化多种类胡萝卜素在C9—C10和C9’—C10’双键位置对称降解而生成C13衍生物如β-紫罗兰酮、环柠檬醛、二氢猕猴桃内酯等降异戊二烯香气物质和C14二醛[58,60]。后续研究发现CCD1也可作用于C5—C6、C7—C8和C11—C12双键[21,61-63]。CCD4则可催化玉米黄质的C7—C8降解生成胭脂树橙(图1a),也可作用于β-胡萝卜素的C9—C10双键,形成β-紫罗兰酮香气物质[63]。CCD7则可非对称性的作用于β-胡萝卜素的C9’—C10’双键,生成β-紫罗兰酮和阿朴-10’-β-胡萝卜醛,而CCD8则作用于阿朴-10’-β-胡萝卜醛的C13—C14,生成阿朴-13’-β-胡萝卜醛[64]。Alder等[26]发现CCD7和CCD8在独脚金内酯的生物合成中有至关重要的作用。
由表2可知,BCO和RPE65主要来自于动物,尤其是哺乳类动物。其中BCO可分为两类:一类是BCO1,可作用于类胡萝卜素的C15—C15’双键位置,生成视黄醛及其衍生物,由于视黄醛在视循环中的重要性,所以BCO1是人体视循环、胚胎发育(尤其是在VA缺乏的情况下)的必须参与者[65]。另一类是BCO2,可催化较广泛的类胡萝卜素底物[66-67],作用位点为C9—C10双键,与CCD1相似,可生成β-紫罗兰酮等香气物质。RPE65则是专指分子质量65 kD,催化生成类维生素A的蛋白,与BCO家族具有高度同源性,但其是异构酶[68]。RPE65可裂解和异构所有的反式视黄酯生成11-顺式-视黄醇,从而形成11-顺式-视黄醛[69-70]。
微生物中发现的CCOs可作用于多种类胡萝卜素底物,其中最典型的是存在于蓝细菌中的ACO,可特异性催化C20~C27类的阿朴-类胡萝卜素,作用位点高度专一,只选择性催化这些底物的C15—C15’双键,生成C20视黄醛和其他醛类物质[14,69]。如从念珠藻属(Nostoc sp.)得到的念珠藻属阿朴类胡萝卜醛降解氧合酶(Nostoc apocarotenal cleavage oxygenase,NSC2),属于ACO家族,其催化位点为C15—C15’[71]。此外从鞘氨醇单胞RB2256、太平洋邻囊菌SIR-1和结核杆菌ORF Rv0654菌株中也得到了类胡萝卜素降解酶[13,72],对其作用位点进行研究,发现其对于不同底物的作用位点不同,与之前植物报道的酶有较大差异,但由于未检测生成的挥发性物质,因此对其降解产物是否为香气物质还不清楚,有待于进一步验证。而王树林[34]首次在巴氏葡萄球菌ts-82中发现类胡萝卜素降解酶,其结构有待于进一步验证。该酶可催化胡萝卜素类和叶黄质类底物降解生成C13类香气化合物[73]。
2.3.1.2 CCOs的结构
近年来,关于CCOs反应机制的研究受到越来越多的关注。自2005年起,学者经研究得到了3 种不同CCOs家族的晶体结构,分别是蓝细菌集胞藻属中的ACO[74]、家牛中的RPE65[75]、玉米中的VP14[76]。这些结构信息及其生化和功能特性为研究该家族蛋白的功能多样性提供极其重要的依据,以便更好的探究该家族酶的反应机制。
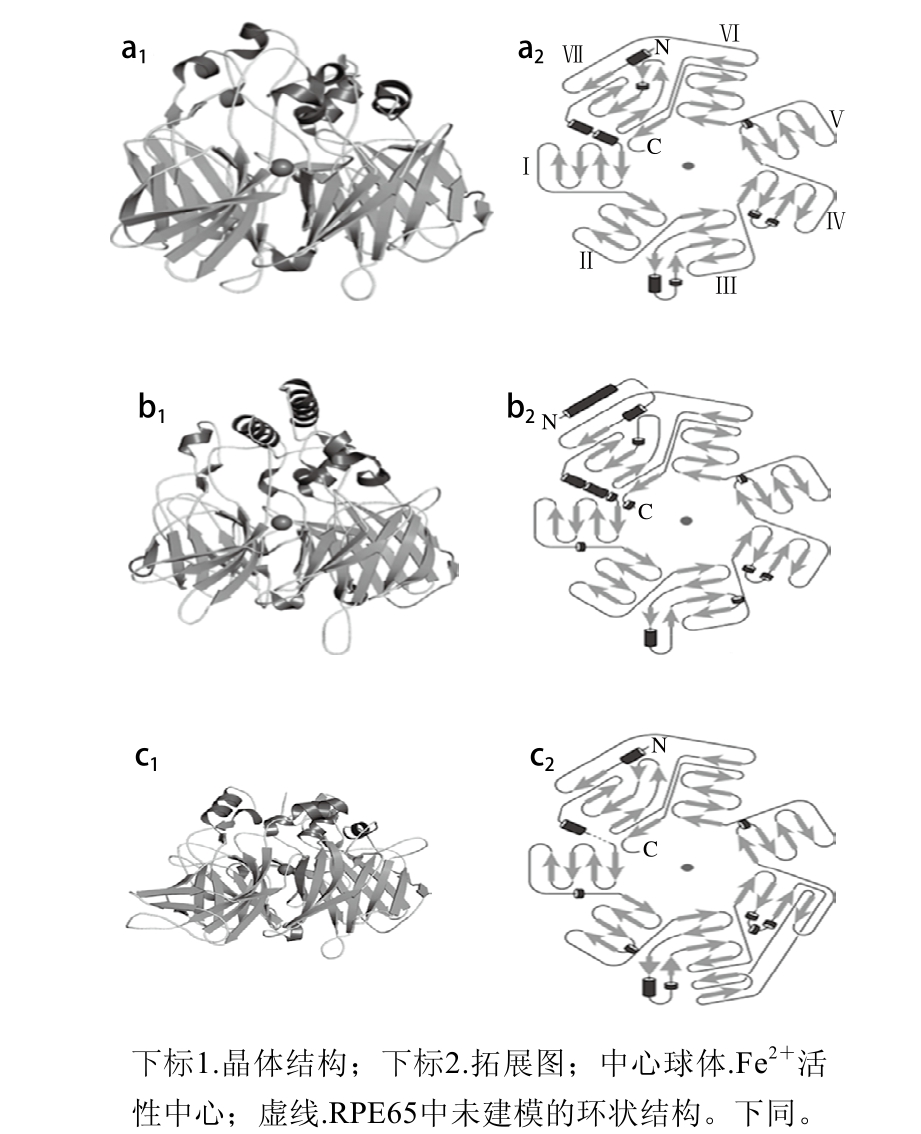
图3 ACO(a)、VP14(b)和RPE65(c)的晶体结构和拓展图[54]
Fig. 3 Crystal structures and topology diagrams of ACO (a), VP14 (b) and RPE65 (c)[54]
图3 显示了ACO、VP14和RPE65的晶体结构和拓扑图,其PDB登录号分别为2BIW、3NPE和3FSN。这些晶体结构图表明从微生物到高等动植物中发现的所有CCOs都含有7 个β-螺旋桨式支架,此为CCOs的关键标志。这3 种结构中的Ⅲ螺旋桨片有一些差别,RPE65结构中的Ⅲ比ACO和VP14结构中的Ⅲ多了两条延长线,由6 个反平行线条构成。这3 种家族酶的次生结构起始均为α-螺旋线。由图3可知,α-螺旋线堆叠在螺旋桨主体的顶部表面,这种α-螺旋结构及其延伸的环状区域堆叠起来在β-螺旋桨主体顶部表面形成大的圆顶状区域,此区域导致该家族酶多样化、功能多样性。在β-螺旋桨的中心轴线上接近顶部表面的地方结合有Fe2+辅离子,是该家族酶的活性中心,四周有4组氨酸保守序列残基结合,如图3、4所示[54]。

图4 ACO(A)、VP14(B)和RPE65(C)的催化中心[54]
Fig. 4 Catalytic centers of ACO (A), VP14 (B) and RPE65 (C)[54]
2.3.2 过氧化物酶
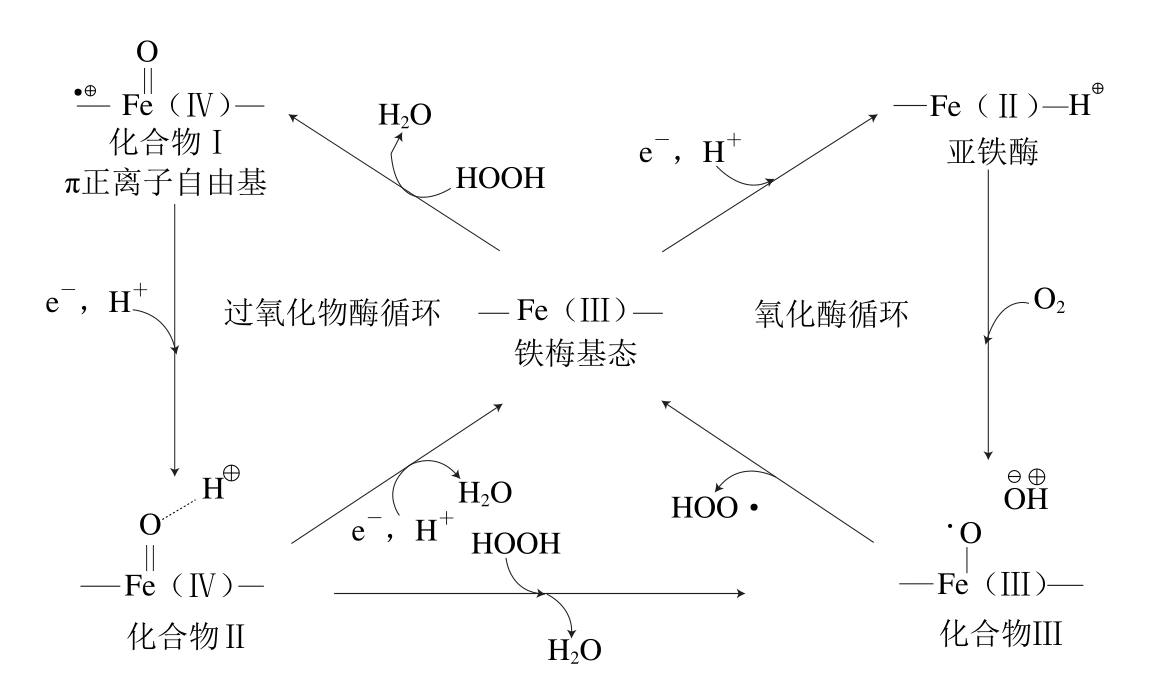
图5 过氧化物酶的5 种氧化态[78]
Fig. 5 Five oxidation states of peroxidases[78]
过氧化物酶在微生物、植物和动物中无处不在。大部分过氧化物酶是一类血红素酶,有Fe3+卟啉Ⅸ类似结构的活性中心[77]。该酶为一种非特异性酶,可参与多种生化反应,但其催化生成的中间产物具有高度相似的氧化状态(图5)。其催化反应一般分为过氧化物反应和氧化反应,在反应过程中所得到的过氧化物酶的氧化状态共有5 种,即化合物Ⅰ、Ⅱ和Ⅲ,以及Fe3+酶的基本状态、Fe2+酶。化合物Ⅰ、Ⅱ是过氧化物酶分别失去2 个和1 个电子所形成的,其氧化态均为Fe(Ⅳ)[78]。
过氧化物酶是一类极其复杂的非特异性酶类,可催化多种化学反应,有多种功能[79-80]。近年来,已有报道称一些过氧化物酶如山葵过氧化物酶、木质素过氧化物酶、灰盖鬼伞菌过氧化物酶等在有氧和酸性环境下可催化底物中相邻的C—C双键降解生成香气物质[81]。从真菌中提取得到的可降解类胡萝卜素产香的酶主要是过氧化物酶[37]。Rodríguez-Bustamante等[82]虽然发现阿氏丝孢酵母和解淀粉类芽孢杆菌混合发酵液可催化降解叶黄质产香,但是一直未说明在降解过程中酶的作用。而Zorn等[83]首次在真菌杏鲍菇发现可有效催化β-胡萝卜素降解产香的万能过氧化物酶,可作用于C9—C10/C9’—C10’和C7—C8/C7’—C8’双键位置,从而生成β-紫罗兰酮、β-环柠檬酸、二氢猕猴桃内酯和2-OH-2,6,6-三甲基环己酮等香气物质。近几年,在皮伞属[84]、侧耳属[85]和灵芝属[86]中也分离纯化得到了过氧化物酶。其中皮伞属中有两种,分别命名为皮伞属过氧化物酶1(Marasmius scorodonius peroxidase 1,MsP1)、MsP2,可作用于多种类胡萝卜素底物,催化位点主要为C9—C10/C9’—C10’,生成一系列C13降异戊二烯化合物。过氧化物酶多数在酸性环境下有催化活性[80],而灵芝属中的过氧化物酶却可在碱性环境下催化β-胡萝卜素降解[84]。
2.3.3 脂肪氧合酶
脂肪氧合酶(EC 1.13.11.12)主要存在于植物和动物中,是一类单一的多肽链蛋白质,为非血红素铁加双氧酶,是一类非特异性酶,可催化所有含cis,cis-1,4-戊二烯特定结构的不饱和脂肪酸进行加氧反应,产物为此类脂肪酸的氢过氧化物[56]。已有研究表明脂肪氧合酶也可高效催化类胡萝卜素双键断裂[87]。Firn等[88]首次发现大豆脂肪氧合酶可有效催化紫黄质降解产生3-OH-β-紫罗兰酮。在脂肪氧合酶的催化作用下,类胡萝卜素底物可降解生成多种香气物质,如紫罗兰酮、黄质醛、紫黄质和香叶醇等[89]。
类胡萝卜素作为具有多种理化功能的物质,其降解产物也一直是研究的热门。大多数阿朴-类胡萝卜素不是由小分子合成,而是由大分子底物氧化降解而成。从现有类胡萝卜素降解途径的研究成果看,生物降解具有独特优点:降解效率高、专一性强、催化条件温和、产物中目标化合物含量高。但是,从目前的研究来看,关于酶尤其是CCOs家族催化底物降解方面仍有许多问题。尽管已得到该家族的典型结构,并利用同位素标记法测定其作用机制,但仍然未得出其是单氧还是双氧机制。因此仍需进一步探究该家族酶的作用机制。
而相较于动植物而言,微生物降解具有较大的优势:微生物种类多、含酶丰富、生长快且易于规模化培养。然而,综上可知用于催化降解类胡萝卜素及其香气产物研究的微生物仍在少数,且大部分菌株产过氧化物酶,而不产特异性酶。另外,所研究菌株的活性均不突出,分离得到的高活性酶甚少。因此,筛选高活性微生物菌株和类胡萝卜素降解酶及其在食品加工工业上的应用等方面有待于进一步解决。
参考文献:
[1] BRITTON G, LIAAEN-JENSEN S, PFANDER H. Natural functions[M]. Carotenoids. Basel: Birkhäuser, 2008: 1-6.
[2] 刘晓瑞. 一株鞘氨醇杆菌合成类胡萝卜素的分子机制和代谢杂环的氧化压力研究[D]. 上海: 上海交通大学, 2013: 10-15.
[3] 孙玉敬, 乔丽萍, 钟烈洲, 等. 类胡萝卜素生物活性的研究进展[J]. 中国食品学报, 2012, 12(1): 160-166. DOI:10.3969/ j.issn.1009-7848.2012.01.025.
[4] BRITTON G. Structure and properties of carotenoids in relation to function[J]. Faseb Journal, 1995, 9(15): 1551-1558.
[5] RAISIG A, SANDMANN G. Functional properties of diapophytoene and related desaturases of C30and C40carotenoid biosynthetic pathways[J]. Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids, 2001, 1533(2): 164-170. DOI:10.1016/S1388-1981(01)00154-8.
[6] 张岩岩, 陈玉超. 类胡萝卜素的研究进展[J]. 硅谷, 2009, 2: 8; 29. DOI:10.3969/j.issn.1671-7597.2009.02.007.
[7] COGDELL R J, THORNBER J P. Light-harvesting pigment-protein complexes of purple photosynthetic bacteria[J]. FEBS Letters, 1980, 122(1): 1-8. DOI:10.1016/0014-5793(80)80388-7R.J.
[8] BERTRAM J S. Induction of connexin 43 by carotenoids: functional consequences[J]. Archives of Biochemistry and Biophysics, 2004, 430(1): 120-126. DOI:10.1016/j.abb.2004.02.037.
[9] ALI E A, LOWE G M, MEGARVEY D J, et al. Carotenoid radical chemistry and antioxidant/pro-oxidant properties[J]. Archives of Biochemistry and Biophysics, 2004, 430(1): 37-48. DOI:10.1016/ j.abb.2004.03.007.
[10] OSHIMA S, OJIMA F, SAKAMOTO H, et al. Supplementation with carotenoids inhibits singlet oxygen-mediated oxidation of human plasma low-density lipoprotein[J]. Journal of Agricultural and Food Chemistry, 1996, 44(8): 2306-2309. DOI:10.1021/jf950350i.
[11] 马乐, 林晓明. 叶黄素干预对长期荧屏光暴露者视功能的影响[J]. 营养学报, 2008, 30(5): 438-442. DOI:10.3321/ j.issn:0512-7955.2008.05.005.
[12] ALEXANDRA A R, ANDREW S. The science behind lutein[J]. Toxicology Letters, 2004, 150(1): 57-83. DOI:10.1016/j.toxlet.2003.10.031.
[13] HOFFMANN J, BÓNA-LOVÁSZ J, BEUTTLER H, et al. In vivo and in vitro studies on the carotenoid cleavage oxygenases from Sphingopyxis alaskensis RB2256 and Plesiocystis pacifica SIR-1 revealed their substrate specif i cities and non-retinal-forming cleavage activities[J]. FEBS Journal, 2012, 279(20): 3911-3924. DOI:10.1111/ j.1742-4658.2012.08751.x.
[14] KLOER D P, SCHULZ G E. Structural and biological aspects of carotenoid cleavage[J]. Cellular and Molecular Life Sciences, 2006, 63(19/20): 2291-2303. DOI:10.1007/s00018-006-6176-6.
[15] GROTE M, O’MALLEY M A. Enlightening the life sciences: the history of halobacterial and microbial rhodopsin research[J]. FEMS Microbiology Reviews, 2011, 35(6): 1082-1099. DOI:10.1111/j.1574-6976.2011.00281.x.
[16] SEKI T, ISONO K, OZAKI K, et al. The metabolic pathway of visual pigment chromophore formation in Drosophila melanogaster-alltrans(3S)-3-hydroxyretinal is formed from all-trans retinal via (3R)-3-hydroxyretinal in the dark[J]. European Journal of Biochemistry, 1998, 257(2): 522-527. DOI:10.1046/j.1432-1327.1998.2570522.x.
[17] 赵珺彦, 陈启和. 某保健乳饮料缓解视疲劳功能的实验研究[J]. 中国卫生检验杂志, 2009, 19(3): 507-508.
[18] SPILIANAKIS C G, LEE G R, FLAVELL R A. Twisting the Th1/Th2 immune response via the retinoid X receptor: lessons from a genetic approach[J]. European Journal of Immunology, 2005, 35(12): 3400-3404. DOI:10.1002/eji.200535588.
[19] ABU J, BATUWANGALA M, HERBERT K, et al. Retinoic acid and retinoid receptors: potential chemopreventive and therapeutic role in cervical cancer[J]. Lancet Oncology, 2005, 6(9): 712-720. DOI:10.1016/S1470-2045(05)70319-3.
[20] HEINRICH U, NEUKAM K, TRONNIER H, et al. Long-term ingestion of high fl avanol cocoa provides photoprotection against UV-induced erythema and improves skin condition in women[J]. Journal of Nutrition, 2006, 136(6): 1565-1569.
[21] BOUVIER F, DOGBO O, CAMARA B. Biosynthesis of the food and cosmetic plant pigment bixin (annatto)[J]. Science, 2003, 300: 2089-2091. DOI:10.1126/science.1085162.
[22] BOUVIER F, SUIRE C, MUTTERER J, et al. Oxidative tailoring of carotenoids: a prospect towards novel functions in plants[J]. Trends in Plant Science, 2005, 10(4): 187-194. DOI:10.1016/ j.tplants.2005.02.007.
[23] LI C N, SRIVASTAVA M K, NONG Q, et al. Molecular cloning and characterization of SoNCED, a novel gene encoding 9-cis-epoxycarotenoid dioxygenase from sugarcane (Saccharum officinarum L.)[J]. Genes & Genomics, 2013, 35(1): 101-109. DOI:10.1007/s13258-013-0065-9.
[24] 刘丹, 姜中珠, 陈祥伟. 水分胁迫下脱落酸的产生、作用机制及应用研究进展[J]. 东北林业大学学报, 2003, 31: 34-38. DOI:10.3969/ j.issn.1000-5382.2003.01.012.
[25] XIONG L M, ZHU J K. Regulation of abscisic acid biosynthesis[J]. Plant Physiology, 2003, 133(1): 29-36. DOI:10.1104/pp.103.025395.
[26] ALDER A, JAMIL M, MARZORATI M, et al. The path from betacarotene to carlactone, a ctrigolactone-like plant hormone[J]. Science, 2012, 335: 1348-1351. DOI:10.1126/science.1218094.
[27] RODRÍGUEZ-BUSTAMANTE E, SÁNCHEZ S. Microbial production of C13-norisoprenoids and other aroma compounds via carotenoid cleavage[J]. Critical Reviews in Microbiology, 2007, 33(3): 211-230. DOI:10.1080/10408410701473306.
[28] UENOJO M, PASTORE G M. β-carotene biotransformation to obtain aroma compounds[J]. Ciência E Tecnologia de Alimentos, 2010, 30(3): 822-827. DOI:10.1590/S0101-20612010000300039.
[29] YAHYAA M, BAR E, DUBEY N K, et al. Formation of norisoprenoid fl avor compounds in carrot (Daucus carota L.) roots: characterization of a cyclic-specif i c carotenoid cleavage dioxygenase 1 gene[J]. Journal of Agricultural and Food Chemistry, 2013, 61(50): 12244-12252. DOI:10.1021/jf404085k.
[30] BOLT A J N, PURKIS S W, SADD J S. A damascone derivative from Nicotiana tabacum[J]. Phytochemistry, 1983, 22(2): 613-614. DOI:10.1016/0031-9422(83)83068-4.
[31] KOTSERIDIS Y, BAUMES R L, BERTRAND A, et al. Quantitative determination of beta-ionone in red wines and grapes of Bordeaux using a stable isotope dilution assay[J]. Journal of Chromatography A, 1999, 848(1/2): 317-325. DOI:10.1016/S0021-9673(99)00422-7.
[32] MENDES-PINTO M M. Carotenoid breakdown products thenorisoprenoids-in wine aroma[J]. Archives of Biochemistry and Biophysics, 2009, 483(2): 236-245. DOI:10.1016/j.abb.2009.01.008.
[33] 和承尧, 胡元文. β-环柠檬醛的合成[J]. 云南化工, 2004, 31(1): 1-5. DOI:10.3969/j.issn.1004-275X.2004.01.001.
[34] 王树林. 沙棘酒香味前体物β-胡萝卜素降解产香规律及机理研究[D]. 杨凌: 西北农林科技大学, 2011: 16-31.
[35] 孙向荣, 刘家仁, 陈炳卿. β-紫罗兰酮的生物活性研究进展[J]. 毒理学杂志, 2008, 22(6): 477-480. DOI:10.3969/ j.issn.1002-3127.2008.06.023.
[36] GURAK P D, MERCADANTE A Z, GONZÁLEZ-MIRET M L, et al. Changes in antioxidant capacity and colour associated with the formation of β-carotene epoxides and oxidative cleavage derivatives[J]. Food Chemistry, 2014, 147: 160-169. DOI:10.1016/ j.foodchem.2013.09.106.
[37] ZELENA K, HARDEBUSCH B, HULSDAU B, et al. Generation of norisoprenoid flavors from carotenoids by fungal peroxidases[J]. Journal of Agricultural and Food Chemistry, 2009, 57(21): 9951-9955. DOI:10.1021/jf901438m.
[38] KANASAWUD P, CROUZET J C. Mechanism of formation of volatile compounds by thermal degradation in aqueous medium. 1. β-Carotene degradation[J]. Journal of Agricultural and Food Chemistry, 1990, 38(1): 237-243. DOI:10.1021/jf00091a052
[39] RODRIGUEZ E B, RODRIGUEZ-AMAYA D B. Formation of apocarotenals and epoxycarotenoids from β-carotene by chemical reactions and by autoxidation in model systems and processed foods[J]. Food Chemistry, 2007, 101(2): 563-572. DOI:10.1016/ j.foodchem.2006.02.015.
[40] BERGER R G. Biotechnology of flavours: the next generation[J]. Biotechnology Letters, 2009, 31(11): 1651-1659. DOI:10.1007/ s10529-009-0083-5.
[41] CROUZET J, KANASAWUD P. Formation of volatile compounds by thermal degradation of carotenoids[J]. Methods in Enzymology, 1992, 213: 54-62. DOI:10.1016/0076-6879(92)13111-A.
[42] BEZMAN Y, BILKIS I, WINTERHALTER P, et al. Thermal oxidation of 9’-cis-neoxanthin in a model system containing peroxyacetic acid leads to the potent odorant β-damascenone[J]. Journal of Agricultural and Food Chemistry, 2005, 53(23): 9199-9206. DOI:10.1021/jf051330b.
[43] ZEPKA L Q, MERCADANTE A Z. Degradation compounds of carotenoids formed during heating of a simulated cashew apple juice[J]. Food Chemistry, 2009, 117(1): 28-34. DOI:10.1016/ j.foodchem.2009.03.071.
[44] 罗昌荣, 赵震毅, 刘涵刚, 等. β-胡萝卜素裂解温度对其裂解产物的影响[J]. 无锡轻工大学学报, 2003, 22(3): 67-75. DOI:10.3321/ j.issn:1673-1689.2003.03.014.
[45] HANDELMAN G J, van KUIJK F J, CHATTERJEE A, et al. Characterization of products formed during the autoxidation of β-carotene[J]. Free Radical Biology and Medicine, 1991, 10(6): 427-437. DOI:10.1016/0891-5849(91)90051-4.
[46] HENRY L K, PUSPITASARI-NIENABER N L, JARÉN-GALÁN M, et al. Effects of ozone and oxygen on the degradation of carotenoids in an aqueous model system[J]. Journal of Agricultural and Food Chemistry, 2000, 48(10): 5008-5013. DOI:10.1021/jf000503o.
[47] 孙力, 肖燕, 张成敏, 等. β-胡萝卜素O3-NaBH4化学降解产物及应用[J].中国烟草学报, 1999, 5(1): 47-48.
[48] 张成敏, 缪明明, 胡群. 从提取的天然类胡萝卜素制备烟用香料的方法: CN 1242417A[P]. 2000-01-26[2016-01-21]. http://dbpub.cnki. net/grid2008/dbpub/detail.aspx?QueryID=2&CurRec=1&dbcode=SC PD&dbname=SCPD0003&f i lename=CN1242417&urlid=&yx=&uid= WEEvREcwSlJHSldRa1FhdXNXZjJDVVVjM1FFY0lBaVp2MGgrT mMvWmJEOD0=$9A4hF_YAuvQ5obgVAqNKPCYcEjKensW4ggI8 Fm4gTkoUKaID8j8gFw!!
[49] 张连富, 胡兴娟. β-胡萝卜素氧化降解及产物对SGC-7901细胞的抑制作用[J]. 天然产物研究与开发, 2007, 19(5): 781-784. DOI:10.3969/j.issn.1001-6880.2007.05.010.
[50] 许春平, 王铮, 郑坚强, 等. 类胡萝卜素降解方式的研究综述[J]. 郑州轻工业学院学报(自然科学版), 2012, 27(4): 56-59. DOI:10.3969/ j.issn.1004-1478.2012.04.015.
[51] 刘金霞, 李元实, 姬小明, 等. 叶黄素氧化降解产物GC-MS分析及在卷烟加香中的应用[J]. 郑州轻工业学院学报(自然科学版), 2011, 26(2): 24-27. DOI:10.3969/j.issn.1004-1478.2011.02.007.
[52] SCHWARTZ S H, QIN X, ZEEVAART J A. Characterization of a novel carotenoid cleavage dioxygenase from plants[J]. Journal of Biological Chemistry, 2001, 276(27): 25208-25211. DOI:10.1074/jbc. M102146200.
[53] YVES W, AURELIE B D, JEAN-CLAUDE L, et al. Effect of cis/trans isomerism of β-carotene on the ratios of volatile compounds produced during oxidative degradation[J]. American Chemical Society, 2003, 51(7): 1984-1987. DOI:10.1021/jf021000g.
[54] SUI X W, KISER P D, von LINTING J, et al. Structural basis of carotenoid cleavage: from bacteria to mammals[J]. Archives of Biochemistry & Biophysics, 2013, 539(2): 203-213. DOI:10.1016/ j.abb.2013.06.012.
[55] SCHWARTZ S H, TAN B C, GAGE D A, et al. Specific oxidative cleavage of carotenoids by VP14 of maize[J]. Science, 1997, 276: 1872-1874. DOI:10.1126/science.276.5320.1872.
[56] 孟凡来, 赵昶灵, 段丽斌, 等. 高等植物类胡萝卜素的生物降解途径研究进展[J]. 中国农学通报, 2013, 29(24): 143-150. DOI:10.3969/ j.issn.1000-6850.2013.24.027.
[57] TAN B C, JOSEPH L M, DENG W T, et al. Molecular characterization of the Arabidopsis 9-cis epoxycarotenoid dioxygenase gene family[J]. The Plant Journal: for Cell and Molecular Biology, 2003, 35(1): 44-56. DOI:10.1046/j.1365-313X.2003.01786.x.
[58] SUN Z, HANS J, WALTER M H, et al. Cloning and characterisation of a maize carotenoid cleavage dioxygenase (ZmCCD1) and its involvement in the biosynthesis of apocarotenoids with various roles in mutualistic and parasitic interactions[J]. Planta, 2008, 228(5): 789-801. DOI:10.1007/s00425-008-0781-6.
[59] KHAN H, FLINT S H, yU P L. Development of a chemically def i ned medium for the production of enterolysin A from Enterococcus faecalis B9510[J]. Journal of Applied Microbiology, 2013, 114(4): 1092-1102. DOI:10.1111/jam.12115.
[60] OHMIYA A. Carotenoid cleavage dioxygenases and their apocarotenoid products in plants[J]. Plant Biotechnology, 2009, 26(4): 351-358. DOI:10.5511/plantbiotechnology.26.351.
[61] ILG A, BEYER P, Al-BABILI S. Characterization of the rice carotenoid cleavage dioxygenase1 reveals a novel route for geranial biosynthesis[J]. FEBS Journal, 2009, 276(3): 736-747. DOI:10.1111/ j.1742-4658.2008.06820.x.
[62] VOGEL J T, TAN B C, MCCHARTY D R, et al. The carotenoid cleavage dioxygenase 1 enzyme has broad substrate specificity, cleaving multiple carotenoids at two different bond positions[J]. Journal of Biological Chemistry, 2008, 283(17): 11364-11373. DOI:10.1074/jbc.M710106200.
[63] BOUVIER F, SUIRE C J, CAMARA B. Oxidative remodeling of chromoplast carotenoids: identif i cation of the carotenoid dioxygenase CsCCD and CsZCD genes involved in Crocus secondary metabolite biogenesis[J]. Plant Cell, 2003, 15(1): 47-62. DOI:10.1105/tpc.006536. [64] SCHWARTZ S H, QIN X, LOEWEN M C. The biochemical characterization of two carotenoid cleavage enzymes from Arabidopsis indicates that a carotenoid-derived compound inhibits lateral branching[J]. Journal of Biological Chemistry, 2004, 279(45): 46940-46945. DOI:10.1074/jbc.M409004200.
[65] KOWATZ T, BABINO D, KISER P, et al. Characterization of human β,β-carotene-15,15’-monooxygenase (BCMO1) as a soluble monomeric enzyme[J]. Archives of Biochemistry & Biophysics, 2013, 539(2): 214-222. DOI:10.1016/j.abb.2013.05.007.
[66] LOBO G P, ANDREA I, SYLVIA H, et al. BCDO2 acts as a carotenoid scavenger and gatekeeper for the mitochondrial apoptotic pathway[J]. Development, 2012, 139(16): 2966-2977. DOI:10.1242/dev.079632.
[67] AMENGUAL J, GOURANTON E, van HELDEN Y G, et al. Betacarotene reduces body adiposity of mice via BCMO1[J]. PLoS ONE, 2011, 6(6): e20644. DOI:10.1371/journal.pone.0020644.
[68] REDMOND T M, GENTLEMAN S, DUNCAN T, et al. Identif i cation, expression, and substrate specificity of a mammalian beta-carotene 15,15’-dioxygenase[J]. Journal of Biological Chemistry, 2001, 276: 6560-6565. DOI:10.1074/jbc.M009030200.
[69] MOISEYEV G, CHEN Y, TAKAHASHI Y, et al. RPE65 is the isomerohydrolase in the retinoid visual cycle[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(35): 12413-12418. DOI:10.1073/pnas.0503460102.
[70] JIN M, LI S W, SUN H, et al. Rpe65 is the retinoid isomerase in bovine retinal pigment epithelium[J]. Cell, 2005, 122(3): 449-459. DOI:10.1016/j.cell.2005.06.042.
[71] JÜTTNER F, HÖFLACHER B. Evidence of β-carotene 7,8(7′,8′) oxygenase (β-cyclocitral, crocetindial generating) in Microcystis[J]. Archives of Microbiology, 1985, 141(4): 337-343. DOI:10.1007/ BF00428846.
[72] HEO J, KIM S H, LEE P C. New insight into the cleavage reaction of Nostoc sp. PCC7120 carotenoid cleavage dioxygenase in natural and non-natural carotenoids[J]. Applied and Environmental Microbiology, 2013, 79(11): 3336-3345. DOI:10.1128/AEM.00071-13.
[73] SCHERZINGER D, SCHEFFER E, BÄR C, et al. The Mycobacteriumtuberculosis ORF Rv0654 encodes a carotenoid oxygenase mediating central and excentric cleavage of conventional and aromatic carotenoids[J]. FEBS Journal, 2010, 277(22): 4662-4673. DOI:10.1111/j.1742-4658.2010.07873.x.
[74] KLOER D P, SANDRA R, SALIM A B, et al. The structure of a retinal-forming carotenoid oxygenase[J]. Science, 2005, 308: 267-269. DOI:10.1126/science.1108965.
[75] KISER P D. Structural and biochemical studies of RPE65, the retinoid isomerase of the visual cycle[D]. Cleveland: Case Western Reserve University, 2010: 1-10.
[76] MESSING S A J, GABELLI S B, ECHEVERRIA I, et al. Structural insights into maize viviparous14, a key enzyme in the biosynthesis of the phytohormone abscisic acid[J]. Plant Cell, 2010, 22(9): 2970-2980. DOI:10.1105/tpc.110.074815.
[77] ADAM W, LAZARUS M, SAHA-MOLLER C R, et al. Biotransformations with peroxidases[J]. Advances in Biochemical Engineering/Biotechnology, 1999, 63: 73-108.
[78] FRANCESCO G M. Alkene cleavage catalysed by heme and nonheme enzymes: reaction mechanisms and biocatalytic applications[J]. Bioinorganic Chemistry and Applications, 2012(23): 1-13. DOI:10.1155/2012/626909.
[79] BERGLUND G I, CARLSSON G H, SMITH A T, et al. The catalytic pathway of horseradish peroxidase at high resolution[J]. Nature, 2002, 417: 463-468. DOI:10.1038/417463a.
[80] SCHLICHTING I, BERENDZEN J, CHU K, et al. The catalytic pathway of cytochrome P450cam at atomic resolution[J]. Science, 2000, 287: 1615-1622. DOI:10.1126/science.287.5458.1615.
[81] MUTTI F G, LARA M, KROUTIL M, et al. Ostensible enzyme promiscuity: alkene cleavage by peroxidases[J]. Chemistry, 2010, 16(47): 14142-14148. DOI:10.1002/chem.201002265.
[82] RODRÍGUEZ-BUSTAMANTE E, MALDONADO-ROBLEDO G, ORTIZ M A, et al. Bioconversion of lutein using a microbial mixture-maximizing the production of tobacco aroma compounds by manipulation of culture medium[J]. Applied Microbiology and Biotechnology, 2005, 68(2): 174-182. DOI:10.1007/s00253-004-1868-z.
[83] ZORN H, LANGHOFF S, SCHEIBNER M, et al. A peroxidase from Lepista irina cleaves beta,beta-carotene to flavor compounds[J]. Biological Chemistry, 2003, 384(7): 1049-1056. DOI:10.1515/ BC.2003.117.
[84] SCHEIBNER M, HÜLSDAU B, ZELENA K, et al. Novel peroxidases of Marasmius scorodonius degrade beta-carotene[J]. Applied Microbiology and Biotechnology, 2008, 77(6): 1241-1250. DOI:10.1007/s00253-007-1261-9.
[85] SCHÜTTMANN I, BOUWS H, SZWEDA R T, et al. Induction, characterization, and heterologous expression of a carotenoid degrading versatile peroxidase from Pleurotus sapidus[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 103: 79-84. DOI:10.1016/ j.molcatb.2013.08.007.
[86] LANFERMANN I, LINKE D, NIMTZ M, et al. Manganese peroxidases from Ganoderma applanatum degrade β-carotene under alkaline conditions[J]. Applied Biochemistry and Biotechnology, 2015, 175(8): 3800-3812. DOI:10.1007/s12010-015-1548-8.
[87] 何承刚, 曾旭波. 烤烟香气物质的影响因素及其代谢研究进展[J]. 中国烟草科学, 2005, 26(2): 40-43. DOI:10.3969/ j.issn.1007-5119.2005.02.013.
[88] FIRN R D, FRIEND J. Enzymatic production of the plant growth inhibitor, xanthoxin[J]. Planta, 1972, 103(3): 263-266. DOI:10.1007/ BF00386849.
[89] ENZELL C. Biodegradation of carotenoids: an important route to aroma compounds[J]. Pure and Applied Chemistry, 1985, 57(5): 693-700. DOI:10.1351/pac198557050693.
Advances in Methods for the Degradation of Carotenoids
ZHU Mingming1, FAN Mingtao2, HE Hongju1,*
(1. School of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China; 2. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
Abstract:Carotenoids are lipophilic isoprenoid pigments produced by plants and some photosynthetic microorganisms, which are ubiquitous in nature. Depending on the variety and the bond cleavage positions, carotenoids can be derivatized into various products playing key roles in living organisms such as retinoids, pigments, phytohormones and aroma compounds. Currently, many methods including physical, chemical and biological (specific enzymatic and non-specific enzymatic degradation) methods have been presented to degrade carotenoids. In this article, the classif i cation and functional properties of cleavage products of carotenoids are described. Moreover, this article provides a comprehensive review of the current methods to degrade carotenoids and highlights the advantages of the biological degradation methods with focus on specif i c enzymatic and non-specif i c enzymatic degradation as well as the enzymatic cleavage sites. In the end, we conclude with some perspectives on future research efforts to screen highly active carotenoid-degrading enzymes for application in the food industry.
Key words:carotenoids; cleavage products; degradation pathways; biological enzymes; microorganisms
DOI:10.7506/spkx1002-6630-201711048
中图分类号:TS201.2
文献标志码:A
文章编号:1002-6630(2017)11-0308-10引文格式:
收稿日期:2016-03-21
基金项目:河南科技学院高层次人才科研项目(2016020;2015015);国家自然科学基金面上项目(31171728);河南省高等学校重点科研项目(17A550001)
作者简介:朱明明(1989—),女,讲师,博士,主要从事食品分析研究。E-mail:happyzhumingming@126.com
*通信作者:何鸿举(1983—),男,教授,博士,主要从事食品质量分析与快速检测研究。E-mail: hongju_he007@126.com