
图1 不同培养方式下2 种酵母菌生长动态变化
Fig.1 Dynamic growth curves of two yeasts under different culture conditions
白梦洋,吴祖芳*,李若云,翁佩芳,张 鑫
(宁波大学海洋学院,应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
摘 要:为研究酵母菌混合培养条件下生长状态的变化规律以及相互影响的因素,选取2 种酵母菌,酿酒酵母菌(Saccharomyces cerevisiae,Sc)131和毕赤酵母菌(Pichia fabianii,Pf)65,考察了初始糖含量、pH值、乙醇体积分数对两菌种混合培养时生长状态的影响,并通过气相色谱-质谱分析方法考察了2 种细胞脂肪酸组成的差异性。结果表明,相对于纯培养,混合培养条件下,Pf对Sc产生明显的抑制作用,在低糖和低pH值环境条件下,Sc受抑制作用加剧,当初始糖含量2%时,Pf/Sc(菌体浓度比)为28,pH 3.5时,Pf/Sc达37;在外源添加乙醇时,随着乙醇体积分数的升高,Pf受抑制程度较Sc严重,Sc生长处于相对优势地位,说明Sc较Pf耐乙醇,当乙醇体积分数为12%时,Pf/Sc为0.5。经细胞脂肪酸组成分析,Sc主要为C16的棕榈酸和棕榈油酸,Pf主要为C18的油酸、亚油酸和亚麻酸,混合培养时细胞脂肪酸组成主要为C18型脂肪酸,Pf细胞代谢产生的亚油酸和亚麻酸的积累释放可能是抑制Sc生长的因素之一。实验结果可为进一步从转录组水平研究混合酵母相互影响的机制,以及发酵质量控制提供理论支持。
关键词:混合培养;初始糖含量;pH值;乙醇;脂肪酸
传统果酒发酵是一个复杂的多种微生物共同作用的过程,酵母在其中起着重要的作用,其中酿酒酵母(Saccharomyces cerevisiae,Sc)主要完成酒精发酵,发酵速率快,发酵力强,而非酿酒酵母(non-Saccharomyces)能将原料中的前体物质转化为风味物质,如酯、酸、高级醇等产物,并合成多种酶,对果酒色泽、风味的形成具有重要作用[1-2]。与单独发酵相比,酵母的混菌发酵能表现出更好的特性,如酒中甘油含量增加、乙酸含量降低,产生酯类、挥发性酚类等特殊风味物质,能够改善成品酒整体质量和品质,增强果酒风味多样性[3-5]。
在前期研究中,分别从热带水果中分离筛选了2 株优良酵母菌株,分别为产酒精和发酵能力较强的Sc 131,以及对风味有显著贡献的毕赤酵母菌(Pichia fabianii,Pf)65,通过不同类型酵母菌的混合培养以达到优势互补,从而可加强产品的功能特性[6-7]。据文献报道,在混菌发酵时,酵母菌在其生长过程中会受到毒性代谢物介导的抑制作用,其中高体积分数的乙醇被认为是Sc对非Sc形成优势地位的主要因素[8]。另有研究表明,Sc在发酵过程中产生除酒精外的代谢产物,如中长链脂肪酸、寡聚肽、环化高级醇等会抑制其他菌种的生长[9-10]。此外,酵母还会受到多种环境因素的影响,如高浓度糖导致的高渗透、pH值降低、营养物质消耗等。Renault等[11]研究了混合发酵体系中戴尔凯氏有孢圆酵母和Sc的生长变化,发现酵母细胞之间的接触和可溶性致死分子的释放似乎引发了戴尔凯氏有孢圆酵母的早期死亡。然而,混菌发酵过程菌种相互作用的影响因素较为复杂,不同酵母之间的作用也具有很大差异,对于其相互之间影响的本质,国内外至今没有统一的定论。
本实验以前期筛选出的2 种优良酵母菌株为研究对象,对其进行单菌种及混合培养,通过考察酵母混菌发酵时生长状态变化规律,分析发酵环境变化和脂肪酸代谢产物,为后续研究酵母混菌培养相互影响的分子机制、指导果酒生产实践等提供一定的理论依据。
1.1 材料与试剂
菌种:Sc 131、Pf 65均保藏于宁波大学海洋学院食品生物技术实验室。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、含山梨醇的基本培养基(蛋白胨5 g/L、酵母浸粉1 g/L、琼脂15 g/L、山梨醇5 g/L,pH 5.5±0.2) 杭州微生物试剂有限公司;乙醇、NaOH、甲醇、正己烷 上海晶纯生化科技股份有限公司。
1.2 仪器与设备
LDZX-40BⅠ型立式蒸汽灭菌器 上海申安医疗器械厂;XPX智能型生化培养箱 宁波江南仪器厂;高速冷冻离心机 德国Eppendorf公司;超净工作台 苏州净化设备有限公司;PHS-3C pH计 上海精密科学仪器有限公司;电子天平 上海民桥精密科学仪器有限公司;超声波振荡仪 昆山市淀山湖检测仪器厂;QP 2010气相色谱-质谱联用仪 日本岛津公司。
1.3 方法
1.3.1 菌种的活化
取甘油保藏菌种,划线于YPD固体培养基上,于30 ℃恒温培养箱中培养48 h,取一环平板活化的菌体于50 mL YPD液体培养基中,30 ℃、150 r/min恒温培养24 h后于4 ℃冰箱中保藏备用。
1.3.2 发酵方法及生长的测定
将活化好的2 种酵母菌以1∶1(V/V)的比例接种于装有50 mL灭菌YPD液体培养基的锥形瓶中,并分别接种2 种酵母菌作为纯培养对照,30 ℃、150 r/min恒温培养。混合培养及纯培养接种后培养液起始浓度均为2×105CFU/mL。
细胞数量测定采用平板计数法。在混合培养条件下,由于Sc和Pf生长形态一致,肉眼难以区分,但Sc在含山梨醇的培养基上不能正常生长,Pf可以正常生长,故采用含山梨醇的基本培养基进行选择计数。
1.3.3 初始糖含量对混合培养酵母菌生长的影响
将活化好的2 种酵母菌按1.3.2节所述分别接种到50 mL YPD液体培养基(葡萄糖含量分别为2%、5%、10%、15%和20%)中,30 ℃、150 r/min培养24 h后测定各菌株生长量。
1.3.4 乙醇体积分数对混合培养酵母菌生长的影响
将活化好的2种酵母菌按1.3.2节所述分别接种到50 mL YPD液体培养基(乙醇体积分数分别为2%、5%、8%、10%和12%)中,30 ℃、150 r/min培养24 h后测定各菌株生长量。
1.3.5 pH值对混合培养酵母菌生长的影响
以YPD为发酵培养基,用1 mol/L NaOH溶液和1 mol/L HCl溶液调节其pH值分别为2.5、3.5、4.5、5.5和6.5,将活化好的2 种酵母菌,按1.3.2节所述分别接种到50 mL不同pH值的培养基中,30 ℃、150 r/min恒温培养24 h后测定各菌株生长量。
1.3.6 脂肪酸的检测
参考Redón等[12]方法测定酵母胞内脂肪酸含量,并略作调整。酵母细胞用冻融法破碎后取1 g湿样,加入1 mL 5% NaOH-CH3OH/H2O溶液,100 ℃封闭水浴30 min,收集皂化液,加入2 mL6 mol/L HCl溶液,80 ℃密封水浴10 min。加入3 mL正己烷,30 s涡流振动提取,3 000 r/min离心3 min收集有机层,提取3 次,合并有机层,氮吹至1 mL,待分析。
采用气相色谱-质谱联用仪对脂肪酸甲酯进行分析,色谱柱:FFAP石英毛细管柱(30 mm×0.32 mm,0.25 μm);柱温:120 ℃维持2 min后以15 ℃/min升到150 ℃,再以5 ℃/min升温至200 ℃保持5 min;氢火焰离子检测器,温度250 ℃,H2流速30 mL/min,空气流速300 mL/min;进样器温度:250 ℃;载气流速:N212 cm/s,进样量:0.5 μL;以商品化的脂肪酸甲酯为标样,气相色谱数据处理采用归一法。
脂肪酸不饱和度根据下式计算:
不饱和度=1×单烯数+2×双烯数+3×三烯数
1.4 数据处理
所有实验平行进行3 次,利用SAS 8.1软件进行统计分析,P<0.05为显著性差异。
2.1 混合培养条件下2 种酵母菌的生长变化

图1 不同培养方式下2 种酵母菌生长动态变化
Fig.1 Dynamic growth curves of two yeasts under different culture conditions
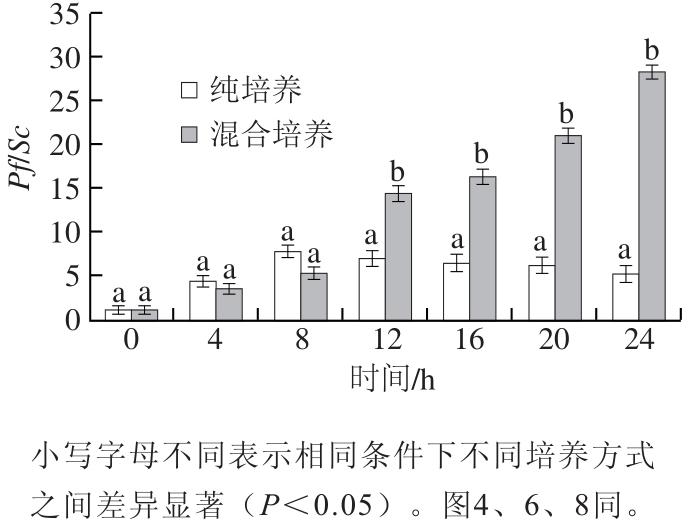
图2 不同培养方式下2 种酵母菌生长比率变化
Fig.2 Changes in Pf/Sc ratio under different culture conditions
由图1、2可知,在发酵过程中,Pf/Sc比值(菌体浓度比)均大于1,说明Pf生长速率较Sc高,2 种酵母均在12 h开始进入稳定期。纯培养时,Pf和Sc分别在24 h达到最大生长量,分别为2.3×108CFU/mL和4.5×107CFU/mL。在混合培养条件下,2 种酵母生长量均未达到其纯培养时生长量,这是由于混菌培养时相互竞争营养资源且相互抑制造成的[13],可以看出,进入稳定期后,Pf/Sc比值迅速升高,说明Pf开始成为优势菌,大大抑制了Sc的生长,在24 h时,Pf/Sc比值达到最高为28,Pf生长量达到1.8×108CFU/mL,基本达到其纯培养时生长量,而Sc此时生长量为6.4×106CFU/mL,低于其纯培养时生长量。据研究报道,Pf在葡萄酒发酵初始阶段能够较早生长,消耗了氨基酸和维生素,并且能产生一种肽类毒素,限制后续Sc菌株的生长[14-15]。此外Pf能耐受低pH值、低水分活度、高渗透压、厌氧等极端环境,相比于Sc更能适应外界环境胁迫[16]。在混菌培养时,Sc虽处于劣势,但仍能保持一定生长量,这可能是由于Pf在发酵初期生长时蛋白水解造成培养基中氮源的富集,增强了Sc对一些氨基酸的吸收和消耗,形成一种氮源利用的协同机制,且随着发酵的进行,乙醇含量将逐渐增加,对Pf产生乙醇胁迫,一定程度上缓解了对Sc的抑制作用[17]。
2.2 初始糖含量对混合培养两菌种生长的影响

图3 初始糖含量对酵母菌混合培养生长的影响
Fig.3 Growth rate of yeasts at different initial glucose concentrations
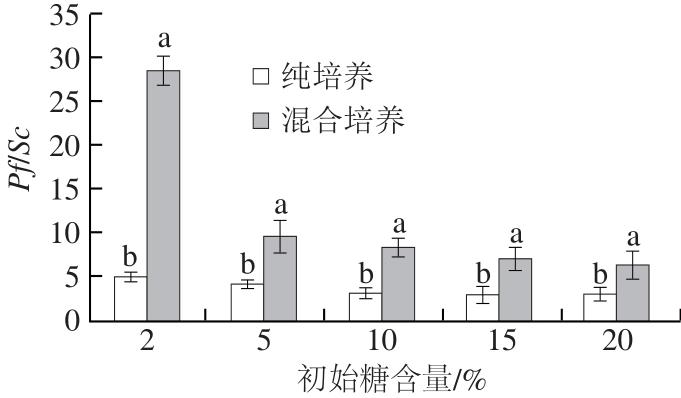
图4 不同初始糖含量条件下2 种酵母菌生长比率
Fig.4 Effect of initial glucose concentration on Pf/Sc ratio
从图3、4可知,与纯培养相比,Sc和Pf混合培养时Sc生长受到明显抑制,而Pf生长基本保持不变,说明在碳源的竞争中,Sc处于劣势,故Pf/Sc比率最大。随着糖含量的升高,可利用的碳源增加,一定程度上缓解了Pf对Sc的抑制,同时,高含量的糖会引起高渗透压胁迫,使酵母细胞失水皱缩,改变细胞膜的双层结构,而其上的蛋白质活性和离子通道受到影响,进而延缓了酵母菌生长的速率[18],因此,Sc的生长量逐渐提升,Pf/Sc逐渐降低,但Pf仍保持着优势以及对Sc的抑制。此外,Sc在糖含量达到20%时,混合培养生长量仍未达到纯培养时生长量。这可能是由于酵母细胞度过迟滞期后快速分裂,糖转化为二氧化碳和乙醇,以及高级醇、寡聚肽等毒性介导物造成酵母之间胁迫作用[19]。
2.3 乙醇体积分数对混合培养两菌种生长的影响
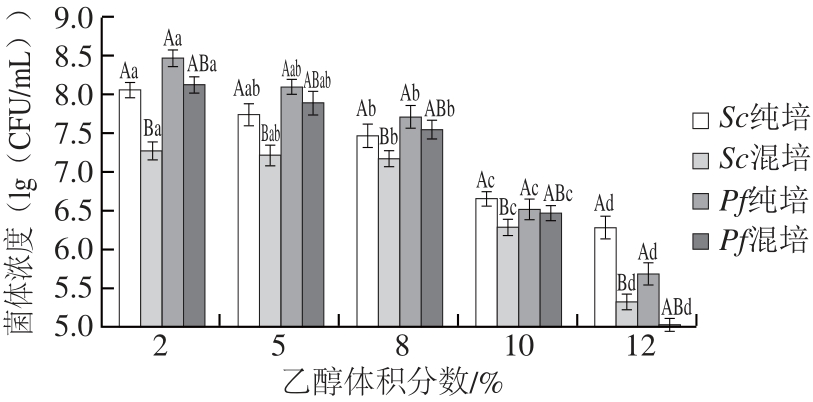
图5 乙醇体积分数对酵母菌混合培养生长的影响
Fig.5 Effect of ethanol concentration on yeast growth
随着乙醇体积分数的升高,酵母菌存活能力变差,这是由于乙醇结合到细胞膜的疏水区,降低疏水性的相互作用,造成酵母蛋白变性,细胞膜破裂,生长量下降[20]。从图5可知,当乙醇体积分数达到10%、12%时Sc生长量开始高于Pf,说明其耐受酒精能力强于Pf。

图6 不同乙醇体积分数条件下2种酵母菌生长比率
Fig.6 Effect of ethanol concentrations on Pf/Sc ratio
从图6可以看出,低乙醇体积分数下,混合培养时,Pf/Sc较高,Pf生长处于优势,而高乙醇体积分数下,Pf耐受能力变差,Pf/Sc变小,Sc开始占优势。这与一般发酵的初期由酒精耐受能力较弱但具有较高产香能力的Pf来完成,但随着乙醇体积分数的不断升高,Pf的这种优势逐渐被乙醇耐受能力较强的Sc代替情况相吻合。
2.4 pH值对混合培养两菌种生长的影响
从图7、8可知,随着酸胁迫的进行,Sc耐酸性较Pf差,pH 2.5时已基本死亡,而Pf仍能保持较好的生长,随着pH值的升高,Sc生长量开始提升,Pf/Sc降低。实际生产中,在发酵初始阶段,酵母就会受到低pH值胁迫,而葡萄醪的pH值通常在2.75~4.20,低pH值会影响细胞壁结构,改变质膜构型,导致其丧失完整性,从而影响Sc发酵速度和正常生理功能[21]。在混合培养体系中,在pH 3.5~6.5期间,Pf均能达到较高生长量,能达到108CFU/mL,相对Sc优势生长,而与纯培养相比,Sc受到明显的抑制。Sc耐酸性较弱,也是其在混合培养中处于劣势的主要因素之一。

图7 pH值对酵母菌混合培养生长的影响
Fig.7 Effect of pH on yeast growth
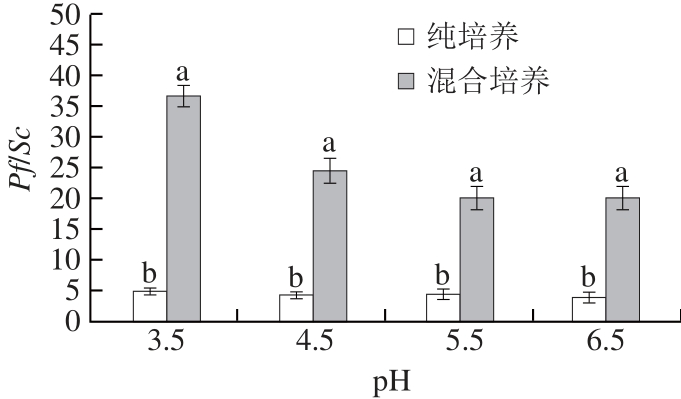
图8 不同pH值条件下2 种酵母菌生长比率
Fig.8 Effects of pH values on Pf/Sc ratio
2.5 不同培养方式下细胞脂肪酸组成比较
表1 培养方式与培养时间酵母菌体细胞脂肪酸组成的比较
Table1 Fatty acid composition of yeast cells cultured by different culture methods for different periods of time

注:Sc1、Sc2分别表示Sc纯培养至对数期、稳定期;Pf同Sc;SP1、SP2表示酵母混合培养至对数期、稳定期。
脂肪酸作为酵母菌的结构成分中的重要成分,有助于维护细胞膜的完整性和流动性,影响细胞活性,在酵母共发酵反应中发挥着重要作用[12]。对2种酵母菌分别纯培养及混合培养,并取其对数期和生长稳定期菌体,经气相色谱法分析脂肪酸组成,结果见表1。脂肪酸作为酵母细胞中含量丰富且稳定的一种化学组分,在不同的酵母中分布有所差异,但绝大多数酵母脂肪酸多由C16脂肪酸和C18脂肪酸构成,其中主要的饱和脂肪酸是棕榈酸,不饱和脂肪酸是棕榈油酸和油酸,与细胞膜的流动性密切相关[22-23]。由表1可以看出,Sc和Pf的脂肪酸分布不同,Sc相对质量分数较多的是C16棕榈酸和棕榈油酸,其次是C18油酸,而Pf中C18油酸和亚油酸相对质量分数最多,其次是C16棕榈酸和棕榈油酸,两种酵母脂肪酸分布集中于C16和C18,而十二烷酸、肉豆蔻酸、花生酸、二十碳五烯酸等其他不同碳数的脂肪酸相对质量分数甚微。
在不同发酵阶段的酵母脂肪酸相对质量分数发生变化(表1),Sc在对数期脂肪酸相对质量分数最高的是棕榈油酸,占43.45%,其次是油酸占22.57%,但进入稳定期后,C16脂肪酸相对质量分数大幅增加,其中棕榈油酸比例升高至61.43%,而C18脂肪酸相对质量分数则减小,油酸比例下降至11.23%,这可能是由于随着发酵的进行,酒精含量增高,乙醇胁迫时能够使酵母的细胞脂质构成发生改变,且有研究证实酵母细胞中单不饱和脂肪酸相对质量分数越高,越有利于酵母在酒精冲击下的存活率,特别是C16类型脂肪酸对发酵酒精耐性影响更大[24],此外,酵母菌细胞在酒精胁迫时可通过不饱和脂肪酸及固醇相对质量分数的增加引起细胞膜整体流动性增加,从而增加酵母菌的酒精耐性[25-26]。王川等[27]通过外源添加棕榈油酸和油酸培养后的酵母发酵产生了较高的酒精体积分数,体现出了高酒精耐性。而Sc中脂肪酸的不饱和度也由对数期的0.842 4上升到稳定期的0.874 0,说明其自身产生的代谢机制促使其不饱和脂肪酸比例升高,以耐受发酵后期不良环境。Pf在稳定期,脂肪酸比例显著增加的是C18油酸和亚油酸,比例分别从47.52%、21.56%增加到49.61%和23.67%,其和酒精耐受性相关的C16脂肪酸比例都有所降低,这也可以验证Pf酒精耐受性较Sc差的实验结果。此外,Pf不饱和度并未发生显著改变,且不饱和度高于Sc,也说明了Pf虽对酒精耐受较差,但对于发酵后期产生的低pH值、低水分活度、营养缺失、厌氧等极端环境的耐受程度较Sc高[17]。
有研究表明,以中长链脂肪酸、乙酸、蛋白化合物为代表的生物活性物质在酵母共发酵体系中发挥着重要作用,可能在相互之间产生不利影响[28]。从表1可知,在对数阶段,混合培养细胞中脂肪酸相对质量分数最多的是C18油酸和亚油酸,分别为45.18%和20.86%,而C16棕榈油酸和棕榈酸分别占12.64%和8.51%,进入稳定期后,C18脂肪酸比例有所下降,C16类型有所上升,但总体而言,占比例最高的仍是油酸31.72%,其次是亚油酸21.23%,亚麻酸相对质量分数也从2.63%升至4.46%。结合2.2节和2.4节的实验结果,在高糖和低pH值等不良外界环境中,混合培养条件下Pf处于优势地位,Sc生长受到明显抑制;从细胞脂肪酸组成上可看出,混合培养条件下细胞脂肪酸组成和Pf单独培养时细胞脂肪酸组成类似,C18型脂肪酸占比例最高,Pf细胞产生的亚油酸、亚麻酸积累释放可能引起Sc细胞活性的变化,造成抑制作用。事实上,早有研究表明酵母细胞产生的风味物质中长链脂肪酸如十二烷酸、亚油酸、亚麻酸等的积累释放会对不同种属的酵母生长具有抑制作用[29]。为进一步证实,在单独培养情况下,外源添加1.0、2.0、3.0 mmol/L的亚油酸时,Sc存活率分别下降了13.2%、26.4%和42.7%,而Pf生长存活率和未添加时基本一致,也说明了亚油酸对Sc的生长产生了抑制。
通过改变外界环境因素,比较了Sc和Pf纯培养及混合培养时的生长差异,结果表明,Pf对Sc产生明显的抑制作用,在低糖、低pH值环境时,Pf/Sc增大,Sc受抑制作用加剧,其中在初始糖含量2%时,Pf/Sc为28,pH 3.5时,Pf/Sc为37;在外源添加乙醇时,随着乙醇体积分数的增加,Pf受抑制程度较Sc严重,Sc生长处于相对优势地位,说明Sc较Pf耐乙醇,当乙醇体积分数为12%时,Pf/Sc为0.5。通过细胞脂肪酸组成分析,Sc细胞脂肪酸组成主要为C16棕榈酸、棕榈油酸,Pf主要为C18油酸、亚油酸和亚麻酸,且Sc在不同培养时期由于环境条件的改变其脂肪酸组成有所变化;混合培养体系中脂肪酸组成主要为C18型脂肪酸,Pf细胞代谢产生的亚油酸、亚麻酸的积累释放可能为抑制Sc生长的因素之一。通过对酵母混菌发酵外界环境因素影响及脂肪酸组成及变化的初步分析,为后续从转录组与蛋白质组学角度研究混合酵母相互影响的机制提供理论依据。
参考文献:
[1] GOBBI M, COMITINI F, DOMIZIO P, et al. Non-Saccharomyces yeasts in controlled mixed culture fermentation in wine making: the role of metabolic interactions[J]. Journal of Biotechnology, 2010, 150(1): 299-300. DOI:10.1016/j.jbiotec.2010.09.258.
[2] CIANI M, COMITINI F. Non-Saccharomyces wine yeasts have a promising role in biotechnological approaches to winemaking[J]. Annals of Microbiology, 2011, 61(1): 25-32. DOI:10.1007/s13213-010-0069-5.
[3] JOLLY N P, VARELA C, PRETORIUS I S. Not your ordinary yeast non-Saccharomyces yeasts in wine production uncovered[J]. FEMS Yeast Research, 2014, 14(2): 215-237. DOI:10.1111/1567-1364.12111.
[4] CONTRERAS A, HIDALUO C, HENSCHKE P A, et al. Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J]. Applied and Environmental Microbiology, 2014, 80(5):1670-1678. DOI:10.1128/AEM.03780-13.
[5] GOBBI M, de VERO L, SOLIERI L, et al. Fermentative aptitude of Saccharomyces wine yeast for reduction in the ethanol contentin wine[J]. European Food Research and Technology, 2014, 239(1):41-48. DOI:10.1007/s00217-014-2187-y.
[6] SADINENI V, KONDAPALLI N, OBULAM V S R. Effect of cofermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii or Metschnikowia pulcherrima on the aroma and sensory properties of mango wine[J]. Annals of Microbiology, 2012, 62(4): 1353-1360. DOI:10.1007/s13213-011-0383-6.
[7] CLEMENTE J J M, MINGORANCE C L, MARTINEZ R S, et al. Influence of sequential yeast mixtures on wine fermentation[J]. International Journal of Food Microbiology, 2004, 98(3): 301-308. DOI:10.1016/j.ijfoodchem.2004.06.007.
[8] PRETORIUS I S. Tailoring wine yeast for the new millennium:novel approaches to the ancient art of winemaking[J]. Yeast, 2000, 16(8): 675-729. DOI:10.1002/1097-0061(20000615)16:8<675:AIDYEA585>3.0.CO;2-B.
[9] BRANCO P, FRANCISCO D, CHAMB ON M, et al. Identification of novel GAPDH-derived antimicrobial peptides secreted by Saccharomyces cerevisiae and involved in wine microbial interactions[J]. Applied Microbiology and Biotechnology, 2014, 98(2):843-853. DOI:10.1007/s00253-013-5411-y.
[10] COMITINI F, GOBBI M, DOMIZIO P, et al. Selected non-Saccharmyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J]. Food Microbiology, 2011, 28(5):873-882. DOI:10.1016/j.fm.2010.12.001.
[11] RENAULT P E, ALBERTIN W, BELY M. An innovative tool reveals interaction mechanisms among yeast populations under oenological conditions[J]. Applied Microbiology and Biotechnology, 2013, 97(9):4105-4119. DOI:10.1007/s00253-012-4660-5.
[12] REDÓN M, GUILLAMÓN J M, MAS A, et al. Effect of lipid supplementation upon Saccharomyces cerevisiae lipid compostion and fermentation performance at low temperature[J]. European Food Research and Technology, 2009, 228(5): 833-840. DOI:10.1007/ s00217-008-0996-6.
[13] HERSEN P, MCCLEAN M N, MAHADEVAN L, et al. Signal processing by the HOG MAP kinase pathway[J]. PNAS, 2008, 105(20): 7165-7170. DOI:10.1073/pnas.0710770105.
[14] ORO L, CIANI M, COMITINI F. Antimicrobial activity of Metschnikowia pulcherrima on wine yeasts[J]. Journal of Applied Microbiology, 2014, 116(5): 1209-1217. DOI:10.1111/jam.12446.
[15] ANFANG N, BRAJKOVICH M, GODDARD M R. Co-fermentation with Pichia kluyveri increases varietal thiol concentrations in Sauvignon Blanc[J]. Australian Journal of Grape and Wine Research, 2009, 15(1): 1-8. DOI:10.1111/j.1755-0238.2008.00031.x.
[16] WALKER G M. Pichia anomala: cell physiology and biotechnology relative to other yeasts[J]. Antonie van Leeuwenhoek International Journal of General and Molecular Microbiology, 2011, 99(1): 25-34. DOI:10.1007/s10482-010-9491-8.
[17] MEDINA K, BOIDOA E, DELLACASSA E, et al. Growth of non-Saccharomyces yeasts affects nutrient availability for Saccharomyces cerevisiae during wine fermentation[J]. International Journal of Food Microbiology, 2012, 157(2): 245-250. DOI:10.1016/ j.ijfoodmicro.2012.05.012.
[18] HOHMANN S. Osmotic stress signaling and osmoadaptation in yeasts[J]. Microbiology and Molecular Biology Reviews, 2002, 66(2):300-372. DOI:10.1128/MMBR.66.2.300-372.2002.
[19] MATURANO Y P, NALLY M C, TORO M E, et al. Monitoring of killer yeast populations in mixed cultures: influence of incubation temperature of microvinifications samples[J]. World Journal of Microbiology and Biotechnology, 2012, 28(11): 3135-3142. DOI:10.1007/s11274-012-1123-1.
[20] CHANDLER M, STANLEY G A, ROGERS P, et al. A genomic approach to defining the ethanol stress response in the yeast Saccharomyces cerevisiae[J]. Annals of Microbiology, 2004, 54(4):427-454.
[21] MARTANI F, FOSSATI T, POSTERI R, et al. Different response to acetic acid stress in Saccharomyces cerevisiae wild-type and L-ascorbic acid producing strains[J]. Yeast, 2013, 30(9): 365-378. DOI:10.1002/ yea.2969.
[22] 孙万儒. 酵母菌[J]. 生物学通报, 2007, 42(11): 5-10. DOI:10.3969/ j.issn.0006-3193.2007.11.005.
[23] KYUNG M Y, ROSENFIELD C L, KNIPPLE D C. Ethanol tolerance in the yeast Saccharomyces cerevisiae is dependent on cellular oleic acid content[J]. Applied and Environmental Microbiology, 2003, 69(3): 1499-1503. DOI:10.1128/AEM.69.3.1499-1503.2003.
[24] DINH T N, NAGAHISA K, HIRASAWA T, et al. Adaptation of Saccharomyces cerevisiae cells to high ethanol concentration and changes in fatty acid composition of membrane and cell size[J]. PLoS ONE, 2008, 3(7): e2623. DOI:10.1371/journal.pone.0002623.
[25] TEIXEIRA M C, RAROSO L R, MIRA N P, et al. Genome-wide identif i cation of Saccharomyces cerevisiae genes required for maximal tolerance to ethanol[J]. Applied and Environmental Microbiology, 2009, 75(18): 5761-5772. DOI:10.1016/j.jelechem.2003.12. 022.
[26] 邢建宇, 李春荣, 林挺花, 等. 脂肪酸对酿酒酵母乙醇耐受性的影响[J]. 食品研究与开发, 2009, 30(6): 33-35. DOI:10.3969/ j.issn.1005-6521.2009.06.011.
[27] 王川, 罗惠波, 黄丹. 脂肪酸对酿酒酵母酒精耐性的影响[J]. 食品科学, 2015, 36(19): 190-193. DOI:10.7506/spkx1002-6630-201519034.
[28] COMITINI F, de INGENIIS J, PEPE L, et al. Pichia anomala and Kluyveromyces wickerhamii killer toxins as new tools against Dekkera/ Brettanomuces spoilage yeasts[J]. FEMS Microbiology Letters, 2004, 241(1): 235-240. DOI:10.1016/j.femsle.2004.07.040.
[29] EDWARDS C G, BEELMAN R B, BARTLEY C E, et al. Production of decanoic and other volatile compounds and the growth of yeast and malolactic bacteria during vinification[J]. American Journal of Enology and Viticulture, 1990, 41(1): 48-56.
Interaction between Saccharomyces cerevisiae and Pichia fabianii in a Mixed Culture
BAI Mengyang, WU Zufang*, LI Ruoyun, WENG Peifang, ZHANG Xin
(Key Laboratory of Applied Marine Biotechnology, Ministry of Education, School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Abstract:In order to investigate the changes in the growth state of different yeast species in a mixed culture and the factors affecting their interaction, the effects of initial glucose concentration, pH, and ethanol concentration on the growth of Saccharomyces cerevisiae (Sc) and Pichia fabianii (Pf) when cultured together were investigated, and the differences in the fatty acid composition of both yeasts were also determined by gas chromatography-mass spectrometry (GC-MS). The results showed that Pf had an obvious inhibitory effect on the growth of Sc during their co-culture under normal conditions. At relatively low sugar concentration and low pH, the growth of Sc was more restrained. At an initial glucose concentration of 2%, the Pf/Sc ratio(the ratio of colony numbers) was 28, and the value was 37 at pH 3.5. With increasing concentration of exogenous ethanol, the growth of Pf was more restrained than that of Sc, and Sc became dominant, suggesting it to be more resistant to ethanol than Pf. The Pf/Sc ratio was 0.5 under 12% ethanol stress. The fatty acid composition of Sc mainly consisted of palmitic acid and palmitoleic acid while that of Pf mainly consisted of oleic acid, linoleic acid and linolenic acid. In the mixed culture, the fatty acid composition was dominated by C18fatty acids, and the linoleic acid and linolenic acid produced by Pf could inhibit the growth of Sc. These results could provide a basis for further research on the interaction of different yeasts in the mixed culture at the transcriptome level and the quality control of fermented products.
Key words:mixed culture; initial glucose concentration; pH; ethanol; fatty acid
DOI:10.7506/spkx1002-6630-201712002
中图分类号:TS261.1
文献标志码:A
文章编号:1002-6630(2017)12-0009-06
引文格式:白梦洋, 吴祖芳, 李若云, 等. 混合培养条件下酿酒酵母菌与毕赤酵母菌的相互影响[J]. 食品科学, 2017, 38(12): 9-14.
DOI:10.7506/spkx1002-6630-201712002. http://www.spkx.net.cn
BAI Mengyang, WU Zufang, LI Ruoyun, et al. Interaction between Saccharomyces cerevisiae and Pichia fabianii in a mixed culture[J]. Food Science, 2017, 38(12): 9-14. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201712002. http:// www.spkx.net.cn
收稿日期:2016-09-13
基金项目:国家自然科学基金面上项目(31471709)
作者简介:白梦洋(1991—),男,硕士研究生,研究方向为食品生物技术。E-mail:mengyang_bai@qq.com
*通信作者:吴祖芳(1963—),男,教授,博士,研究方向为食品生物技术。E-mail:wzfwpf@163.com