表1 rolB rolC基因PCR扩增引物序列
Table1 Primer sequences of rolB and rolC for PCR amplification

邹 凯,刘泽波,陈继光,尹忠平*,上官新晨,许小向
(江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西 南昌 330045)
摘 要:以发根农杆菌ACCC10060诱导甜叶菊毛状根,建立毛状根培养生产绿原酸类物质体系,研究茉莉酸甲酯对绿原酸类化合物积累的影响。经发根农杆菌ACCC10060侵染的甜叶菊叶片外植体,共培养14 d后产生毛状根。聚合酶链式反应检测结果表明,发根农杆菌Ri质粒的rolB和rolC基因已成功整合到甜叶菊毛状根基因组中。MS液体培养基较B5、WPM更利于甜叶菊毛状根生长及绿原酸类物质的积累,培养35 d后,干质量增加约30 倍,绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸最高含量分别为3.47、11. 47、3.04 mg/g。毛状根在MS液体培养基中培养至第3周时分别添加15、45、100 µmol/L的茉莉酸甲酯进行诱导,处理后第1、2、4、8天收获,毛状根的生长量和绿原酸类物质含量均有提高,其中以45 μmol/L茉莉酸甲酯的促进作用最为显著,3 种绿原酸类物质的总产量是对照组的2.68 倍(P<0.01)。以上结果表明,甜叶菊毛状根培养可用于绿原酸类物质的生产,经茉莉酸甲酯处理可显著提高绿原酸类物质的产量。
关键词:甜叶菊;发根农杆菌;毛状根;茉莉酸甲酯;绿原酸类化合物
甜叶菊(Stevia rebaudiana Bertoni)是一种多年生菊科草本植物[1],其叶片中含有丰富的次生代谢产物。Karakö se等[2]以高效液相色谱-质谱仪鉴定出甜叶菊叶片中的24 种奎宁酸和莽草酸的衍生物,其中绿原酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸的含量分别为35.5、145.6、37.2 μg/g。研究发现绿原酸类物质具有多种功能活性,如抗氧化性[3]、增强肝糖原利用能力[4]、抑制HIV-1整合酶[5-6]、抑制致癌物质的突变型[7]等。
目前绿原酸类化合物主要是从杜仲[8]、金银花[9]、咖啡豆[10]等天然植物中提取,需要大量的植物资源,成本较高,毛状根培养生产次生代谢物有望解决此难题。研究表明,毛状根培养有很多优点,如生化和遗传性状的稳定性高、对季节和地理环境的依赖性低、生长速率快、能高效地合成次生代谢物等[11],因此具有很好的应用前景。但从目前的研究报道来看,毛状根生产次生代谢产物还存在产量较低等问题,影响了其在实际生产中的应用,通过诱导子刺激提高产量是解决这一问题的较好途径之一[12]。茉莉酸甲酯是目前研究较多的一种诱导子,其在植物次生代谢过程中起信号分子的作用,能有效地刺激植物次生代谢产物的合成,如萜类、黄酮类、生物碱类等[13]。研究表明,茉莉酸甲酯可促进野葛毛状根内总异黄酮的积累,提高其含量和产量[14]。根据Yukimune等[13]研究报道,向培养基中添加100 μmol/L的茉莉酸甲酯能有效提高紫衫醇含量。王学勇等[15]研究了茉莉酸甲酯对丹参毛状根中丹参酮类成分积累和释放的影响,经茉莉酸甲酯处理后第2、6、9天隐丹参酮的含量分别达0.039、0.204、0.572 mg/g,分别是同时期未经茉莉酸甲酯处理的2.2、8.5、23.8 倍;丹参酮ⅡA的含量达0.251、0.601、1.563 mg/g,分别是未经茉莉酸甲酯处理的1.9、4.1、6.2 倍。本研究利用发根农杆菌ACCC10060诱导甜叶菊毛状根,建立了毛状根培养生产绿原酸类化合物体系,在此基础上研究茉莉酸甲酯对绿原酸类化合物积累的影响,旨在为毛状根培养生产植物次生代谢物提供参考。
1.1 材料及试剂
甜叶菊种子:购于安徽宿州,品种为丰农3号。甜叶菊无菌苗的培养参考Fu Xiao等[16]的方法,培养后的无菌苗在MS培养基+1.0 mg/L吲哚丁酸(indole-3-butytric acid,IBA)培养基继代培养,2 周后剪下甜叶菊叶片,用于诱导实验。
MS、WPM、B5培养基 青岛高科园海博生物技术有限公司;甲醇(色谱纯) 美国Tieda试剂有限公司;绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸(均为色谱纯) 上海同田生物科技有限公司;茉莉酸甲酯美国Sigma公司;DNA Marker 北京全式金生物技术有限公司。
1.2 仪器与设备
电热恒温鼓风干燥箱 上海三发科学仪器有限公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪、水平电泳仪 美国Bio-Rad有限公司;电泳成像仪 美国UVP公司;台式离心机 上海安亭仪器有限公司。
1.3 方法
1.3.1 农杆菌的活化
挑取保存于-8 0 ℃甘油中的发根农杆菌ACCC10060,于酵母甘露醇培养基(yeast mannitol broth,YMB)上进行活化,2 d后挑选单菌落,转接到YMB液体培养基,在27 ℃、115 r/min黑暗条件下进行培养,当生长到对数期时用于侵染甜叶菊叶片。
1.3.2 外植体的制备
取甜叶菊幼嫩叶片,剪成2.5~3.0 cm2左右,用无菌针头在叶片上戳若干小孔,置于1/2 MS+100 μmol/L乙酰丁香酮的固体培养基中,(27±1)℃暗培养2 d后用于毛状根诱导实验。
1.3.3 毛状根的诱导与除菌
毛状根的诱导与除菌参考Fu Xiao等[16]的方法。将预培养的叶片浸入已重悬浮的发根农杆菌菌液中,115 r/min条件下暗培养25 min。然后将侵染的叶片用无菌滤纸吸干表面多余菌液,转入1/2 MS+100 μmol/L乙酰丁香酮的固体培养基中,(27±1)℃、暗条件下共培养2 d,空白对照组用无菌水代替菌液。共培养结束后,将叶片转接至1/2 MS+50 mg/mL头孢噻肟钠中进行一次除菌培养,7 d后转至1/2 MS+50 mg/mL头孢噻肟钠培养基中进行第2次继代除菌培养,以后每7 d除菌一次。
1.3.4 液体培养基的筛选
挑选生长旺盛、分枝较多的毛状根根系,接种于无激素MS液体培养基,(27±1)℃、115 r/min黑暗条件下培养2 周,再分别称取湿质量为0.3 g左右的毛状根,接种到装有50 mL的MS、B5、WPM液体培养基(蔗糖3%,pH 6.0)中,培养5 周后收获,烘干,称质量,并测定其绿原酸类物质含量。
1.3.5 毛状根生长曲线的绘制
将培养10 d后的毛状根,接入到装有50 mL、pH 6.0的MS液体培养基中,每瓶接入毛状根鲜质量为0.3 g,27 ℃、115 r/min暗培养,每7 d收获一次,烘干,称质量。以培养时间为横坐标、干质量为纵坐标绘制生长曲线图。
1.3.6 毛状根rolB和rolC基因的PCR检测
取在无激素培养基上快速生长的无菌毛状根100 mg,按照TransGen EasyPure Plant Genomic DNA Kit的方法提取毛状根基因组DNA,同时采用同样的方法提取发根农杆菌基因组DNA,以非转化根基因组作为对照组,进行rolB和rolC基因的PCR检测。在进行PCR检测时,采用周伟等[17]设计的引物,扩增rolB(423 bp)、rolC(626 bp)基因,引物序列如表1所示。
表1 rolB rolC基因PCR扩增引物序列
Table1 Primer sequences of rolB and rolC for PCR amplification

PCR体系(15 μL):1 μL DNA、7.5 μL 2×Easy Taq PCR SuperMix(Taq DNA polymerase、MgCl2、dNTP)、5.5 μL ddH2O、0.5 μL上游引物和0.5 μL下游引物。
PCR扩增条件[16]:94 ℃预变性5 min;94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸60 s,进行35 个循环;72 ℃终延伸10 min。PCR产物在1.0%琼脂糖(Gel View染色)上电泳30 min,电泳结束后在UVP凝胶成像仪上观察结果。
1.3.7 茉莉酸甲酯诱导处理
毛状根培养至第3周时,分别加入15、45、100 μmol/L的茉莉酸甲酯诱导子溶液,pH值调至6.0,继续培养,分别在处理后的第1、2、4、8天后收获,烘干并称质量,同时测绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸的含量。
1.3.8 毛状根绿原酸类成分的提取
称取0.2 g毛状根干燥粉末,置于10 mL离心管中,加入4 mL 50%的甲醇溶液,30 ℃、180 W超声辅助提取30 min,冷却,5 000 r/min离心10 min,收集上清液。重复提取一次,合并2 次提取液,并定容至10 mL,待测。
1.3.9 绿原酸类化合物HPLC测定
检测条件[16]:色谱柱:Waters Symmetry C18柱(4.6 mm×250 mm,5 μm);流动相:0.2%醋酸水(A)和甲醇(B);流速:1 mL/min;洗脱条件:0~10 min:70% A;10~15 min:70%~45% A;15~25 min:45% A;25~26 min:45~70% A;26~30 min:70% A;检测波长:327 nm;柱温:40 ℃;进样量:10 μL。
2.1 毛状根的诱导与培养

图1 甜叶菊毛状根诱导、固体培养和液体培养过程照片
Fig.1 Pictures showing hairy root induction, solid-state culture and liquidstate culture of Stevia rebaudiana Bertoni
经发根农杆菌ACCC10060侵染的甜叶菊叶片外植体共培养10 d左右,伤口周围出现白色半透明的小突起,14 d左右陆续长出白色的诱导根,出根的部位多在外植体下端靠近叶柄及伤口处(图1C)。待根长至3~5 cm时,将其剪下并转至1/2 MS+250 mg/mL羧苄青霉素的固体培养基上,1 周后转接到1/2 MS+50 mg/mL头孢噻肟钠固体培养基上继续除菌培养,重复除菌5~6 次,除菌完全。无菌毛状根在1/2 MS固体培养基上能快速生长,呈现出多分枝、无向地性等特点(图1D)。以上这些特征与Fu Xiao等[16]研究报道一致,因此从形态学上可以初步判定经发根农杆菌ACCC10060诱导所获得的根为毛状根。挑选生长旺盛且带有较多分枝的毛状根单根,置于无激素的MS液体培养基中进行培养,其以初始部位为中心快速生长,25 d左右可以长满整瓶(图1E、F)。将所获得的有代表性的无菌毛状根置于MS液体培养基进行继代培养,供后续实验及毛状根rolB和rolC基因鉴定用。
2.2 毛状根rolB和rolC基因检测结果

图2 甜叶菊毛状根rolB rolC基因PCR扩增产物的凝胶电泳分析图
Fig.2 Gel electrophoresis analysis of PCR amplified fragments of rolB and rolC genes from Stevia rebaudiana Bertoni hairy roots
研究表明,毛状根的形成与发根农杆菌Ri质粒T-DNA上的rol家族基因有着密切关系[18]。现已证实,转入rolB和rolC基因的植物能产生毛状根如烟草、胡萝卜等,这种毛状根主要表现出生长快、分枝多和无向地性等特点[19-20]。因此,检测rolB和rolC基因成为了毛状根鉴定的主要方法。黄伟剑等[21]根据rolB基因序列设计引物,进行PCR扩增反应,从转化的广藿香毛状根DNA中扩增出一条423 bp特异片段,表明发根农杆菌TL-DNA中的rolB已成功整合到广藿香毛状根中。本研究首先从外观形态特征上对发根农杆菌ACCC10060所诱导出的根进行了甄别,选取生长快、分枝多和无向地性的根进行进一步鉴定,以未经农杆菌感染的正常甜叶菊无菌苗的根为阴性对照,检测了其基因组中的rolB和rolC基因,结果表明(图2),所诱导的根基因组中均扩增出423 bp和626 bp的特异性目标片段,且该片段与从发根农杆菌ACCC10060 Ri质粒中所扩增出的基因片段相同,而未转化的正常根中未能扩增出目标片段。因此,可以据此鉴定本实验以发根农杆菌ACCC10060所诱导出的根为毛状根。
2.3 毛状根绿原酸类成分检测结果
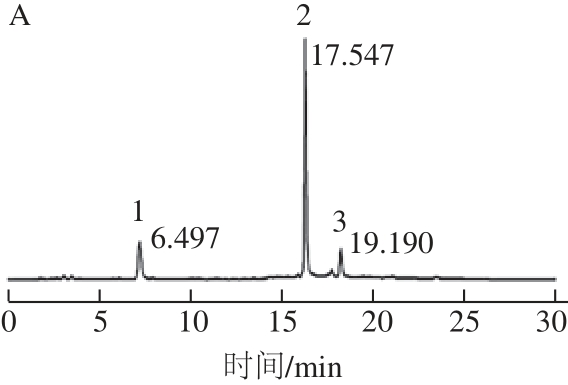

图3 毛状根绿原酸类化合物HPLC图
Fig.3 HPLC chromatograms of chlorogenic acids of hairy roots
收集甜叶菊毛状根,以超声辅助提取法提取其中的绿原酸类成分,参考Fu Xiao等[16]的HPLC法测定提取物中3 种绿原酸类单体成分的含量。从图3可知,绿原酸、3,5-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸3 个标准品的保留时间分别为6.497、17.547、19.190 min(图3A),所测毛状根样品中同时检测出了以上3 种成分,且这3 种组分有很好的分离度(图3B)。本研究基于此HPLC法,建立了3 种绿原酸成分的检测标准曲线,结果如表2所示。
表2 绿原酸类化合物标准曲线
Table2 Standard curve of chlorogenic acids

2.4 培养基优选

图4 毛状根在B5、MS和WPM3 种培养基中培养至第5周后的生物量(A)及绿原酸类化合物含量(B)B
Fig.4 Biomass and contents of chlorogenic acids of hairy roots cultured in B5, MS and WPM culture medium for5 weeks
培养基是毛状根生长及代谢产物积累的重要影响因素。在毛状根培养过程中,发现毛状根在WPM、B5和MS3 种液体培养基里的生长特性和生物量积累有明显的差别。检测结果表明(图4),培养基种类对毛状根生物量的积累影响非常大,在第5周收获时MS培养基中的生物量积累最高,干质量增加倍数约为30 倍,显著高于B5和WPM培养基;绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸产量均在MS培养中最高,分别高达3.47、11.47、3.04 mg/g。因此,MS培养基有利于毛状根的生长与绿原酸类化合物的积累,选取MS培养基进行后续实验。研究结果与王丽等[22]报道MS液体培养基更利于龙葵毛状根生长一致。MS与B5培养基无机氮源的含量较高,但两者所培养的毛状根的生物量相差很大,说明甜叶菊毛状根的生长可能与无机氮源关系不太大,主要可能是受其中有机氮源的影响,王冲之等[23]有类似的研究报道。
2.5 毛状根生长曲线的建立
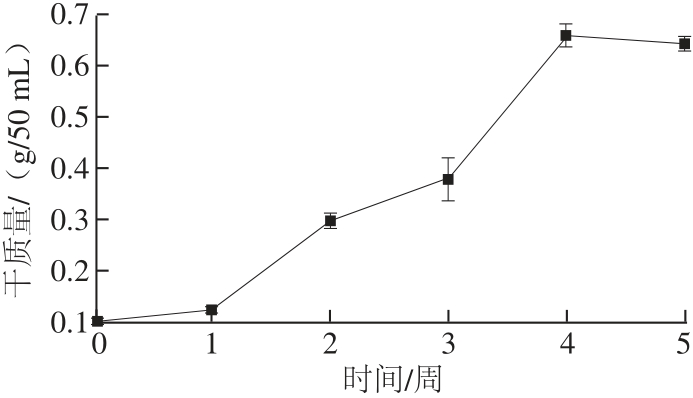
图5 甜叶菊毛状根生长曲线
Fig.5 Growth curve of Stevia rebaudiana Bertoni hairy roots
由图5可知,在MS液体培养基中毛状根生长曲线总体上呈“S”型,第1周为毛状根生长延滞期,可能是毛状根在适应新的生长环境,表现出生长迟滞的现象;2~4 周为指数生长期,此期间毛状根快速生长;至第4周末生长达到最高峰,这时干质量可达0.66 g/50 mL;在生长周期的第5周,由于培养基中的营养物质基本上被消耗掉了,毛状根由初期的乳白色变逐渐变为黄褐色,呈现老化状态(图1G),干质量呈现下降的趋势。由以上分析可知,生长周期的第3周左右为毛状根继代的最佳时期,也可能是添加诱导子最佳添加的最好时间,而第4周则是收获毛状根的最佳时间。
2.6 外源添加茉莉酸甲酯对毛状根生长的影响

图6 茉莉酸甲酯对毛状根生长的影响
Fig.6 Effect of methyl jasmonate on the growth of hairy roots
当毛状根培养到第3周时,添加3 种浓度的茉莉酸甲酯诱导,分别处理1、2、4、8 d后称其干质量,结果如图6所示。与对照组相比,添加3 种浓度的茉莉酸甲酯诱导1、2、4、8 d后都提高毛状根的生物量,其中添加15 μmol/L茉莉酸甲酯诱导第8天后,干质量增值倍数最大,生物量高达0.533 g/50 mL,为对照的1.20 倍(P<0.05),这表明茉莉酸甲酯对毛状根生长存在一定程度的促进作用。此外,茉莉酸甲酯处理的毛状根在后期培养中褐化现象比对照组更明显,可能是因为茉莉酸甲酯引起了毛状根的过敏反应,进而促进了酚酸类物质的释放。
2.7 茉莉酸甲酯对毛状根绿原酸类成分积累的影响
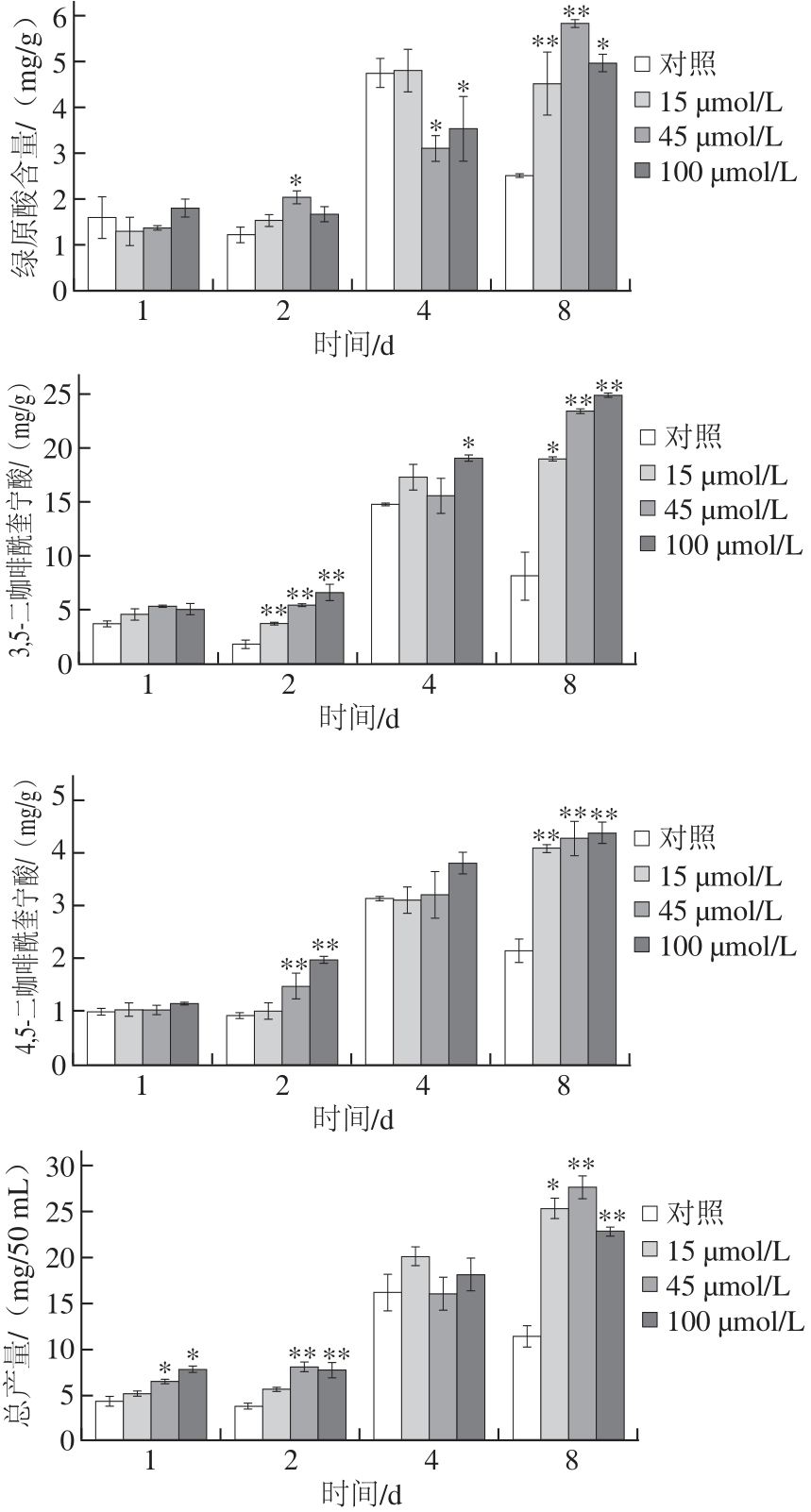
图7 茉莉酸甲酯对毛状根绿原酸类成分的影响
Fig.7 Effect of methyl jasmonate on the production of chlorogenic acids by hairy roots
由图7可知,添加3 种浓度的茉莉酸甲酯诱导第1、2天,绿原酸类化合物积累量增加不明显。当诱导到第4天时,绿原酸类化合物积累量开始增加,至第8天时绿原酸类化合物积累量显著性提高。当茉莉酸甲酯诱导浓度为45 μmol/L时,绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸以及总产量分别为5.85、23.45、4.28 mg/g和27.71 mg/50 mL,总产量是对照组的2.68 倍(P<0.01)。以上结果表明,外源添加茉莉酸甲酯对毛状根进行诱导,激发了植物细胞的信号响应机制,促进了毛状根更快地积累次生代谢物。
发根农杆菌是一种土壤农杆菌,可以侵染双子叶植物,诱发产生毛状根。目前对于毛状根的研究主要集中在植株再生与新品种培育方面,如紫高杯花和长寿花等[23]。在利用毛状根生产植物中次生代谢产物方面,目前已有不少研究报道,如利用鼠尾草[24]、丁香罗勒[25]、藿香[26]等毛状根生产酚酸类成分。
从已有的文献报道来看,发根农杆菌诱导植物产生毛状根,主要机制可能有2 个:一是叶片产生伤口后48 h会形成并且释放乙烯丁香酮等酚类物质,该类化合物可能是诱导发根农杆菌识别的信号分子;二是叶片伤口处的细胞正处于生长活跃期,会形成大量的新细胞,使得外植体更容易侵染成功,从而产生毛状根[27]。本实验室已利用发根农杆菌C58C1成功从甜叶菊叶片中诱导出毛状根,并在毛状根中检测出含量较高的绿原酸类化合物。在此基础上,利用发根农杆菌ACCC10060从预培养48 h的甜叶菊叶片外植体中诱导出毛状根,这种毛状根易于在MS液体培养基中生长,培养3 周后可积累较多的绿原酸类物质,绿原酸、3,5-二咖啡酰奎宁酸、4,5-二咖啡酰奎宁酸含量分别为1.58、3.73、0.39 mg/g。对培养基成分进行比较分析发现,MS培养基中NO3-、NH4+、NaH2PO4、CaCl2使用量较WPM、B5高,其中NaH2PO4的使用量均比B5、WPM高出4 倍,CaCl2的使用量比B5高出2 倍。此外,MS中KI(0.83 mg/L)的使用量也高于B5、WPM,但VB1(0.5 mg/L)的使用量均比WPM、B5少1 倍;3 种培养基的铁盐均采用EDTA类化合物和Fe2SO4。通过以上分析,猜测NH4NO3、KNO3、NaH2PO4、CaCl2、VB1可能是影响甜叶菊毛状根生长及次生代谢物积累的主要因素,但这些化合物对毛状根培养具体有何作用及作用的机理还有待进一步研究。
本研究建立了甜叶菊毛状根的培养体系,优化了其液体培养条件,并通过采用在液体培养体系中添加一定浓度的外源诱导子方法来提高次级代谢物的产量。实验结果表明,茉莉酸甲酯诱导能大幅度提高绿原酸类物质的产量,其主要原因可能有2 个方面:一是茉莉酸甲酯的加入提高了细胞活力,导致了生物量上升;另一方面,茉莉酸甲酯的加入可提高绿原酸类物质合成代谢途径中某些酶的活力,从而使绿原酸类物质的合成速率提高,进而提高了产量,但加入茉莉酸甲酯对绿原酸类物质代谢途径中关键酶的影响还需进一步深入研究。
添加诱导子是提高次级代谢产物含量的一种有效途径,能专一、选择性地诱导植物合成特定信号分子,产生防御反应并促进次生代谢产物的积累[12]。目前,常用的诱导子有水杨酸、茉莉酸甲酯、寡聚糖、稀土元素以及重金属等,其中茉莉酸甲酯是近年来研究的热点,它作为一类信号物质,被辨认并结合细胞膜上特定的受体,刺激细胞内产生特定细胞内信息分子,在毛状根培养中可使次生代谢相关基因激活,最终提高次生代谢物的产量[28]。诱导子在诱导植物次生代谢产物的合成过程中,其浓度效应有2 种,一种是反应饱和型,即次生产物的合成随诱导子浓度增加而增加,达到最大值后稳定;另一种是最适浓度型,即诱导反应要求最适浓度下诱导子表现出最强的活性[29]。本实验中茉莉酸甲酯浓度效应属于后者,在毛状根培养过程中添加茉莉酸甲酯,当浓度为45 μmol/L时,诱导效果最佳。
关于茉莉酸甲酯信号分子转导作用机理,目前一些相关研究报道认为,当植物处于逆境时,会自发启动相应的防御机制来抵御外来环境对自身生长的影响。首先通过细胞膜上的受体感知外界的刺激,然后通过信号转导系统,激活相应的基因,最后诱发合成次生代谢物[30]。研究发现,植物体通过积累特定次生代谢物来抵抗外界不良环境的伤害,而植物体的这种从感知到发生相应生理生化反应的过程被认为是信号转导系统,在信号转导途径中,当遇到诱导子时,首先会被植物体细胞膜上特定的受体感知,经信号转换,转变成胞内信号,形成的胞内信号再与其特定的受体结合,活化其下游的通路,最后会引发相应酶活性的变化,最终做出相应的生理生化反应[30]。在这个途径中,胞内信号通常包含有钙离子、超氧阴离子、腺苷酸环化酶[30],以及活性氧迸发的产物(H2O2和O2-•)[30-31]。文献表明当植物体遇到外源诱导子处理时,通常会诱发氧迸发,植物发生氧迸发反应后,会在其体内迅速积累较多的活性氧(如H2O2和O2-•)物质,而这些物质在植物体诱发合成次生代谢物过程中发挥着重要的信号分子作用,在活性氧大量产生的同时也会提高一些氧化酶活性,而这些具有活性的氧化酶又可以清除过多的活性氧物质,从而保护植物体免受过多活性氧的毒害,以此达到保护植物体[30]。在活性氧迸发的产物中由于O2-•的半衰期特别短,对此,大多数学者认为H2O2是次生代谢途径中不可忽视的信号分子[30],但H2O2在甜叶菊毛状根的次生代谢途径中是否同样发挥着信号分子的作用以及H2O2与茉莉酸甲酯信号分子在代谢途径中的具体作用都有待于进一步考察与研究。
参考文献:
[1] MOSETTIG E, BEGLINGER U, DOLDER F, et al. The absolute configuration of steviol and isosteviol[J]. Journal of the American Chemical Society, 1963, 85(15): 2305-2309. DOI:10.1021/ja00898a025.
[2] KARAKÖSE H, JAISWAL R, KUHNERT N. Characterization and quantif i cation of hydroxycinnamate derivatives in Stevia rebaudiana leaves by LC-MSn[J]. Journal of Agricultural & Food Chemistry, 2011, 59(18): 10143-10150. DOI:10.1021/jf202185m.
[3] KONO Y, KOBAYASHI K, TAGAWA S, et al. Antioxidant activity of polyphenolics in diets: rate constants of reactions of chlorogenic acid and caffeic acid with reactive species of oxygen and nitrogen[J]. Biochimica et Biophysica Acta, 1997, 1335(3): 335-342.
[4] HEMMERLE H, BURGER H J, BELOW P, et al. ChemInform abstract: chlorogenic acid and synthetic chlorogenic acid derivatives:novel inhibitors of hepatic glucose-6-phosphate translocase[J]. Journal of Medicinal Chemistry, 1997, 40(2): 137-145. DOI:10.1021/ jm9607360.
[5] ROBINSON W E, CORDEIRO M, ABDEL-MALEK S, et al. Dicaffeoylquinic acid inhibitors of human immunodeficiency virus integrase: inhibition of the core catalytic domain of human immunodef i ciency virus integrase[J]. Molecular Pharmacology, 1996, 50(4): 846-855.
[6] ROBINSON W E, REINECKE M G, ABDEL-MALEK S, et al. Inhibitors of HIV-1 replication that inhibit HIV integrase[J]. PNAS, 1996, 93(13): 6326-6331. DOI:10.1073/pnas.93.13.6326.
[7] STICH H F, ROSIN M P, BRYSON L. Inhibition of mutagenicity of a model nitrosation reaction by naturally occurring phenolics, coffee and tea[J]. Mutation Research/Fundamental & Molecular Mechanisms of Mutagenesis, 1982, 95(2/3): 119-128. DOI:10.1016/0027-5107(82)90251-2.
[8] 卢琪, 段家彩, 高丽, 等. 杜仲绿原酸的分离纯化及结构鉴定[J].食品科学, 2010, 31(14): 275-279.
[9] 尤秀丽, 池路花, 曹芸梅, 等. 响应面法优化微波超声双辅助提取金银花绿原酸工艺[J]. 食品工业科技, 2014, 35(12): 272-276. DOI:10.13386/j.issn1002-0306.2014.12.051.
[10] 王立志, 胡晓梅, 付其胜, 等. 绿咖啡豆中总绿原酸的纯化工艺研究[J]. 中国食品添加剂, 2014(7): 123-128. DOI:10.3969/ j.issn.1006-2513.2014.07.014.
[11] 陶如, 冯蕾, 赵法兴, 等. 白花丹参毛状根诱导体系的建立与其内生真菌提高毛状根中丹酚酸含量的研究[J]. 时珍国医国药, 2015, 26(6): 1469-1473. DOI:10.3969 /j.issn.1008-0805.2015.06.078.
[12] 孙际薇. 茉莉酸甲酯对曼陀罗毛状根的生长及次生代谢产物产生的影响[D]. 重庆: 西南大学, 2014: 12-13.
[13] YUKIMUNE Y, TABATA H, HIGASHI Y, et al. Methyl jasmonateinduced overproduction of paclitaxel and baccatin Ⅲ in Taxus cell suspension cultures[J]. Nature Biotechnology, 1996, 14(9): 1129-1132. DOI:10.1038/nbt0996-1129.
[14] 于树宏, 李玲, 潘瑞炽, 等. 茉莉酸甲酯和ABA对野葛毛状根中异黄酮含量的影响[J]. 植物生理学报, 2002, 38(4): 344-346.
[15] 王学勇, 崔光红, 黄璐琦, 等. 茉莉酸甲酯对丹参毛状根中丹参酮类成分积累和释放的影响[J]. 中国中药杂志, 2007, 32(4): 300-302. DOI:10.3321/j.issn:1001-5302.2007.04.007.
[16] FU X, YIN Z, CHEN J, et al. Production of chlorogenic acid and its derivatives in hairy root cultures of Stevia rebaudiana[J]. Journal of Agricultural & Food Chemistry, 2015, 63(1): 262-268. DOI:10.1021/ jf504176r.
[17] 周伟, 姚倩雯, 钱忠英, 等. 丹参毛状根诱导条件的优化[J]. 上海师范大学学报(自然科学版), 2007, 36(2): 93-98. DOI:10.3969/ j.issn.1000-5137.2007.02.019.
[18] DI C A, COSTANTINO P L, DI C A. Cell commitment and rolB gene expression in the induction of root differentiation[J]. Plant Cell Tissue & Organ Culture, 1996, 46(3): 203-209. DOI:10.1007/BF02307096.
[19] 徐洪伟. 高山红景天毛状根培养系统的建立[D]. 长春: 东北师范大学, 2004: 4-6.
[20] 万小荣, 李玲. 发根农杆菌Ri质粒rolB基因研究进展(综述)[J]. 亚热带植物科学, 2001, 30(3): 63-68. DOI:10.3969/ j.issn.1009-7791.2001.03.017.
[21] 黄伟剑, 何梦玲, 张宏意, 等. 发根农杆菌诱导广藿香毛状根的研究[J]. 广东药学院学报, 2015, 31(2): 156-160. DOI:10.3969/ j.issn.1006-8783.2015.02.004.
[22] 王丽, 刘琪, 罗志文, 等. 龙葵毛状根诱导及其抑菌活性的研究[J]. 安徽农业科学, 2015, 43(20): 63-65. DOI:10.3969/ j.issn.0517-6611.2015.20.022.
[23] 王冲之, 丁家宜. 不同培养基及外源激素对西洋参毛状根的生长和皂甙含量的影响[J]. 植物资源与环境学报, 2001, 10(4): 1-4. DOI:10.3969/j.issn.1674-7895.2001.04.001.
[24] 施和平, 朱远锋, 王蓓, 等. 香石竹毛状根诱导、离体培养及其植株再生[J]. 生物工程学报, 2014, 30(11): 1742-1750. DOI:10.13345/ j.cjb.140057.
[25] GRZEGORCZYK I, KRÓLICKA A, WYSOKIŃSKA H. Establishment of Salvia officinalis L. hairy root cultures for the production of rosmarinic acid[J]. Zeitschrift Für Naturforschung C Journal of Biosciences, 2006, 61(5/6): 351-356. DOI:10.1515/znc-2006-5-609.
[26] TADA H, MURAKAMI Y, OMOTO T, et al. Rosmarinic acid and related phenolics in hairy root cultures of Ocimum basilicum[J]. Phytochemistry, 1996, 42(2): 431-434. DOI:10.1016/0031-9422(96)00005-2.
[27] 吕政, 张淑丽, 路放, 等. 关苍术毛状根培养体系建立及其多糖含量测定[J]. 中国药学杂志, 2014, 49(16): 1386-1392. DOI:10.11669/ cpj.2014.16.005.
[28] SEMBDNER G, PARTHIER B. The biochemistry and the physiological and molecular actions of jasmonates[J]. Annual Review of Plant Biology, 2003, 44(1): 569-589. DOI:10.1146/annurev. pp.44.060193.003033.
[29] 李家儒, 管志勇, 刘曼西, 等. Cu2+对红豆杉培养细胞中紫杉醇形成的影响[J]. 华中农业大学学报, 1999, 18(2): 117-120. DOI:10.3321/ j.issn:1000-2421.1999.02.006.
[30] 焦蒙丽. 水杨酸和茉莉酸甲酯对丹参培养细胞迷迭香酸生物合成的诱导作用[D]. 杨凌: 西北农林科技大学, 2012: 4-5.
[31] VERPOORTE R. Elicitor signal transduction leading to production of plant secondary metabolites[J]. Biotechnology Advances, 2005, 23(4):283-333. DOI:10.1016/j.biotechadv.2005.01.003.
Induction and Culture of Stevia rebaudiana Bertoni Hairy Roots and Effect of Methyl Jasmonate on the Accumulation of Chlorogenic Acids
ZOU Kai, LIU Zebo, CHEN Jiguang, YIN Zhongping*, SHANGGUAN Xinchen, XU Xiaoxiang
(Jiangxi Key Laboratory of Natural Products and Functional Food, College of Food Science and Technology, Jiangxi Agricultural University, Nanchang 330045, China)
Abstract:In the present study, hairy roots of Stevia rebaudiana were induced by Agrobacterium rhizogenes ACCC10060, and then cultured to produce chlorogenic acids. Furthermore, the effect of methyl jasmonate on the synthesis of chlorogenic acids was also investigated. Leaf explants of Stevia rebaudiana were infected with Agrobacterium rhizogenes ACCC10060, and then co-cultured for inducing hairy roots. After14 days, hairy roots grew out. The PCR analysis results indicated that the rolB and rolC genes of Ri plasmid in Agrobacterium rhizogenes were successfully transferred into the hairy root genome, which confirmed that the tested induced roots were hairy roots. Compared with B5 and WPM liquid medium, MS was more suitable for hairy root growth and the accumulation of chlorogenic acids. After 35-day culture, the dry weight of hairy roots increased about 30 times, and the maximum contents of chlorogenic acid, 3,5-dicaffeylquinic acid, and 4,5-dicaffeylquinic acid were 3.47, 11.47 and 3.04 mg/g, respectively. Methyl jasmonate solutions at 15, 45 and 100 µmol/L were added into the medium, respectively as an inducer for higher production of chlorogenic acids after three weeks of culture. Both biomass and chlorogenic acid content were increased when the hairy roots were treated with methyl jasmonate for 1, 2,4 and8 days respectively. The optimal concentration of methyl jasmonate was 45 µmol/L for chlorogenic acid production. The total yield of chlorogenic acids was increased to 2.68 folds as compared to that of the control group (P < 0.01). These results suggested that Stevia rebaudiana hairy roots could be used to produce chlorogenic acids and that methyl jasmonate treatment could significantly increase chlorogenic acid production.
Key words:Stevia rebaudiana; Agrobacterium rhizogenes; hairy root; methyl jasmonate; chlorogenic acids
DOI:10.7506/spkx1002-6630-201712014
中图分类号:�图分类号:Q943.4
文献标志码:A
文章编号:1002-6630(2017)12-0089-07
收稿日期:2016-09-28
基金项目:江西省食品药品监督管理局科技计划项目(2015yp17);江西省科技支撑计划项目(2010BNB00503);国家自然科学基金地区科学基金项目(31260368)
作者简介:邹凯(1990—),男,硕士研究生,研究方向为天然产物与功能食品。E-mail:455016597@qq.com
*通信作者:尹忠平(1971—),男,副教授,博士,研究方向为天然产物与功能食品。E-mail:364207482@qq.com
引文格式:邹凯, 刘泽波, 陈继光, 等. 甜叶菊毛状根的诱导培养及茉莉酸甲酯对其绿原酸类物质积累的影响[J]. 食品科学, 2017, 38(12): 89-95.
DOI:10.7506/spkx1002-6630-201712014. http://www.spkx.net.cn
ZOU Kai, LIU Zebo, CHEN Jiguang, et al. Induction and culture of Stevia rebaudiana Bertoni hairy roots and effect of methyl jasmonate on the accumulation of chlorogenic acids[J]. Food Science, 2017, 38(12): 89-95. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712014. http://www.spkx.net.cn