赵丽芳1,2,马翠云3,罗海澜2,王 飞1,3,*
(1.漯河医学高等专科学校 漯河市医学生物工程重点实验室,河南 漯河 462002;2.漯河医学高等专科学校基础医学部,河南 漯河 462002;3.漯河医学高等专科学校食品营养系,河南 漯河 462002)
摘 要:从赣南野生松木上分离到1 株产蓝色素真菌F10,该菌经鉴定为葡萄糖座科Pseudofusicoccum属。为研究F10产生的蓝色素的 性质,实验采用不同pH值、温度、光照、金属离 子、氧化剂和还原剂处理蓝色素,结果表明,该蓝色素对光照、温度、氧化剂都不敏感,对pH值、金属离子、还原剂敏感,推测这几种因素可能改变了色素的化学结构。为确定该蓝色素的结构成分,采用高效液相色谱串联质谱、红外光谱法对其进行鉴定,结果表明该色素为芳香族羧酸类化合物。
关键词:葡萄糖座科Pseudofusicoccum属;蓝色素;性质
色素即着色剂,是印染工业和食品添加剂的一个重要组成部分[1]。色素一般分为合成色素和天然色素。虽然合成色素占据市场的主导地位,但是随着合成色素具有毒性、致癌性,甚至可能导致对重要机体损伤的报道,其安全性成为消费者关注的最大热点[2-4]。比较而言,天然色素具有安全可靠、无毒副作用、色调自然等优点,某些天然色素还有抗肿瘤及其他生理功能[5-8],越来越受到关注。微生物色素因生产不受资源、环境和空间的限制,具有植物色素和动物色素无可比拟的优越性[9-10]。在自然界中微生物能产生色素的种类丰富,但在发酵工业中得到应用的为数不多,国际上被正式批准生产的天然蓝色素种类很少,而用微生物发酵生产的蓝色素更是罕见[11]。
天然蓝色素中有的具有抑菌作用(主要对革兰氏阳性菌),如放线紫素和石蕊杀菌素;有的具有保健功能,如花青素[12-14],有的作为酸碱指示剂[8]。目前真菌产蓝色素的研究还鲜见报道。对江西野外松木中分离得到的1 株产蓝色素的真菌F10进行了生物学鉴定,经鉴定为葡萄糖座科Pseudofusicoccum属,优化了产色素条件,对蓝色素的稳定性及结构进行了分析[15-16],以期为开发利用天然蓝色素资源提供理论依据。
1.1 材料与试剂
菌株F10由江西野外松木中分离得到。
基础接种培养基为马铃薯蔗糖琼脂(potato saccharose agar,PSA)培养基:马铃薯200 g、蔗糖20 g、琼脂20 g、ddH2O1 000 mL;发酵培养基为马铃薯蔗糖(potato saccharose,PS)培养基。
氯化铵、甘氨酸、硝酸钾、尿素、ZnSO4、MgSO4、Fe2(SO4)3天津市津东天正精细化学试剂厂;水解乳蛋白和酵母膏 北京奥博星生物技术有限责任公司;甲醇、乙醇、二氯甲烷、二甲基甲酰胺、丙酮、石油醚天津市四友精细化学品有限公司;Pfu高保真酶、底物、总DNA提取试剂盒 北京全式金生物技术公司;分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
RE2A型旋转蒸发器 上海亚荣生化仪器厂;Varian cary 100型紫外-可见分光光度计、高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用仪 美国Agilent公司;低温高速离心机 德国Beckman公司。
1.3 方法
1.3.1 F10菌株培养
固体培养:将保 存于4 ℃ PSA斜面的F10菌株接种于PSA平板上,28 ℃培养3 d。
发酵培养:无菌条件下,用打孔器接种直径6 mm、菌龄一致的F10菌块于装有100 mL PS培养基的250 mL摇瓶中,28 ℃、200 r/min培养7 d。
1.3.2 F10菌株ITS鉴定
利用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法提取F10菌株的基因组[17-18],取少许新鲜菌丝体,加液氮研磨,加入2 mL 2% CTAB,重新悬浮;加入200 μL蛋白酶K(20 mg/mL),轻轻混匀,65 ℃水浴45 min,13 000 r/min离心10 min;取上清液加入一新离心管中,加入等体积的酚-氯仿-异戊醇(25∶24∶1,V/V),12 000 r/min离心10 min;吸上清液,加入等体积的氯仿-异戊醇(24∶1,V/V),12 000 r/min离心10 min;将上清液小心吸入新的离心管中,加入等体积的异丙醇,-20 ℃放置1 h,12 000 r/min离心10 min;弃上清液,用冰冷的70%乙醇清洗沉淀,颠倒离心管数次,12 000 r/min离心5 min,重复洗涤一次后,超净工作台中室温干燥;加入40 μL灭菌的ddH2O溶解,-20 ℃条件下保存,备用。利用提取的总DNA对转录间隔区(internal transcribed spacer,ITS)保守序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增获得目的基因片段。核糖体RNA基因间隔区ITS常用于真菌类的分子生物学鉴定,采用通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’),PCR体系:10×Buffer5 μL、10 mmol/L dNTP4 μL、引物各l μL、Pfu酶l μL(5 U/μL)、模板DNA1 μL,ddH2O补足至50 μL。PCR条件:94 ℃预变性5 min,94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检验后送上海生工生物技术公司进行测序。
1.3.3 培养条件优化
PS培养基添 加质量浓度为20 g/L的不同碳源,如淀粉、蔗糖、葡萄糖、果糖、麦芽糖、乳糖等,培养7 d,确定最佳碳源;在最佳碳源培养条件下添加质量浓度为2 g/L的不同氮源,如氯化铵、硝酸钾、尿素、甘氨酸、水解乳蛋白、酵母提取物等;在最佳碳源时分别用3 mol/L HCl溶液和6 mol/L NaOH溶液调pH值为5、6、7、8、9、10,确定最佳初始pH值;所有处理设3 个重复。接种后置于28 ℃条件下摇床培养7 d,测菌体生长量和产色素量。菌体生长量用菌丝干质量表示,鲜菌体去离子水洗2 遍,于60 ℃烘箱中烘至恒质量后称量。收集发酵液,在580 nm波长处测定其OD值,此为胞外色素;称取等量的鲜菌丝体,利用超声波破碎,8 000 r/min离心10 min收集上清液,测定其OD580nm,此为胞内色素。
1.3.4 色素在不同溶剂中的溶解性
各称取湿菌体1 g入50 mL离心管中,分别加入ddH2O、甲醇、乙醇、二氯甲烷、二甲基甲酰胺(N,N-dimethylformamide,DMF)、丙酮、石油醚各15 mL,在400 W、间歇2 s、破碎1 s的条件下,超声破碎30 min,8 000 r/min离心15 min取上清液,进行全波长扫描。
1.3.5 色素的稳定性
1.3.5.1 pH值对蓝色素稳定性的影响
将色素分别溶于pH 3、4、5、6、7、8、9、10的水溶液中,混匀,静置12 h,观察pH值对蓝色素的影响,在200~800 nm波长范围内进行光谱扫描,根据下式计算残存率(residual rate,RSR):
1.3.5.2 光线对蓝色素稳定性的影响
将1.3.5.1节中RSR最高的色素溶液分为3 份,一份置于室内自然光下,分别在0、4、8 h后,在200~800 nm波长范围内进行光谱扫描,计算RSR;一份置于紫外灯下,分别在0、20、40、60、80、100 min后,在200~800 nm波长范围内进行光谱扫描,计算RSR;一份置于黑暗中,分别在0、12、24 h后,在200~800 nm波长范围内进行光谱扫描,计算RSR。
1.3.5.3 温度对蓝色素稳定性的影响
将1.3.5.1节中RSR最高的色素溶液,分别在室温、20、60、80、100 ℃恒温水浴中放置1 h,冷却至室温后进行定容,测最大吸收峰的OD值,计算RSR。
1.3.5.4 金属离子对蓝色素稳定性的影响
将1.3.5.1节中RSR最高的色素溶液,分别加入Mg2+、Fe3+、Zn2+3 种金属离子,使金属离子浓度为0.1 mol/L,摇匀,静置90 min后,以不加金属离子的色素溶液为对照,测最大吸收峰处的OD值,计算RSR。
1.3.5.5 氧化剂和还原剂对蓝色素稳定性的影响
在OD580nm为2.9的蓝色素水溶液中分别添加氧化剂H2O2和还原剂Na2SO3,使H2O2和Na2SO3的终质量分数为0.2%、0.4%、0.6%,室温静置1 h后,测最大吸收峰处的OD值,计算RSR。
1.3.6 色素的提取及纯化鉴定
菌丝冷冻干燥,加入酸性pH 5的二氯甲烷,振荡浸提20 min,过滤,水洗除去稀盐酸,合并有机相,无水MgSO4干燥,减压除溶剂,得色素粗品,进行薄层层析。硅胶柱层析分离,采用石油醚-二氯甲烷(分别为4∶1、2∶1、2∶3、0∶1,V/V)2 倍柱体积进行洗脱,接着pH 5的二氯甲烷-甲醇(分别为500∶1、250∶1、200∶1、100∶0.8、100∶1、100∶1.5、50∶1,V/V)梯度洗脱获得纯品,HPLC-MS、红外光谱等对其进行初级结构鉴定。
1.4 数据处理
检验正态分布和单因素方差分析(o n e-w a y ANOVA)检验处理间均值差异,显著性由统计软件SAS 8完成,用Microsoft Excel作图。
2.1 F10 ITS片段的序列测定及进化树分析
漯河市医学生物工程重点实验室于2013年分离到菌株F10,对其进行分子生物学鉴定。用引物以菌株F10的基因组DNA为模板,进行PCR扩增其ITS序列,扩增结果送生工生物工程(上海)股份有限公司测序。序列提交GenBank,获登录序列号FJ888472.1。与NCBI上相似序列经BLAST比对的结果表明:该菌株与Pseudofusicoccum属的Pseudofusicoccum violaceum的ITS序列相似度为98%,与Pseudofusicoccum ardesiacum的ITS序列相似度为95%。根据比对结果,在GenBank中选取与F10 ITS序列相似度高的菌株构建系统发育树,结果显示,F10与Pseudofusicoccum violaceum构成一支。该菌气生菌丝的着色随真菌和孢子的生长由灰白色变为黑色(图1A),在培养皿背面颜色逐渐变蓝灰色(图1B),最终变为蓝黑色,气生菌丝顶端形成头状孢囊梗(图1C),产生透明孢囊(图1D)。

图1 F10菌落、孢囊梗及孢囊形态特征
Fig.1 Colonial morphology, sporangiophore and sporscyst of F10
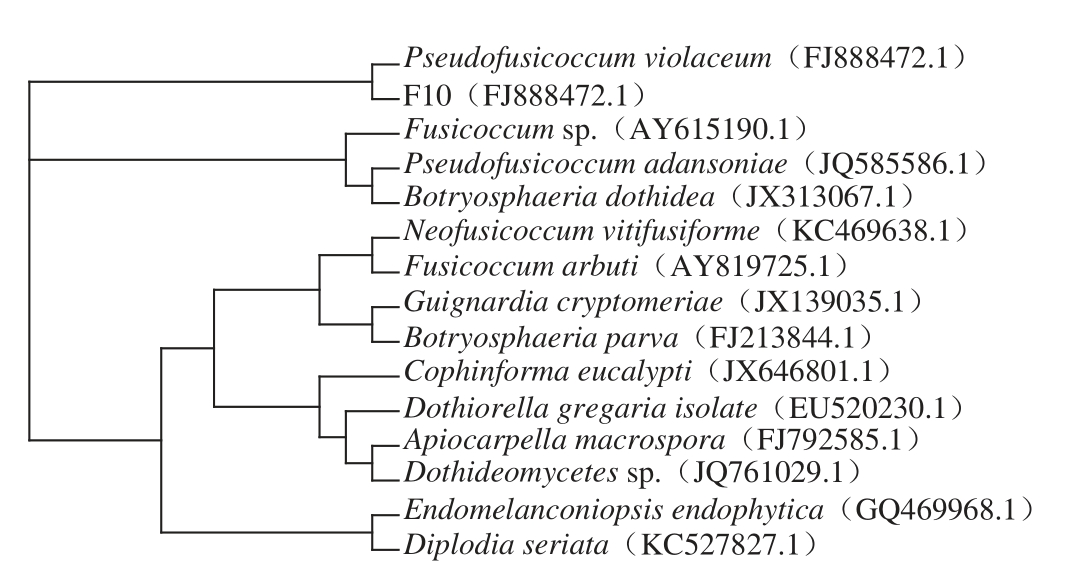
图2 根据菌株F10 ITS序列与相似菌相应序列构建进化树
Fig.2 Multifurcating phylogenetic tree indicating the overall relationship between F10 ITS sequence and other homologous sequences
利用序列比对软件ClustalX1.83和系统发育分析软件PHYLIP3.68使用Neighbor-Joining法构建系统进化树,TreeView软件示图如图2,进化分析(图2)并结合形态特征分析确定F10属于葡萄座科Pseudofusicoccum属。
2.2 碳源对F10菌生长量和产色素量的影响

图3 碳源对F10菌体生长量、胞外色素及胞内色素产量的影响
Fig.3 Effect of carbon sources on the growth of Pseudofusicoccum F10 and the production of intracellular and extracellular pigments
无菌条件下,用打孔器接种直径6 mm、菌龄一致的F10菌块于不同碳源的PS液体培养基中,28 ℃、200 r/min培养7 d。如图3所示,就菌体生长量来看,碳源的选择依次为淀粉、麦芽糖、葡萄糖、蔗糖和甘油;甘油作为碳源不产色素,碳源为麦芽糖和淀粉时的色素产量高,其次为蔗糖和葡萄糖。综合菌体生长量及色素产量,麦芽糖为F10的最佳碳源,从成本考虑,淀粉和蔗糖也是不错的选择[19]。
2.3 氮源对F10菌生长量和产色素量的影响
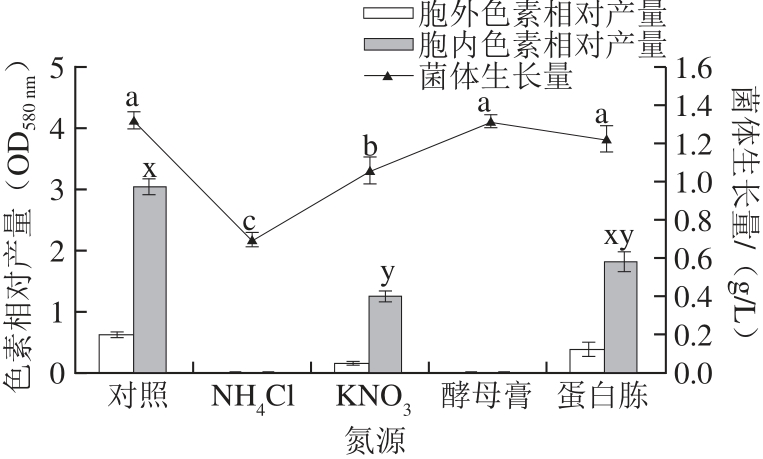
图4 氮源对F10菌体生长量、胞外色素及胞内色素产量的影响
Fig.4 Effect of nitrogen sources on the growth of Pseudofusicoccum F10 and the prod uction of intracellular and extracellular pigments
综合菌体生长、产色素量及成本考虑,本次实验以蔗糖为碳源。后续最佳氮源优化实验中(图4),与对照相比添加氮源对菌体生长及产色素量都没有促进作用。相反,添加NH4Cl和酵母膏后F10不产色素,其他几种氮源的加入也减少了色素的产生,这可能是PS培养基中原有的氮源足以满足F10色素的产生,多余的氮源反而会抑制F10色素的产生。这一现象与在放线菌Gordonia amicalis y1上的实验结果相似[20]。
2.4 初始pH值对F10菌生长量和产色素量的影响
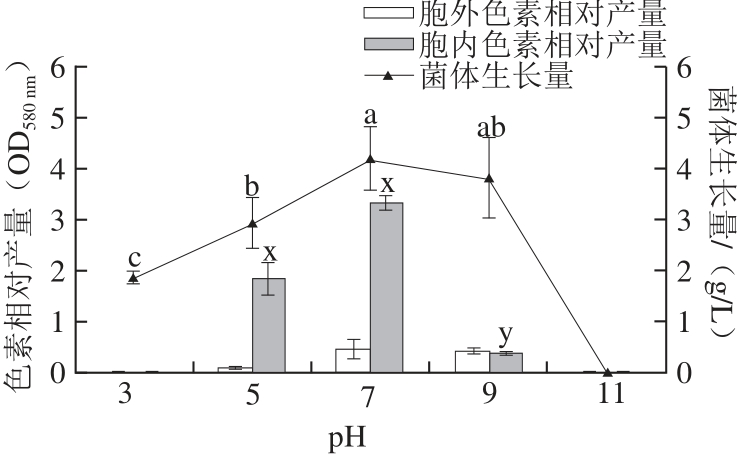
图5 初始pH值对F10菌体生长量及产胞内外色素量的影响
Fig.5 Effect of initial pH value on the growth of Pseudofusicoccum F10 and the production of intracellular and extracellular pigments
培养基的初始pH值对F10菌生长量和产色素量均有影响,如图5所示。菌株在中性环境(pH 7)中生长量和胞内色素产量最高;当初始pH 5时,胞内色素产量较高;在初始pH 9时,色素产量较低;当初始pH 3时,只有少量菌体生长,没有色素产生;当初始pH 11时,没有菌体生长,说明过酸过碱的环境都不利于F10的生长和色素产生。
2.5 色素在不同溶剂中的溶解性
菌株F10同时能产胞内、外蓝色素,从前面的实验结果看,F10胞内色素产量远大于胞外色素。因此,本实验利用超声破碎法获得胞内色素,并观察胞内色素在不同溶剂中的溶解性,结果显示,胞内色素易溶于DMF和水,呈靛蓝色;微溶于二氯甲烷、甲醇、乙醇,呈淡蓝色;不溶于丙酮、石油醚等。由此可见,该蓝色素易溶于极性强的溶剂,不溶于极性小的溶剂。
2.6 蓝色素的稳定性
2.6.1 pH值对蓝色素稳定性的影响

图6 pH值对蓝色素稳定性的影响
Fig.6 Effect of pH value on blue pigment stability of Pseudofusicoccum F10
由图6可知,该色素在碱性(pH 10)水溶液中为暗紫红色,在偏碱性(pH 8~9)水溶液中呈蓝灰色;在中及酸性水溶液中为蓝色,在中性溶液中溶解度最好,pH 3~4酸性水溶液中色素溶解度变小,以沉淀析出。
2.6.2 光线对蓝色素稳定性的影响
取等量的pH 7的蓝色素水溶液分别置于日光、紫外光以及黑暗中处理,研究光线对蓝色素的影响,结果显示色素在日光和黑暗中有少量降解,而紫外光线却对其没有降解作用。
2.6.3 温度对蓝色素稳定性的影响
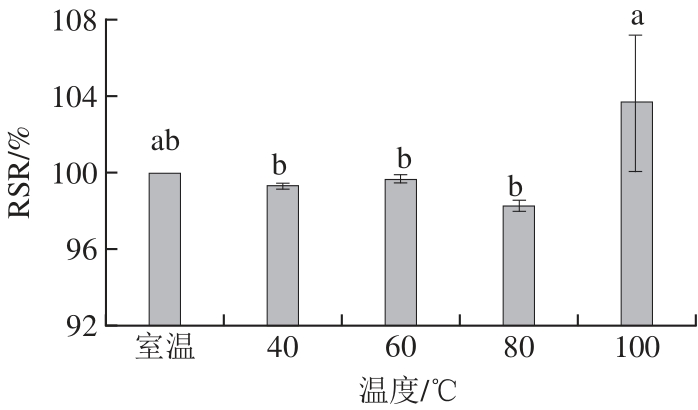
图7 不同温度对蓝色素稳定性的影响
Fig.7 Effect of temperature on blue pigment stability of Pseudofusicoccum F10
由图7可知,蓝色素在80 ℃条件下RSR有所下降,到100 ℃时RSR与室温相比没有显著变化,表明蓝色素的热稳定性较好。
2.6.4 金属离子对蓝色素稳定性的影响
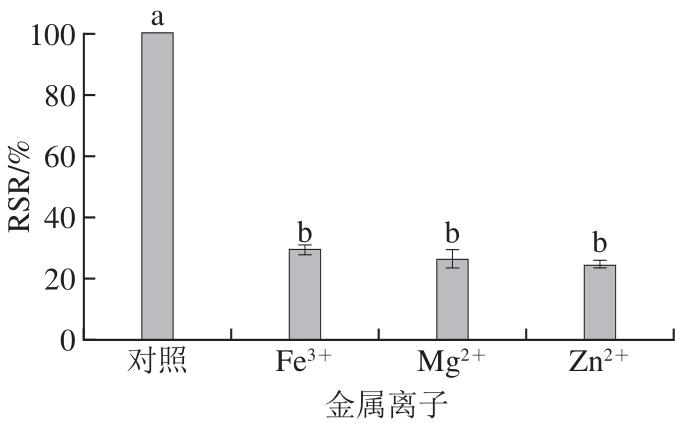
图8 金属离子对蓝色素稳定性的影响
Fig.8 Effect of metal ions on blue pigment stability of Pseudofusicoccum F10
由图8可知,加入金属离子后RSR明显下降,但几种金属离子对蓝色素的影响数据间差异不显著。推测可能是金属离子改变了蓝色素基团间的空间结构导致。
2.6.5 氧化剂与还原剂对蓝色素稳定性的影响
由图9可知,添加0.6% H2O2时蓝色素的RSR为99%,说明氧化剂对该色素的稳定性没有影响;而低质量分数的还原剂Na2SO3就对该色素有很强的破坏作用,当还原剂Na2SO3的质量分数为0.6%时色素的RSR仅为1.64%,说明还原剂可能破坏了该色素的立体结构,或改变了其基团的亲水性,进而影响了其稳定性。
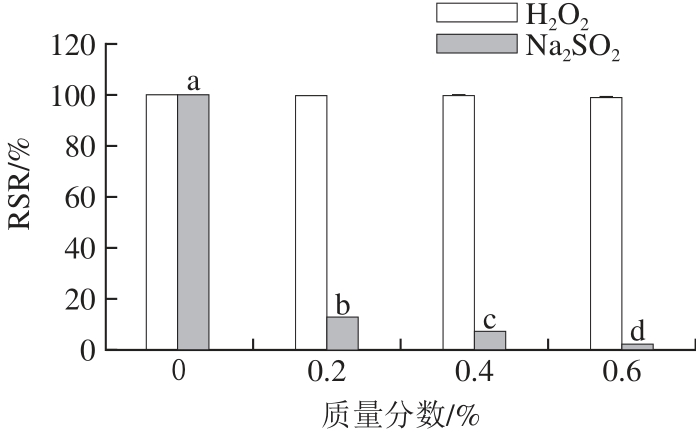
图9 氧化剂与还原剂对蓝色素稳定性的影响
Fig.9 Effects of oxidizers and reductants on blue pigment stability of Pseudofusicoccum F10
2.7 色素的提取及纯化鉴定

图10 蓝色素薄层层析图
Fig.10 TCL of the blue pigment from Pseudofusicoccum F10
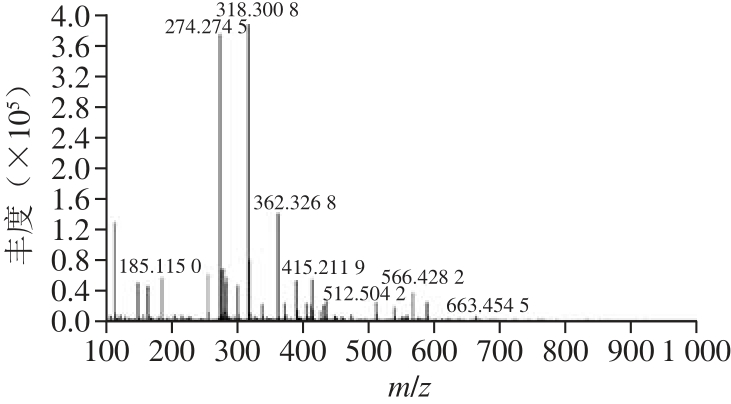
图11 蓝色素的HPLC-MS鉴定分析
Fig.11 HPLC-MS analysis of the blue pigment from Pseudofusicoccum F10
因DMF的沸点较高,实验采用酸性二氯甲烷萃取比移值为0.54组分的色素(二氯甲烷-甲醇体积比2∶1)(图10),并用旋转蒸发仪浓缩提取的色素;采用柱层析法进行分离,获得色素纯品(0.114 g/L)。利用HPLCMS、红外色谱对物质进行鉴定。由图11可知,产物为羧酸类化合物(m/z 318、274的碎片峰)。
上述结论可以从红外光谱分析(图12)得到验证,3 423 cm-1为羧酸中缔合的O—H,峰形宽而散,吸收强度中;羧酸分子中的双分子缔合,使得C=O的吸收峰向低波数方向移动,因此,1 719 cm-1为C=O吸收峰,肩峰,吸收强度中;1 304、1 226 cm-1为C—O的伸缩振动峰,肩峰,吸收强度中。3 100~3 000 cm-1附近,有较弱的峰,吸收强度较弱,但1 582、1 542、1 500 cm-13 处中强峰,则可鉴定含有苯环,即产物为芳香化合物。虽然,3 000~2 850 cm-1之间表示CH3中C—H伸缩振动的多重峰较弱,但1 427 cm-1处,多重峰,吸收强度中,则为CH3中C—H弯曲振动。以上可以说明产物为芳香族羧酸类化合物。

图12 蓝色素的红外光谱分析
Fig.12 FT-IR spectrum of the blue pigment from Pseudofusicoccum F10
红、黄品系的天然色素来源较多,而蓝色素则较罕见。目前,报道的产蓝色菌多为放线菌[21-22],产蓝色素的真菌鲜见报道。本实验室从野外分离到1 株产蓝色素真菌F10,经形态和分子鉴定,确定该蓝色素产生菌为葡萄座科Pseudofusicoccum属。葡萄座腔菌科是子座中或子囊中产生双腔壁的真菌的总称;囊实体由单腔形式到多腔结构;子囊圆柱形或者通常多个形状、棍棒状,经常具有不明确的颈,子囊孢子透明,单细胞;该类真菌是农业和林业上重要的病原菌、内生真菌或潜在的致病菌,寄主范围广,分布于全球,在生态系统中占有重要的地位[23]。但该属中产蓝色素的菌鲜见报道。
实验结果表明,该色素易溶于中性偏碱性(pH 7~9)溶液,溶于酸性溶液和极性大的有机溶剂,不溶于非极性溶剂,这与天蓝色链霉菌所产蓝色素的溶解性相似[24]。该色素的光、热及氧化剂的稳定性都较好,但对还原剂和金属离子敏感。说明该色素基团比较稳定,这与本实验结构分析结果为羧酸类化合物相印证。该蓝色素对紫外光、热,特别是氧化剂的高稳定性,为其今后在食品加工、印染[25-26]、化妆品等方面的应用奠定了良好的基础。
实验中该真菌生长最适碳源为淀粉,在葡萄糖为唯一碳源时生长量最低,应当是F10适应于在野生丛林环境生态的结果。微生物对于生长所必需的最适碳源的选择应依赖自身的酶系统,结果中F10以淀粉为碳源生长量最大可能是因为其淀粉酶的优先表达;而葡萄糖作为唯一碳源时生长量最低或是因为葡萄糖本身对其生长存在一定的抑制。
由于本研究中菌株F10为野生株,拟进一步进行菌种诱变选育,以提高其色价相对单位;并对蓝色素开展毒理学评价,以便该蓝色素能应用于行业生产。
参考文献:
[1] 车双辉, 杜琪珍, 夏明. 天然蓝色素的研究进展[J]. 食品研究与开发, 2003, 24(2): 18-20. DOI:10.3969/j.issn.1005-6521.2003.02.007.
[2] ABEROUMAND A. A review article on edible pigments properties and sources as natural biocolorants in foodstuff and food industry[J]. World Journal of Dairy and Food Sciences, 2011, 6(1): 71-78.
[3] SADILOVA E. Pigments in food: a challenge to life sciences[J]. European Food Research and Technology, 2007, 225(3): 613-614. DOI:10.1007/ s00217-007-0599-7.
[4] BRIDLE P, TIMBERLAKE C F. Anthocyanins as natural food coloursselected aspects[J]. Food Chemistry, 1997, 58(1): 103-109. DOI:10.1016/ S0308-8146(96)00222-1.
[5] 毛得奖, 朱 亚玲. 我国食用天然蓝色素研究进展[J]. 中国食品添加剂, 2011(4): 149-155. DOI:10.3969/j.issn.1006-2513.2011.04.023.
[6] OTHMAN S, PARTON R, COOTE J. Interaction between mammalian cells and Pasteurella multocida B: 2. adherence, invasion and intracellular survival[J]. Microbial Pathogenesis, 2012, 52(6): 353-358. DOI:10.1016/j.micpath.2012.03.005.
[7] VELMURUGAN P, KAMALA-KANNAN S, BALACHANDAR V, et al. Natural pigment extraction from five filamentous fungi for industrial applications and dyeing of leather[J]. Carbohydrate Polymers, 2010, 79(2): 262-268. DOI:10.1016/j.carbpol.2009.07.058.
[8] MANIKPRABHU D, LINGAPPA K. γ-Actinorhodin a natural and attorney source for synthetic dye to detect acid production of fungi[J]. Saudi Journal of Biological Sciences, 2013, 20(2): 163-168. DOI:10.1016/ j.sjbs.2013.01.004.
[9] WANG Hailei, REN Zhifang, LI Ping, et al. Improvement of the production of a re d pigment in Penicillium sp. HSD07B synthesized during co-culture with Candida tropicalis[J]. Bioresource Technology, 2011, 102(10): 6082-6087. DOI:10.1016/j.biortech.2011.01.040.
[10] DUFOSSEE L, GALAUP P, YARON A, et al. Microorganisms and microalgae as sources of pigments for food use: a scientific oddity or an industrial reality?[J]. Trends in Food Science and Technology, 2005, 16(9): 389-406. DOI:10.1016/j.tifs.2005.02.006.
[11] MARGALITH P Z. Pigment microbiology[M]. London: Chapman and Hall, 1992: 130-143.
[12] GAUSE G F. Litmocidin, a new antibiotic substance produced by Proactinomyces cyaneus[J]. Journal of Bacteriology, 1946, 51(6): 649.
[13] FRAMPTON V L, TAYLOR C F. Isolation and identification of pigment present in cultures of Actinomyces violaceus-ruber[J]. Phytopathology, 1938, 28(7): 467-475.
[14] BROCKMANN H, PINI H. Actinorhodin, ein roter Farbstoff aus Actinomyceten[J]. Naturwissenschaften, 1947, 34(6): 190. DOI:10.1007/ BF00602581.
[15] SANTOS-EBINUMA V C, ROBERTO I C, TEIXEIRA M F S, et al. Improving of red colorants production by a new Penicillium purpurogenum strain in submerged culture and the effect of different pa rameters in their stability[J]. Biotechnology Progress, 2013, 29(3):778-785. DOI:10.1002/btpr.1720.
[16] RAMACHANDRAN H, IQBAL M A, AMIRUL A A. Identification and characterization of the yellow pigment synthesized by Cupriavidus sp. USMAHM13[J]. Applied Biochemistry and Biotechnology, 2014, 174(2): 461-470. DOI:10.1007/s12010-014-1080-2.
[17] GUO L D, HYDE K D, LIEW E C Y. Identification of endophytic fungi from Livistona chinensis based on morphology and rDNA sequences[J]. New Phytologist, 2000, 147(3): 617-630. DOI:10.1046/ j.1469-8137.2000.00716.x.
[18] SAGHAI-MAROOF M A, SOLIMAN K M, JORGENSEN R A, et al. Ribosomal DNA spacer-length polymorphisms in barley: mendelian inheritance, chromosomal location, and population dynamics[J]. PNAS, 1984, 81(24): 8014-8018. DOI:10.1073/pnas.81.24.8014.
[19] CASAROLI-MARANO R P, SOUSA-MARTINS D, MARTINEZCONESA E M, et al. Dye solutions based on lutein and zeaxanthin:in vitro and in vivo analysis of ocular toxicity profiles[J]. Current Eye Research, 2015, 40(7): 707-718. DOI:10.3109/02713683.2014.952831.
[20] 王飞, 罗海澜, 刘畅, 等. 碳氮源、初始pH值对Gordonia amicalis y1色素产量的影响[J]. 食品工业, 2011, 32(3): 63-65.
[21] 赵辉. 一株产蓝色素海洋链霉菌及其色素性质的研究[J].食品研究与开发, 2009, 30(6): 186-189. DOI:10.3969/ j.issn.1005-6521.2009.06.056.
[22] 孙延涛. 一种链霉菌产蓝色素各成分的分离与分析[J]. 微生物学杂志, 2007, 27(6): 5-7. DOI:10.3969/j.issn.1005-7021.2007.06.002.
[23] 程燕林, 梁军, 吕全, 等. 葡萄座腔菌科研究进展: 鉴定、系统发育学和分子生态学[J]. 生态学报, 2011, 31(11): 3197-3207.
[24] 张和春, 陈亮,季文明, 等. 产蓝色素放线菌的初步鉴定和蓝色素性质研究[J]. 无锡轻工大学学报, 1999, 18(3): 23-28.
[25] VELMURUGAN P, KAMALA-KANNAN S, BALACHANDAR V, et al. Natural pigment extraction from five filamentous fungi for industrial applications and dyeing of leather[J]. Carbohydrate Polymers, 2010, 79(2): 262-268. DOI:10.1016/j.carbpol.2009.07.058. [26] KRAMAR A, ILIC-TOMIC T, PETKOVIC M, et al. Crude bacterial extracts of two new Streptomyces sp. isolates as bio-colorants for textile dyeing[J]. World Journal of Microbiology and Biotechnology, 2014, 30(8): 2231-2240. DOI:10.1007/s11274-014-1644-x.
Identification of a Fungal Strain F10 Producing Blue Pigment and Properties of the Pigment
ZHAO Lifang1,2, MA Cuiyun3, LUO Hailan2, WANG Fei1,3,*
(1. Luohe Key Laboratory of Medical Bioengineering, Luohe Medical College, Luohe 462002, China; 2. Department of Basic Medicine, Luohe Medical College, Luohe 462002, China; 3. Department of Food Science and Human Nutrition, Luohe Medical College, Luohe 462002, China)
Abstract:A fungal strain producing blue pigment, named F10, was isolated from a wild pine in southern Jiangxi, and it was identified as a member of the genus Pseudofusicoccum in the family Botryosphaeria by using ITS rDNA sequence homology comparison as well as morphological traits. We studied the stability of blue pigment when exposed to different solvents, pH values, temperatures illumination intensities, metal ions, oxidizers and reductants. The data showed that the pigment was sensitive to pH, metal ions, and reductants but not light, temperature or oxidants. We speculated that pH, metal ions, and reductants might change the structure of the pigment. Analysis of the basic chemical structure by high performance liquid chromatography-mass spectrometry (HPLC-MS) and infrared spectroscopy (IR) revealed that the pigment was aromatic carboxylic acid compounds.
Key words:the genus Pseudofusicoccum in the family Botryosphaeria; blue pigment; properties
DOI:10.7506/spkx1002-6630-201712017
中图分类号:Q815
文献标志码:A
文章编号:1002-6630(2017)12-0112-07
引文格式:
赵丽芳, 马翠云, 罗海澜, 等.1 株产蓝色素真菌F10的ITS序列及其色素性质分析[J]. 食品科学, 2017, 38(12): 112-118. DOI:10.7506/spkx1002-6630-201712017. http://www.spkx.net.cn
ZHAO Lifang, MA Cuiyun, LUO Hailan, et al. Identification of a fungal strain F10 producing blue pigment and properties of the pigment[J]. Food Science, 2017, 38(12): 112-118. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201712017. http://www.spkx.net.cn
收稿日期:2016-05-27
基金项目:漯河医学高等专科学校校级项目(2014-S-LMC14)
作者简介:赵丽芳(1986—),女,讲师,硕士,研究方向为分子生物学与天然产物的开发和应用。E-mail:zhaolifang0401@163.com
*通信作者:王飞(1972—),男,副教授,博士,研究方向为生物化学与天然产物开发。E-mail:whovering@yahoo.com