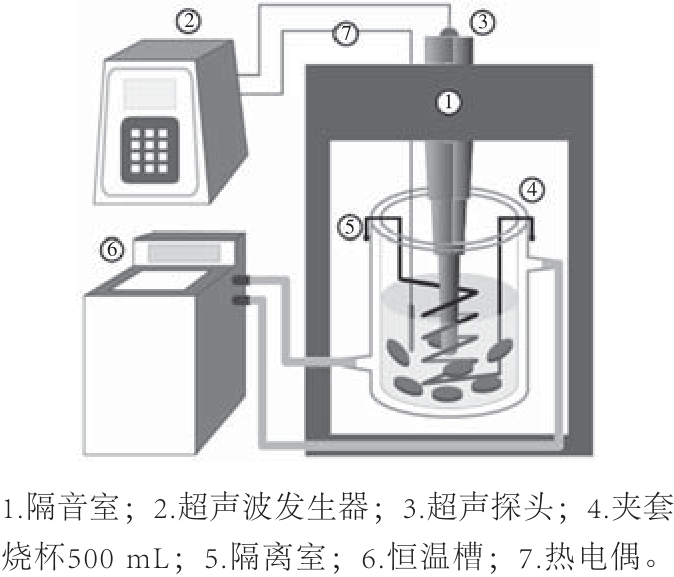
图1 UBA预处理实验装置
Fig.1 Schematic of the experimental setup for UBA pretreatment
周新丽,张宵敏,戴 澄
(上海理工大学医疗器械与食品学院,上海2 00093)
摘 要:利用超声波辅热联合抗坏血酸(ultrasonic-assisted blanching combined with ascorbic acid,UBA)的方法对胡萝卜进行 预处理。以过氧化物酶和多酚氧化酶为灭酶指标,通过单因素试验以及响应面分析法得出UBA预处理的最佳作用参数;比较UBA预处理、漂烫预处理以及抗坏血酸浸泡预处理对胡萝卜品质的影响。预处理工艺优化结果为超声波功率强度0.29 W/mL、作用时间3 min、作用温度60 ℃、抗坏血酸质量分数1%;相较于其他的预处理方法,UBA预处理在保证灭酶效果的基础上不仅能显著提 高胡萝卜样品中的VC含量,还能最大程度地维持胡萝卜细胞的原有结构,是一种温和且高效的预处理方式。
关键词:超声波;抗坏血酸;预处理;漂烫
在果蔬加工过程中,对新鲜果蔬造成的机械损伤,如去皮、去核、切片等操作,在酶的作用下,会造成果蔬的酶促褐变,加速食物变质。因此在进行加工处理前,通常需要对鲜切果蔬进行预处理,达到灭酶目的。食品加工工艺中通常以漂烫等热处理的形式来灭酶,但对含有较多热敏性营养物质的果蔬来说,有效成分损失严重。为了保证果蔬的灭酶效果且同时降低热损害,各种非热型食品加工技术应运而生,例如超声波、高压、脉冲电场、振荡磁场等。其中超声波技术作为一种近年来备受关注的新型食品加工技术,被多项研究[1-5]证明能有效改善传统灭酶处理对食品品质带来的不利影响。
由于食品结构的复杂性及酶结构本身对超声波具有很高的耐受性,通过单一作用超声波的方式实现对酶活的抑制通常效果欠佳[6],因此在超声波灭酶的众多研究中,普遍以超声波联合其他加工技术的方式实现对果蔬酶活的抑制。大量研究证明[7-13]超声波结合传统热处理的方式能有效降低预处理温度以及预处理时间。例如Cheng等[13]对蘑菇中多酚氧化酶(polyphenol oxidase,PPO)的抑制研究中发现,在55~75 ℃温度区间内,超声波联合热处理使PPO,D值(在一定的处理环境和一定的热力致死温度条件下某细菌数群中每杀死90%原有残存活菌数时所需要的时间)范围从单纯热处理的(112±8.4)~(1.2±0.07) min下降至(57.8±6.1)~(0.88±0.05) min。另外,超声波高压热处理同样被证明能有效提升酶活抑制效率[14-17],Lopez等[16]发现相比于单纯热处理,利用超声波高压热处理能使果胶酯酶溶液的D值在62.5 ℃缩短52.9 倍,但该技术只适用于液态食品[6,18]。而有机酸溶液因为其低pH值环境和抗氧化特性常被用来防止鲜切果蔬的褐变以及微生物增长,但其时效性通常很短;Jang等[19-20]发现超声波与抗坏血酸对于苹果中PPO和过氧化物酶(peroxidase,POD)的抑制具有协同作用,而单独超声波或抗坏血酸作用对酶活的抑制效果均不理想。
结合前人对抑制果蔬酶促褐变技术的研究成果,本研究尝试利用超声波辅热联合抗坏血酸(ultrasonicassisted blan ching combined with ascorbic acid,UBA)方式在冷冻干燥前对胡萝卜进行灭酶护色预处理,研究降低预处理强度的可能性,实现在预处理过程中对果蔬品质的保护。首先通过单因素试验以及响应面确定UBA预处理抑制胡萝卜酶活的最佳作用参数; 随后以内源酶恢复情况、VC含量和对胡萝卜细胞结构的影响作为品质指标,衡量UBA预处理相较于传统预处理(漂烫、抗坏血酸浸泡)的技术优势。
1.1 材料与试剂
厚5 mm、直径33 mm圆柱状新鲜胡萝卜切片。
0.1 mol/L磷酸缓冲液(pH 6.5)、愈创木酚、30%过氧化氢、邻苯二酚、抗坏血酸、草酸、2,6-二氯靛酚国药集团化学试剂有限公司。
1.2 仪器与设备
JY92-2DN超声波细胞破碎仪 宁波新艺超声设备公司;THD-2006低温恒温槽 宁波天恒仪器厂;722s分光光度计 上海仪电分析仪器有限公司;HR2860食物搅拌机 飞利浦公司;BX51光学显微镜 奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 UBA预处理装置与条件

图1 UBA预处理实验装置
Fig.1 Schematic of the experimental setup for UBA pretreatment
如图1所示,该装置主要由两个系统组成:一是由超声波发生器、超声探头、热电偶和隔音室组成的超声系统,超声波以超声探头的形式通过在预处理溶液中的传播作用于胡萝卜样品,其中超声波作用参数(如功率强度、作用时间、作用温度)通过超声波发生器来调节,预处理溶液的温度通过热电偶进行实时监测;二是由夹套烧杯与恒温槽组成的热循环系统,该系统的目的是为了控制UBA预处理温度保持恒定,其中热循环温度由恒温槽控制,循环介质为水溶液。用0.1 mol/L磷酸缓冲液(pH 6.5)配制一定质量分数抗坏血酸溶液作为UBA预处理溶液,料液比(胡萝卜-预处理溶液)为1∶4(g/mL)。设置不同的参数进行实验,相同参数重复3 次。
1.3.2 酶活力的测定
PPO[21]和POD[22-24]是最常见的参与食品褐变的酶类,同时也是参与果蔬风味、营养物质 降解的酶类[25-27]。因此本研究以POD和PPO的残余活力作为指标。
1.3.2.1 POD残余活力测定
酶液的制备:将预处理好的胡萝卜倒入食物搅拌机,以1∶2(g/mL)的料液比加入磷酸缓冲液,研磨过滤,再以7 000 r/min转速将滤液离心15 min,取上清液。
反应液制备:配制pH 6.5浓度为0.1 mol/L的磷酸缓冲溶液,于4 ℃冰箱中冷藏。取50 mL缓冲液于烧杯中,加入28 μL愈创木酚加热搅拌均匀,再加入19 μL的30%过氧化氢,混合均匀后倒入玻璃瓶于4 ℃冰箱中保存。
取上述反应液3 mL和1 mL缓冲液于10 mm光径比色皿中,作为吸光度对照。另一只比色皿加入3 mL反应液和1 mL胡萝卜提取酶液,搅拌均匀后,于470 nm波长每10 s记录一次吸光度的变化,连续记录180 s。共做3次平行。最后酶活力用单位时间内吸光度变化的平均值(ΔA/min)来表征,并利用如下公式计算残余活力:
式中:Ax为预处理后样品酶活力;A0为新鲜样品初始酶活力。
1.3.2.2 PPO残余活力测定
酶液的制备:同POD制备方法。
反应液制备:配制0.1 mol/L邻苯二酚溶液,放入玻璃瓶中于4 ℃冰箱中保存。
事先将磷酸缓冲液、邻苯二酚溶液于30 ℃恒温水浴锅中预热。在比色皿中加入1.6 mL缓冲液、1.2 mL邻苯二酚溶液以及0.2 mL胡萝卜酶液。搅拌均匀后,于420 nm波长每10 s记录一次吸光度的变化,连续记录90 s。共做3 次平行。最后酶活力用单位时间内吸光度变化的平均值(ΔA/min)来表征,并利用公式计算残余活力。
1.3.3 单因素试验设计
为研究在UBA预处理时,超声波功率强度、作用时间、作用温度及抗坏血酸质量分数对POD、PPO残余活力的影响,进行了单因素试验设计。具体作用参数如下:超声波功率强度分别为0.05、0.15、0.21、0.28、0.32、0.34 W/mL,作用时间3 min、占空比0.5、作用温度50 ℃、抗坏血酸质量分数1%;超声波作用时间分别为1、2、3、4 min,占空比0.5、超声波功率强度0.32 W/mL、作用温度为60℃、抗坏血酸质量分数1%;超声波作用温度分别为30、40、50、60、70、80 ℃,超声波功率强度0.32 W/mL、作用时间3 min、占空比0.5、抗坏血酸质量分数1%;抗坏血酸质量分数分别为0.05%、0.1%、0.3%、0.5%、0.7%、1.0%,超声波功率强度0.32 W/mL、作用温度60 ℃、作用时间3 min、占空比0.5。
1.3.4 响应面试验设计
表1 响应面试验因素与水平
Table1 Coded levels and corresponding actual levels of the independent variables used in the response surface analysis

为找到UBA预处理的最佳工艺参数以及各因素之间的交互关系,在单因素试验的基础上利用Design-Expert 8.0进行响应面分析。采用Box-Behnken试验方案进行四因素三水平的试验设计。由于在UBA预处理单因素试验中,PPO和POD呈现基本相似的被抑制趋势,且PPO在大部分情况下比POD更容易被抑制,因此在响应面分析中单采用POD残余活力作为响应指标。响应面因素与水平设计见表1。
1.3.5 不同预处理方式对胡萝卜品质影响的比较
采用UBA、漂烫、抗坏血酸浸泡3 种方法对胡萝卜进行预处理。UBA预处理:采用优化出来的最有条件;漂烫:90 ℃水浴4 min;抗坏血酸浸泡:1.2%抗坏血酸溶液浸泡2 h。随后,以VC含量、内源酶恢复情况和对胡萝卜结构的影响作为品质指标,衡量3种预处理方式的技术优劣。
1.3.6 指标测定
1.3.6.1 VC含量的测定
采用2,6-二氯靛酚法测定VC含量。
1.3.6.2 内源酶恢复情况的测定
将预处理好的胡萝卜样品平均分成4 份。真空包装,放入4 ℃冰箱冷藏保存。每过4 d拿出1 份测POD和PPO活力的恢复情况,共测12 d。
1.3.6.3 细胞结构的观察
将预处理好的胡萝卜样品切成0.1 mm的薄片,利用光学显微镜设备在×20目镜下观察细胞结构并拍摄图片。
2.1 单因素试验结果
2.1.1 超声波功率强度对酶活力的影响

图2 超声波功率强度对PPO、POD残余活力的影响
Fig.2 Effect of ultrasonic power intensity on the residual activity of PPO and POD
图2显示,超声波对酶活力有明显抑制作用,并且PPO和POD的残余活力随着超声波功率强度的增大而逐渐减小,这是由于超声功率强度越高,造成的空化搅动越强烈[28],对酶蛋白结构的破坏性越大[29]。当超声功率强度为0.34 W/mL时,样品中PPO和POD的活力已被完全抑制。另外由图2可看出,POD比PPO对超声波更为敏感,二者对超声波敏感程度的不同可能是因为PPO的三级结构较POD结构更稳定,因此PPO对超声波的耐受性更高。
2.1.2 超声波作用 时间对酶活力的影 响
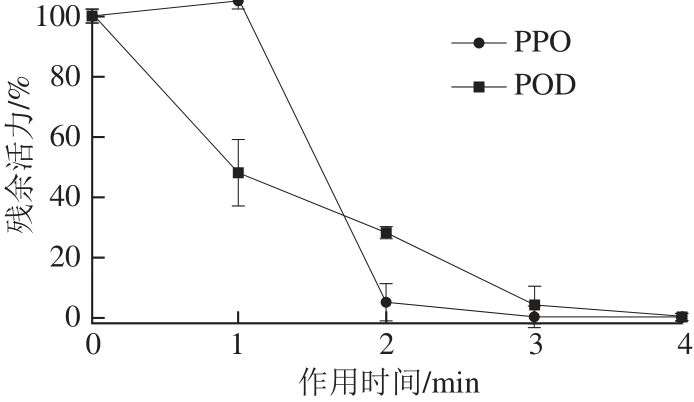
图3 超声波作用时间对PPO、POD残余活力的影响
Fig.3 Effect of ultrasonic irradiation time on the residual enzymatic activity of PPO and POD
由图3可知,POD的残余活力随着超声波作用时间的延长而降低。当作用时间为4 min时,POD活力已被完全抑制。而对于PPO,当作用了1 min超声波后,其残余活力不但没有下降反而有略微上升,有研究显示,短时间的超声波作用可能会通过打破大分子结构,增加酶蛋白活性基团与底物结合的几率,从而提升酶活力[21];而随着作用时间的不断延长,酶蛋白在空化效应的持续影响下逐渐失活,当预处理时间延长至2 min后,PPO的残余活力急速下降并几乎接近失活;当作用时间继续延长至3 min后,样品中的PPO全部失活。
2.1.3 抗坏血酸质量分数对酶活力的影响
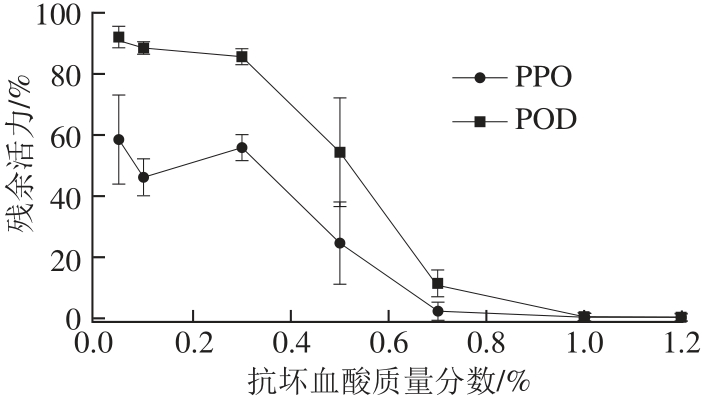
图4 抗坏血酸质量分数对PPO、POD残余活力的影响
Fig.4 Effect of ascorbic acid concentration on the residual activity of PPO and POD
从图4可以看出,POD和PPO的残余活力基本随着抗坏血酸质量分数的增加而逐渐减小,当预处理溶液中的抗坏血酸质量分数达到0.7%时,两种酶都已被完全抑制。相比于POD,抗坏血酸对PPO的抑制显然更为有效。当0.05%和0.1%的抗坏血酸作用于预处理溶液时,POD的残余活力并没有明显改变,而此时PPO的残余活力已分别降至68.33%和50%。当抗坏血酸质量分数提升至0.3%时,PPO的残余活力相较于0.1%反而有所上升,但随着抗坏血酸质量分数的进一步增加,PPO的残余活力继续下降直至被完全抑制。
PPO是造成果蔬酶促褐变最主要的酶类。在氧气的存在下,PPO催化果蔬内的单酚类物质氧化成醌,醌类物质的聚集从而形成褐色沉淀。抗坏血酸可以通过将醌类物质还原成二羟基多酚,从而达到抑制褐变的作用[30]。但由于抗坏血酸抑制褐变的途径并不直接针对于PPO本身,一旦溶液中的抗坏血酸被消耗殆尽,醌类物质又会重新聚集[31]。因此抗坏血酸抑制褐变的有效性和溶液中抗坏血酸的质量分数直接相关。抗坏血酸对POD抑制的有效性也在多项研究中被证实[32]。这可能是由于抗坏血酸的抗 氧化能力降低了水果表面的氧化应激,从而实现对POD的抑制。另外,抗坏血酸的加入能够使预处理溶液偏离酶的最适pH值范围,从而达到抑制酶活的作用。
2.1.4 超声波作用温度对酶活力的影响
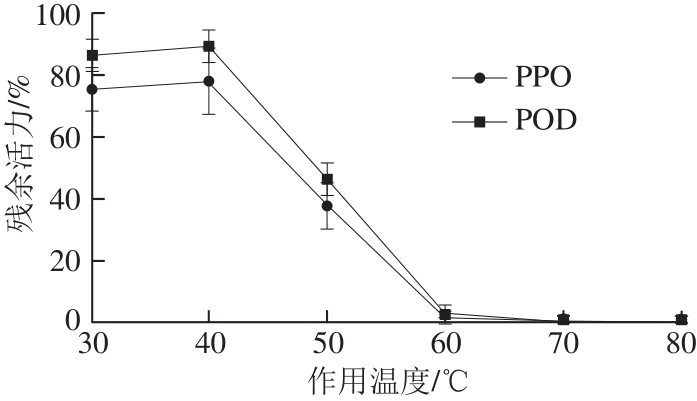
图5 超声波作用温度对POD、PPO残余活力的影响
Fig.5 Effect of pretreatment temperature on the residual activity of PPO and POD
图5显示,在本试验条件下,60 ℃的预处理温度即实现了对POD和PPO活力的完全抑制,说明超声波与热处理温度对于灭酶存在协同效应[33],当然这其中还包括抗坏血酸的参与作用。在30 ℃和40 ℃,POD和PPO的残余活力几乎没有改变,说明在该条件下,温度并没有对两种酶的酶活产生任何影响,此时两种酶的残余活力下降完全是超声波在预处理溶液中产生的物理化学效应所造成的。且30~40 ℃通常是酶最适温度最集中的温度范围,说明在该温度范围内,热处理温度和超声波不存在协同效应。
2.2 响应面试验结果
表2为响应面试验设计及结果,根据试验结果进行回归拟合得到二次回归方程:POD残余活力/%=36.19-3.34A-16.26B-13.64C-13.08D-0.010AB+0.46AC+0.29AD+0.94BC+1.09BD+1.8CD-1.88A2-0.12B2+1.4C2-5D2。为了进一步对得到的回归方程进行显著性检验,继续利用Design-Expert 8.0对其进行方差分析,见表3。图6为回归模型中功率强度-作用温度、功率强度-抗坏血酸质量分数间交互作用的响应面图,其他情况类似,各因素间均没有交互作用。
根据响应面试验结果并结合实际情况得出最佳预处理工艺参数为:超声波功率强度0.29 W/mL、作用时间3 min、作用温度60 ℃、抗坏血酸质量分数1%。4 个因素均影响显著(P<0.05),且超声波作用时间、作用温度以及抗坏血酸质量分数均为极显著因素(P<0.000 1)。各因素间没有交互作用。
表2 响应面试验设计及结果
Table2 Response surface design in terms of coded data with experimental results

表3 方差分析结果
Table3 Analysis of variance
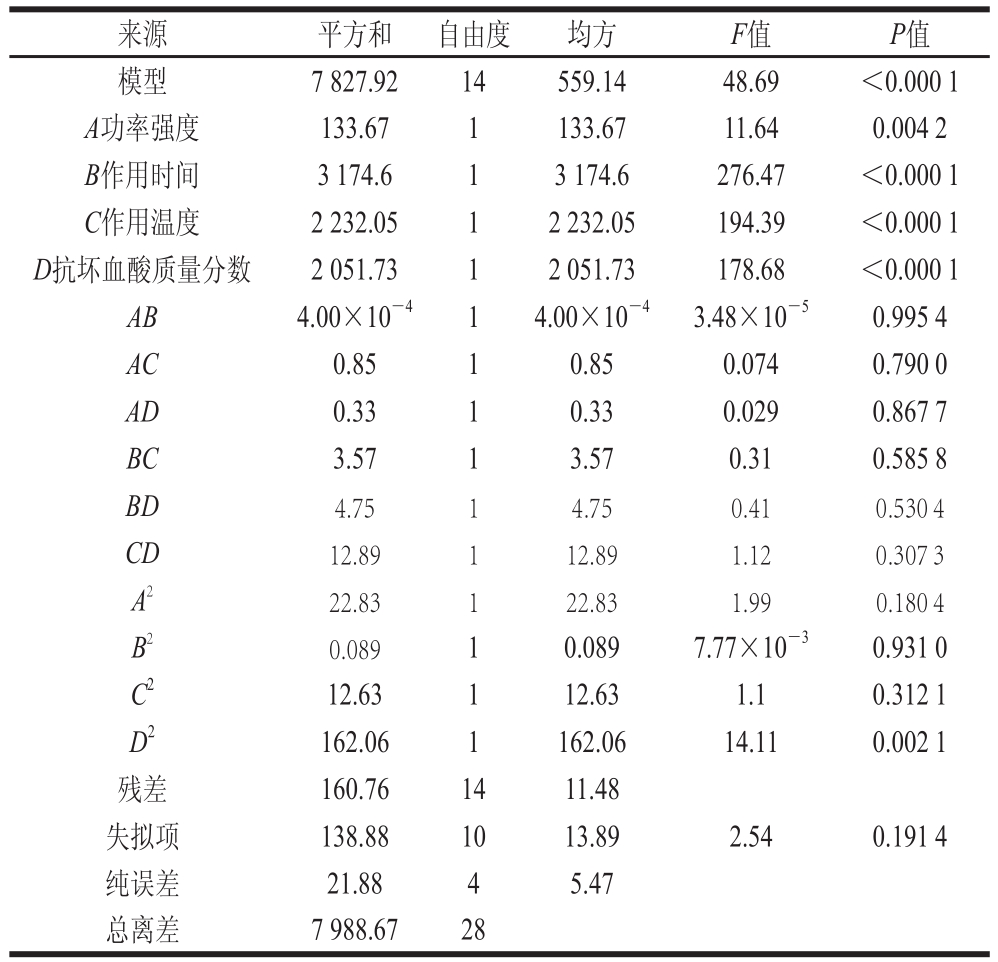
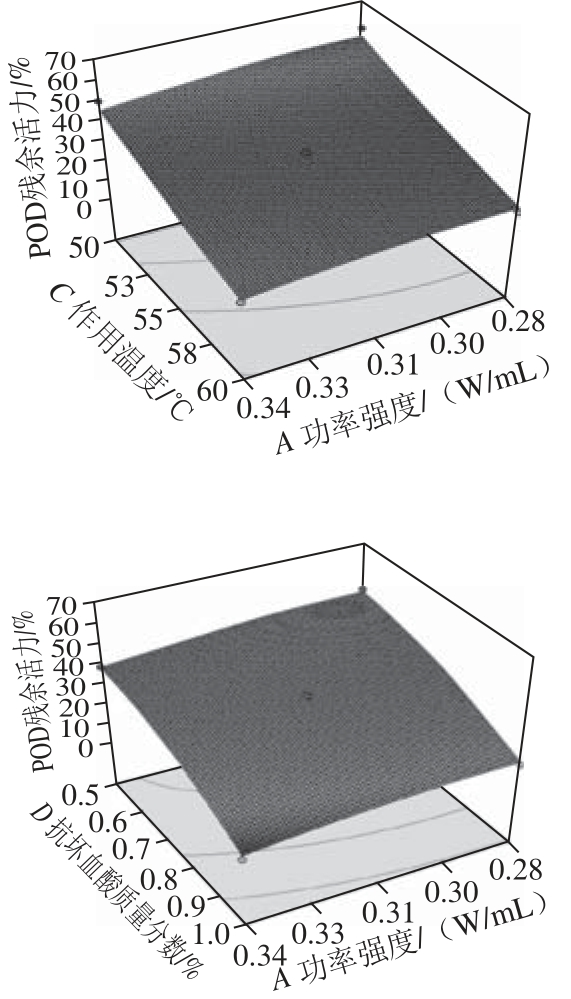
图6 各试验因素间的交互影响
Fig.6 Response surface plots showing the effect of various factors on the residual activity of POD
2.3 不同处理方式对胡萝卜品质的影响
2.3.1 不同处理方式的酶活力恢复情况
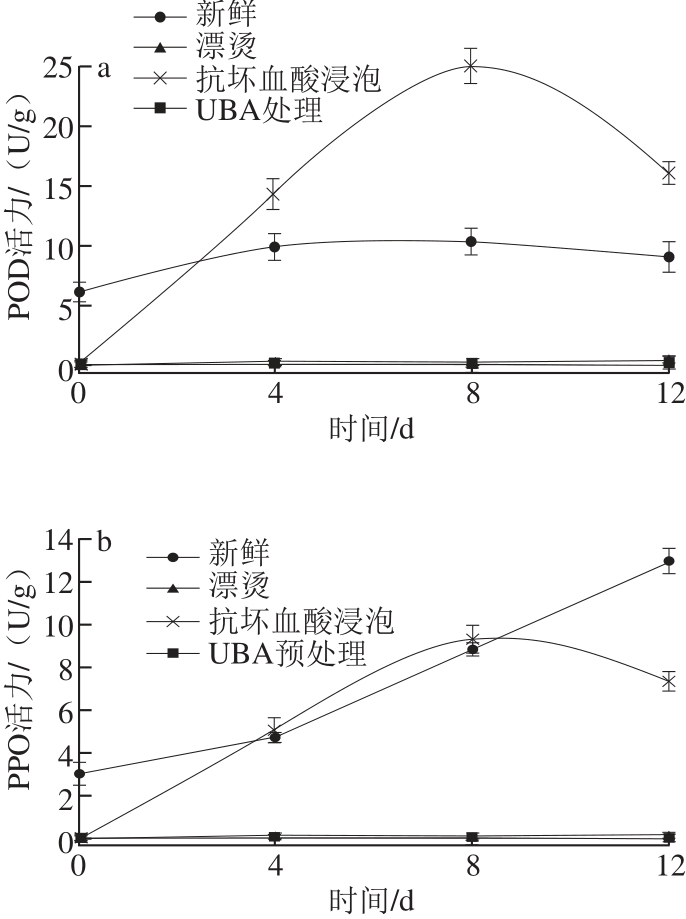
图7 不同预处理方式下POD(a)、PPO(b)活力变化
Fig.7 Changes in POD and PPO activities in carrots with different pretreatments as a function of storage time
由图7可知,未经任何预处理的新鲜样品在贮藏期间的酶活呈上升趋势;其中POD活力在第8天左右达到最高,继而有略微下降;而PPO活力在贮藏期间则呈逐渐上升的态势。经过预处理后的样品,不论哪种方式,在预处理后当下酶活力都得到了很好的抑制。然而抗坏血酸浸泡组的样品在接下来的贮藏期间酶活有明显的复原现象。其中POD活力在保存期间远高于对照组,而PPO活力同样保持上升的态势。由此看来,抗坏血酸浸泡法对于酶活的抑制方面,并不是一种长期有效的方法,因为一 旦抗坏 血酸消耗殆尽,对酶活力的抑制效果则不复存在。与上两组相比,漂烫组和UBA预处理组的酶活力在贮藏期间则始终保持在极低的状态,说明这两种预处理方式都可以使POD和PPO彻底变性,实现对酶活力的完全抑制。
2.3.2 不同处理方式的VC含量

图8 不同预处理方式的VC含量
Fig.8 VC contents obtained with different pretreatment methods
图8显示,新鲜样品的VC含量为(13.22±0.29)mg/100 g,而经过漂烫预处理的样品VC含量为(6.26±0.24) mg/100 g,相比于新鲜样品下降了52.65%。而UBA预处理和抗坏血酸预处理由于外源抗坏血酸的添加,VC含量被显著提升。
2.3.3 不同处理方式的细胞结构

图9 不同预处理方式的胡萝卜细胞结构
Fig.9 Carrot cell structure under different pretreatments
如图9所示,新鲜的胡萝卜细胞呈饱满的多边形结构,细胞间排列紧 密。而过高温漂烫后的样品细胞呈现出明显的皱缩状态,可能是由于长时间的高温漂烫对细胞的细胞膜产生了破坏,导致了部分细胞液的流出,造成细胞结构变形。经过抗坏血酸浸泡的样品细胞间的排列依旧紧密,但细胞呈现出失水的状态,这是由于在高浓度抗坏血酸溶液的环境下,细胞内外产生了渗透压从而导致细胞内水分的流失。而在UBA预处理下的样品细胞保持着和新鲜样品细胞最为近似的状态,基本没有发生细胞变形失水的情况,但相较于新鲜样品,该组样品细胞间的间隙明显增大。这是由于在超声波交替产生的正负压的作用下产生了“海绵效应”,这种大于物质中毛细血管表面张力的力量使细胞间产生了微通道[34-35]。
本研究以POD和PPO为灭酶指标,通过单因素试验及响应面分析法得出了UBA预处理的最佳作用参数为:超声波功率强度0.29 W/mL、作用时间3 min、作用温度60 ℃、抗坏血酸质量分数1%。通过对回归方程的显著性检验发现,以上4 个因素均影响显著(P<0.05),且超声波作用时间、作用温度以及抗坏血酸质量分数均为极显著因素(P<0.000 1)。
通过对不同预处理方法对胡萝卜品质影响的比较发现,在胡萝卜贮藏期间,漂烫和UBA预处理能使胡萝卜中POD和PPO活力始终保持在被抑制的状态;对VC含量的影响方面,UBA预处理和抗坏血酸浸泡能显著提高胡萝卜样品中的VC含量;而从细胞结构的角度来看,UBA预处理对细胞结构的破坏程度最小。综上所述,UBA预处理在保证灭酶效果的基础上,相较于其他的预处理方法,能最大程度地保护胡萝卜原先的品质不被破坏,是一种温和且高效的预处理方式。
参考文献:
[1] RAWSON A, TIWARI B K, TUOHY M G, et al. Effect of ultrasound and blanching pretreatments on polyacetylene and carotenoid content of hot air and freeze dried carrot discs[J]. Ultrasonics Sonochemistry, 2011, 8(5): 1172-1179. DOI:10.1016/j.ultsonch.2011.03.009.
[2] MOTHIBE K J, ZHANG M, NSOR-ATINDANNA J, et al. Use of ultrasound pretreatment in drying of fruits: drying rates, quality attributes, and shelf life extension[J]. Drying Technology, 2011, 29(14): 1611-1621. DOI:10.1080/07373937.2011.602576.
[3] ANSORENA M R, MOREIRA M R, ROURA S I. Combined effect of ultrasound, mild heat shock and citric acid to retain greenness, nutritional and microbiological quality of minimally processed broccoli (Brassica oleracea L.): an optimization study[J]. Postharvest Biology & Technology, 2014, 94: 1-13. DOI:10.1016/ j.postharvbio.2014.02.017.
[4] FONTELES T V, COSTA M G M, JESUS A L T D, et al. Power ultrasound processing of cantaloupe melon juice: effects on quality parameters[J]. Food Research International, 2012, 48(1): 41-48. DOI:10.1016/j.foodres.2012.02.013.
[5] ZENKER M, HEINZ V, KNORR D. Application of ultrasoundassisted thermal processing for preservation and quality retention of liquid foods[J]. Journal of Food Protection, 2003, 66(9):1642-1649. DOI:10.1002/1522-2640(200106)73:6<696::aidcite6961111>3.0.co;2-0.
[6] DEMIRDOVEN A, BAYSAL T. The use of ultrasound and combined technologies in food preservation[J]. Food Reviews International, 2008, 25(1): 1-11. DOI:10.1080/87559120802306157.
[7] RUI M S C, VIEIRA M C, SILVA C L M. Effect of heat and thermosonic ation treatments on watercress (Nasturtium officinale) vitamin C degradation kinetics[J]. Innovative Food Science & Emerging Technologies, 2008, 9(4): 483-488. DOI:10.1016/ j.ifset.2007.10.005.
[8] RUI M S C, VIEIRA M C, SILV A C L M. Effect of heat and thermosonication treatments on peroxidase inactivation kinetics in watercress (Nasturtium officinale)[J]. Journal of Food Engineering, 2006, 72(1): 8-15. DOI:10.1016/j.jfoodeng.2004.11.007.
[9] ATHMASELVI K A, KUMAR N, SOORIANATHASUNDARAM K, et al. Effect of ultrasound treatments in papaya juice processing[C] //ⅡInternational Symposium on Papaya, Madurai, India, 2008: 9-12. DOI:10.17660/actahortic.2010.851.93.
[10] KULDILOKE J, ESHTIAGHI M, ZENKER M, et al. Inactivation of lemon pectinesterase by thermosonication[J]. International J ournal of Food Engineering, 2007, 3(2). DOI:10.2202/1556-3758.1055.
[11] TEREFE N S, GAMAGE M, VILKHU K, et al. The kinetics of inactivation of pectin methylesterase and polygalacturonase in tomato juice by thermosonication[J]. Food Chemistry, 2009, 117(1): 20-27. DOI:10.1016/j.foodchem.200 9.03.067.
[12] AADIL R M, ZENG X A, ZHANG Z H, et al. Thermosonication: a potential technique that influences the quality of grapefruit juice[J]. International Journal of Food Science & Technology, 2015, 50(5): 1275-1282. DOI:10.1111/ijfs.12766.
[13] CHENG X F, ZHANG M, ADHIKARI B. The inactivation kinetics of polyphenol oxidase in mushroom (Agaricus bisporus) during thermal and thermosonic treatments[J]. Ultrasonics Sonochemistry, 2013, 20(2):674-679. DOI:10.1016/j.ultsonch.2012.09.012.
[14] VERCET A, LOPEZ P, BURGOS J. Inactivation of heat-resistant pectinmethylesterase from orange by manothermosonication[J]. Journal of Agricultural & Food Chemistry, 1999, 47(2): 432-437. DOI:10.1021/ jf980566v.
[15] VERCET A, SANCHEZ C, BURGOS J, et al. The effects of manothermosonication on tomato pectic enzymes and tomato paste rheological properties[J]. Journal of Food Engineering, 2002, 53(3): 273-278. DOI:10.1016/s0260-8774(01)00165-0.
[16] LOPEZ P, VERCET A, SANCHEZ A C, et al. Inactivation of tomato pectic enzymes by manothermosonication[J]. European Food Research and Technology, 1998, 207(3): 249-252. DOI:10.1007/s002170050327.
[17] VERCET A, BURGOS J, LOPEZBUESA P. Manothermosonication of heat-resistant lipase and protease from Pseudomonas fl uorescens: effect of pH and sonication parameters[J]. Journal of Dairy Research, 2002, 69(2): 243-254. DOI:10.1017/s0022029902005460.
[18] ZINOVIADOU K G, GALANAKIS C M, BRNČIĆ M, et al. Fruit juice sonication: implications on food safety and physicochemical and nutritional properties[J]. Food Research International, 2015, 77: 743-752. DOI:10.1016/j.foodres.2015.05.032.
[19] JANG J H, MOON K D. Inhibition of polyphenol oxidase and peroxidase activities on fresh-cut apple by simultaneous treatment of ultrasound and ascorbic acid[J]. Food Chemistry, 2010, 124(2): 444-449. DOI:10.1016/j.foodchem.2010.06.052.
[20] JANG J H, KIM S T, MOON K D. Inhibitory effects of ultrasound in combination with ascorbic acid on browning and polyphenol oxidase activity of fresh-cut apples[J]. Food Science & Biotechnology, 2009, 18(6):1417-1422.
[21] ESPIN J C, GARCIARUIZ P A, TUDELA J, et al. Monophenolase and diphenolase reaction mechanisms of apple and pear polyphenol oxidases[J]. Journal of Agricultural & Food Chemistry, 1998, 46(8): 2968-2975. DOI:10.1021/jf971045v.
[22] CHISARI M, BARBAGALLO R N, SPAGNA G. Characterization of polyphenol oxidase and peroxidase and influence on browning of cold stored strawberry fruit[J]. Journal of Agricultural & Food Chemistry, 2007, 55(9): 3469-3476. DOI:10.1021/jf063402k.
[23] MDLULI K M. Partial purification and characterisation of polyphenol oxidase and peroxidase from marula fruit (Sclerocarya birrea, subsp. Caff ra)[J]. Food Chemistry, 2005, 92(2): 311-323. DOI:10.1016/ j.foodchem.2004.07.026.
[24] SPAGNA G, BARBAGALLO R N, MARCO C A, et al. Characterization of a tomato polyphenol oxidase and its role in browning and lycopene content[J]. Journal of Agricultural & Food Chemistry, 2005, 53(6): 2032-2038. DOI:10.1021/jf040336i.
[25] TOMÁS-BARBERÁN F A, ESPÍN J C. Phenolic compounds and related enzymes as determinants of quality in fruits and vegetables[J]. Journal of the Science of Food & Ag riculture, 2001, 81(9): 853-876. DOI:10.1002/ jsfa.885.
[26] TEREFE N S, BUCKOW R, VERSTEEG C. Quality-related enzymes in fruit and vegetable products: effects of novel food processing technologies, part 1: high-pressure p rocessing[J]. Critical Reviews in Food Science & Nutrition, 2014, 54(1): 24-63. DOI:10.1080/10408398.2011.566946.
[27] OMS-OLIU G, ODRIOZO-SERRANO I, SOLIVA-FORTUNY R, et al. The role of peroxidase on the antioxidant potential of fresh-cut ‘Piel de Sapo’ melon packaged under different modified atmospheres[J]. Food Chemistry, 2008, 106(3): 1085-1092. DOI:10.1016/ j.foodchem.2007.07.040.
[28] ISLAM M N, MIN Z B A. The inactivation of enzymes by ultrasound-a review of potential mechanisms[J]. Food Reviews International, 2013, 30(1):1-21. DOI:10.1080/87559129.2013.853772.
[29] KARASEVA E I, METELITZA D I. Stabilization of glucoso-6-phosphate dehydrogenase by its substrate and cofactor in an ultrasonic field[J]. Russian Journal of Bioorganic Che mistry, 2006, 32(5): 436-443. DOI:10.1134/s1068162006050062.
[30] GRANDISON A. Food processing technology: principles and practice[M]. Ellis Horwood, 2008: 1072-1075. DOI:10.1201/ noe0849308871.
[31] LOZANO J E. Inhibition and control of browning[M]. Springer US, 2006: 183-215. DOI:10.1007/978-0-387-30616-2_8.
[32] LAMIKANRA O, WATSON M A. Effects of ascorbic acid on peroxidase and polyphenoloxidase activities in fresh-cut cantaloupe melon[J]. Journal of Food Science, 2002, 66(9): 1283-1286. DOI:10.1111/j.1365-2621.2001.tb15202.x.
[33] AMIOUR S D, HAMBABA L. Effect of pH, temperature and some chemicals on polyphenoloxidase and peroxidase activities in harvested Deglet Nour and Ghars dates[J]. Postharvest Biology & Technology, 2016, 111(6): 77-82. DOI:10.1016/j.postharvbio.2015.07.027.
[34] ENSMINGER D. Acoustic dewatering and drying (low and high frequency): state of the art review[J]. Drying Technology, 1985, 3(4): 529-566. DOI:10.1080/07373938508916296.
[35] TARLETON E S. The role of Field-assisted techniques in solid/ liquid separation[J]. Filtration & Separation, 1992, 29(3): 246-238. DOI:10.1016/0015-1882(92)80255-h.
Effect of Ultrasonic-Assisted Blanching Combined with Ascorbic Acid on the Inactivation of Browning-Related Enzymes in Carrot
ZHOU Xinli, ZHANG Xiaomin, DAI Cheng
(School of Medical In strument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Ultrasound-assisted blanching combined with ascorbic acid (UBA) was applied in the pretreatment of carrots for the purpose of inhibiting enzymatic browning in this study. The optimization of processing parameters for the inactivation of peroxidase (POD) and polyphenol oxidase (PPO) was done by the com bined use of one-factor-at-a-time method and response surface me thodology. The combined method was compared with individual blanching and ascorbic acid soaking in terms of their effect on carrot quality. The optimized processing parameters were 0.29 W/mL,3 min, 60 ℃ and 1% for ultrasonic power density, irradiation time, temperature and ascorbic acid concentration, respectively. In addition to ensuring the inactivation of both enzymes, UBA treatment was able to greatly increase ascorbic acid content in carrot while maximally maintaining the integrity of the cell structure than could the separate treatments. Hence, UBA was a mild and eff i cient pretreatment method.
Key words:ultrasonic; ascorbic acid; pretreatment; blanching
DOI:10.7506/spkx1002-6630-201712024
中图分类号:TS255.3
文献标志码:A
文章编号:1002-6630(2017)12-0157-07
引文格式:周新丽, 张宵敏, 戴澄. 超声波辅热联合抗坏血酸对胡萝卜钝酶效果的影响[J]. 食品科学, 2017, 38(12): 157-163.
DOI:10.7506/spkx1002-6630-201712024. http://www.spkx.net.cn
ZHOU Xinli, ZHANG Xiaomin, DAI Cheng. Effect of ultrasonic-assisted blanching combined with ascorbic acid on the inactivation of browning-related enzymes in carrot[J]. Food Science, 2017, 38(12): 157-163. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712024. http://www.spkx.net.cn
收稿日期:2016-07-21
基金项目:国家自然科学基金面上项目(51376132)
作者简介:周新丽(1979—),女,副教授,博士,研究方向为食品冷冻冷藏与冷冻干燥。E-mail:zjulily@163.com