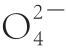 。75 ℃干燥12 h,称质量后备用。
。75 ℃干燥12 h,称质量后备用。韩鹏飞1,2,虞佐嗣1,郭建忠1,*,李 兵1,刘 力1
(1.浙江农林大学理学院,浙江省林业生物质化学利用重点实验室,浙江 临安 311300;2.浙江农林大学工程学院,浙江 临安 311300)
摘 要:以榉木木聚糖为原料,采用炭基固体酸催化剂(AC-SO3H)催化水解制备得到低聚木糖。分别考察反应时间、反应温度、催化剂用量对低聚木糖收率及各组分收率的影响,并通过正交试验设计确定最佳工艺条件为20 mL蒸馏水,0.5 g木聚糖、0.2 g AC-SO3H、反应时间3 h、反应温度140 ℃。并在此条件下,分别以AC-SO3H、M-ACSO3H、S-AC-SO3H为催化剂,考察不同催化剂对低聚木糖收率的影响,结果表明以AC-SO3H为催化剂时低聚木糖收率最大为66.60%。
关键词:木聚糖;低聚木糖;炭基固体酸催化剂
作为一种可再生能源,农林生物质的高效利用引起了全世界范围的高度重视。农林生物质主要由纤维素、半纤维素、木质素组成[1]。目前,利用最多的是纤维素,其次是木质素,最后才是半纤维素。因此,研究半纤维素高效应用的方法迫在眉睫。木聚糖作为半纤维素主要成分,其降解产物低聚木糖因其独特的理化性质在医药、食品等领域有着广泛的应用[2-6]。
目前低聚木糖的制备方法主要有酸水解法、热水抽提法、酶水解法。酸水解法主要以硫酸、盐酸等直接作用于原料制备低聚木糖。因其周期短、再现性好被用于动力学研究,但催化剂回收困难,对设备腐蚀严重,副产物多而没有用于大规模生产。Akpinar等[7]以烟草秸秆、小麦秸秆、棉花秸秆等为原料,通过碱法提取半纤维素,并以H2SO4降解制备低聚木糖,研究发现,低聚木糖收率主要取决于原料中木聚糖含量、H2SO4浓度及反应时间。刘英丽等[8]研究发现微波辅助酸水解法能有效降解木聚糖制备低聚木糖,但是这种方法木聚糖反应不完全且生产成本较高。热水抽提法是以水为原料制备低聚木糖。Garrote等[9]建立了以桉木为原料自水解制备低聚木糖的动力学模型,为水热法制备低聚木糖的工艺研究提供了重要参考。Carvalheiro等[10]以啤酒糟为原料制备低聚木糖,在190 ℃反应5 min时低聚木糖收率最大为原料木聚糖的61%。但水热法需要耐热、耐压设备,耗能大,产物收率低,不适合工业化生产[11]。酶水解法是使用微生物产生的内切型木聚糖酶分解木聚糖,后经分离提纯制备低聚木糖,此法副产物较少,有利于后续工艺中低聚木糖的分离、提纯和精制[12-16]。但是此法存在木聚糖酶系分离纯化困难,产品分离困难等问题,影响最终产品的纯度。
固体酸催化剂因其使用方便、易于回收、可重复利用、对设备无腐蚀等优点越来越引起国内外研究者的广泛关注。近年来,磺化炭型固体酸催化剂逐渐引起了科学家的关注[17-20]。目前用于制备磺化炭的碳源主要有糖类(葡萄糖、蔗糖、纤维素)[21-22]、有机高分子材料[23]、纳米碳管[24]等,磺化方法有硫酸磺化法[25-26]和化学还原法等[27]。本实验以榉木木聚糖为原料,以活性炭为载体,通过硫酸磺化法制备得到固体酸催化剂(记作AC-SO3H)通过固体酸催化木聚糖制备低聚木糖,并考察反应工艺条件对低聚木糖收率的影响,并通过正交试验得到了最佳工艺条件。
1.1 材料与试剂
榉木木聚糖(纯度≥95%) 美国Sigma-Aldrich公司;木糖、木二糖、木三糖、木四糖、木五糖(纯度均不小于98%) 上海源叶生物科技有限公司;活性炭国药集团化学试剂有限公司。
1.2 仪器与设备
1260高效液相色谱仪 美国安捷伦科技有限公司;ZNCL-S型智能恒温磁力搅拌器 河南爱博特科技发展有限公司;DF-101S集热式恒温磁力搅拌器巩义市予华仪器有限责任公司;SLM100型反应釜北京世纪森朗实验仪器有限公司;DGG-9240A电热恒温鼓风干燥箱 上海森信实验仪器有限公司;TE214S型电子分析天平 北京赛多利斯科学仪器有限公司;708P型温度控制柜 厦门宇电自动化科技有限公司;MT50-3J型流量显示仪 北京汇博隆仪器有限公司。
1.3 方法
1.3.1 AC-SO3H固体酸催化剂的制备
称取一定量的活性炭以固液比1∶10(g/mL)加入浓硫酸中,在165 ℃磺化1 h。冷却,过滤,热水洗至滤液用Ba(NO3)2检测不到S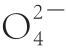 。75 ℃干燥12 h,称质量后备用。
。75 ℃干燥12 h,称质量后备用。
1.3.2 M-AC-SO3H、S-AC-SO3H固体酸催化剂的制备
分别称取一定量的马尾松粉、杉木粉以固液比1∶20(g/mL)加入到质量分数40%磷酸溶液,浸泡3 h后用布氏漏斗抽滤,所得滤渣100 ℃干燥24 h得到浸渍磷酸的马尾松粉和杉木粉,再分别从中取出适量,在管式炉中进行热解,以10 ℃/min升温至250 ℃,保温2 h,自然降至室温,所得产物用去离子水洗涤至中性,105 ℃烘干12 h,干燥后得到马尾松活性炭与杉木活性炭。分别称取一定量的马尾松活性炭与杉木活性炭以固液比1∶10(g/mL)加入浓硫酸中,在165 ℃磺化1 h。冷却,过滤,热水洗至滤液用Ba(NO3)2检测不到SO42-,75 ℃干燥12 h,干燥后得到马尾松AC-SO3和杉木AC-SO3H催化剂分别标记为M-AC-SO3H和S-AC-SO3H。
1.3.3 催化剂表面酸量的测定
取催化剂样品0.05 g和2 mol/L氯化钠溶液15 mL加入至50 mL锥形瓶中,30 ℃超声振荡30 min,使氢离子与钠离子充分交换,过滤,滤液用0.010 mol/L氢氧化钠溶液滴定,酚酞做指示剂。氢氧化钠用标准邻苯二甲酸氢钾标定。催化剂表面酸量按公式(1)计算:
式中:X为催化剂表面酸量/(mmol/g);C为氢氧化钠溶液浓度/(mol/L);V为滴定体积/L;M为催化剂质量/g。
1.3.4 木聚糖水解
在不锈钢反应釜中,加入木聚糖0.5 g、0.1 g AC-SO3H、去离子水20 mL,在140 ℃反应1 h,过滤,定容至50 mL,滤液经高效液相色谱测定其成分及含量。滤渣在70 ℃干燥24 h,称质量,计算转化率。
1.3.5 水解液成分及含量的测定
实验采用高效液相色谱对木聚糖水解液进行定性和定量分析。反应结束后,过滤,滤液定容至50 mL,用0.22 μm滤膜过滤,采用高效液相色谱仪测定水解液中的低聚木糖含量。采用示差折光检测器,Aminex HPX-87P糖分析柱,以0.005 mol/L的稀硫酸为流动相,流速为0.500 mL/min,柱温为50 ℃,停止时间30 min,最大压力400 bar,最小压力0 bar。
水解液中各组分收率(Y)按公式(2)计算:
式中:Y为水解液中各组分木糖、木二糖、木三糖、木四糖、木五糖收率/%;C为水解液中各组分的含量/(g/L);V为水解液体积/L;M为木聚糖质量/g。
1.3.6 单因素试验设计
以催化剂用量、反应时间、反应温度3 个影响木聚糖水解液中低聚木糖收率的因素做单因素试验,重复3 次取平均值,确定各因素适宜的范围。
1.3.7 正交试验设计
在单因素试验的基础上,选取催化剂用量、反应时间、反应温度3 个因素,以低聚木糖收率(木二糖、木三糖、木四糖、木五糖收率总和)为指标,选用L9(34)正交试验表进行试验,重复3 次取平均值,确定最佳工艺条件。
2.1 单因素试验结果
2.1.1 催化剂对木聚糖降解反应的影响

图1 AC-SO3H催化剂对木聚糖水解反应的影响
Fig.1 Effect of solid acid catalyst on the chemical composition of the hydrolysates
在160 ℃条件下等量AC-SO3H(0.2 g)与H2SO4(0.25 moL/L、8.16 mL)催化木聚糖水解1 h后水解液中木糖与低聚木糖(木二糖、木三糖、木四糖、木五糖)收率对比。如图1所示,与添加H2SO4相比,添加催化剂AC-SO3H后木糖收率降低,低聚木糖收率有显著的提高。AC-SO3H催化条件下低聚木糖收率可达58.31%,分别为木二糖收率14.77%、木三糖收率16.14%、木四糖收率14.11%、木五糖收率13.29%。H2SO4催化条件下木二糖和木三糖得率之和仅为11.23%。
2.1.2 反应温度与反应时间对木聚糖水解液中木糖收率的影响
为了探究反应温度与反应时间对木聚糖水解液中木糖收率的影响,在不锈钢反应釜中加入0.5 g木聚糖与0.2 g AC-SO3H催化剂,蒸馏水20 mL,分别在140、150、160 ℃条件下反应0.5、1、2、3 h,反应结束后,通过高效液相色谱测定水解液中木糖收率,如图2所示。随着反应温度与反应时间的增加,水解液中木糖收率逐渐升高;时间越长,随着温度的升高木糖收率的增幅越大,在160 ℃反应3 h,木糖的收率达到40.45%。这可能是因为水解液中存在的低聚木糖,随着反应温度的升高,部分低聚木糖继续水解从而导致木糖含量增加。

图2 反应温度与反应时间对木聚糖水解液中木糖收率的影响
Fig.2 Effect of reaction temperature and time on xylose yield
2.1.3 反应温度对木聚糖水解液中低聚木糖收率的影响

图3 140 ℃(A)、150 ℃(B)和160 ℃(C)条件下反应时间对木聚糖水解液中低聚木糖收率的影响
Fig.3 Effect of reaction time on XOS yield at different reaction temperatures
为了探究反应温度与反应时间对木聚糖水解液中低聚木糖收率的影响,在不锈钢反应釜中加入0.5 g木聚糖与0.2 g AC-SO3H催化剂,蒸馏水20 mL,分别在140、150、160 ℃条件下反应1、2、3 h,反应结束后,通过高效液相色谱测定水解液中低聚木糖收率,如图3所示。从图3A可以看出,在140 ℃条件下,随着反应时间从1 h延长到3 h,低聚木糖(包括木二糖、木三糖、木四糖、木五糖)收率从12.72%增加至66.60%,这说明在140 ℃条件下延长反应时间有利于提高低聚木糖收率,这可能是由于延长反应时间有助于木聚糖水解。从图3B可以看出,在150 ℃条件下随着反应时间的延长,水解液中低聚木糖收率先增高后降低,而图3C中160 ℃条件下随着反应时间的延长水解液中低聚木糖收率几乎呈线性下降。结合图2可以推测这可能是由于在较高温度条件下,延长反应时间导致部分易解聚的低聚木糖分解成木糖。从图3可以看出,在温度140 ℃、催化剂用量0.2 g、反应时间3 h或温度160 ℃、催化剂用量0.2 g、反应时间1 h条件下低聚木糖收率相对较高。
2.1.4 催化剂用量对水解液中木糖与低聚木糖收率的影响
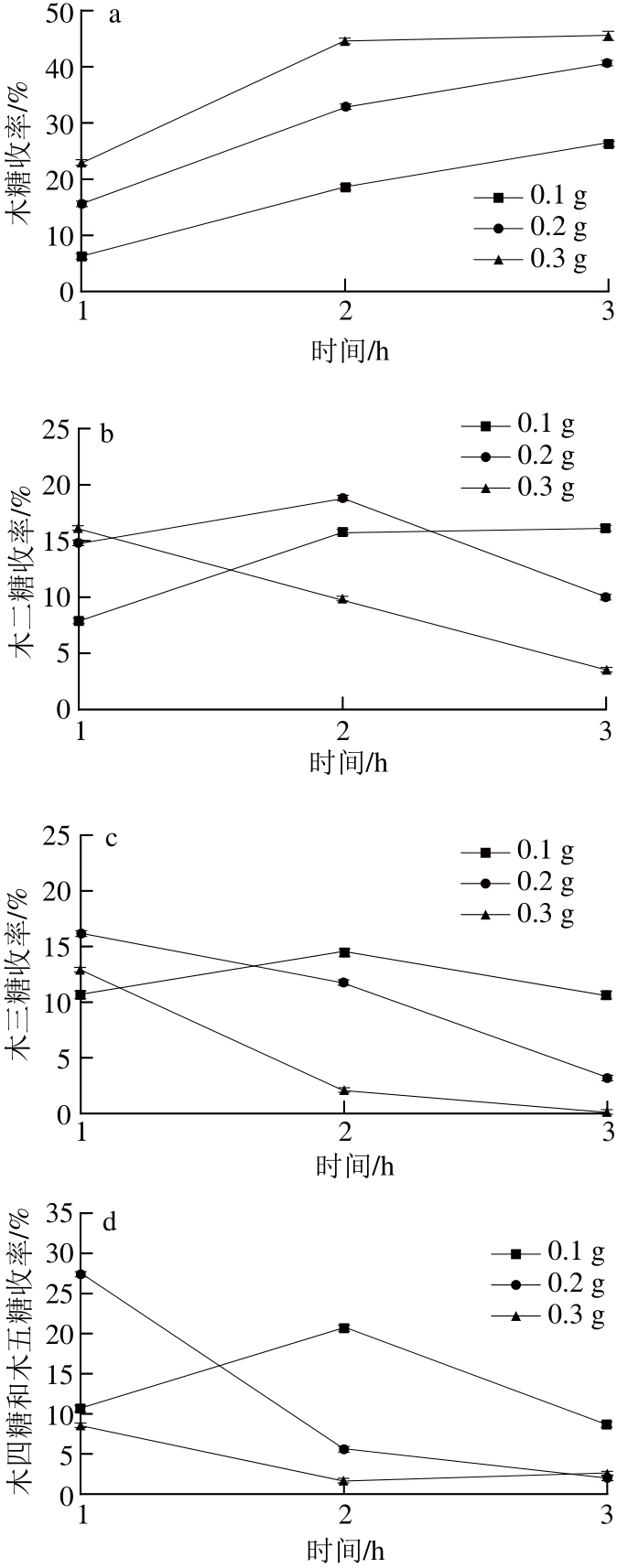
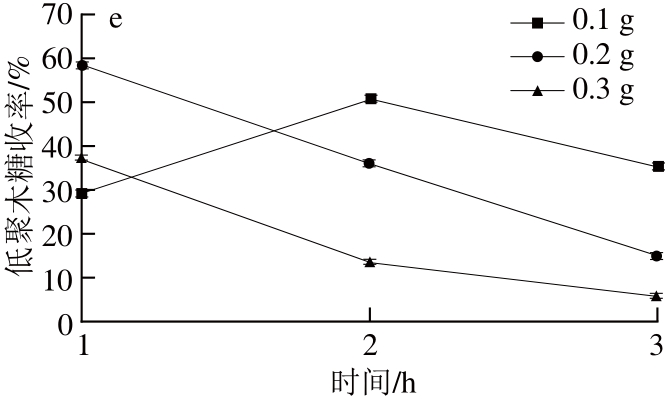
图4 催化剂用量对木聚糖水解液中木糖(a)、木二糖(b)、木三糖(c)、木四糖和木五糖(d)和低聚木糖(e)收率的影响
Fig.4 Effect of dosage of solid acid catalyst on the chemical composition of the hydrolysates
为考察催化剂用量对水解液中木糖及低聚木糖收率的影响,温度160 ℃时,分别考察了催化剂用量分别为0.1、0.2、0.3 g,反应时间分别为1、2 h和3 h时木聚糖水解液中木糖与低聚木糖收率。反应条件为:木聚糖0.5 g,蒸馏水20 mL,AC-SO3H(0.1、0.2、0.3 g),分别反应1、2、3 h,反应结束后,通过高效液相色谱测定水解液中低聚木糖收率,结果如图4所示。在160 ℃、0.3 g AC-SO3H、3 h条件下,木糖收率达到最大,收率为45%,而反应时间3 h时,木二糖、木三糖、木四糖和木五糖的收率均有明显的降低,这可能是由于增加催化剂用量导致溶液酸性增强,促进了木聚糖的水解。从图4e可以看出,随着时间从2 h延长至3 h,水解液中低聚木糖收率都有所下降,与图4a相比较,这可能是由于延长反应时间导致部分低聚木糖水解生成木糖。
2.2 正交试验结果
表1 L1 L9(334)正交试验设计与结果
Table1 Orthogonal array design with response variable

通过对木聚糖催化降解制备低聚木糖各单因素的考察,选择正交试验来确定其最佳工艺条件,正交实验设计方案及结果见表1。影响低聚木糖收率的各因素的主次顺序为:催化剂用量>反应时间>反应温度。经验证实验确定木聚糖催化降解制备低聚木糖的最佳工艺条件为反应温度140 ℃、AC-SO3H催化剂用量0.2 g、反应时间3 h。
2.3 不同催化剂对木聚糖水解液中低聚木糖收率的影响
为探究不同催化剂对低聚木糖收率的影响,在最佳条件下,分别用AC-SO3H、M-AC-SO3H、S-AC-SO3H催化木聚糖水解,见表2。
表2 不同催化剂对低聚木糖收率的影响
Table2 Effect of different catalysts on XOS yield
从表2可以看出,3 种催化剂作用下低聚木糖收率有一定的差异,AC-SO3H为催化剂时低聚木糖收率较大,可达66.60%。
2.4 催化剂表面酸量的测定
表3 催化剂表面酸量
Table3 Surface acidity of catalysts
从表3可以看出,与M-AC-SO3H、S-AC-SO3H相比,AC-SO3H表面酸量相对较小,但AC-SO3H作为催化剂低聚木糖收率最大,说明催化剂表面酸量对低聚木糖收率有一定的影响,得到高收率的低聚木糖可能需要适当量的表面酸量,酸量不能太多也不能太少。
2.5 最佳工艺条件下低聚木糖分布
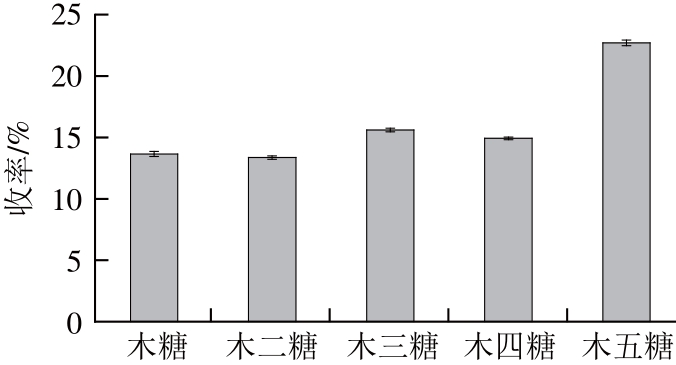
图5 最佳工艺条件下低聚木糖分布图
Fig.5 XOS composition of xylan hydrolysates under the optimized hydrolysis conditions
为确定最佳工艺条件下木聚糖水解制备低聚木糖收率,在反应釜中添加木聚糖0.5 g、蒸馏水20 mL、AC-SO3H催化剂0.2 g,在140 ℃反应3 h,反应结束后,通过高效液相色谱测定水解液中低聚木糖收率,如图5所示。以AC-SO3H为催化剂,在反应温度140 ℃、催化剂用量0.2 g、反应时间3 h时,木糖收率为13.65%,木二糖收率为13.36%,木三糖收率为15.61%,木四糖收率为14.93%,木五糖收率为22.70%,低聚木糖收率为66.60%。
以榉木木聚糖为原料,采用炭基固体酸催化剂(AC-SO3H)使其水解制备低聚木糖。利用单因素试验考察反应时间、反应温度、催化剂(AC-SO3H)用量等对低聚木糖收率及各组分收率的影响,并通过正交设计试验确定最佳工艺条件为0.5 g木聚糖、0.2 g AC-SO3H、反应时间3 h、反应温度140 ℃。并在此条件下,分别以AC-SO3H、M-AC-SO3H、S-AC-SO3H为催化剂,考察了不同催化剂对低聚木糖收率的影响,以AC-SO3H为催化剂时低聚木糖收率最大,为66.60%,较之优化前提高8%。
据报道[28-30],酸水解法、酶水解法、热水抽提法低聚木糖收率可达30%~60%,本实验采用炭基固体酸催化剂催化木聚糖降解,不仅具有反应易操作,催化剂使用方便、易于回收、可重复利用、对设备无腐蚀等优点,而且低聚木糖收率可达66.60%。
参考文献:
[1] 杨淑惠. 植物纤维化学[M]. 北京: 中国轻工业出版社, 2005: 6-9.
[2] 齐治涛, 张启焕, 仇明, 等. 低聚木糖对斑点叉尾鲴生长及血液指标的影响[J]. 水产科学, 2011, 30(12): 785-788. DOI:10.16378/ j.cnki.1003-1111.2011.12.015.
[3] LECERF J M, DEPEINT F, DUGENET Y, et al. Xylo-oligosaccharide (XOS) in combination with inulin modulates both the intestinal environment and immune status in healthy subjects, while XOS alone only shows prebiotic properties[J]. British Journal of Nutrition, 2012, 108(10): 1-12. DOI:10.1017/S0007114511007252.
[4] 张洪宾, 丁长河, 周迎春, 等. 低聚木糖生产现状及其应用[J]. 粮食与油, 2012(11): 46-68. DOI:10.3969/j.issn.1008-9578.2012.11.016.
[5] ALEXANDER A, DWIVEDI S, AJAZUDDIN, et al. Approaches for breaking the barriers of drug permeation through transdermal drug delivery[J]. Journal of Controlled Release, 2012, 164: 26-40. DOI:10.1016/ j.jconrel.2012.09.017.
[6] 孙毅, 韩春超. 低分子木糖的制备与应用[J]. 化工时刊, 2014(6):31-34. DOI:10.3969/j.issn.1002-154X.2014.06.010.
[7] AKPINAR O, ERDOGAN K, BOSTANCI S. Production of xylooligosaccharides by controlled acid hydrolysis of lignocellulosic materials[J]. Carbohydrate Research, 2009, 344(5): 660-666. DOI:10.1016/j.carres.2009.01.015.
[8] 刘英丽, 李夏兰, 余晓芬, 等. 微波辅助酸水解麦糟制备低聚木糖的工艺[J]. 华侨大学学报(自然科学版), 2008, 29(2): 232-235. DOI:10.11830/ISSN.1000-5013.2008.02.0232.
[9] GARROTE G, PARAJO J. Non-isothermal autohydrolysis of Eucalyptus wood[J]. Wood Science and Technology, 2002, 36(2): 111-123. DOI:10.1007/s00226-001-0132-2.
[10] CARYVALHEIRO F, ESTEVES M, PARAJO J, et al. Production of oligosaccharides by autohydrolysis of brewery’s spent grain[J]. Bioresource Technology, 2004, 91(1): 93-100. DOI:10.1016/S0960-8524(03)00148-2.
[11] MOSIER N, WYMAN C, DALE B, et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresource Technology, 2005, 96(6): 673-686. DOI:10.1021/jp002156r.
[12] WANG T H, LU S. Production of xylooligosaccharide from wheat bran by microwave assisted enzymatic hydrolysis[J]. Food Chemistry, 2013, 138(2/3): 1531-1535. DOI:10.1016/ j.foodchem.2012.09.124.
[13] MANDELLI F, BRENELLI L B, ALMEIDA R F, et al. Simultaneous production of xylooligosaccharides and antioxidant compounds fromsugarcane bagasse via enzymatic hydrolysis[J]. Industrial Crops and Products, 2014, 52(1): 770-775. DOI:10.1016/j.indcrop.2013.12.005.
[14] AZELEE N I W, JAHIM J M, ISMAIL A F, et al. High xylooligosaccharides (XOS) production from pretreated kenaf stem by enzyme mixture hydrolysis[J]. Industrial Crops and Products, 2016, 81:11-19. DOI:10.1016/j.indcrop.2015.11.038.
[15] 朱浩拥, 王俊丽, 吴春, 等. 酶法制备玉米芯低聚木糖工艺条件的研究[J]. 粮食与饲料工业, 2011(12): 54-57. DOI:10.3969/ j.issn.1003-6202.2011.12.016.
[16] 方哈哈, 王敏敏, 张晓勤. 利用秸秆等农弃物制备低聚木糖的研究[J].广州化工, 2013, 41(13): 6-7. DOI:10.3969/j.issn.1001-9677.2013.13.003.
[17] WANG M, WU W, WANG S, et al. Preparation and characterization of a solid acid catalyst from macro fungi residue for methyl palmitate production[J]. Bioresources, 2015, 10(3): 237-251. DOI:10.15376/ biores.10.3.5691-5708.
[18] ZHANG M, SUN A, MENG Y, et al. catalytic performance of biomass carbon-based solid acid catalyst for esterif i cation of free fatty acids in waste cooking oil[J]. Catalysis Surveys from Asia, 2015, 19(2): 61-67. DOI:10.1007/s10563-014-9182-y.
[19] XUE W, ZHAO H, YAO J, et al. Esterif i cation of cyclohexene with formic acid over a peanut shell-derived carbon solid acid catalyst[J]. Chinese Journal of Catalysis, 2016, 37(5): 769-777. DOI:10.1016/ S1872-2067(15)61076-2.
[20] 詹盈盈, 杨文霞, 刘迎新. 碳基固体酸的制备与应用研究进展[J].浙江化工, 2016(1): 21-25. DOI:10.3969/j.issn.1006-4184.2016.01.012.
[21] FU X, LI D, CHEN J, et al. A microalgae residue based carbon solid acid catalyst for biodiesel production[J]. Bioresource Technology, 2013, 146(10):767-770. DOI:10.1016/j.biortech.2013.07.117.
[22] 李明, 陈登宇, 朱锡锋. 稻壳炭基固体酸催化剂的制备及其催化酯化反应性能[J]. 催化学报, 2013, 34(9): 1674-1682. DOI:10.1016/ S1872-2067(12)60634-2.
[23] MO X, LOTERO E, LU C, et al. A novel sulfonated carbon composite solid acid catalyst for biodiesel synthesis[J]. Catalysis Letters, 2008, 123(1): 1-6. DOI:10.1007/s10562-008-9456-y.
[24] PENG F, ZHANG L, WANG H, et al. Sulfonated carbon nanotubes as a strong protonic acid catalyst[J]. Carbon, 2005, 43(11): 2405-2408. DOI:10.1016/j.carbon.2005.04.004.
[25] 江文辉, 文鹤林. 磺化碳固体酸催化麻疯油与甲醇的酯交换反应[J]. 林产化学与工业, 2009, 29(4): 113-116. DOI:10.3321/ j.issn:0253-2417.2009.04.024.
[26] 张文娟, 马海龙, 杨亚提, 等. 松木粉制备高比表面积炭基固体酸催化剂[J]. 生物质化学工程, 2012, 46(1): 15-18. DOI:10.3969/ j.issn.1673-5854.2012.01.004.
[27] WANG X, LIU R, WAJE M M, et al. Sulfonated ordered mesoporous carbon as a stable and highly active protonic acid catalyst[J]. Chemistry of Materials, 2007, 19(10): 2395-2397. DOI:10.1021/cm070278r.
[28] JING B, PENG F, PENG X P, et al. Structural features and antioxidant activity of xylooligosaccharides enzymatically produced from sugarcane bagasse[J]. Bioresource Technology, 2013, 127(1): 236-241. DOI:10.1016/j.biortech.2012.09.112.
[29] AKPINAR O, ERDOGAN K, BAKIR U, et al. Comparison of acid and enzymatic hydrolysis of tobacco stalk xylan for preparation of xylooligosaccharides[J]. Food Science and Technology, 2010, 43(1): 119-125. DOI:10.1016/j.lwt.2009.06.025.
[30] XIAO X, BIAN J, PENG X P, et al. Autohydrolysis of bamboo (Dendrocalamus giganteus Munro) culm for the production of xylooligosaccharides[J]. Bioresource Technology, 2013, 138(6): 63-70. DOI:10.1016/j.biortech.2013.03.160.
Opimization of Xylan Hydrolysis Catalyzed by Carbon-Based Solid Acid Catalyst for Preparing Xylooligosaccharides
HAN Pengfei1,2, YU Zuosi1, GUO Jianzhong1,*, LI Bing1, LIU Li1
(1. Key Laboratory of Chemical Utilization of Forestry Biomass of Zhejiang Province, School of Sciences, Zhejiang A&F University, Lin’an 311300, China; 2. School of Engineering, Zhejiang A&F University, Lin’an 311300, China)
Abstract:In the current study, xylooligosaccharides (XOS) were prepared by catalytic hydrolysis of beech wood xylan using carbon-based solid acid catalyst (AC-SO3H). The effects of reaction time, temperature and catalyst dosage on the yield of XOS were investigated. Using orthogonal array design, t he optimal hydrolysis conditions were determined as 0.5 g of xylan, 0.2 g of AC-SO3H, and reaction time3 h at 140 ℃. Under these conditions, the effect of different catalysts, namely, AC-SO3H, M-ACSO3H and S-AC-SO3H, on XOS yield was investigated. The results showed that the highest yield of XOS of 66.60% was obtained by using AC-SO3H.
Key words:xylan; xylooligosaccharides; carbon-based solid acid catalyst
DOI:10.7506/spkx1002-6630-201712026
中图分类号:TS245.9
文献标志码:A
文章编号:1002-6630(2017)12-0171-06
引文格式:韩鹏飞, 虞佐嗣, 郭建忠, 等. 炭基固体酸催化水解木聚糖制备低聚木糖的工艺优化[J]. 食品科学, 2017, 38(12):171-176.
DOI:10.7506/spkx1002-6630-201712026. http://www.spkx.net.cn
HAN Pengfei, YU Zuosi, GUO Jianzhong, et al. Opimization of xylan hydrolysis catalyzed by carbon-based solid acid catalyst for preparing xylooligosaccharides[J]. Food Science, 2017, 38(12): 171-176. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201712026. http://www.spkx.net.cn
收稿日期:2016-09-03
基金项目:国家自然科学基金面上项目(21677132);浙江省科技厅公益技术研究农业项目(2014C32040;2016C32014);浙江农林大学林业工程学科创新团队基金项目(101/206001000710);浙江农林大学学生科研训练项目(110-2013200025)
作者简介:韩鹏飞(1991—),男,硕士研究生,研究方向为多糖物质。E-mail:912954585@qq.com
*通信作者:郭建忠(1975—),男,副教授,博士,研究方向为功能性低聚糖开发。E-mail:gjianzhong123@163.com