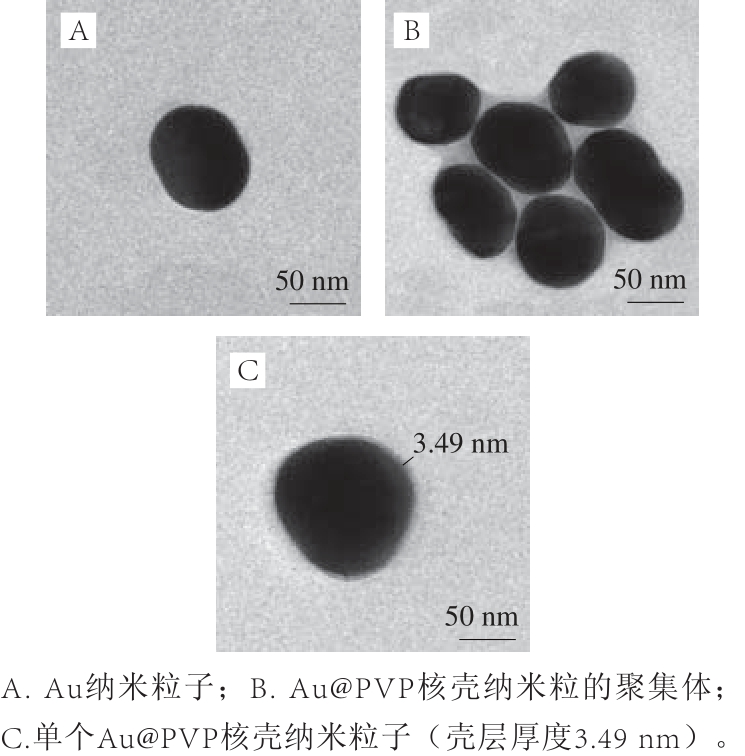
图1 Au@PVP核壳纳米粒子滴加在铜网上的透射电子显微镜图
Fig.1 Transmission electron microscope of Au@PVP core-shell nanoparticles on the Cu net
徐宁宁,孙 文,张 芹*
(集美大学食品与生物工程学院,福建 厦门 361021)
摘 要:利用水热法合成聚乙烯吡咯烷酮包金(Au@PV P)核壳纳米粒子,通过氢键的作用使联苯胺吸附在Au@ PVP核壳纳米粒子表面增强拉曼基底上,优化激发光波长、选择合适的pH值条件,利用其内核金纳米粒子的等离子共振效应实现了对联苯胺分子的高灵敏度表面增强拉曼检测,检测限达到10-9mol/L。此值与GB 3838—2002《地表水环境质量标准》中用气相色谱法检测集中式生活饮用地表水源的特定分析方法检测联苯胺的检测限相比,降低了接近3 个数量级。
关键词:聚乙烯吡咯烷酮包金(Au@PVP)核壳纳米粒子;联苯胺;表面增强拉曼
联苯胺又名对二氨基联苯,这类污染物经由化工合成工业废水而引入水体、土壤和空气中,包括高分子材料、钢管材料以及生物医药的废水;皮革、造纸等相关行业的废水[1]。水体中的联苯胺对环境危害大[2],通过海洋生物直接或者间接的被鱼类或者贝类吸收,进入食物链最终到达人体内,从而引起人类产生癌变[3]。目前检测联苯胺的主要方法包括高效液相色谱法[4-5]、质谱法[6]、液相色谱-质谱联用法[7]和气相色谱-质谱联用[8]。这些方法具有精确度高、准确性好的优点,但是其存在样品的前处理繁琐、耗时费力等弊端。
表面增强拉曼散射(surface enhanced Raman scattering,SERS)主要是指纳米尺度的粗糙金属,如金、银、铂及过渡金属表面或颗粒体系所具有的异常光学增强现象,它可以将吸附在表面的分子拉曼信号放大约106~1014倍[9],有的甚至能实现单分子检测[10]。因其具有检测快、灵敏度高、干扰性小及无损等优点,使其在分析中得到了广泛应用。SERS的检测主要依赖于制备出的基底,食品中有毒有害物质的定量检测SERS基底主要有银纳米粒子[11-16]、金纳米粒子[17-22]、以氧化铝蜂巢状的纳米孔洞结构为模板制备的金纳米粒子[23]、气液界面自组装制备纳米粒子阵列[24-25]等。目前,杨有铭等[26]通过制备银纳米溶胶对水中微量联苯胺进行了定性的检测,但是银溶胶SERS基底易被氧化,不能长时间放置;Wang Zhijiang等[27]通过合成榴莲状的Fe3O4-Au纳米粒子用巯基进行修饰后,根据磁性的可分离性对联苯胺进行了检测,检测限达到1.8×10-7mol/L。上述利用SERS技术对联苯胺进行检测存在基底易氧化和检测限高的弊端。
本实验通过水热法合成了粒径均一可控的聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)包金(Au@PVP)核壳纳米粒子,以Au@PVP核壳纳米粒子作为SERS基底联苯胺作为探针分子,通过探讨联苯胺与Au@PVP核壳纳米粒子的吸附能力强弱,最适波长、最适pH值条件后,确定其最佳吸附作用的因素对联苯胺分子进行了定量检测分析,其检测限达到10-9mol/L。
1.1 材料与试剂
氯金酸、柠檬酸钠、PVP、过氧化氢、浓盐酸、浓硫酸、浓硝酸(均为分析纯) 国药集团化学试剂有限公司;联苯胺(分析纯) 上海阿拉丁化学试剂有限公司;Milli-Q超纯水 美国Millipore公司。
1.2 仪器与设备
JEM-1400透射电子显微镜 日本Jeol公司;UV-2550紫外-可见分光光度计 日本岛津公司;Nicolet Avatar 330傅里叶变换红外光谱仪 美国热电公司;HIT ACHI S-4800扫描电子显微镜 日本日立公司;Xplora共焦显微拉曼光谱仪 法国Horiba Jobin Yvon公司;N型100单晶面硅片 中国电子科技集团公司第四十六研究所。
1.3 方法
1.3.1 SERS基底的制备
Au纳米粒子(AuNPs)按照Fren’s[28]法用柠檬酸还原氯金酸合成制备。在沸腾条件下,向200 mL质量浓度0.2 g/100 mL的HAuCl4溶液中快速加入1.4 mL 1%的柠檬酸三钠溶液,溶液于30 s内变为黑色,接着回流溶液由黑色变为红棕色,持续反应30 min,自然冷却至室温可制备粒径为55 nm的Au纳米粒子溶胶。
取20 mL的AuNPs溶胶于烧瓶中,加入100 μL 1%的PVP溶液,室温25 ℃、1 000 r/min离心20 min,在下层可合成制得Au@PVP核壳纳米粒子。
1.3.2 联苯胺紫外及拉曼检测
Au@PVP核壳纳米粒子原液与联苯胺按照不同体积比例吸附适当时间后,在9 000 r/min离心5 min,取上清液测紫外吸收峰。
取适量的联苯胺固体粉末,置于干净的载玻片上,用盖玻片将其压平,在拉曼仪器上,在合适的激发波长条件下测得联苯胺固体常规拉曼标准谱图。用HCl和NaOH调联苯胺的pH值,不同的pH值条件下,测其拉曼强度。配制系列浓度10-9、10-8、10-7、10-6、10-5、10-4mol/L的联苯胺溶液,分别于SERS基底混合吸附一定时间后离心浓缩,取金溶胶10 μL滴加于干净的硅片上,干燥后对吸附在SERS基底表面的联苯胺分子进行表面增强拉曼检测。实验上共计合成16 个批次的Au@PVP,每个批次的纳米粒子的壳层厚度经过超声水洗后[29],都约为1.5 nm;以Au@PVP核壳纳米粒子为基底检测SERS是在不同位置测了8 个点,其SERS强度相对标准偏差小于20%。
2.1 Au@PVP核壳纳米粒子合成
向金纳米粒子溶液中加入PVP,在室温条件下控制反应时间,可制备得到以金纳米粒子为核、PVP为壳层的核壳纳米粒子。透射电子显微镜结果显示(图1),金纳米粒子的周围有一层很薄均匀的壳层,壳层厚度约为3.5 nm。经过超声水洗后,壳层厚度会变薄,但不会被完全洗掉。这主要是因为PVP通过五元环上的N原子与O原子与Au纳米粒子通过化学键作用[30]形成Au@PVP核壳纳米粒子。随着Au@PVP核壳纳米粒子的壳层厚度减小,从3.5 nm减小到1.5 nm,联苯胺拉曼信号强度增加约1.5 倍。

图1 Au@PVP核壳纳米粒子滴加在铜网上的透射电子显微镜图
Fig.1 Transmission electron microscope of Au@PVP core-shell nanoparticles on the Cu net
2.2 Au@PVP核壳纳米粒子对联苯胺分子的吸附作用
向10-5mol/L浓度的联苯胺分子中加入不同量的Au@ PVP核壳纳米粒子混合吸附,根据联苯胺溶液在吸附前后吸光度变化可估算出联苯胺分子在Au@PVP壳层表面吸附程度。由图2可以看出,联苯胺被吸附后其溶液吸光度呈现明显降低,Au@PVP的核壳纳米粒子按照体积比为9∶1时降低最明显,从降低的程度可以估算联苯胺与的吸附率,最高可达到96%。这种吸附作用很有可能是由酰基的氧原子(未与金属结合的)与联苯胺分子的—NH2上的H形成氢键而将其捕获至核壳纳米粒子表面,利用内核的金纳米粒子的表面等离子体共振效应,实现联苯胺分子的表面增强拉曼检测。

图2 不同比例联苯胺与Au@PVP核壳纳米粒子混合吸附相同时间后未被吸附的联苯胺溶液的紫外吸光光谱
Fig.2 UV-Vis spectra of 10-5mol/L benzidine solution after being absorbed by Au@PVP for the same periods at different volume ratios
2.3 联苯胺的拉曼检测结果
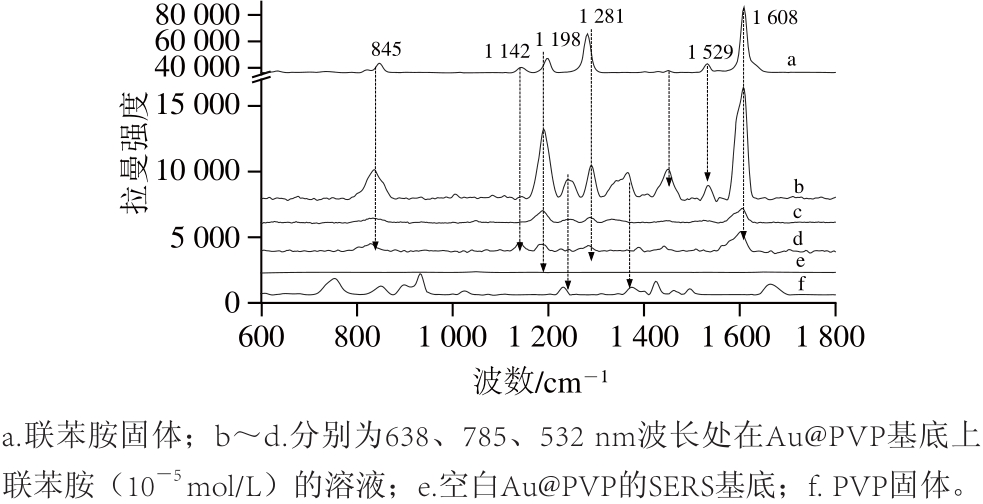
图3 不同激光波长条件下联苯胺(10-55mol/L)溶液在Au@PVP基底的拉曼光谱图
Fig.3 Raman spectra of benzidine ( 10-5mol/L) absorbed on the substrate of Au@PVP obtained at different laser wavelengths
联苯胺与Au@PVP核壳纳米粒子SERS基底混合吸附后,滴加到硅片上在激发波长分别为785、638、532 nm的条件下测试结果如图3所示。从图3可以看出,638 nm激发光的波长条件下拉曼强度最强。在1 608 cm-1最强的峰处,638 nm波长条件下的拉曼强度是785 nm的5.4 倍,是532 nm的5.1 倍。这说明638 nm的激光波长是检测联苯胺的最适波长,这比联苯胺的275 nm的最大紫外吸收波要长很多,这主要是因为联苯胺分子的—NH2上的H与Au@PVP核壳纳米粒子的酰基的氧原子(未与金属结合的)与形成氢键而使其紫外共振吸收向长波长方向移动。因此,选择638 nm作为最适的激发波长。从图3还可以看出,联苯胺的拉曼峰主要在817、845、1 142、1 198、1 281、1 529、1 608 cm-1。拉曼峰数多与联苯胺两个对位芳香环不在同一平面上,整个分子对称性降低即为C2对称性相关。其中1 529、1 608 cm-1和1 427、1 397 cm-1处的峰归属于苯环的C—C伸缩振动和苯环的振动,1 142 cm-1处的峰归属于C—H面内的弯曲振动,1 281 cm-1的峰归属于联苯胺的桥键伸缩振动,817、845 cm-1处的峰归属于环的呼吸,这些峰与文献[26]报道的一致。

图4 不同pH值条件下联苯胺溶液(10-55mol/L)在Au@PVP基底的拉曼SEERRSS光谱
Fig.4 Raman spectra of benzidine (10-5mol/L) absorbed on Au@PVP substrate at different pH values
联苯胺溶液(10-5mol/L)在不同pH值条件下与Au@ PVP核壳纳米粒子混合吸附后测其拉曼谱图结果见图4。在pH 3的条件下联苯胺的拉曼峰最强,pH 13的条件下联苯胺的拉曼峰最弱。pH 3条件下的拉曼强度比pH 6条件下的拉曼强度高1.5 倍,比pH 13条件下的拉曼强度高13 倍。与联苯胺固体相比,pH 3条件下的联苯胺在1 608 cm-1处发生了6 cm-1的位移,1 198 cm-1处的峰位发生了10 cm-1的位移。这主要是因为联苯胺属于芳香胺含有两个氨基基团,当溶液的酸碱性发生变化时,联苯胺的氨基存在形式可能发生变化[30],影响了联苯胺与Au@PVP核壳纳米粒子的结合,拉曼信号强度发生改变。
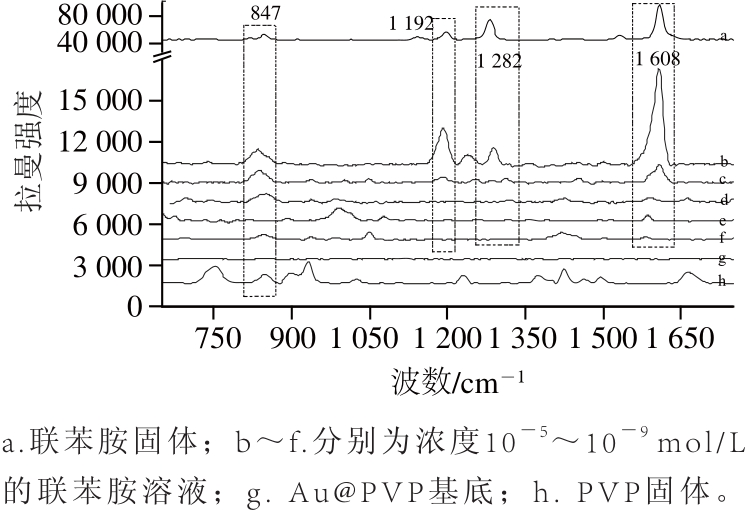
图5 联苯胺的定量SERS检测
Fig.5 SERS detection of benzidine at different concentrations
以Au@PVP为SERS基底,在pH 3的条件下,分别检测10-9、10-8、10-7、10-6、10-5、10-4mol/L的联苯胺分子得到的拉曼谱图(图5)。从图5可以看出,联苯胺分子的拉曼峰强度与浓度呈正相关,联苯胺分子的浓度越大,拉曼峰强度越强。该方法线性范围为10-6~10-9mol/L,线性相关系数0.94,检测限可达到1×10-9mol/L。此值与GB 3838—2002《地表水环境质量标准》中用气相色谱法检测集中式生活饮用地表水源的特定分析方法检测联苯胺的检测限[2]相比,降低了接近3 个数量级。
Au@PVP核壳纳米粒子作为SERS基底除了检测联苯胺以外,也可以检测孔雀石绿。根据Au@PVP与孔雀石绿作用的研究[31]得知,919、1 176、1 219、1 299、1 367、1 399、1 591、1 618 cm-1为孔雀石绿的特征拉曼峰(图6中用直线标出),与测得联苯胺拉曼特征峰847、1 192、1 282、1 608 cm-1(图6用方框标出)相区别。由于孔雀石绿和联苯胺的特征峰波数不同,可以将两者很好地区分,因此用Au@PVP的SERS基底对联苯胺进行拉曼检测具有很好的选择性。

图6 联苯胺和孔雀石绿在Au@PVP基底上的SERS谱图
Fig.6 SERS spectra of benzidine and malachite green absorbed on Au@PVP

图7 联苯胺实际样品拉曼测定
Fig.7 SERS detection of benzidine in real samples of tap water
自来水样品与Au@PVP核壳纳米粒子进行混合吸附后进行SERS测定,自来水样品中未检测到联苯胺。于自来水样品中添加系列联苯胺标样的拉曼图见图7。可以看出,与相同浓度的标准溶液的拉曼图相比较,峰的位置和形状基本相同,可以对实际样品进行定性,但检测的灵敏度下降,检测限为5.3×10-8mol/L,检出范围为1.04×10-5~5.3×10-8mol/L。样品加标回收率为53%~129%,相对标准偏差为0.9%~3.77%(表1)。这说明联苯胺测定的回收率较高,测定的精密度好,结果可靠。
表1 自来水样品中联苯胺的表面增强拉曼检测的回收率
Table1 Recoveries of benzidine in spiked real samples of tap water

通过在常温条件下用水热法合成了粒径均一的Au@ PVP核壳纳米粒子。Au@PVP核壳纳米粒子对联苯胺分子之间通过氢键作用进行吸附。通过对Au@PVP核壳纳米粒子与联苯胺分子最适比例进行优化以及测试条件pH值进行优化后,利用Au@PVP核壳纳米粒子SERS基底的内核金纳米粒子的等离子体共振效应可以实现联苯胺分子的高灵敏的分析检测。联苯胺分子在SERS基底上的检测限达到了1×10-9mol/L。此值与GB 3838—2002中用气相色谱法检测集中式生活饮用地表水源的特定分析方法检测联苯胺的检测限相比,降低了接近3 个数量级。
参考文献:
[1] 曹向禹. 含联苯胺废水处理技术的研究进展[J]. 染料与染色, 2012, 49(4): 52-55.
[2] 国家环境保护总局, 国家质量监督检验检疫总局. 地表水环境质量标准: GB 3838—2002[S]. 北京: 中国标准出版社, 2002 .
[3] 刘斌, 周培疆, 吴新国, 等. 联苯胺对酸碱性磷酸酶抑制作用及其动力学研究[J]. 环境科学与技术, 2005, 28(3): 6-8.
[4] 史新梅, 王氢, 吴万年. 高效液相色谱法测定棉布中的联苯胺[J].色谱, 1999(17): 75-76.
[5] 何立志, 贺丰炎, 黄警萱, 等. 饮用水源中痕量联苯胺的检测方法[J].中国环境检测, 2012, 28(4): 98-100. DOI:10.12030/j.cjee.201503037.
[6] CASAL S, MENDES E, FERNANDES J O, et al. Analysis of heterocyclic aromatic aromatic amines in foods by gas chromatography-mass spectrometry as their tert.-butyldimethylsilyl derivatives[J]. Journal of Chromatography A, 2004, 1040(1): 105-114.
[7] 朱丽波, 徐能斌, 冯加永, 等. 双柱串联UPLC-MS/MS法检测水中的4种胺类物质[C]//中国环境科学学术年会论文集: 第四卷, 2013: 594-597.
[8] 罗毅. 地表水环境质量检测实用分析方法[M]. 北京: 中国环境科学出版社, 2009: 12-14.
[9] 丁松园, 吴德印, 杨志林, 等. 表面增强拉曼散射增强机理的部分研究进展[J]. 高等化学学报, 2008, 29(12): 2569-2681.
[10] NIE S M, EMERY S R. Probing single molecules and single nanoparticles by surface-enhanced raman scattering[J]. Science, 1997, 275: 1102-1106.
[11] 左奇, 陈瑶, 石彩霞, 等. 表面增强拉曼散射光谱定量分析技术的研究进展[J]. 分析化学, 2015, 43(11): 1656-1663. DOI:10.11895/ j.issn.0253-3820.150597.
[12] LI J L, CHEN L X, LOU T, et al. High sensitive SERS detection of As3+ions in aqueous media using glutathione functionalized silvernanoarticles[J]. ACS Applied Materials & Interfaces, 2011, 3(10): 3936-3941.
[13] 李晓坤, 张友林, 孔祥贵. Ag纳米粒子聚集体的SiO2包覆及其SERS效应[J]. 发光学报, 2014, 35(7): 853-857.
[14] SAITO Y, WANG J J, SMITH D A, et al. A simple chemical method for the preparation of silver surfaces for efficient SERS[J]. Langmuir, 2002, 18(8): 2959-2961.
[15] LIAO P F, BERGMAN J G, CHEMLA D S, et al. Surface-ehanced Raman scattering from microlithographic silver particle surfaces[J]. Chemical Physics Letters, 1981, 82(2): 355-359. DOI:10.1016/0009-2614(81)85172-X.
[16] LIN C C, LIN C Y, LIN C Y, et al. Highly efficiency SERS detection of clinical microorganism by AgNPs-decorated filter membrane and pattern recogintion techniques[J]. Sensors and Actuators B: Chemical, 2017, 241:513-521. DOI:10.1016/j.snb.2016.09.183.
[17] 黄梅英, 李攻科, 胡玉玲. 表面增强拉曼光谱法定量检测食品中香豆素[J]. 分析化学研究报告, 2015, 43(8): 1218-1223.
[18] ZHANG R Y, PANG D W, ZHANG Z L, et al. Investigation of ordered Ds-DNA monolayers on gold electrodes[J]. Journal of Physical Chemistry B, 2002, 106(43): 11233-11239.
[19] KIM Y T, SCHILLING J, STEFAN L S, et al. Morphology dependence on surface-enhanced Raman scattering using gold nanord arrays consisting of agglomerateal nanoparticles[J]. Plasmonics, 2017, 12(1):203-208. DOI:10.1007/s11468-016-0250-1.
[20] CAO Qian, WANG Xiaoyu, CUI Qianling, et al. Synthesis and application of bifunctional gold/gelatin nanocomposites with enhanced fluorescence and Raman scattering[J]. Colloids Surfaces A: Physicochemical and Engineering Aspects, 2017, 514: 117-125. DOI:10.1016/j.colsurfa.2016.11.057.
[21] WANG Liwei, LI Ruoping, LIU Junhui, et al. Synthesis of Au@CdS core-shell nanoparticles and their photocatalytic capacity researched by SERS[J]. Journal of Materials Science, 2017, 52: 1847-1855.
[22] AMENDOLA V, SCARAMUZZA S, CARRARO F, et al. Formation of alloy nanoparticles by laser ablation of Au/Fe multilayer films in liquial environment[J]. Journal of Colloid anol Interface Science, 2017, 489: 18-27. DOI:10.1016/j.jcis.2016.10.023.
[23] 潘晓会, 张芹, 郭伟, 等. 利用AAO模板制备SERS基底检测Sudan I[J].光谱学与光谱分析, 2015, 35(6): 1556-1561.
[24] 肖海波, 张芹, 郭伟, 等. 气/液界面自组装金纳米粒子薄膜作为SERS基底检测三聚氰胺[J]. 光谱学与光谱分析, 2012, 32(8): 2147-2151.
[25] FREEMAN R G, KATHERINE C, ALLISON K J, et al. Self-assemnled metal colloid monlayers: an approach to SERS substrates[J]. Science, 1995, 267: 1629-1632.
[26] 杨有铭, 阮伟东, 宋薇, 等. 表面增强拉曼光谱检测联苯胺[J]. 高等学校化学学报, 2012, 33(10): 2191-2194.
[27] WANG Z J, WU L, WANG F P, et al. Durian-like multi-funcational Fe3O4-Au nanoparticles: synthesis, characterization and selective dectection of benzidine[J]. Juranal of Materials Chemistry A, 2013, 1(34):9746-9751. DOI:10.1039/C3TA11477E.
[28] FREN’S G. Controlled nucleation for the regulation of the particle size in monodispers gold suspensions[J]. Nature, 1973, 241: 20-22.
[29] SEOUDI R, FOUDA A, ELMENSHAWY D. Synthesis, characterization and vibrational spectroscopic studies of different particle size of gold nanoparticle capped with polyvinylpyrrolidone[J]. Physica B: Condensed Matter, 2010, 405(3): 906-911.
[30] do NASCIM G M, BARBOSA P S M, CONSTANTINO V R L, et al. Berzidine oxidation on cationic clay surfaces in aqueous suspension monitored by in situ resonance Raman spectroscopy[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 289(1/2/3):39-46.
[31] 徐宁宁, 张芹, 郭伟, 等. Au@PVP核壳纳米粒子作为表面增强拉曼散射基底检测孔雀石绿[J]. 分析化学, 2016, 44(9): 1378-1384.
Surface-Enhanced Raman Scattering Detection of Benzidine
XU Ningning, SUN Wen, ZHANG Qin*
(College of Food and Biological Engineering, Jimei University, Xiamen 361021, China)
Abstract:Au@PVP core-shell nanoparticles were prepared by the hydrothermal method. Benzidine molecules were absorbed onto the surface of Au@PVP core-shell nanoparticles through the hydrogen bonding interaction between benzidine and polyvinylpyrrolidone (PVP). Benzidine molecules could be highly sensitively detected by the electromagnetic enhancement effect of the inner-core Au nanoparticles under the optimal excitation wavelength and the appropriate pH value. The limit of detection (LOD) was 10-9mol/L, which was nearly 103times lower than the limit of detection of the gas chromatography (GC) method for surface drinking water described in the Environment Quality Standards for Surface Water.
Key words:Au@PVP core-shell nanoparticle; benzidine; surface-enhanced Raman scattering (SERS)
DOI:10.7506/spkx1002-6630-201712035
中图分类号:O657.37
文献标志码:A
文章编号:1002-6630(2017)12-0229-05
引文格式:徐宁宁, 孙文, 张芹. 表面增强拉曼散射法检测联苯胺[J]. 食品科学, 2017, 38(12): 229-233.
DOI:10.7506/spkx1002-6630-201712035. http://www.spkx.net.cn
XU Ningning, SUN Wen, ZHANG Qin. Surface-enhanced raman scattering detection of benzidine[J]. Food Science, 2017, 38(12): 229-233. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712035. http://www.spkx.net.cn
收稿日期:2016-07-04
基金项目:国家自然科学基金青年科学基金项目(21101073);福建省自然科学基金计划项目(2011J01053);福建省教育厅杰青培育项目(JA11147)
作者简介:徐宁宁(1989—),女,硕士研究生,主要从事食品安全质量检测研究。E-mail:123941147@qq.com
*通信作者:张芹(1976—),女,副教授,博士,主要从事食品分析及表面物理化学研究。E-mail:qinzhang@jmu.edu.cn