表1 食品中常用农残检测前处理方法的特点
Table1 Features of several commonly used sample pretreatment methods for the determination of pesticide residues in food

卢俊文,张宪臣*,杨 芳,李 蓉*,张朋杰,黄思允,林淑绵
(中山出入境检验检疫局,广东 中山 528400)
摘 要:建立QuEChERS-气相色谱-串联质谱法测定蔬菜中20 种多溴联苯和多溴联苯醚残留量方法。样品采用酸化乙腈振荡提取,无水硫酸镁与氯化钠盐析,经十八烷基硅烷键合硅胶和乙二胺-N-丙基硅烷净化,并利用气相色谱-串联质谱在选择反应监测模式下进行检测,外标法定量。1~6溴代联苯及联苯醚的线性范围为0.05~5.0 mg/ L、7~8溴代联苯及联苯醚为0.1~5.0 mg/L、9~10溴代联苯和联苯醚为0.2~5.0 mg/L;相关系数(r)均大于0.99,方法检出限范围为0.30~17.67 ng/kg。在3 种不同蔬菜基质中3 个添加水平(0.25、0.5、2.5 mg/kg)的平均回收率为70.5%~118.9%,相对标准偏差为1.3%~11.2%。该方法前处理简单快速、灵敏度高,具有良好的回收率和稳定性,适用于蔬菜中多种多溴联苯和多溴联苯醚残留量的测定与确证。
关键词:多溴联苯和多溴联苯醚;QuEChERS;气相色谱-串联质谱;蔬菜
多溴联苯(polybrominated biphenyls,PBBs)和多溴联苯醚[1-2](polybrominated diphenyl ethers,PBDEs)属于溴代阻燃剂[3](biominated flame retardants,BFRs)。由于其优良的阻燃效率、热稳定性而被广泛应用于建材、纺织、化工等行业。近年来我国对BFRs的需求量不断增大,另外大量电子垃圾流入我国,在其拆解、回收有用金属的同时,产品中的多溴会释放到环境中,对周围生态及人体健康造成危害。目前在水体、大气、土壤、生物体及人体内均不同程度地检出PBBs和PBDEs[4-8],且其浓度呈上升趋势。PBBs、PBDEs及其代谢产物可使人的大脑、肝脏和肾脏等器官以及神经系统、内分泌系统、生殖系统等产生急性或慢性毒性,具有“致癌、致畸和致突变”三致作用[9],在环境中难降解,亲脂性高,可生物富集并产生放大效应。鉴于其毒性,PBBs和PBDEs的应用已受到密切的关注和控制。为了保护环境以及人类生态健康,PBBs、PBDEs类有机污染物已被欧盟和中国等众多法律法规与标准列为禁止使用。由于PBBs和PBDEs在环境介质中广泛分布,以及明显的生物富集作用,在很多食物中都检测出,包括饮用水、海洋鱼类及其产品、牛奶、鸡蛋、肉类和蔬菜等;目前有关食品中PBBs和PBDEs类污染物的研究主要集中在饮用水、海洋鱼类及其产品上,而蔬菜作为日常大量食用的食品,由于其生长过程与大气、水体、土壤密不可分而有可能受到PBBs和PBDEs类物质污染,因此蔬菜中PBBs和PBDEs类物质的污染状况值得关注[10-11]。
目前,食品中的PBBs和PBDEs的提取方法主要有索氏萃取[12]、液液萃取[13]、加速溶剂萃取[14]、固相微萃取[15]、微波辅助萃取等,净化步骤多采用凝胶渗透色谱[16](gel permeation chromatography,GPC)结合多层硅胶柱净化,前处理方法较为繁琐。而QuEChERS[17](Quick,Easy,Cheap,Effective,Rugged and Safe)方法具有简单、快速、廉价等特点,能有效去除有机酸、糖、色素及脂肪等杂质。测定方法[18]主要有气相色谱法[19-20]、高效液相色谱法[21]、气相色谱-质谱法[22-26]、气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GCMS/MS)法[27]和液相色谱-串联质谱法[28];多级质谱串联技术比单级质谱具有更高的灵敏度,常在复杂样品PBBs和PBDEs痕量分析中使用。卢大胜等[29]将鲈鱼样品进行快速溶剂萃取提取,然后采用分散固相萃取去除脂肪和串联固相萃取柱净化,最后使用GC-MS/MS法检测,方法检测限为0.16~3.29 pg/g;Baron等[30]使用GC-MS/ MS法同步分析了环境介质和生物样品中8 种PBDEs、8 种甲氧基化PBDEs和3 种新型阻燃剂(HBB、PBEB和DBDPE),其中鱼类样品中的方法检出限为0.04~10.6 ng/g。目前鲜见采用GC-MS/MS法检测蔬菜中PBBs和PBDEs残留量的相关报道。因此,本实验采用QuEChERS前处理提取净化方法,结合GC-MS/ MS法,建立测定蔬菜中多种PBBs和PBDEs残留量的方法。
1.1 材料与试剂
菜心、大白菜、黄瓜、番茄、土豆、胡萝卜、莲藕、蘑菇等蔬菜样品均为市购。
乙腈、甲酸(均为色谱纯) 美国默克公司;乙二胺-N-丙基硅烷(primary secondary amine,PSA)、十八烷基硅烷键合硅胶(ostade-cylsilane,C18)、石墨化炭黑(graphitized carbon black,GCB)德国C N W公司;2 0 种P B B s和P B D E s标准品:4-溴联苯(PBBs-3)、4,4’-二溴联苯(PBBs-1 5)、2,2’,5-三溴联苯(P B B s-1 8)、2,2’,5’,5’-四溴联苯(PBBs-52)、2,2’,4,5,5’-五溴联苯(PBBs-101)、2,2’,4,4’,5,5’-六溴联苯(PBBs-153)、2,2’,3,4,4’,5,5’-七溴联苯(PBBs-180)、2,2’,3,3’,4,4’,5,5’-八溴联苯(PBBs-194)、2,2’,3,3’,4,4’,5,5’,6-九溴联苯(PBBs-206)、十溴联苯(PBBs-209)混合标准品溶液 加拿大Wellington Laboratories公司;其中1~4溴联苯质量浓度1 μg/mL,5~8溴联苯质量浓度2 μg/mL,9~10溴联苯质量浓度5 μg/mL,纯度大于98.0%;3-溴联苯醚(PBDEs-2)、3,4’-二溴联苯醚(PBDEs-13)、2,4,4’-三溴联苯醚(PBDEs-28)、2,3’,4,4’-四溴联苯醚(PBDEs-66)、2,2’,3,4,4’-五溴联苯醚(PBDEs-85)、2,2’,3,4,4’,5’-六溴联苯醚(PBDEs-138)、2,3,3’,4,4’,5’,6-七溴联苯醚(PBDEs-191)、2,3,3’,4,4’,5,5’,6-八溴联苯醚(PBDEs-205)、2,2’,3,3’,4,4’,5,5’,6-九溴联苯醚(PBDEs-206)、十溴联苯醚(PBDEs-209)混合标准品溶液(质量浓度50 μg/mL,纯度>97.0%) 美国Accu Standard公司;无水硫酸镁、氯化钠(使用前在650 ℃的马弗炉内灼烧4 h)均为国产分析纯。
1.2 仪器与设备
TSQ Quantum XLS系列三重四极杆质谱仪(配Xcalibur数据处理系统) 美国赛默飞世尔公司;GM 200捣磨仪 德国Retsch公司;2-16K台式离心机、3-16K高速台式离心机 德国Sartorius-Sigma公司;涡旋混合器 德国IKA公司;TruboVapⅡ全自动浓缩仪美国Biotage公司。
1.3 方法
1.3.1 标准溶液的配制
PBDEs标准工作液:准确量取PBDEs的混合标准品溶液1 mL,用正己烷配制成5 μg/mL的混合标准工作液。
混合标准工作系列溶液:分别准确量取PBBs混合标准品溶液和PBDEs混合标准工作液0.1、0.2、0.5、1.0、2.0 mL用正己烷进行稀释,配制成混合标准工作系列溶液。
1.3.2 GC条件
色谱:DB-5 HT色谱柱(15 m×0.25 mm,0.1 μm);进样方式:不分流进样,分流流量50 mL/min,不分流时间1 min;进样口温度280 ℃;升温程序:初始温度120 ℃,保持2 min,以20 ℃/min升到320 ℃,以5 ℃/min升到340 ℃;流速1.5 mL/min;进样体积1 μL。
1.3.3 质谱条件
电子电离源;碰撞能量70 eV;离子源温度240 ℃;传输线温度300 ℃;溶剂延迟时间2.8 min;碰撞气(Ar)压力1.5 mtorr;扫描模式:选择性反应监测(selective reaction monitoring,SRM)模式;定量方法:峰面积外标法定量。
1.3.4 样品前处理
将样品置于捣磨仪中捣碎,准确称取混合均匀试样5.0 g(精确到0.01 g)于50 mL具塞离心管中,加入5 mL水,再加入0.2 mL甲酸和10.0 mL乙腈,涡旋1 min;再加入4 g无水MgSO4和1 g NaCl,振荡提取10 min,以4 500 r/min离心5 min;吸取全部上清液进行氮吹浓缩并定容至2.0 mL;再加入300 mg无水硫酸镁、50 mg C18粉末和50 mg PSA粉末,涡旋3 min,以12 000 r/min高速离心5 min,取上清液,供GC-MS/MS分析。
2.1 样品前处理方法的选择
目前,常用的食品中农药残留检测样品前处理方法主要有索氏提取法、液液萃取法、加速溶剂萃取法、凝胶渗透色谱法、固相微萃取法、微波辅助萃取法、基质固相分散法等,这些样品前处理方法尽管已经被研究了40~50 a,但都无法同期实现高选择性、高重复性、高回收率、快速简单的目标。表1中列出了食品中常用农残检测前处理方法的优缺点。QuEChERS方法是一种基于有机溶剂提取、盐析分层、吸附剂分散固相萃取净化3个步骤的快速样品前处理方法,该方法因其具有快速、简单、廉价、有效、可靠、安全的特点而得名QuEChERS。QuEChERS方法已成为国际上最新发展起来的一种用于农产品检测的快速样品前处理技术,因此本实验采用QuEChERS前处理方法结合GC-MS/MS法对蔬菜中多种PBBs和PBDEs进行检测。
表1 食品中常用农残检测前处理方法的特点
Table1 Features of several commonly used sample pretreatment methods for the determination of pesticide residues in food

2.2 吸附剂的优化
目前QuEChERS方法的本质就是使用分散固相萃取材料吸附杂质,去除基质成分,从而达到净化样品的目的。可用作QuEChERS法吸附剂有很多种,如PSA、C18、中性氧化铝、GCB等。PSA是正相硅胶键合吸附剂,可去除脂肪酸、有机酸、极性色素及糖类等物质;中性氧化铝表面呈中性,容易保留杂环类(含氮、磷、硫基),芳香烃和有机胺等富电化合物。C18是反向硅胶键合吸附剂,可以吸附溶液中弱极性的干扰物如脂肪、多环芳烃等。本实验选择以50 mg PSA和50 mg C18作为QuEChERS方法的吸附剂。如某些含色素较多的蔬菜(菜心、胡萝卜等),可加入25 mg GCB;因其具有片层结构,对于平面结构分子具有较好的保留,对蔬菜中色素的去除效果尤为显著。
2.3 进样口温度的优化
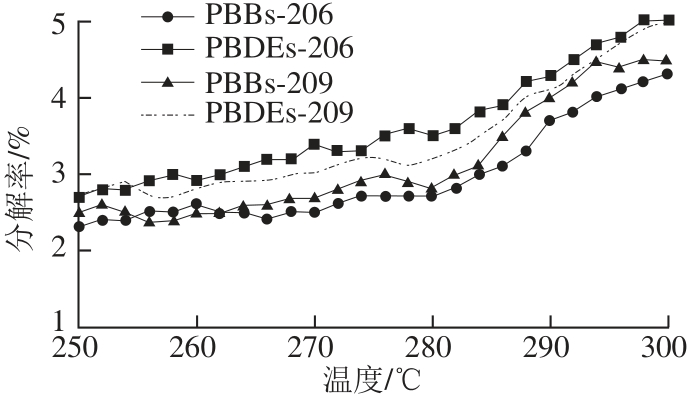
图1 PBBs和PBDEs的分解率随温度的变化图
Fig.1 Changes in the decomposition percentage with temperature of PBBs and PBDEs
在PBBs和PBDEs中,9~10溴联苯及联苯醚对温度比较敏感,高 温容易导致分解。因此,进样口温度对其影响较大。如图1所示,经过反复实验发现,9~10溴联苯及联苯醚的分解率随进样口温度的升高而升高。当进样口温度达到300 ℃时,分解率达到了5%左右;而进样口温度在250~280 ℃时,分解率基本变化不大。因此,在确保高灵敏度的条件下,最终确定进样口温度为280 ℃。
2.4 色谱柱及升温程序的选择和优化
对于1~7溴代联苯及联苯醚,考察在常规DB-5MS色谱柱(30 m×0.32 mm,0.25 μm)及DB-5HT色谱柱(15 m×0.25 mm,0.1 μm)上的出峰情况。从整体出峰情况看,化合物在2 种色谱柱上均能很好的分离,并且有较强的响应值;然而对于8~10溴代联苯和联苯醚,考虑到高溴代联苯及联苯醚类容易降解,如使用30 m的DB-5MS柱进行分析,化合物在色谱柱中更容易发生降解,从而导致二级响应值降低,影响定性与定量分析的准确性;因此选用分离性能好,对高溴代联苯及联苯醚降解性低的DB-5HT色谱柱(15 m×0.25 mm,0.1 μm),升温程序应控制在15 min以内,以确保分析物良好的信噪比,如图2、表2所示。

图2 20 种PBBs和PBDEs在SRM模式下总离子流图
Fig.2 Total ion current (TIC) chromatogram of 20 PBBs and PBDEs in selected reaction monitoring (SRM) mode
表2 20 种PBBs和PBDEs的SRM分析参数
Table2 Parameters of SRM for 20 PBBs and PBDEs

注:*.定量离子。
2.5 线性范围、方法检出限及定量限结果
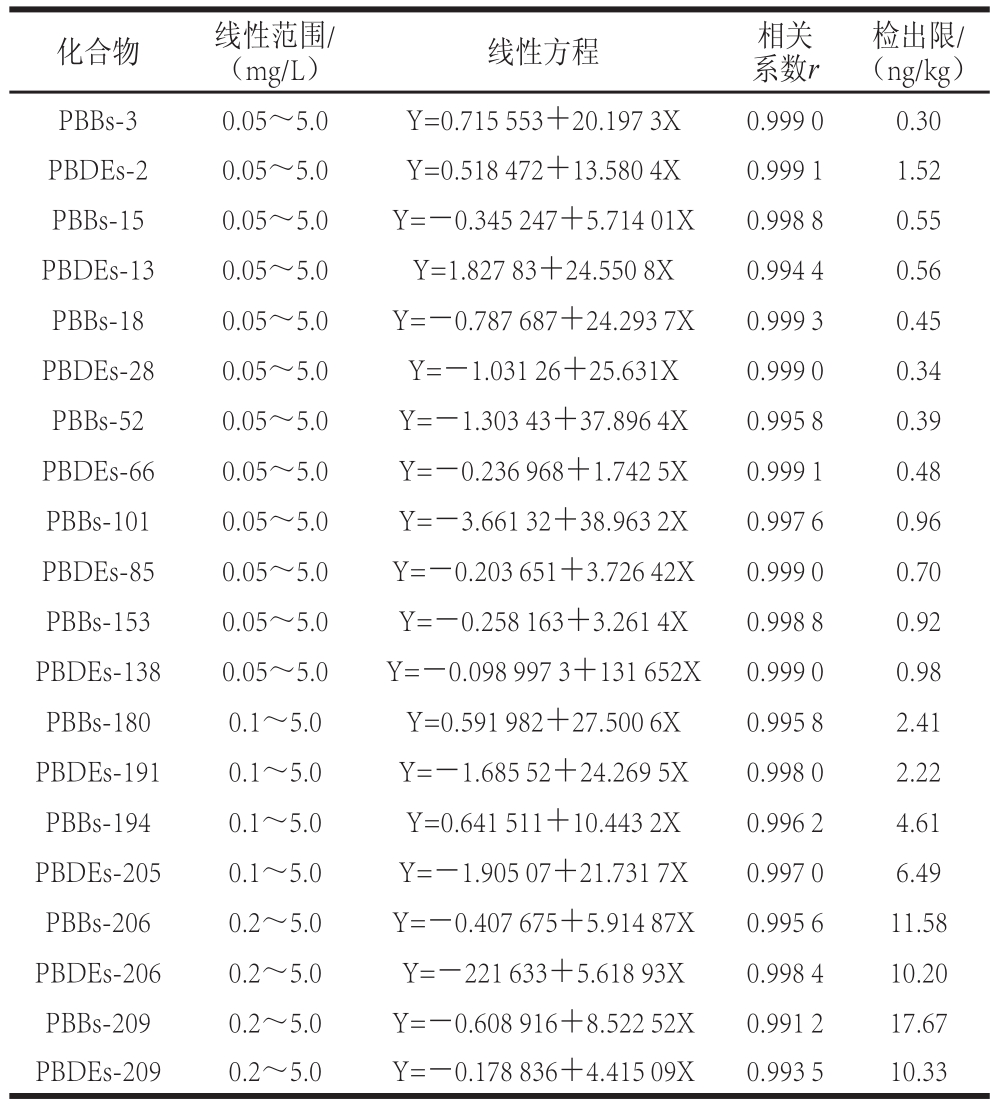
在优化实验条件下,按照1.3.1节配制一系列质量浓度的混合标准工作溶液,再按1.3.2节和1.3.3节所述的GCMS/MS条件进行检测,以定量离子的峰面积Y对质量浓度X(μg/mL)绘制标准曲线,得到20 种PBBs和PBDEs的线性方程。采用逐级稀释法,以3 倍信噪比作为各化合物的方法检出限。将1~6溴代联苯及其醚的标曲范围设置为0.05~5.0 mg/L,7~8溴代联苯及其醚的标曲范围设置为0.1~5.0 mg/L,9~10溴代联苯及其醚的标曲范围设置为0.2~5.0 mg/L,如表3所示。
表3 20 种PBBs和PBDEs的线性方程、相关系数、线性范围和方法检出限
Table3 Linear equations, correlation coefficients, linear ranges, and LODs of the method for detection of 20 PBBs and PBDEs
2.6 回收率与精密度结果
续表4

表4 菜心、黄瓜、胡萝卜基质3 个添加量的加标回收率和RSD( =6)
Table4 Recoveries and precision (RSDs) at three spiked levels in flowering cabbage, cucumber and carrot ( =6)

选取菜心、黄瓜、胡萝卜3 种具有代表性的蔬菜进行加标回收实验,考察该方法的回收率与精密度。称取空白样品5 g,分别添加0.25、0.5、2.5 mg/kg 3个水平的PBBs及PBDEs的混合标准溶液,按1.3.4节进行前处理后进行GC-MS/MS分析,测定后计算回收率和相对标准偏差(relative standard deviation,RSD)。20 种PBBs及PBDEs的平均回收率为70.5%~118.9%,RSD为1.3%~11.2%,如表4所示。
2.7 样品分析
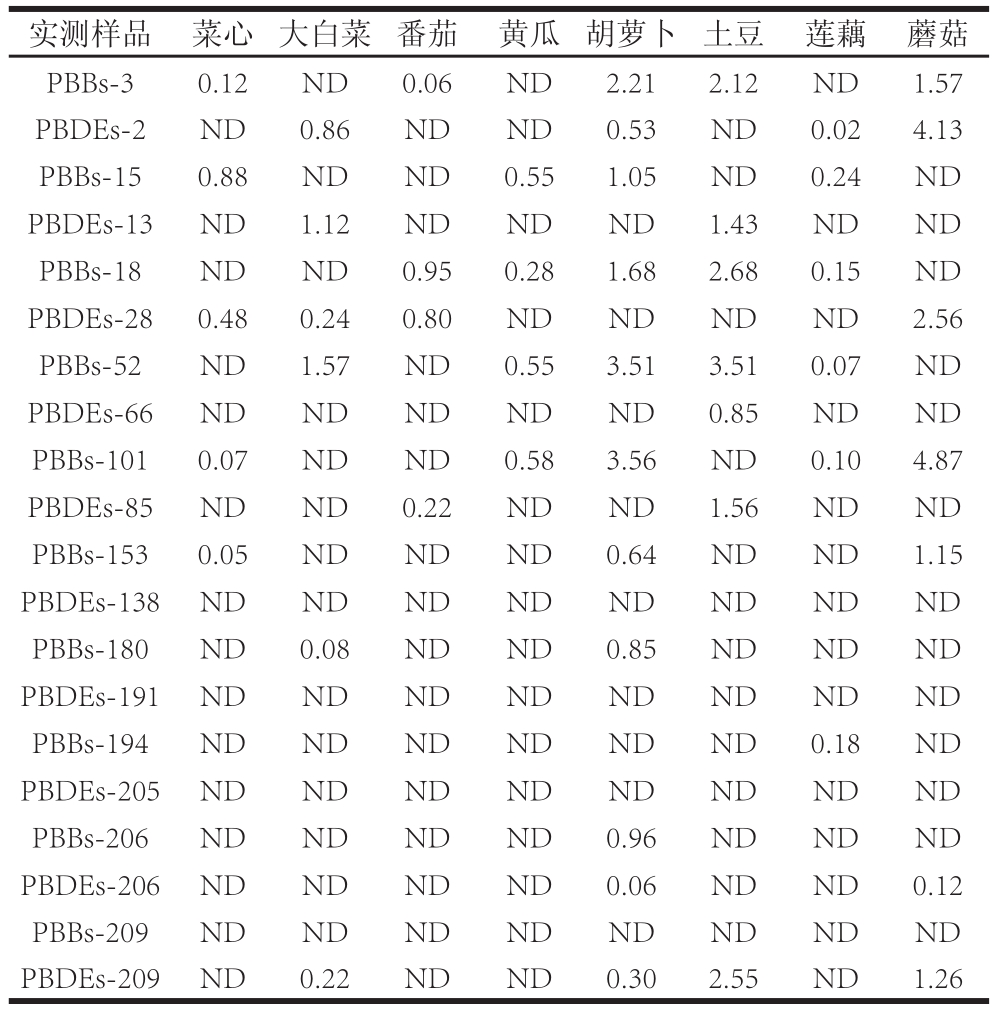
对菜心、大白菜、番茄、黄瓜、胡萝卜、土豆、莲藕和蘑菇8 种代表性蔬菜样品进行定性定量分析。结果表明,各蔬菜样品均检出PBBs和PBDEs,说明各种蔬菜均受到不同程度的PBBs和PBDEs污染,如表5、图3所示。样品中低溴代的PBBs和PBDEs同系物含量相对较大,主要是因为高溴代联苯及联苯醚具有较低的挥发性、水溶性和较强的吸附性,相对较为稳定;而低溴代联苯及联苯醚易于迁移溶解和生物积累。其次,高溴代联苯及联苯醚可能在光降解等作用下脱溴生成低溴代产物。蔬菜是人们日常必不可少的食物,而人体通过食用蔬菜摄入了PBBs和PBDEs,应加以重视。
表5 实际样品中PBBs和PBDEs的残留检测结果
Table5 Residues of PBBs and PBDEs in real samples μg/kg
注:ND.未检出。

图3 阳性土豆的总离子流图
Fig.3 TIC chromatogram of positive potato
本研究建立了QuEChERS-GC-MS/MS法快速测定蔬菜中20 种PBBs和PBDEs残留量的分析方法。该法具有简便、快速、选择性好、灵敏度高、抗杂质干扰能力强的特点,适用于不同种蔬菜中多种PBBs和PBDEs的筛查和确证。
参考文献:
[1] 方旭辉, 马长文, 陈卫东, 等. 色谱法分析多溴联苯醚研究进展[J]. 上海第二工业大学学报, 2013, 30(4): 275-284. DOI:10.3969/ j.issn.1001-4543.2013.04.006.
[2] 唐庆峰, 马黎春, 杨明, 等. 溴元素分析的研究进展[J]. 盐业与化工, 2015, 44(7): 10-18. DOI:10.16570/j.cnki.issn1673-6850.2015.07.004.
[3] 黄铸颖, 李海燕, 吴启航, 等. 溴代阻燃剂环境污染及毒性研究进展[J]. 环境与健康杂志, 2014, 31(11): 1026-1031. DOI:10.16241/ j.cnki.1001-5914.2014.11.013.
[4] 校瑞, 徐林芳, 张晓娜, 等. 环境样品中多溴联苯醚分析方法的研究进展[J]. 化学研究, 2015, 26(4): 343-350. DOI:10.14002/jh.xya2.0150.40.02.
[5] 宋倩. 环境中新型污染物多溴联苯醚的预处理技术及分析方法研究进展[J]. 四川化工, 2015, 18(5): 17-20. DOI:10.3969/ j.issn.1672-4887.2015.05.006.
[6] 邹梦遥, 龚剑, 冉勇, 等. 珠江三角洲流域土壤多溴联苯醚(PBDEs)的分布及环境行为[J]. 生态环境学报, 2009, 18(1): 122-127. DOI:10.3969/j.issn.1674-5906.2009.01.024.
[7] 董黎静, 戴玄吏, 滕加泉, 等. SBSE-TDU-GC/MS法同步测定饮用水源水中16 种多溴联苯化合物[J]. 环境监控与预警, 2015, 7(5): 37-41. DOI:10.3969/j.issn.1674-6732.2015.05.011.
[8] 李凤华, 陈金东. 珠江河口水生生物中多溴联苯醚的分布[J]. 环境科学, 2006, 27(9): 1732-1737. DOI:10.13227/j.hjkx.2006.09.007.
[9] 王若希, 刘晓辉, 邵静, 等. 多溴联苯醚致癌效应研究进展[J].中国预防医学杂志, 2012, 13(12): 947-950. DOI:10.16506/j.1009-6639.2012.12.006.
[10] 陆敏, 韩姝媛, 余应新, 等. 蔬菜中多溴联苯醚的定量测定及其对人体的生物有效性[J]. 分析测试学报, 2009, 28(1): 1-6. DOI:10.3969/ j.issn.1004-4957.2009.01.001.
[11] 李科, 王浚卿, 蒙丽娜, 等. 北京地区市售蔬菜中多溴联苯醚的污染状况[J]. 环境与健康杂志, 2015, 32(6): 528-531. DOI:10.16241/ j.cnki.1001-5914.2015.06.016.
[12] MEDINA C M, PITARCH E, PORTOL S T, et al. GC-MS/MS multiresidue method for the determination of organochlorine pesticides, polybrominated diphenyl ethers in human breast tissues[J]. Journal of Separation Science, 2009, 32(12): 2090-2102. DOI:10.1002/ jssc.200800737.
[13] LIU X J, ZHAO A J, ZHANG A N, et al. Dispersive liquid-liquid microextraction and gas chromatography-mass spectrometry determination of polychlorinated biphenyls and polybrominated diphenyl ethers in milk[J]. Journal of Separation Science, 2011, 34(9):1084-1090. DOI:10.1002/jssc.201000767.
[14] LACORTEA S, IKONOMOUB M G, FISCHER M. A comprehensive gas chromatography coupled to high resolution mass spectrometry based method for the determination of polybrominated diphenyl ethers and their hadroxylated and methoxylated metabolites in environmental samples[J]. Journal of Chromatography A, 2010, 1217(3): 337-347. DOI:10.1016/j.chroma.2009.11.024.
[15] ZHANG H, LEE H K. Plunger-in-needle solid-phase microextraction with graphene-based sol-gel coating as sorbent for determination of polybrominated diphenyl ethers[J]. Journal of Chromatography A, 2011, 1218(28): 4509-4516. DOI:10.1016/j.chroma.2011.05.016.
[16] 李敏洁, 金芬, 杨莉莉, 等. 凝胶渗透色谱-分散固相萃取法同时测定鸡蛋中多溴联苯醚及其衍生物、四溴双酚A和六溴环十二烷[J]. 分析化学, 2014, 42(9): 1288-1294. DOI:10.11895/ j.issn.0253-3820.140233.
[17] 刘亚伟, 董一威, 孙宝利, 等. QuEChERS在食品中农药多残留检测的应用研究进展[J]. 食品科学, 2009, 30(9): 285-289. DOI:10.3321/ j.issn:1002-6630.2009.09.067.
[18] 缪文彬, 李皖豫, 蒋伟, 等. 食品中多溴联苯醚检测技术研究进展[J].食品安全质量检测学报, 2015, 6(12): 4878-4880.
[19] 何迎春, 王正虹, 李林, 等. 固相萃取/固相微萃取-气相色谱法测定饮用水中多溴联苯醚[J]. 食品科学, 2012, 33(8): 236-240.
[20] 由宗政, 孔德洋, 徐静, 等. 固相萃取-气相色谱法测定水中13 种多溴联苯醚[J]. 环境科学与技术, 2014(S1): 230-233. DOI:10.3969/ j.issn.1003-6504.2014.6N.051.
[21] 张瑞, 张志辉, 刘卓钦, 等. 高效液相色谱法测定皮革中20 种溴代阻燃剂[J]. 分析实验室, 2014, 33(1): 73-77. DOI:10.13595/j.cnki.issn1000-0720.2014.0016.
[22] 王俊平, 江小梅, 黄硕, 等. 气相色谱-电子轰击源质谱测定海产品中多溴联苯(醚)[J]. 食品工业科技, 2011, 32(3): 390-393. DOI:10.13386/j.issn1002-0306.2011.03.099.
[23] 付英明, 王乃丽, 王金梅, 等. 快速溶剂萃取-气相色谱质谱法测定土壤样品中的多溴联苯醚[J]. 城市环境与城市生态, 2015, 28(4): 39-42.
[24] 李玮, 卢春山, 李康, 等. 气相色谱-质谱联用检测塑料产品中溴化阻燃剂[J]. 分析化学, 2009, 37(9): 1319-1323. DOI:10.3321/ j.issn:0253-3820.2009.09.013.
[25] 林竹光, 涂逢樟, 马玉, 等. 气相色谱-负离子化学电离质谱法分析深海鱼油食品中的五种多溴联苯醚残留[J]. 色谱, 2007, 35(2): 262-266. DOI:10.3321/j.issn:1000-8713.2007.02.030.
[26] 王麟, 李卫东, 诸佩菊, 等. 气质联用法测定纺织品中多溴联苯及多溴联苯醚[J]. 上海纺织科技, 2014, 42(5): 50-53. DOI:10.16549/j.cnki. issn.1001-2044.2014.05.005.
[27] 张莉莉, 彭淑女, 赵汝松, 等. 食品中多溴联苯醚残留的气相色谱-串联质谱分析方法研究[J]. 分析测试学报, 2010, 29(6): 603-607. DOI:10.3724/jissn.1004-4957.2010.06.015.
[28] 符惠, 李秀琴, 韦超, 等. 高效液相色谱-串联电感耦合等离子体质谱法测定塑料中3 种溴化阻燃剂[J]. 分析化学, 2013, 41(12):1881-1886. DOI:10.3724/SP.J.1096.2013.30691.
[29] 卢大胜, 林元杰, 冯超, 等. GC-MS/MS同时测定鱼样中39 种多溴联苯醚[J]. 食品安全质量检测学报, 2013, 4(4): 1124-1131.
[30] BARON E, ELJARRAT E, BARCELO D. Gas chromatography/tandem masss pectrometry method for the simultaneous analysis of 19 brominated compounds in environmental and biological samples[J]. Analytical and Bioanalytical Chemistry, 2014, 406(29): 7667-7676. DOI:10.1007/s00216-014-8196-7.
Rapid Quantification of 20 Polybrominated Biphenyls (PBBs) and Polybrominated Diphenyl Ethers (PBDEs) in Vegetables Using QuEChERS Coupled with Gas Chromatography-Tandem Mass Spectrometry
LU Junwen, ZHANG Xianchen*, YANG Fang, LI Rong*, ZHANG Pengjie, HUANG Siyun, LIN Shumian
(Zhongshan Entry-Exit Inspection and Quarantine Bureau, Zhongshan 528400, China)
Abstract:A quick, easy, cheap, effective, rugged, and safe (QuEChERS) sample pretreatment coupled with gas chromatographytandem mass spectrometry (GC-MS/MS) method was proposed to determine 20 polybrominated biphenyls (PBBs) and polybrominated diphenyl ethers (PBDEs) in vegetables. Samples were extracted with acidified acetonitrile, salted out with anhydrous magnesium sulfate and sodium chloride and cleaned with C18modified silica gel and primary secondary amine (PSA), and the analytes were detected by GC-MS/MS under the selective reaction monitoring (SRM) mode and quantified by an external standard method. The calibration curves of monobromobiphenyl, dibromobiphenyl, tribromobiphenyl, terabromobiphenyl, pentabromobiphenyl and exabromobiphenyl as well as the corresponding PBDEs showed good linearity in the range of 0.05-5.0 mg/L, heptabromobiphenyl and octabromobiphenyl as well as the corresponding PBDEs showed good linearity in the range of 0.1-5.0 mg/L, nonabromobiphenyl and decabromobiphenyl as well as and the corresponding PBDEs showed good linearity in the range of 0.2-5.0 mg/L, with correlation coefficients of greater than 0.99. The limits of detection (LODs) were 0.30-17.67 ng/ kg. With the proposed method, the recoveries in3 different vegetables at spiked levels of 0.25, 0.5 and 2.5 mg/kg were 70.5%-118.9% with relative standard deviations (RSDs) of 1.3%-11.2%. The proposed method is simple and sensitive with good reproducibility and recovery, and thus can be suitable for the determination of PBBs and PBDEs in vegetables.
Key words:PBBs and PBDEs; QuEChERS; gas chromatography-tandem mass spectrometry; vegetables
DOI:10.7506/spkx1002-6630-201712039
中图分类号:TS207;TS210
文献标志码:A
文章编号:1002-6630(2017)12-0253-07
引文格式:卢俊文, 张宪臣, 杨芳, 等. QuEChERS-气相色谱-串联质谱法测定蔬菜中多溴联苯和多溴联苯醚[J]. 食品科学, 2017,38(12): 253-259.
DOI:10.7506/spkx1002-6630-201712039. http://www.spkx.net.cn
LU Junwen, ZHANG Xianchen, YANG Fang, et al. Rapid quantification of 20 polybrominated biphenyls (PBBs) and polybrominated diphenyl ethers (PBDEs) in vgetables using QuEChERS coupled with gas chromatography-tandem mass spectrometry[J]. Food Science, 2017, 38(12): 253-259. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712039. http://www.spkx.net.cn
收稿日期:2016-09-05
基金项目:国家质检总局科技计划项目(2015IK052;2015IK260);广东省省级科技计划项目(2014A040401011;2015A050502010);广东检验检疫局科技计划项目(2015GDK32;2017GDK24);中山市科技计划项目(2016B2168)
作者简介:卢俊文(1981—),男,主管药师,学士,研究方向为食品分析与天然植物提取。E-mail:dutylu@163.com
*通信作者:张宪臣(1976—),男,高级工程师,硕士,研究方向为食品检测质量与安全。E-mail:zhangxc@zs.gdciq.gov.cn李蓉(1969—),女,高级工程师,学士,研究方向为食品安全监测技术。E-mail:lirong828@126.com