刘 曼,施 敏,曹学丽*
(北京工商大学食品学院,北京食品营养与人类健康高精尖创新中心,北京 100048)
摘 要:建立亲水性离子液体[C4MIM]BF4与无机盐(NH4)2SO4形成的离子液体双水相萃取富集红酒样品中6 种痕量氯酚类物质的方法。通过考察离子液体和盐的种类、pH值、离子液体和盐质量分数对氯酚萃取率和富集倍数的影响,确定萃取氯酚的最优条件。在最佳萃取条件下,6 种氯酚的线性范围为20~200 μg/L,相关系数(R2)达到0.999,6 种氯酚的检出限在3.68~12.16 μg/L之间。对实际红酒样品进行测定,加标回收率为87.73%~103.44%,相对标准偏差在0.33%~6.35%之间。该法操作简单、迅速、绿色且具有较高的萃取效率。
关键词:离子液体;双水相;氯酚;红酒;高效液相色谱
氯酚类化合物是指在苯酚的苯环上连有不同数目氯原子的一类具有毒性、难降解的环境激素。由于其抑菌特性而作为木材防腐剂、杀菌剂、除草剂和防锈剂等在化工和农业生产中得到了广泛应用[1]。但氯酚是高毒性化合物,具有雌激素、致突变以及致癌的作用,可经眼睛和皮肤接触、膳食摄入等进入人体,对人类健康和环境造成了严重威胁,已被美国国家环境保护局列为优先控制污染物[2]。有文献报道,在环境水样[3]甚至一些食品如红酒[4]、蜂蜜[2]中检测到了痕量氯酚。目前,氯酚类物质的检测方法主要有高效液相色谱法、紫外分光光度法、液相色谱-质谱联用、气相色谱、气相色谱-质谱联用等。而由于样品基质复杂,在测定氯酚类物质含量之前需进行样品前处理,前处理的方法主要有溶剂萃取、固相萃取、固相微萃取、液相微萃取、液液微萃取[2]等,但这些方法大多会使用到有机溶剂,存在污染。因此,寻求一种绿色且简单、迅速的检测方法成为亟待解决的问题。
离子液体是指在室温或接近室温条件下呈液态,由有机阳离子和有机或无机阴离子组成的盐,又称室温离子液体、低温熔融盐或室温熔融盐[5-6]。由于其具有不挥发、不易燃、毒性小、良好的热稳定性和化学稳定性,对许多无机物和有机物有独特的溶解性, 且阴阳离子种类多使其具有广泛的可调性[7-10]等独特的优点,在有机合成、电化学、化学分离等方面引起了人们广泛的兴趣。尤其是近年来与普通双水相体系结合形成离子液体双水相体系后,既利用了离子液体和双水相体系较之于两相有机溶剂体系毒性小等的优点,又克服了离子液体黏度大、普通双水相体系成相慢和易乳化的缺点,使得离子液体双水相体系成为研究的热点。
离 子液体双水相是继普通双水相体系后,于2002年由Dupont等[3]发现,Gutowski等[12]提出的可用于萃取分离、分析前处理的体系,通常是由离子液体、盐和水组成的两相系统。离子液体双水相萃取与传统的两相溶剂系统和双水相系统萃取类似,是根据物质在离子液体相和无机盐相中分配系数的差异从而达到与其他物质分离的效果。此体系除具有传统双水相具有的优点外,能够更好地控制乳化现象,且离子液体可以回收。目前,离子液体双水相体系在食品和环境中痕量有害物质的富集和分析前处理方面得到广泛应用。如通过离子液体双水相萃取富集蜂蜜、牛奶等食品和环境水样中的抗生素[13-16]、饮料和糖果等中的染料和色素[17-19]、牛奶和茶饮料等中的农兽药残留[20-21]、香精香料中的抗氧化剂[22]、人体体液中的有毒有害物质[23]等,这些研究都表明,离子液体双水相萃取较传统的利用液液萃取、液液微萃取、固相萃取、固相微萃取等分析前处理方法操作简单、高效,且可避免有机溶剂等的使用,萃取后可直接取样检测,因此在对食品样品和环境等的分析前处理方面有广泛的应用前景。
本实验主要研究离子液体[C4MIM]Cl、[C4MIM]BF4与不同种类的无机盐形成的离子液体双水相体系对红酒中的氯酚类物质富集的效果,通过研究离子液体和盐的种类、pH值、离子液体和盐质量分数对氯酚萃取率和富集倍数的影响,最终确定最优的离子液体双水相体系,并对实际的红酒样品进行分析检测。
1.1 材料与试剂
红酒 市购;6 种氯酚标准品:2-氯酚(2-chlorophenol,2-CP)、4-氯酚(4-chlorophenol,4-CP)、2,4-二氯酚(2,4-dichlorophenol,2,4-DCP)、2,6-二氯酚(2,6-dichlorophenol,2,6-DCP)、2,4,5-三氯酚(2,4,5-trichlorophenol,2,4,5-TCP)、2,4,6-三氯酚(2,4,6-trichlorophenol,2,4,6-TCP) 美国Sigma公司;氯化-1-丁基-3-甲基咪唑([C4MIM]Cl)、1-丁基-3-甲基咪唑四氟硼酸盐([C4MIM]BF4) 上海成捷化学有限公司;乙腈、磷酸(均为色谱纯) 美国Fisher公司;无水乙醇(分析纯) 北京化工厂;所有用盐均为国产分析纯。
1.2 仪器与设备
1100高效液相色谱仪(配有四元梯度泵、自动进样器、二极管阵列检测器、Chem Station色谱工作站)美国安捷伦科技有限公司;TP-214电子分析天平 美国Denver公司;QL-901涡旋振荡器 江苏海门其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 色谱条件
色谱柱:Agilent ZORBAX Eclipse XDB-C8柱(150 mm×4.6 mm,5 μm);流动相:A为0.5%磷酸溶液,B为乙腈;梯度洗脱:0~4 min,25% A;4~6 min,25%~30% A;6~20 min,30% A,回至初始25% A平衡8 min;流速1 mL/min;进样量10 μL;柱温40 ℃;检测波长215 nm。
1.3.2 样品溶液的配制
准确称量2-CP、4-CP、2,4-DCP、2,6-DCP、2,4,5-TCP、2,4,6-TCP,用乙醇溶解并用容量瓶定容至10 mL,配制成0.25 mg/mL的标准溶液,存放于4 ℃冰箱。实验时用体积分数12.5%乙醇溶液稀释至0.5 mg/L作为氯酚标准工作液。
红酒样品的配制:红酒经0.22 μm微孔滤膜过滤,于4 ℃冰箱存放。
1.3.3 离子液体双水 相萃取
在10 mL的离心管中放入一定量的盐、离子液体和氯酚标准工作液或红酒样品,涡旋振荡使其充分溶解,放入高速离心机中使其快速分相,取出含氯酚的少量离子液体相进行高效液相色谱分析检测。
1.3.4 定量分析
氯酚在双水相中的萃取效果通过萃取率(E)和富集倍数(F)描述[24]。按公式(1)、(2)计算:
式中:Vt、Ct为萃取后上相体积/mL和氯酚质量浓度/(mg/mL);V、C分别为加入的标准工作液体积/mL和氯酚质量浓度/(mg/mL)。
2.1 离子液体的选择
考察了[C4MIM]Cl、[C4MIM]BF4两种离子液体与K2HPO4、KH2PO4、Na2HPO4、NaH2PO4、(NH4)2SO4、Na2SO4、Na2CO37 种无机盐的成相能力。其中,[C4MIM]Cl可以与K2HPO4形成双水相,[C4MIM]BF4可以与Na2HPO4、NaH2PO4、(NH4)2SO4、Na2SO4、Na2CO3形成双水相。
[C4MIM]Cl可以与K2HPO4形成双水相,但由于红酒样品呈酸性,[C4MIM]Cl与K2HPO4形成的双水相体系由于盐的存在呈碱性,会与红酒样品发生颜色反应。并且研究[C4MIM]BF4与盐形成的双水相对氯酚的萃取效果得出,[C4MIM]BF4与一些盐形成的双水相与红酒样品不会发生颜色反应,并能够有效地对氯酚进行富集,因此,选择[C4MIM]BF4作为萃取氯酚的离子液体。
2.2 无机盐的选择
Na2HPO4、Na2CO3溶液呈碱性,与[C4MIM]BF4形成的双水相体系仍会与红酒样品发生颜色反应。因此,选用[C4MIM]BF4与NaH2PO4、(NH4)2SO4、Na2SO43种无机盐形成的双水相体系,比较其对氯酚的萃取性能。结果表明,在[C4MIM]BF4量少的情况下,即使NaH2PO4和Na2SO4达到溶解度,也不能形成双水相,提高[C4MIM]BF4的量,虽然能够形成双水相,但是氯酚在[C4MIM]BF4与NaH2PO4形成的双水相体系中富集倍数低,在[C4MIM]BF4与Na2SO4形成的双水相体系中氯酚分配在两相,达不到富集痕量氯酚的效果。[C4MIM]BF4与(NH4)2SO4形成的双水相体系通过调节[C4MIM]BF4和(NH4)2SO4的量能够使氯酚完全富集在一相,且能够达到较高的富集倍数。因此,选用(NH4)2SO4作为与[C4MIM]BF4形成离子液体双水相富集氯酚的无机盐。
2.3 双水相相图的绘制
通过浊点滴定法[11]测定[C4MIM]BF4-(NH4)2SO4体系的双水相相图。由于大多的红酒样品中有12.5%乙醇,乙醇对双水相的成相有影响,因此,双水相相图的测定选用体积分数12.5%乙醇溶液。将一定量的[C4MIM]BF4-乙醇溶液加入试管中,逐步滴加已知质量分数的(NH4)2SO4-乙醇溶液,直至溶液恰好变浑浊;再逐步滴加12.5%乙醇溶液至恰好变澄清。再滴加(NH4)2SO4溶液使其刚好变浑浊,如此反复操作。通过称重法测量滴加的(NH4)2SO4溶液和乙醇溶液的质量,计算在浊点时的[C4MIM]BF4质量分数和(NH4)2SO4质量分数,如图1所示。通过所绘制的双水相相图,在优化条件下,可以直接以相图为参考,选取能够形成双水相的合适体系,考察其对氯酚的萃取效率和富集倍数。

图1 [C1 [C4MIM]BFIM]BF4-(NH-(NH4)2SOSO4体系的双结线
Fig.1 Bimodal curves for [C4MIM]BF4-(NH4)2SO4ILATPS system
2.4 pH值的选择
溶液的pH值是影响萃取效率的一个重要因素,特别是当所萃取的物质为弱酸或弱碱性的物质时,溶液的酸碱性会影响萃取物在溶液中的存在形式,因此,调节溶液的pH值可以使萃取物呈现不同的状态从而改变萃取物在溶液中的溶解度,使萃取物更易在萃取溶剂中存在,以达到萃取的目的。氯酚是一种弱酸,在溶液呈碱性条件下,羟基上氧的电子云向苯环移动,容易电离出H+而呈现酸性,改变了氯酚的状态,但在溶液呈酸性时,可抑制氯酚的电离,使氯酚仍旧以中性分子的形式存在[1],不改变其性质和状态,利于氯酚的萃取。通过测定从市场上购买的3 种红酒样品的pH值,范围 在2.89~3.54之间,呈酸性,且文献[7,26]报道的对氯酚类物质富集的最优pH值大都在3.0~4.5之间。因此,在优化离子液体双水相条件时,为减少对红酒样品的前处理,所选取的氯酚标准工作液的pH值定为3.00。
2.5 双水相体系的优化
2.5.1 (NH4)2SO4质量分数的影响

图2 (NH4)2SSOO4质量分数对萃取率的影响
Fig.2 Effects of (NH4)2SO4concentration on extraction efficiency
为考察(NH4)2SO4质量分数对氯酚萃取效果的影响,根据所绘制的双水相相图,选择[C4MIM]BF4质量分数为10%、能够形成双水相的不同(NH4)2SO4质量分数体系对氯酚标准工作液中的氯酚进行富集、高效液相色谱检测,如图2所示。在[C4MIM]BF4一定的情况下,随着(NH4)2SO4质量分数的增加,氯酚会逐渐富集到[C4MIM] BF4相,达到一定质量分数的(NH4)2SO4时,氯酚完全富集到一相,因此可得出,较高质量分数的(NH4)2SO4利于氯酚的富集。
2.5.2 离子液体用量的影响
表1 离子液体用量对萃取率和富集倍数的影响
Table1 Effects of ionic liquid concentration on extraction efficiency and enrichment factor
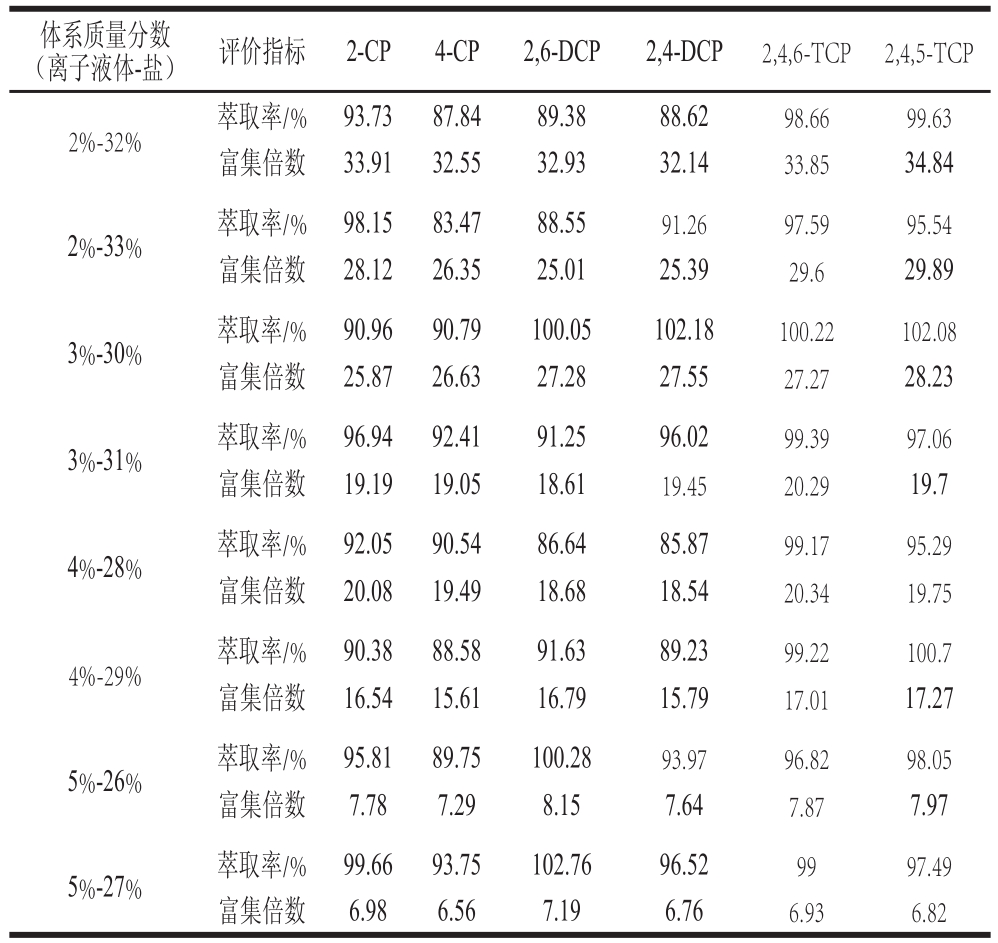
为能对红酒样品中痕量氯酚进行分析检测,需要选择能够将氯酚完全富集到小体积上相的体系,即萃取率高、且上下相体积比(Vt/Vb)小的体系。2.5.1节结果表明,较高的(NH4)2SO4质量分数利于氯酚的萃取,且根据双水相体系的性质,上相富含离子液体,下相富含盐,离子液体量减少、盐量增多会使双水相体系的上下相体积比减少。因此根据绘制的[C4MIM]BF4与(NH4)2SO4双水相体系的相图,选择[C4MIM]BF4少且(NH4)2SO4多的体系,比较其对氯酚的萃取性能,如表1所示。8 个体系对氯酚的萃取率都能达到较高、即能够将氯酚富集到一相,但从富集倍数来看,质量分数2% [C4MIM]BF4、32% (NH4)2SO4、66%氯酚标准工作液的体系对6 种氯酚富集倍数达到32.14~34.84,是所选取体系中富集倍数最高的。因此,选取该体系作为最优体系,研究其对实际红酒样品中氯酚的检测。
2.6 方法学验证结果
将0.5 mg/L氯酚标准工作液作为母液,用12.5%乙醇溶液配制一系列不同质量浓度的氯酚工作液,在所优化的实验条件下富集、高效液相色谱检测,以所测得峰面积为纵坐标、各组分的质量浓度为横坐标作标准曲线,如表2所示,2-CP、4-CP、2,4-DCP、2,6-DCP、2,4,5-TCP、2,4,6-TCP的线性范围为20~200 μg/L,相关系数(R2)为0.999;以3 倍信噪比计算出6 种氯酚的方法检出限(limit of detection,LOD)为3.68~12.16 μg/L,以10 倍信噪比计算出6 种氯酚的定量限(limit of quantity,LOQ)为12.27~40.53 μg/L。
表2 6 种氯酚的标准曲线、LOD、LOQ和富集倍数
Table2 Regression equations, LODs, LOQs and enrichment factors for six chlorophenols
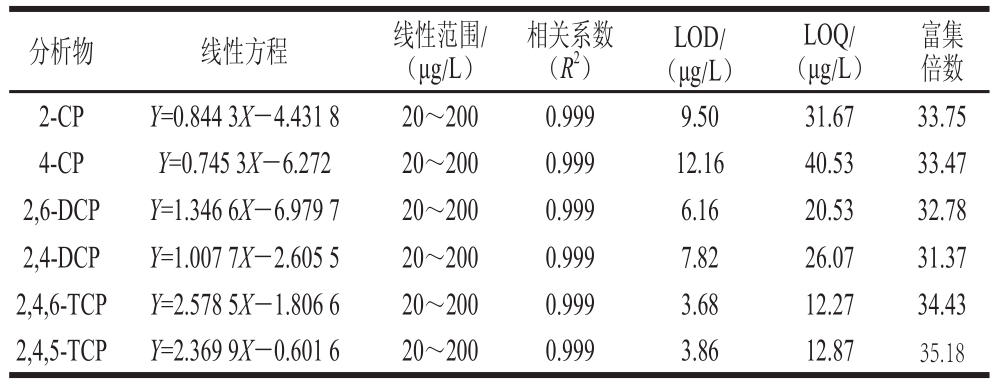
表3 加标回收率、精密度和实际样品分析
Table3 Recovery and precision of six chlorophenols in spiked samples and analytical results for chlorophenol contents of real samples
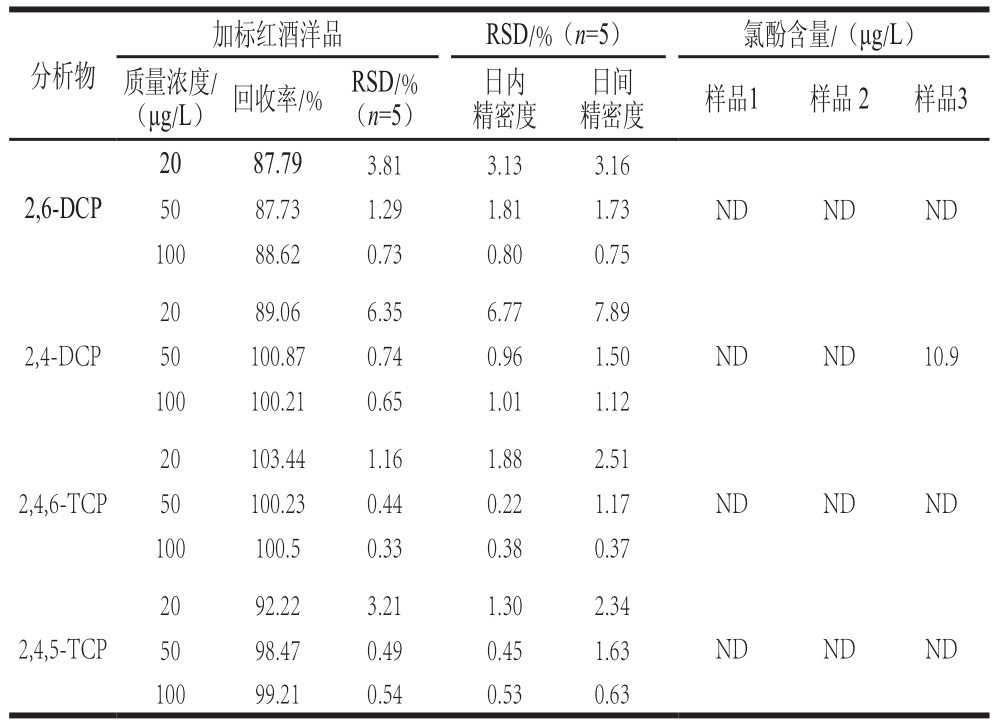
注:ND.未检出。
取红酒样品,按照优化的实验方法测定6 种氯酚含量。根据所测定的值,在红酒样品中加入不同质量浓度的6 种氯酚混合标准溶液,在优化实验条件下,测定其加标后的质量浓度,计算加标回收率和相对标准偏差(relative standard deviation,RSD)(n=5),如表3所示。精密度通过日内精密度和日间精密度评价[14]。日内精密度是指相同的实验条件下一天内连续5 次分析加标样品,计算RSD;日间精密度是连续5 d分析加标样品,计算RSD,测得4 种氯酚的日内精密度和日间精密度分别在0.22%~6.77%、0.37~7.89%之间,结果证明该方法的灵敏度较高、精密度较好,可满足分析的要求。
如图3所示,从空白红酒经富集后的色谱图B和6 种氯酚混合标准品的色谱图D比较来看,空白红酒经过富集后,在2-CP、4-CP出峰时间有物质被检出,通过对这2 个峰进行全波长扫描,发现这2 种物质为红酒本身的基质,但由于其与2-CP、4-CP出峰时间吻合,对2-CP、4-CP的定量有干扰,因此计算加标回收率、精密度和对实际样品定量时,只考虑其他4 种氯酚。经过计算,得到4 种氯酚的回收率为87.73%~103.44%,RSD为0.33%~6.35%。
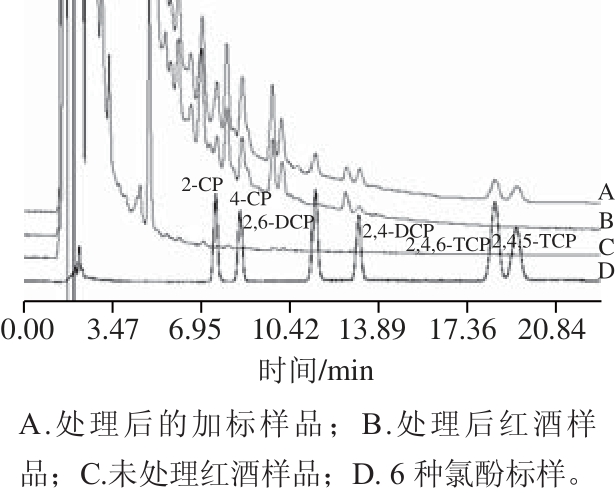
图3 红酒样品中氯酚的高效液相色谱图
Fig.3 HPLC chromatograms of chlorophenols in red wine
2.7 实际样品的分析
将购买的3 种红酒经0.22 μm的微孔滤膜过滤后,按照所优化的实验条件对红酒样品进行氯酚富集,测定结果见表3,色谱图见图3。由于红酒样品中的氯酚为痕量物质,因此无法通过直接检测被检出。经过离子液体双水相富集后,有一种红酒样品中检测出含有10.9 μg/L的2,4-DCP。红酒中氯酚主要来源与软木塞的杀菌处理以及木桶的漂白和杀菌处理[26]。
建立了[C4MIM]BF4-(NH4)2SO4离子液体双水相体系快速萃取红酒中氯酚类物质的方法,该法对氯酚的富集倍数高、重复性好、样品用量低,且在红酒不经过其他任何前处理的情况下,能够直接用优化的双水相体系萃取富集红酒中的氯酚类物质、高效液相色谱分析检测,与其他大多采用固相萃取[27]、固相微萃取[28-29]、液液微萃取[26]等检测红酒中氯酚类物质的方法相比,该法前处理步骤少、操作简单易行、且避免了有机溶剂等物质的使用。该法也可广泛用于其他食品样品中痕量有毒有害物质的检测。
参考文献:
[1] CAMPILLO N, PENALVER R, HERNANDEZ-CORDOBA M. Evaluation of solid-phase microextraction conditions for the determination of chlorophenols in honey samples using gas chromatography[J]. Journal of Chromatography A, 2006, 1125: 31-37. DOI:10.1016/j.chroma.2006.05.051.
[2] 王良, 朱红, 马春宏, 等. 氯酚类毒物的分离分析研究进展[J]. 化学世界, 2011, 52(6): 373-375. DOI:10.3969/j.issn.0367-6358.2011.06.016.
[3] WANG L, ZHU H, CHUNHONG M A, et al. HPLC determinat ion of chlorophenols in water with separation by ionic liquids [Bmim]BF4aqueous two-phase solvent sublation[J]. Asian Journal of Chemistry, 2013, 25(4): 2129-2134. DOI:10.14233/ajchem.2013.13358.
[4] MARTINEZ-URUNUELA A, RODRIGUEZ I, CELA R, et al. Development of a solid-phase extraction method for the simultaneous determination of chloroanisoles and chlorophenols in red wine using gas chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2005, 549(1): 117-123. DOI:10.1016/j.aca.2005.06.016.
[5] 林潇. 离子液体双水相萃取分离生物活性物质及其机理的研究[D].长沙: 湖南大学, 2013.
[6] 刘晓洁. 咪唑类离子液体用于中草药及蛋白质样品的分离分析方法研究与应用[D]. 长沙: 湖南大学, 2013.
[7] 朱红. 离子液体双水相萃取/气浮溶剂浮选分离/富集环境中的氯酚类内分泌干扰物的研究[D]. 四平: 吉林师范大学, 2012.
[8] 王伟涛. 木瓜蛋白酶的双水相萃取研究[D]. 海口: 海南大学, 2014.
[9] 曹婧. 离子液体/盐双水相体系萃取分离葛根素研究[D]. 南昌: 南昌大学, 2010.
[10] 白智文. 离子液体双水相体系的构建及其萃取蛋白质的研究[D].海口: 海南师范大学, 2014.
[11] DUPONT J, CONSORTI C S, SUAREZ P A Z, et al. Preparation of 1-butyl-3-methyl imidazolium-based room temperature ionic liquids[J]. Organic Syntheses, 2002, 79(6): 236-243. DOI:10.1002/0471264180. os079.28.
[12] GUTOWSKI K E, BROKER G A, WILLAUER H D. Controlling the aqueous miscibility of ionic liquids: aqueous biphasic systems of water-miscible ionic liqueds and water-structuring salts for recycle, metathesis, and separations[J]. Journal of the American Chemical Society, 2003, 125(22): 6632-6633. DOI:10.1021/ja0351802.
[13] HAN J, WANG Y, YU C L, et al. Extraction and determination of chloramphenicol in feed water, milk, and honey samples using an ionic liquid/sodium citrate aqueous two-phase system coupled with highperformance liquid chromatography[J]. Analytical and Bioanalytical Chemistry, 2011, 399: 1295-1304. DOI:10.1007/s00216-010-4376-2.
[14] JIANG B, FENG Z B, LIU C H, et al. Partitioning behavior of penicillin G in aqueous two phase system based on ionic liquids[J]. Advanced Materials Research, 2013, 864/867: 324-327. DOI:10.4028/ www.scientif i c.net/AMR.864-867.324.
[15] XIAO Y, ZHANG S, WEI Y, et al. Ionic liquid-anionic surfactant based aqueous two-phase extraction for determination of antibiotics in honey by high-performance liquid chromatography[J]. Talanta, 2014, 124(13): 1-6. DOI:10.1016/j.talanta.2014.02.039.
[16] GAO S, JIN H, YOU J, et al. Ionic liquid-based homogeneous liquid-liquid microextraction for the determination of antibiotics in milk by high-performance liquid chromatography[J]. Journal of Chromatography A, 2011, 1218(41): 7254-7263. DOI:10.1016/ j.chroma.2011.08.063.
[17] WEI Y, LIU Z, QIANG L, et al. Determination of SudanⅠ-Ⅳ in candy using ionic liquid/anionic surfactant aqueous two-phase extraction coupled with high-performance liquid chromatography[J]. Food Chemistry, 2015, 173: 815-820. DOI:10.1016/j.foodchem.2014.10.091. [18] SHA O, ZHU X, FENG Y, et al. Determination of sunset yellow and tartrazine in food samples by combining ionic liquid-based aqueous two-phase system with high performance liquid chromatography[J]. Journal of Analytical Methods in Chemistry, 2014: 1-8. DOI:10.1155/2014/964273.
[19] OU S, ZHU X, FENG Y, et al. Aqueous two-phase based on ionic liquid liquid-liquid microextraction for simultaneous determination of five synthetic food colourants in different food samples by highperformance liquid chromatography[J]. Food Chemistry, 2015, 174:380-386. DOI:10.1016/j.foodchem.2014.11.068.
[20] 邵明媛. 离子液体双水相体系在茶饮料和牛奶中农兽药萃取中的应用[D]. 长春: 吉林大学, 2014.
[21] SHAO M, LI N, SHI J, et al. Ionic liquid-based ultrasound-assisted aqueous two-phase extraction of the pyrethroid insecticides in tea drinks[J]. Analytical Methods, 2013, 5(10): 2529-2535. DOI:10.1039/ c3ay40114f.
[22] 孟冬玲, 刘畅, 李小兰. 离子液体双水相萃取-高效液相色谱法测定香精香料中的抗氧化剂[C]//广西烟草学会2014年学术年会论文集. 2014.
[23] HE C, LI S, LIU H, et al. Extraction of testosterone and epitestosterone in human urine using aqueous two-phase systems of ionic liquid and salt[J]. Journal of Chromatography A, 2005, 1082: 143-149. DOI:10.1016/ j.chroma.2005.05.065.
[24] LI C X, HAN J, WANG Y, et al. Extraction and mechanism investigation of trace roxithromycin in real water samples by use of ionic liquid-salt aqueous two-phase system[J]. Analytica Chimica Acta, 2009, 653(2):178-183. DOI:10.1016/j.aca.2009.09.011.
[25] HAN J, YU C, YUN W, et al. Liquid-liquid equilibria of ionic liquid 1-butyl-3-methylimidazolium tetrafluoroborate and sodium citrate/ tartrate/acetate aqueous two-phase systems at 298.15 K: experiment and correlation[J]. Fluid Phase Equilibria, 2010, 295(1): 98-103. DOI:10.1016/ j.fluid.2010.03.044.
[26] FAN C, LI N, CAO X. Determination of chlorophenols in red wine using ionic liquid countercurrent chromatography as a new pretreatment method followed by high-performance liquid chromatography[J]. Journal of Separation Science, 2015, 38(12): 2109-2116. DOI:10.1002/ jssc.201500172.
[27] CACHO J I, CAMPILLO N,VINAS P, et al. Stir bar sorptive extraction polar coatings for the determination of chlorophenols and chloroanisoles in wines using gas chromatography and mass spectrometry[J]. Talanta, 2014, 118: 30-36. DOI:10.1016/j.talanta.2013.09.047.
[28] INSA S, SALVADO V, ANTICO E. Development of solidphase extraction and solid-phase microextraction methods for the determination of chlorophenols in cork macerate and wine samples[J]. Journal of Chromatography A, 2004, 1047: 15-20. DOI:10.1016/ j.chroma.2004.06.104.
[29] PIZZRRO C, MARTINEZ-URUNUELA A, PEREZ-DELNOTARIO N, et al. Robustness test of a headspace solid-phase microextraction method for the determination of chloroanisoles and chlorophenols related to cork taint in wine using experimental design[J]. Journal of Chromatography A, 2008, 1208: 54-61. DOI:10.1016/ j.chroma.2008.08.110.
[30] CAMPILLO N, VINAS P, CACHO J I, et al. Evaluation of dispersive liquid-liquid microextraction for the simultaneous determination of chlorophenols and haloanisoles in wines and cork stoppers using gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2010, 1217: 7323-7330. DOI:10.1016/j.chroma.2010.09.058.
Determination of Trace Chlorophenols in Red Wine by Ionic Liquid Aqueous Two-Phase Extraction Coupled to HPLC
LIU Man, SHI Min, CAO Xueli*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health, School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China)
Abstract:An extraction method based on an aqueous two-phase system consisting of the hydrophilic ionic liquid [C4MIM] BF4and the inorganic salt (NH4)2SO4for the simultaneous determination of six chlorophenols in red wine by high performance liquid chromatography (HPLC) was established. The extraction efficiency and enrichment factor were found to be influenced by the types and concentrations of salts and ionic liquids, as well as pH value, and these parameters were investigated to determine the optimal conditions for extracting chlorophenols. Under the optimal conditions, the linear ranges of six chlorophenols were 20-200 μg/L with correlation coefficients (R2) of 0.999, and the limits of detection (LODs) were in the range of 3.68-12.16 μg/L. This method was successfully applied to analyze six chlorophenols in real red wine samples with spiked recoveries ranging from 87.73% to 103.44% and relative standard deviation (RSD) ranging from 0.33% to 6.35%. This method is simple, rapid, environmentally friendly and efficient.
Key words:ionic liquid; aqueous two-phase system; chlorophenols; red wine; high performance liquid chromatography (HPLC)
DOI:10.7506/spkx1002-6630-201712040
中图分类号:TS262.6
文献标志码:A
文章编号:1002-6630(2017)12-0260-06
引文格式:刘曼, 施敏, 曹学丽. 离子液体双水相萃取-HPLC分析红酒中的痕量氯酚类物质[J]. 食品科学, 2017, 38(12): 260-265.
DOI:10.7506/spkx1002-6630-201712040. http://www.spkx.net.cn
LIU Man, SHI Min, CAO Xueli. Determination of trace chlorophenols in red wine by ionic liquid aqueous two-phase extraction coupled to HPLC[J]. Food Science, 2017, 38(12): 260-265. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712040. http://www.spkx.net.cn
收稿日期:2016-09-07
基金项目:北京市自然科学基金重点项目(KZ201410011016)
作者简介:刘曼(1992—),女,硕士研究生,研究方向为生物分离工程。E-mail:jmpliu@163.com
*通信作者:曹学丽(1967—),女,教授,博士,研究方向为生物分离与分析。E-mail:caoxl@th.btbu.edu.cn