表1 抗体与微球的优化
Table1 Optimization of antibody and latex beads
管 笛1,2,魏 颖1,2,王 旗1,2,李俊博1,2,武会娟1,2,*
(1.北京市理化分析测试中心,北京 100089;2.北京市基因测序与功能分析工程技术研究中心,北京 100089)
摘 要:目的:建立以彩色乳胶微球为标记物的免疫层析技术检测猪尿液中的盐酸克伦特罗(clenbuterol,CLB)。方法:彩色乳胶微球标记CLB抗体并真空冷冻干燥,盐酸克伦特罗-牛血清白蛋白(CLB-bovine serum albumin,CLB-BSA)人工抗原与羊抗鼠抗体分别喷到硝酸纤维素膜上作检测线和质控线,猪尿液样本与冻干微球混匀后,插入试纸条,通过读条仪进行测定。结果:通过理化参数的优化,吐温-20为最优表面活性剂,选用300 nm乳胶微球,层析时间为9 min。方法的检出限为0.013 ng/mL,回收率范围在97.8%~106.0%之间,相对标准偏差不高于9.6%。结论:本研究成功建立了一种灵敏、准确的检测猪尿液中CLB的彩色乳胶免疫层析方法。
关键词:免疫层析试纸;彩色乳胶;盐酸克伦特罗;猪尿液;定量检测
盐酸克伦特罗(clenbuterol,CLB),瘦肉精的一种,是一种人工合成的β-肾上腺素受体激动剂。在医学和兽医学领域,因其具有加强心脏收缩、骨骼肌血管和支气管平滑肌的扩张的作用,常用于治疗休克和支气管痉挛[1]。当大剂量使用CLB时,又具有能量重分配的作用,可显著提高饲料转化率和瘦肉率[2]。但是,CLB在动物体内具有残留性积累和半衰期长等药理特性,且分布广的特点。人们食用含有CLB残留的肉品后,常常造成心动过速、肌肉震颤、口干、头晕、失眠甚至于瘫痪等中毒症状,对心脏病患者更有生命危险[3-4]。我国农业部发文明确禁止在饲料中添加CLB,并规定在动物性食品中不得检出CLB。
目前CLB的检测方法主要有仪器分析法和免疫学分析法。仪器分析法主要包括气相色谱-串联质谱法[5-7]、高效液相色谱法[8-9]、高效液相色谱-串联质谱法[10-13]、毛细管电泳法[14-15]。以上方法主要用于确证检测,具有检测灵敏度高、特异性强的优点;但是也存在检测步骤复杂,依赖昂贵设备支撑和对人员操作要求高等缺点,不适用于市场现场检测[16]。免疫学分析法包括酶联免疫吸附法[17-21]、化学发光检测法[22-23]和胶体金免疫层析方法[24-26]等。酶联免疫吸附法和化学发光法检测灵敏度高,可用于定量分析,但检测时间相对较长(30 min以上),对操作者素质要求较高,无法实现现场检测[27]。胶体金免疫层析法具有检测速度快(3~10 min)、成本低、操作简单等优点,适用于现场快速筛查;但该法目前多采用裸眼目测方式通过条带显色的有无进行结果判读,只能用于定性分析,存在检测灵敏度不高、人为因素干扰大的缺点[28]。近年来,基于免疫层析读数仪的试纸条定量检测研究越来越多,在CLB检测方面也有较多报道,用于定量检测的标记物主要为胶体金和荧光微球。彩色乳胶微球作为免疫层析技术的标记物,与胶体金相比,成本更低且灵敏度更好。目前,主要应用于疾病诊断领域,在食品安全领域应用相对较少。本研究以彩色乳胶微球作为标记物,建立定量检测猪尿液中CLB的免疫层析技术,以期降低检测成本,获得更高检测灵敏度。
1.1 材料、试剂与仪器
CLB标准品、牛血清白蛋白(bovine serum albumin,BSA)、吐温-20、吐温-80、Triton X-100、2-(N-吗啡啉)乙磺酸(2-(N-morpholino)ethanesulfonic acid monohydrate,MES)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(N-(3-dimethylaminopropyl)-N-ethylcarbodiimide hydrochloride crystalline,EDC)、羊抗鼠抗体 美国Sigma-Aldrich公司;乳胶微球 德国Merck公司;硝酸纤维素(nitrocellulose fi lter membrane,NC)膜 德国赛多利斯公司;N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS) 美国Pierce公司;CLB单克隆抗体、CLB-BSA偶联物 北京百欧美生科技有限公司;Tetronic 1307 上海杰一生物技术有限公司;氯化钾、氯化钠、磷酸氢二钾、磷酸二氢钠国药集团化学试剂有限公司;实验用水均为超纯水。
SCAN-01试纸条读条仪 北京百欧美生科技有限公司;XYZ3060点膜仪 美国BioDot公司;ZQ2000斩切机 上海金标生物科技有限公司;THZ-C恒温摇床太仓市实验设备厂。
1.2 方法
1.2.1 乳胶微球与抗体的偶联
以p H 6.0、0.1 m o l/L的M E S溶液(称取1.066 g MES,0.45 g NaCl溶于50 mL纯水,调pH 6.0)作为活化缓冲溶液,取50 μL乳胶微粒溶液于2 mL离心管中,14 000 r/min离心7 min,弃去液体,加入300 μL活化缓冲溶液,旋涡振荡器上混匀;14 000r/min离心7 min,弃去液体,重复洗涤2 遍后,向乳胶微粒中加入0.96 mg EDC、1.15 mg NHS和300 μL活化缓冲溶液,37 ℃、120 r/min摇床振荡30 min;用活化缓冲溶液洗涤2 遍,除去未反应的活化剂,并更换新的2 mL离心管。加入CLB单克隆抗体至活化缓冲液终体积为400 μL,37 ℃、120 r/min摇床振荡2.5 h。
封闭加入100 μL的BSA溶液(BSA事先溶解在偶联缓冲液中)至BSA终质量浓度为5 mg/mL,对免疫乳胶微粒表面没有偶联抗体的活化基团进行封闭,并且通过BSA的物理吸附,封闭其他空间位点,降低在之后实验中可能发生的非特异性吸附。37 ℃、120 r/min摇床振荡30 min。14 000 r/min离心7 min,弃去液体,用含0.5% BSA的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤两次,加入400 μL 0.5% BSA的PBS,80%功率超声振荡4 min后,4 ℃保存待用。
1.2.2 试纸条喷制与乳胶微球冻干
采用点膜仪将CLB-BSA(抗原质量浓度为1 mg/mL)以及羊抗鼠二抗(质量浓度为2 mg/mL)以1 μL/cm的喷量分别喷涂至NC膜上作为检测线(T线)与质控线(C线),T线与C线的间隔为0.5 cm,37 ℃烘箱干燥过夜。将NC膜、样品垫、吸水垫依次相互交错2 mm粘在含有不干胶的底板上得到试纸板,并用斩切机切割成宽度为4 mm的试纸条,置于含干燥剂的锡箔袋中密封,并于室温条件保存备用。
取上述偶联好抗体的乳胶微球加入到冻干缓冲液中(含1% BSA、1%蔗糖、2%吐温-20、0.1% Proclin 300的PBS,pH 7.0),涡旋混匀后,以100 μL/孔加到微孔条中。将微孔条放入-80 ℃冰箱中预冷2 h后放入真空冷冻干燥机中,真空冻干16 h。冻干后将微孔条扣盖放入含干燥剂的锡箔袋中密封,并于4 ℃冰箱中保存备用。
1.2.3 猪尿液的测定
用移液器吸取100 μL猪尿液加入到含有冻干免疫乳胶微球的微孔中,反复吸打几次直至乳胶微球与猪尿液充分混匀,将试纸条插入微孔中进行层析,9 min后将试纸条放入读条仪中进行测定。
1.2.4 标准曲线建立与数据处理
取CLB标准品溶液进行梯度稀释,分别加入到含有冻干免疫乳胶微球的微孔中,充分混匀后,插条层析,9 min后将试纸条放入仪器中进行测定,获得T线和C线位置的光密度值,每个质量浓度重复测定3 次。以CLB的质量浓度为横坐标,T/(T+C)值为纵坐标,作标准曲线,结果用非线性四参数逻辑斯蒂回归拟合。
1.2.5 猪尿液样品中CLB回收率的测定
以不同质量浓度CLB添加于空白猪尿液样品中,使猪尿液中CLB的质量浓度分别为0.8、0.2 ng/mL和0.08 ng/mL。取上述猪尿液样品加入冻干免疫乳胶微球的微孔中,充分混匀后,插条层析,9 min后将试纸条放入读条仪中进行测定,每个质量浓度试纸条重复测定5 次。1.2.6 与酶联免疫吸附法的比较
利用本研究建立的彩色乳胶免疫层析法与酶联免疫吸附法测定含不同质量浓度的CLB尿样20 份,计算结果,并比较两种方法的相关性。
2.1 表面活性剂的选择
表面活性剂在免疫层析过程中起到不可忽视的重要作用,表面活性剂的物理化学性质对免疫层析试纸条的亲水性、层析速度、灵敏度、均一性和稳定性等都有着重要的影响。本实验选取免疫层析研究中常用的表面活性剂:2%吐温-20、2%吐温-80、2% Triton X-100与20 mg/mL Tetronic 1307进行优化。在免疫乳胶微球层析9 min后,分别测定加入吐温-20、吐温-80、Triton X-100与Tetronic 1307表面活性剂的试纸条的T/(T+C)值。当T/(T+C)值在0.5~1之间时,表明检测线T值大于C值,相对于彩色乳胶免疫层析来说就是检测线的颜色要比质控线的颜色更深。在测定空白样品时要尽量选取T/(T+C)值大的为最优,表明在此条件下,抗体抗原结合更充分。加入2% 吐温-20、2% 吐温-80、2% Triton X-100与20 mg/mL Tetronic 1307表面活性剂的试纸条的T/(T+C)值分别为0.66、0.55、0.63、0.36。由于加入2%吐温-20的试纸条T/(T+C)值最大,因此实验选择2% 吐温-20为最优表面活性剂。
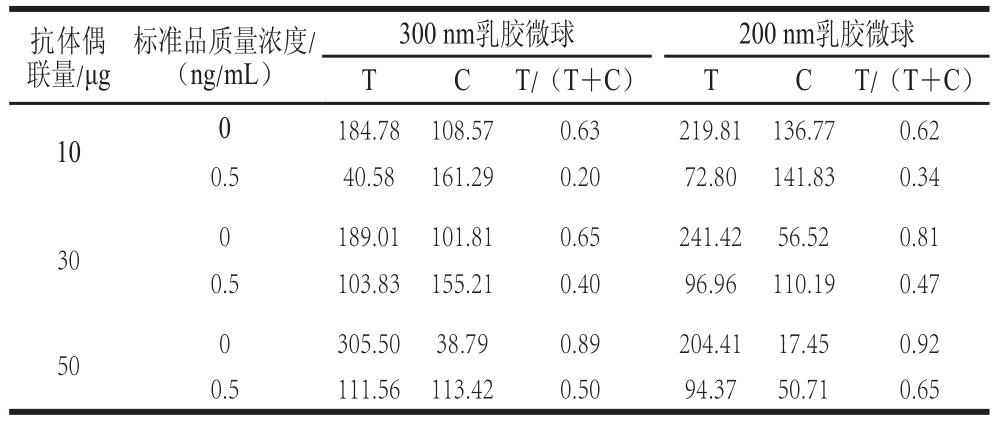
2.2 抗体用量与微球大小优化
本研究选取两种不同粒径的乳胶微球(300 nm和200 nm)各50 μL分别偶联3 种不同质量的CLB抗体(10、30 μg和50 μg)。以上6 种乳胶微球各取0.5 μL加入到微孔中,再补加100 μL冻干缓冲液后进行真空冷冻干燥。干燥完成后,分别测定空白猪尿液(CLB为阴性的猪尿液样品)和CLB质量浓度为0.5 ng/mL的猪尿液,层析9 min后对试纸条进行测定,结果见表1。
表1 抗体与微球的优化
Table1 Optimization of antibody and latex beads

由表1可知,两种不同粒径的乳胶微球均随着偶联抗体量的增多,T/(T+C)值呈上升的趋势。表明单位乳胶微球内抗体量的增加,使得免疫乳胶微球与T线的结合能力增加。在空白猪尿液时,抗体量的增加,使得T线的颜色比C线的颜色要深的多。但是实验发现在偶联抗体量为50 μg时,两种粒径的乳胶微球层析后由于乳胶微球绝大部分与T线的包被抗原结合,使得C线的颜色非常浅,用裸眼很难辨别是否显色,容易使检测人员作出试纸条失效判断,因此该质量浓度不可取。在猪尿液中CLB质量浓度为0.5 ng/mL时,偶联抗体量为30 μg的两种乳胶微球的T/(T+C)值在0.5左右,表明T线与C线颜色深浅差不多;偶联抗体量为10 μg的两种乳胶微球的T/(T+C)值分别为0.20和0.34,表明300 nm乳胶微球T线与C线颜色深浅差异最明显,接近T线消线。从用裸眼初步定性检测的角度考虑,偶联10 μg抗体的300 nm乳胶微球优势明显,更易于判断。因此,综合定性检测和定量检测两方面的要求,选择偶联10 μg抗体的300 nm乳胶微球为最优。
2.3 层析时间的确定
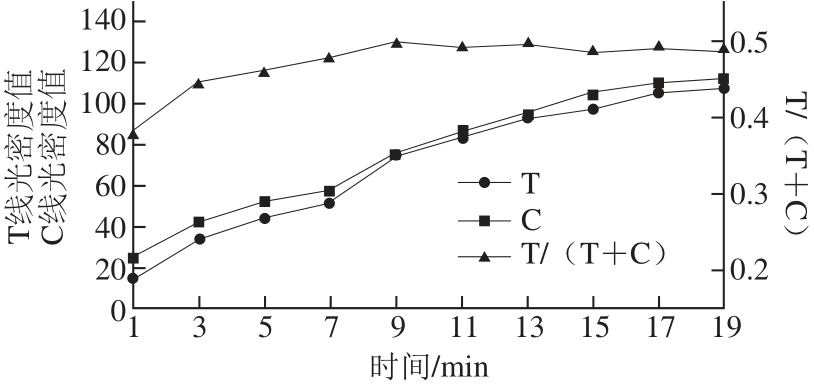
图1 层析时间的影响
Fig.1 Effect of chromatography time
层析时间过长,影响检测的效率;层析时间过短,免疫反应不够充分,造成结果重复性差,不稳定。本研究在免疫层析开始后,从1 min开始测定,每间隔2 min测定一次,到19 min结束。由图1可知,随着时间的延长,T线和C线的光密度值逐渐增大,即颜色一直加深。表明免疫乳胶微球随着层析液均匀的在试纸条上层析,随着时间的延长,层析到T线和C线的乳胶微球也随之增加,因此光密度值一直升高。但是T/(T+C)值没有随着层析时间的延长而一直增加,在层析反应的一开始T/(T+C)值一直在增加,但在9 min以后一直到19 min,T/(T+C)值不再增加维持相对稳定。因此选择9 min为最佳层析反应时间。
2.4 标准曲线的建立与检出限的确定
用空白猪尿液配制标准品溶液,标准品质量浓度分别为1、0.5、0.17、0.056 ng/mL和0.019 ng/mL。将0.5 μL偶联10 μg抗体的300 nm乳胶微球加入到微孔中,再补加100 μL冻干缓冲液后进行真空冷冻干燥。干燥完成后,将标准品溶液加入微孔中混匀,插试纸条层析9 min后测定结果。标准曲线横坐标为CLB质量浓度,纵坐标为T/(T+C)值,标准曲线采用四参数逻辑斯蒂拟合。标准曲线方程为:![]() ,线性范围在0.062~1 ng/mL之间,r值为0.999。
,线性范围在0.062~1 ng/mL之间,r值为0.999。
取20 个空白猪尿液,采用彩色乳胶试纸条检测,每个样品重复检测3 次,9 min后测定试纸条的T/(T+C)值。试纸条测定猪尿液的检出限等于20 个阴性样品测量的T/(T+C)平均值减去3 倍的标准偏差所对应的质量浓度。通过测定该法猪尿液样品的检出限为0.013 ng/mL。
2.5 方法的特异性实验结果
将彩色乳胶试纸条与其他常见的β-兴奋剂化学药物进行交叉反应的测定。在阴性尿样中分别添加莱克多巴胺、沙丁胺醇、赛曼特罗、盐酸特布他林和盐酸环仑特罗5 种药物,添加质量浓度均为50 ng/mL,用本研究建立的方法定量检测。结果测得的质量浓度均小于0.013 ng/mL的检出限,表明本研究建立的彩色乳胶免疫层析法与以上5 种药物几乎没有交叉反应,特异性良好。2.6 添加回收率测定结果
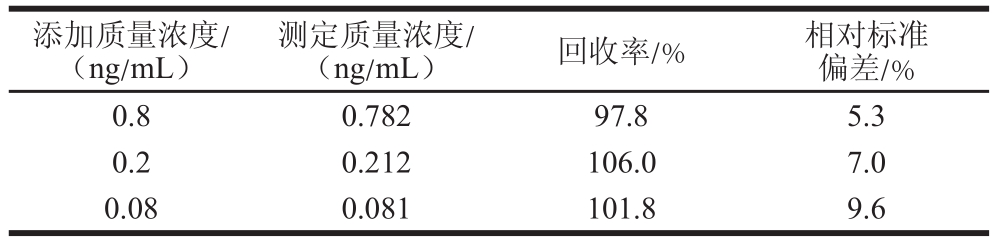
向空白猪尿液样品中添加一定量的CLB标准品,使终质量浓度为0.8、0.2 ng/mL和0.08 ng/mL。每个质量浓度试纸条重复测定5 次,结果见表2,添加回收率范围在97.8%~106.0%之间,相对标准偏差在5.3%~9.6%之间。表明本实验建立的用于猪尿液中CLB定量检测的彩色乳胶免疫层析法具有良好的精密度。
表2 CLB添加回收率测定
Table2 Recoveries of CLB from spiked swine urine samples
2.7 方法的比较
利用彩色乳胶试纸条与酶联免疫吸附试剂盒测定20 份不同质量浓度的猪尿液样品,两种方法测得的结果进行相关性比较,结果见图2。两种方法测定结果相关性良好,相关性方程为y=0.981x-0.005,R2为0.982。
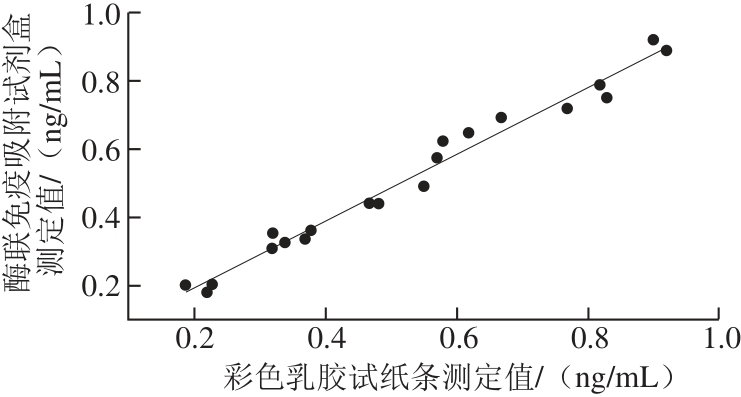
图2 彩色乳胶试纸条与酶联免疫吸附试剂盒测定方法的相关性
Fig.2 Correlation between the proposed method in the study and enzymelinked immunoabsorbent assay (ELISA)
本研究中,实验将彩色乳胶微球最为标记物并应用于免疫层析检测中,通过层析时间、微球粒径、抗体用量和表面活性剂等参数的优化,建立了能够定量检测猪尿液中CLB的免疫层析技术。该技术的检出限为0.013 ng/mL,添加回收率范围在97.8%~106.0%之间,相对标准偏差在5.3%~9.6%之间。本研究建立的方法比文献报道利用胶体金标记物[29](检出限为0.22 ng/mL)和荧光硅球标记物[30](检出限为0.28 ng/mL)的检出限更低,更加灵敏。综上,本研究成功建立了一种检测猪尿液中CLB的彩色乳胶免疫层析方法。
参考文献:
[1] ZHANG X F, ZHAO H, XUE Y, et al. Colorimetric sensing of clenbuterol using gold nanoparticles in the presence of melamine[J]. Biosensors and Bioelectronics, 2012, 34(1): 112-117. DOI:10.1016/ j.bios.2012.01.026.
[2] MERSMANN H J. Overview of the effects of β-adrenergic receptor agonists on animal growth including mechanisms of action[J]. Journal of Animal Science, 1998, 76(1): 160-172. DOI:10.2527/1998.761160x.
[3] RAMOS F, BAETA M L, REIS J, et al. Evaluation of the illegal use of clenbuterol in portuguese cattle farms from drinking water, urine, hair and feed samples[J]. Food Additives and Contaminants, 2009, 26(6):814-820. DOI:10.1080/02652030902729908.
[4] 吴银良, 杨挺, 单吉浩, 等. 高效液相色谱法测定猪尿中克伦特罗对映异构体残留量[J]. 分析化学, 2010, 38(6): 833-837. DOI:10.3724/ SP.J.1096.2010.00833.
[5] 黄仕稳, 曾婷, 马丽. 气相色谱-质谱法测定动物类食品中盐酸克伦特罗[J]. 理化检验: 化学分册, 2014, 50(6): 763-765. DOI:1001-4020(2014)06-0763-03.
[6] BOCCA B, FIORI M, CARTONI C, et al. Simultaneous determination of zilpaterol and other beta agonists in calf eye by gas chromatography/ tandem mass spectrometry[J]. Journal of AOAC International, 2003, 86(1): 8-14.
[7] HE L, SU Y, ZENG Z, et al. Determination of ractopamine and clenbuterol in feeds by gas chromatography-mass spectrometry[J]. Animal Feed Science and Technology, 2007, 132(3): 316-323.
[8] LIU B, YAN H, QIAO F, et al. Determination of clenbuterol in porcine tissues using solid-phase extraction combined with ultrasound-assisted dispersive liquid-liquid microextraction and HPLC-UV detection[J]. Journal of Chromatography B, 2011, 879(1): 90-94. DOI:10.1016/ j.jchromb.2010.11.017.
[9] YAN K, ZHANG H, HUI W, et al. Rapid screening of toxic salbutamol, ractopamine, and clenbuterol in pork sample by high-performance liquid chromatography-UV method[J]. Journal of Food and Drug Analysis, 2016, 24(2): 277-283. DOI:10.1016/j.jfda.2015.12.002.
[10] CHEN X B, WU Y L, YANG T. Simultaneous determination of clenbuterol, chloramphenicol and diethylstilbestrol in bovine milk by isotope dilution ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography B, 2011, 879(11): 799-803. DOI:10.1016/j.jchromb.2011.02.030.
[11] 方萍, 林慧, 颜春荣. 超高效液相色谱-串联质谱法同时测定猪肉中20 种β-受体激动剂[J]. 食品安全质量检测学报, 2016(4): 1645-1651.
[12] 王鹤佳, 李丹, 毕言锋, 等. 应用超高效液相色谱-四级杆-飞行时间质谱鉴定克伦特罗在猪尿中的主要代谢产物[J]. 食品安全质量检测学报, 2014(10): 3203-3209.
[13] WANG Z L, ZHANG J L, ZHANG Y N, et al. Mass spectrometric analysis of residual clenbuterol enantiomers in swine, beef and lamb meat by liquid chromatography tandem mass spectrometry[J]. Analytical Methods, 2016, 8(20): 4127-4133. DOI:10.1039/C6AY00606J.
[14] WANG H, YAN H, SHI M, et al. An enzyme-assisted and nitrogenblowing salt-induced solidified floating organic droplet microextraction for determination of clenbuterol and ractopamine in swine feed via capillary electrophoresis[J]. Animal Feed Science and Technology, 2015, 209: 257-267. DOI:10.1016/j.anifeedsci.2015.09.004.
[15] FAN L Y, CHEN Q, ZHANG W, et al. Sensitive determination of illegal drugs of clenbuterol and salbutamol in swine urine by capillary electrophoresis with on-line stacking based on the moving reaction boundary[J]. Analytical Methods, 2013, 5(11): 2848-2853. DOI:10.1039/ c3ay40100f.
[16] XING W W, HE L, YANG H, et al. Development of a sensitive and group-specific polyclonal antibody-based enzyme-linked immunosorbent assay (ELISA) for detection of malachite green and leucomalachite green in water and fish samples[J]. Journal of the Science of Food and Agriculture, 2009, 89(13): 2165-2173. DOI:10.1002/ jsfa.3695.
[17] XU T, WANG B M, SHENG W, et al. Application of an enzyme-linked immunosorbent assay for the detection of clenbuterol residues in swine urine and feeds[J]. Journal of Environmental Science and Health Part B, 2007, 42(2): 173-177. DOI:10.1080/03601230601123508.
[18] 王日楠, 王培龙, 安悦, 等. Au@Pt纳米材料作为模拟酶标记酶联免疫测定克伦特罗[J]. 分析试验室, 2015, 34(7): 770-773. DOI:10.13595/j.cnki.issn1000-0720.2015.0166.
[19] PLEADIN J, VULIC’ A, PERŠI N, et al. Ractopamine and clenbuterol urinary residues in pigs as food-producing animals[J]. Food Technology & Biotechnology, 2011, 49(4): 517-522.
[20] ZHENG S L, SONG S Q, LAN H, et al. Newly combined method of molecularly imprinted solid-phase extraction with ELISA for rapid detection of clenbuterol in animal-tissue samples[J]. Analytical Letters, 2009, 42(3): 600-614. DOI:10.1080/00032710802677134.
[21] 袁利鹏, 卢倚群, 孙远明, 等. 盐酸克伦特罗抗体纯化及直接竞争ELISA方法研究[J]. 食品科学, 2013, 34(14): 227-231. DOI:10.7506/ spkx1002-6630-201314046.
[22] 杨金易, 李萍, 雷红涛, 等. 直接竞争化学发光酶免疫方法检测克伦特罗残留[J]. 食品与发酵工业, 2013, 39(8): 198-202. DOI:10.13995/ j.cnki.11-1802/ts.2013.08.041.
[23] HAN J, GAO H, WANG W, et al. Time-resolved chemiluminescence strategy for multiplexed immunoassay of clenbuterol and ractopamine[J]. Biosensors and Bioelectronics, 2013, 48(19): 39-42. DOI:10.1016/ j.bios.2013.03.033.
[24] ZHANG M Z, WANG M Z, CHEN Z L, et al. Development of a colloidal gold-based lateral-flow immunoassay for the rapid simultaneous detection of clenbuterol and ractopamine in swine urine[J]. Analytical and Bioanalytical Chemistry, 2009, 395(8): 2591-2599. DOI:10.1007/ s00216-009-3181-2.
[25] 姜艳彬, 孙冠如, 王海, 等. 盐酸克伦特罗胶体金快速检测试纸条的研制[J]. 中国畜牧兽医, 2010, 37(10): 109-113. DOI:1671-7236(2010)10-0109-05.
[26] QU X, LIN H, DU S, et al. Development of a nano-gold capillary immunochromatographic assay for rapid and semi-quantitative detection of clenbuterol residues[J]. Food Analytical Methods, 2016, 9(9): 2531-2540. DOI:10.1007/s12161-016-0442-5.
[27] JIANG T, ZHONG L, REN W W, et al. A simple and rapid colloidal gold-based immunochromatogarpic strip test for detection of FMDV serotype A[J]. Virologica Sinica, 2011, 26(1): 30-39. DOI:10.1007/ s12250-011-3166-5.
[28] ADEYABEBA A, CHOI J W. Quantitative lateral flow immunosensor using carbon nanotubes as label[J]. Analytical Methods, 2010, 2(11):1819-1822. DOI:10.1039/C0AY00412J.
[29] 李超辉, 罗薇, 徐波, 等. 胶体金免疫层析试纸条定量检测猪尿中克伦特罗[J]. 食品科学, 2013, 34(12): 114-118. DOI:10.7506/spkx1002-6630-201312024.
[30] 李怀明, 赖卫华, 许恒毅, 等. 基于荧光硅球的克伦特罗快速定量免疫层析试纸条的研制[J]. 分析化学, 2011, 39(11): 1647-1652. DOI:10.3724/SP.J.1096.2011.01647.
Development of Dyed Latex Bead-Based Immunochromatographic Assay for Quantitative Detection of Clenbuterol in Swine Urine
GUAN Di1,2, WEI Ying1,2, WANG Qi1,2, LI Junbo1,2, WU Huijuan1,2,*
(1. Beijing Center for Physical and Chemical Analysis, Beijing 100089, China; 2. Beijing Engineering Technique Research Center for Gene Sequencing & Function Analysis, Beijing 100089, China)
Abstract:Objective: Aiming at the development of an immunochromatographic method based on dyed latex beads for the detection of clenbuterol (CLB) in swine urine. Methods: Dyed latex beads were conjugated with anti-CLB antibody and vacuum freeze-dried. CLB-bovine serum albumin (CLB-BSA) conjugate and goat anti-mouse IgG antibodies were coated onto nitrocellulose membranes to establish test and control lines, respectively. The test was carried out by placing swine urine into the sample well and mixed with dyed latex beads. After incubation, the optical density was measured by a microplate reader. Results: After optimizing the physical and chemical parameters, the best surfacant was Tween-20, 300 nm dyed latex beads were chosen, and the incubation time was9 minutes. The limit of detection (LOD) was 0.013 ng/mL. The recoveries from spiked swine urine varied from 97.8% to 106.0%, with relative standard deviation of less than 9.6%. Conclusion: A sensitive and accurate method for the detection of CLB was successfully developed in this paper.
Key words:immunochromatographic strip; dyed latex beads; clenbuterol; swine urine; quantitative detection
DOI:10.7506/spkx1002-6630-201712042
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)12-0273-05
引文格式:管笛, 魏颖, 王旗, 等. 乳胶免疫层析法定量检测猪尿液中的盐酸克伦特罗[J]. 食品科学, 2017, 38(12): 273-277.
DOI:10.7506/spkx1002-6630-201712042. http://www.spkx.net.cn
GUAN Di, WEI Ying, WANG Qi, et al. Development of dyed latex bead-based immunochromatographic assay for quantitative detection of clenbuterol in swine urine[J]. Food Science, 2017, 38(12): 273-277. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201712042. http://www.spkx.net.cn
收稿日期:2016-07-22
基金项目:北京市优秀人才项目(2014400685627G277);北京市科学技术研究院青年骨干计划项目(201415)
作者简介:管笛(1983—),男,副研究员,博士,研究方向为分析化学。E-mail:guandi@yeah.net
*通信作者:武会娟(1972—),女,研究员,博士,研究方向为分子生物学。E-mail:sunnywhj@126.com