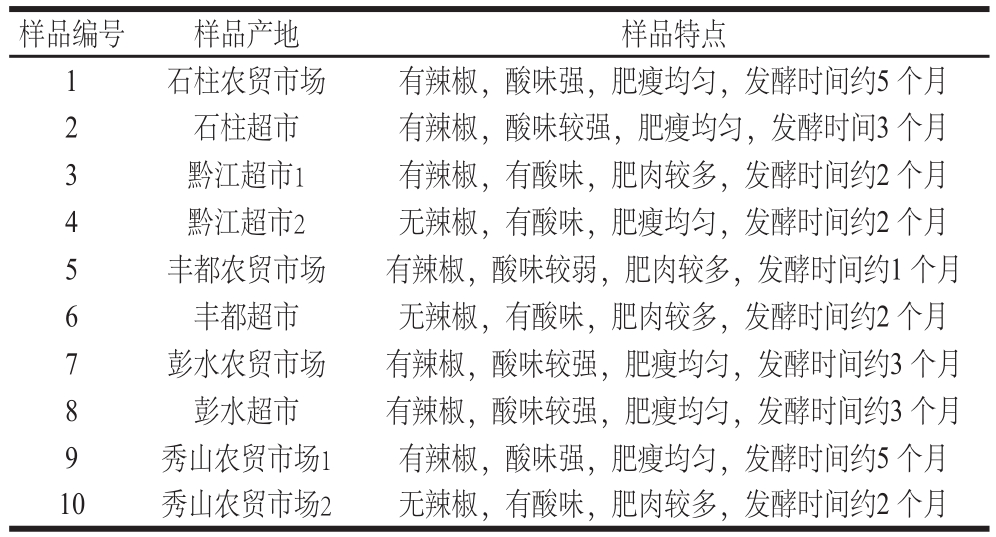
表1 渝东南地区传统土家特色酸鲊肉的来源和特点
Table1 The origin and characteristics of traditional Tujia special Suanzharou meat in southeast area of Chongqing
冉春霞1,2,陈光静3,胡 江4
(1.重庆三峡医药高等专科学校医学技术系,重庆 404120;2.重庆市抗肿瘤天然药物工程技术研究中心,重庆 404120;3.西南大学食品科学学院,重庆 400715;4.重庆市万州区农产品质量安全监督检测中心,重庆 404120)
摘 要:建立测定渝东南地区传统土家特色酸鲊肉中组胺含量的高效液相色谱(high performance liquid chromatography,HPLC)方法,并进行样品中组胺含量的测定。以1,7-庚二胺为内标物,丹磺酰氯为样品衍生剂;Agilent C18柱为固定相,70%甲醇和30%超纯水为流动相,于波长254 nm处进行紫外检测。用0.4 mol/L高氯酸溶液提取样品中的组胺,然后测定酸鲊肉中的组胺含量。结果表明:内标物和组胺标准品分别在4.335 min和7.723 min出峰,且分离效果良好。经实验验证,组胺盐酸盐标准品的峰面积和内标物峰面积的比值与组胺质量浓度之间存在良好的线性关系,样品加标实验回收率在98.5%~102.2%之间;仪器检出限为0.50 mg/L,定量限为1.00 mg/L,精密度相对标准偏差为1.0%。经检测10 个样品中组胺含量在19.68~44.15 mg/kg之间,不同样品组胺含量有显著性差异(P<0.05)。本研究表明HPLC方法的灵敏度和精密度较高,是检测酸鲊肉中组胺含量的可靠方法。
关键词:渝东南地区;传统土家特色酸鲊肉;组胺;高效液相色谱法
酸鲊肉属于“鲊”的一种,其传统制作工艺距今已有2 000多年的历史。渝东南地区传统土家特色酸鲊肉是一种以新鲜猪肉为原料,洗净后切片,同时将大米(玉米或糯米)、花椒、八角、山柰等放入锅内,用小火炒出焦香味,取出磨成粉。然后将米粉、猪五花肉片、白酒、糟辣椒按一定比例混合均匀,再装入坛子里,在自然条件下利用微生物的厌氧发酵作用而形成的一种乳酸细菌型发酵肉制品[1]。酸鲊肉具有肉质细腻、风味独特、肥而不腻、营养丰富、保存期长、绿色和原生态等特点,同时现代营养学研究表明其具有降血清胆固醇、调节胃肠道、抗氧化等生理保健功能[2-4],因而越来越受到广大消费者的喜爱。
组胺是游离的组氨酸在微生物产生的组氨酸脱羧酶的作用下脱羧或醛、酮类物质氨基化形成的一类具有生物活性的小分子质量含氮有机化合物,同时也是生物胺中毒性最强的一种,对人类健康影响最大。适量的组胺是人体神经系统、消化系统以及心血管系统的正常功能所必需的,但高浓度摄入可能会引起食物过敏和食物中毒,并表现出一系列症状:喷嚏、面部潮红、呕吐、腹泻、头痛、呼吸困难、发热、高血压等[5-7],严重时还可能引起脑出血,甚至是死亡。据统计:2000—2006年期间,英国发生组胺中毒事件187 例;1998—2008年期间,日本发生组胺中毒事件1 500 例[8];2002—2012年期间,中国发生食品组胺中毒事件约140 例[9],组胺中毒已经成为主要的公共卫生和食品安全问题。组胺广泛存在于发酵香肠、发酵豆制品、奶酪、发酵酒等发酵食品中,其含量越来越受到国内外研究人员的关注[10-14]。传统酸鲊肉在自然发酵过程中有大量不同种类微生物的参与,可能含有组胺。组胺的分析方法有分光光度法、高效液相色谱(high performance liquid chromatography,HPLC)法、薄层色谱法、气相色谱法、毛细管电泳法、电化学生物传感器法等[15],其中HPLC法具有分析速度快、柱效高、检测灵敏度高、定量分析准确等特点,是目前食品中生物胺分析检测的主要手段。大量研究[16-20]采用HPLC法检测发酵香肠、发酵豆制品等食品中的生物胺的含量,但目前未见有关传统酸鲊肉中组胺含量测定的报道。因此,本研究采用HPLC法测定渝东南地区传统土家特色酸鲊肉中组胺的含量,从组胺的角度考察传统酸鲊肉的安全性,以期为渝东南地区土家特色酸鲊肉中组胺的定量风险评估提供试验数据。
1.1 材料与试剂
酸鲊肉样品(10 个)分别购于重庆市石柱、黔江、丰都、彭水、秀山等土家族聚居地的农贸市场和超市(表1);0.22 μm滤膜针头滤器。
表1 渝东南地区传统土家特色酸鲊肉的来源和特点
Table1 The origin and characteristics of traditional Tujia special Suanzharou meat in southeast area of Chongqing

组胺盐酸盐标准品(纯度≥99%)、丹磺酰氯(纯度≥98%)、1,7-庚二胺(内标物)(纯度≥99%)美国Sigma公司;甲醇(色谱纯) 天津四友精细化工厂;氢氧化钠、碳酸氢钠、丙酮、乙酸酐、浓氨水(均为分析纯) 成都科龙化工试剂厂;高氯酸、盐酸、冰醋酸(均为分析纯) 重庆川东化工有限公司;水为超纯水。
1.2 仪器与设备
1260高效液相色谱仪 美国Agilent公司;GTR16-2高速冷冻离心机 北京时代北利离心机有限公司;DS-1高速组织捣碎机 上海标本模型厂;XH-C旋涡混匀器无锡沃信仪器有限公司;RE-2000B旋转蒸发仪 上海亚荣生化仪器厂;WITOPET premium(20~200 μL)移液枪 上海安谱实验科技股份有限公司;Hitech-Kflow超纯水仪 上海和泰仪器有限公司;KQ-100E超声波清洗器 昆山市超声仪器有限公司;PTX-FA300电子分析天平 美国康州HZ电子科技有限公司。
1.3 方法
1.3.1 样品预处理
准确称取已绞碎和匀浆的酸鲊肉5 g置于50 mL离心管中,加入20 mL 0.4 mol/L高氯酸溶液和2.0 mL(100 mg/L)内标使用液,混匀,振荡提取60 min,放入高速冷冻离心机中4 ℃、4 000 r/min离心10 min,取上清液,移入50 mL容量瓶中,连续提取两次,合并上清液,用0.4 mol/L高氯酸溶液定容至刻度,待衍生。
1.3.2 组胺相关试剂的配制
准确称取10 mg组胺盐酸盐标准品于10 mL容量瓶中,用0.4 mol/L高氯酸溶液稀释至刻度,混匀,配制成质量浓度为1 000 mg/L的标准储备溶液,置4 ℃冰箱贮存。
准确吸取5.00 mL组胺标准储备溶液,置于50 mL容量瓶中,用0.4 mol/L高氯酸溶液稀释至刻度,混匀,配制成质量浓度为100 mg/L的标准使用液,置4 ℃冰箱贮存。
吸取0.10、0.25、0.50、1.00、1.50、2.5、5.0 mL组胺标准使用液(100 mg/L),分别置于10 mL容量瓶中,用0.4 mol/L高氯酸溶液稀释至刻度,混匀,使质量浓度分别为1.00、2.50、5.00、10.0、15.0、25.0、50.0 mg/L,同时做标准品空白实验。
1.3.3 内标标准储备液和标准使用液的配制
准确称取1,7-庚二胺内标物质10 mg于10 mL容量瓶中,用0.4 mol/L高氯酸溶液稀释至刻度,混匀,配制成质量浓度为1 000 mg/L的标准储备溶液,置4 ℃冰箱贮存。
准确吸取5.00 mL 1,7-庚二胺内标标准储备溶液,置于50 mL容量瓶中,用0.4 mol/L高氯酸溶液稀释至刻度,混匀,配制成质量浓度为100 mg/L的标准使用液,置4 ℃冰箱贮存。
1.3.4 丹磺酰氯衍生剂溶液的配制
准确称取500 mg丹磺酰氯于50 mL容量瓶中,以丙酮稀释定容,混匀,配制成10 mg/mL的衍生剂标准使用液,置4 ℃冰箱贮存。
1.3.5 组胺标准系列溶液和样品溶液的衍生
参照孙霞等[21]的方法,并经预实验进行相关参数的优化。分别移取1.00 mL组胺标准系列溶液于具塞试管中,加入200 μL2 mol/L氢氧化钠溶液调至中性,然后加入300 μL饱和碳酸氢钠溶液缓冲,再加入40 μL内标物和2.0 mL丹磺酰氯衍生剂,振荡混匀。置于60 ℃培养箱中反应30 min,中间振荡两次,取出,分别加入100 μL浓氨水混匀,置于暗处20 min以终止反应。40 ℃减压蒸馏除去丙酮,剩余样液用甲醇定量至5 mL,振荡混匀,过0.22 μm微孔滤膜,滤液待测。
分别移取1.00 mL样品溶液于具塞试管中,加入200 μL2 mol/L氢氧化钠溶液调至中性,然后加入300 μL饱和碳酸氢钠溶液缓冲,再加入2.0 mL丹磺酰氯衍生剂,振荡混匀。置于60 ℃培养箱中反应30min,中间振荡两次,取出,分别加入100 μL浓氨水混匀,置于暗处20 min以终止反应。40 ℃减压蒸馏除去丙酮,剩余样液用甲醇定量至5 mL,振荡混匀,过0.22 μm微孔滤膜,滤液待测。
1.3.6 高效液相色谱分析条件
色谱柱为Agilent C18柱(250 mm×4.6 mm,5 μm),紫外检测器,检测波长254 nm。进样量20 μL,柱温35 ℃,流动相A为甲醇溶液,B为超纯水,A-B比例70∶30(V/V),流速1.0 mL/min。
1.3.7 检出限、定量限和精密度的测定[17,22]
将1.00 mg/L的组胺标准溶液用甲醇适当稀释,按
1.3.5 节的方法进行衍生后测定,以信噪比确定检出限(RSN=3)和定量限(RSN=10)。
取质量浓度为15.00 mg/L的组胺标准溶液按1.3.5节方法进行衍生后测定,连续进样5 次,根据组胺与内标物的峰面积比计算相对标准偏差(relative standard deviation,RSD)。
1.3.8 组胺加标回收率的测定
从5 个样品产地采集的酸鲊肉样品中分别选择1 个样品作为研究对象,向样品中添加一定量组胺标准溶液(20、50 mg/kg),每个加标水平平行测定5 次,计算不同加标水平的回收率和平均回收率。
1.3.9 组胺含量的计算
按下式计算样品中组胺的含量:
式中:ρ为样品中组胺的含量/(mg/kg或mg/L);m1为样品中组胺色谱峰与内标色谱峰的峰面积比值对应的组胺质量/μg;f为试样稀释倍数;m为取样量/(g或mL)。
1.4 数据处理
采用Microsoft Excel 2007和Origin 7.5(美国Origin Lab公司)分析和处理数据,实验平行测定5 次并计算平均值和标准偏差。同时采用t检验和方差分析各测定结果在95%置信区间(P<0.05)水平下是否存在显著性差异。
2.1 组胺标准品图谱和标准曲线
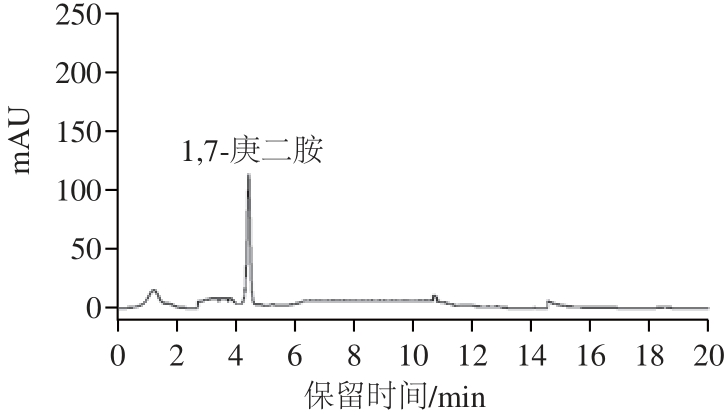
图1 内标物质1,7-庚二胺的HPLC图
Fig.1 HPLC chromatogram of internal standard substance 1,7-heptanediamine
在本实验建立的色谱条件下得到HPLC图,从图1和图2可知:内标物质1,7-庚二胺和组胺盐酸盐标准品的保留时间分别为4.335 min和7.723 min,两组峰得到有效分离,且峰形比较对称、无基线漂移和拖尾现象,分离效果较理想。
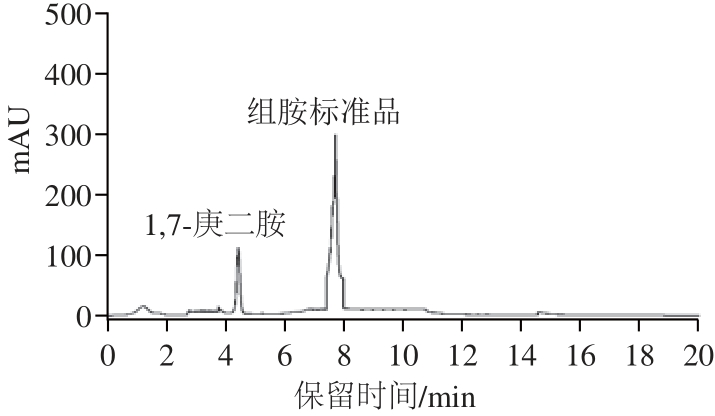
图2 组胺盐酸盐标准品的HPLC图
Fig.2 HPLC chromatogram of histamine dihydrochloride standard
将1.00、2.50、5.00、10.0、15.0、25.0、50.0 mg/L的标准溶液依次进样,以组胺盐酸盐标准品的峰面积与内标物峰面积的比值为纵坐标,标准系列溶液的质量(μg)为横坐标绘制标准曲线,并计算标准曲线的回归方程及相关系数。组胺衍生物的标准曲线回归方程为y = 2.027x-1.455。标准回归曲线图中各点偏离曲线的幅度很小,回归分析结果显示相关系数R2为0.999 0。因此,在1.00~50.0 mg/L线性范围内标准品和内标物的峰面积比与相应标准系列溶液的质量呈现良好的线性关系,符合测定要求。
2.2 检出限、定量限和精密度的测定结果
将质量浓度为1.00 mg/L的组胺标准溶液稀释成不同的低质量浓度溶液,经衍生后进样测定。结果表明:当RSN为3时,组胺标准溶液的质量浓度为0.50 mg/L;当RSN为10时,组胺标准溶液的质量浓度为1.00 mg/L。因此,仪器的检出限为0.50 mg/L,定量限为1.00 mg/L。将质量浓度为15.00 mg/L的组胺标准溶液经衍生后测定,连续进样5 次,组胺的保留时间稳定且峰面积与内标物的峰面积比值的RSD为1.0%。根据《中国药品检验标准操作规程》规定:HPLC分析的允许RSD范围为±2%,说明仪器精密度较好。
2.3 样品中组胺加标回收率的测定
表2 组胺加标回收率的测定( =5)
Table2 Recovery of histamine in spiked samples ( = 5)
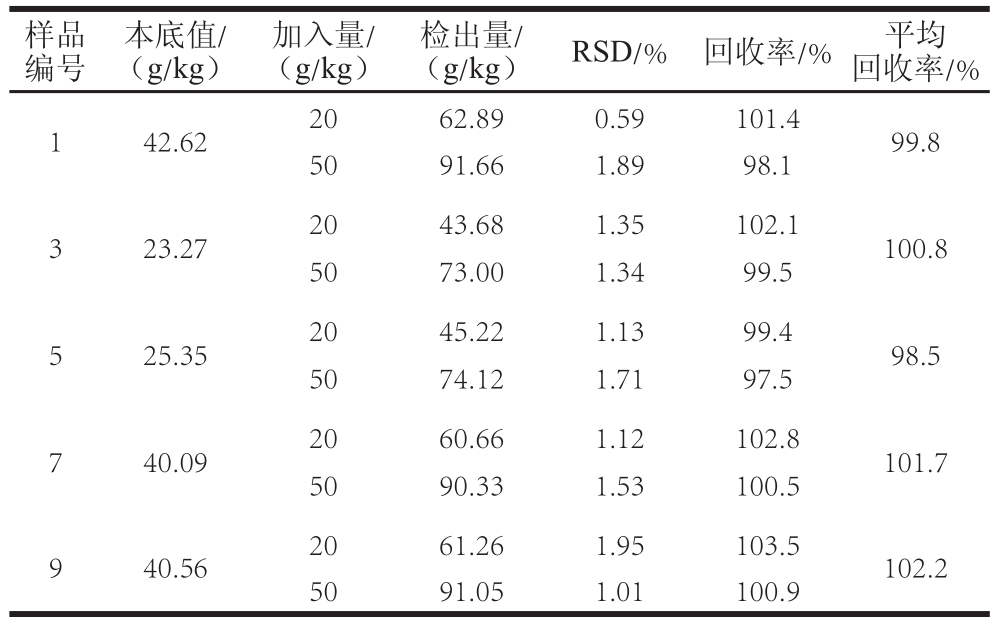
由表2可知,样品中组胺加标回收实验RSD在0.59%~1.95%之间,在±2%范围内;平均回收率在98.5%~102.2%之间,经t检验分析平均回收率数据间差异水平,在置信区间95%范围内得到P值为1.0(>0.05),表明各组加标实验平均回收率之间无显著性差异。可见该方法回收率高,可靠性高。
2.4 渝东南地区传统土家特色酸鲊肉中组胺含量的测定结果
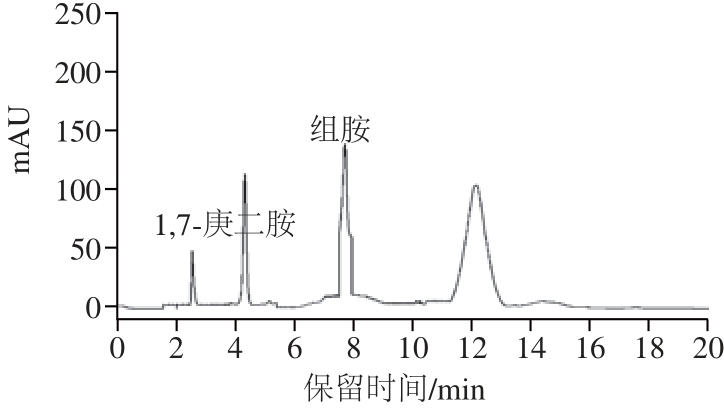
图3 酸3 鲊肉样品中组胺的HPLC图HPLC
Fig.3 HPLC chromatogram of histamine in Suanzharou
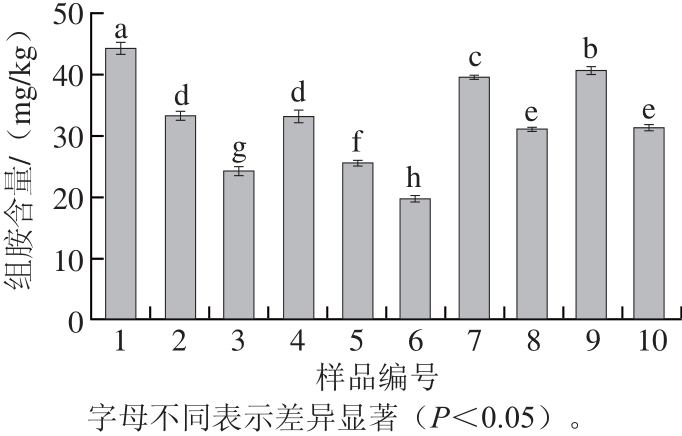
图4 酸鲊肉中的组胺含量(n=5)=5
Fig.4 The content of histamine in Suanzharou (n = 5)
欧盟规定除鱼类以外的其他食品中组胺含量不得超过100 mg/kg[23];美国食品和药品管理局标准规定食品中组胺含量应低于500 mg/kg[24];到目前为止,我国仅仅在食品安全标准GB 2733—2005《鲜(冻)动物性水产品卫生标准》中规定了鱼类的组胺含量,而其他食品中组胺含量的尚未限定[25]。从图3和图4可知,酸鲊肉中存在组胺且组胺含量在19.68~44.15 mg/kg之间,其含量低于欧盟和美国食品和药品管理局的规定。组胺含量在样品2和样品4之间、样品8和样品10之间无显著性差异(P>0.05),其他各样品之间均存在显著性差异(P<0.05),即不同来源的样品组胺含量不同。
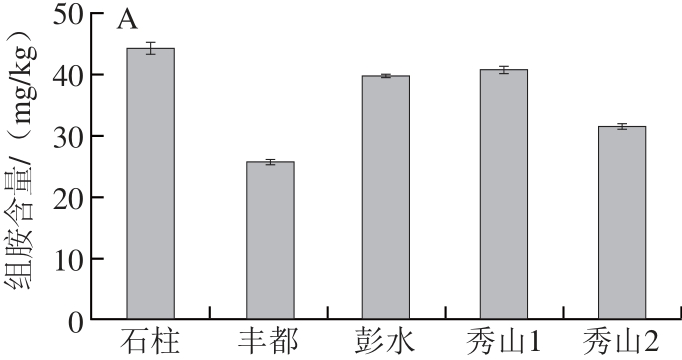
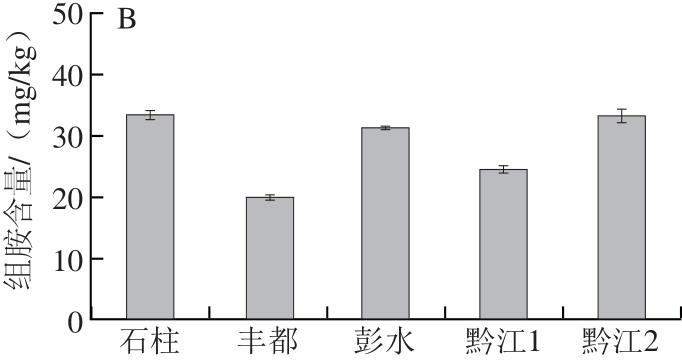
图5 农贸市场(A)和超市(B)酸鲊肉中组胺含量的比较( =5)
Fig.5 Comparison of histamine content in Suanzharou from farmer’s market and supermarket (n = 5)
食品中组胺的形成受到很多因素的影响,如原料的pH值、种类、组分、微生物种类、贮藏温度、包装条件以及辅料等[11,26]。结合表1和图5可知,来源于超市的样品中组胺含量普遍低于农贸市场的样品,同时采用t检验分析两类样品组胺含量是否存在显著性差异,结果表明在置信区间95%内P值为0.025(<0.05),即来源于超市的样品与农贸市场的样品中组胺含量存在显著性差异。发酵时间越长的样品组胺含量越高;肥肉较多的样品中组胺含量会相应低于瘦肉较多的样品,可能的原因:1)来源于农贸市场的酸鲊肉的贮藏温度、包装条件不当或环境卫生条件较差,有研究[27-28]表明贮藏在4 ℃、真空或气调包装的肉制品组胺含量更少,这与产组氨酸脱羧酶微生物的生长受到抑制有关;2)发酵时间越长,受到肠细菌、乳酸菌的某些种、假单胞菌等杂菌污染的几率就越大,在一定程度上也增加了组胺大量产生的风险[29];3)脂肪含量会影响组胺的形成,原料肉中脂肪含量越高则组胺生成量越低,这可能是因为水分活度抑制了微生物的生长和游离组氨酸的形成,从而降低了生物胺的生成量[30]。
本研究采用丹磺酰氯衍生,高效液相色谱-紫外检测方法测定渝东南地区传统土家特色酸鲊肉中的组胺含量,组胺在7.723 min出峰且峰形对称、无漂移和拖尾现象。该方法快速、灵敏、精密度和回收率较高,能够满足酸鲊肉中组胺的测定。采用该方法测得渝东南地区土家特色酸鲊肉中组胺含量在19.68~44.15 mg/kg之间,低于欧盟和美国食品和药品管理局的标准,但我国还没有相关标准规定。酸鲊肉中组胺的形成受多种因素的影响,要确定各种因素在组胺形成中的作用,还需要进一步的实验验证,从而为渝东南地区传统土家特色酸鲊肉的安全食用提供理论依据。
参考文献:
[1] 卫飞, 赵海伊, 余文书. 酸肉的营养价值及安全性研究[J]. 粮食科技与经济, 2011, 36(4): 54-56. DOI:10.3969/j.issn.1007-1458.2011.04.019.
[2] 丁苗, 刘洋, 葛平珍, 等. 发酵酸肉中降胆固醇乳酸菌的筛选、鉴定及降胆固醇作用[J]. 食品科学, 2014, 35(19): 203-207. DOI:10.7506/ spkx1002-6630-201419041.
[3] 秦春君, 李想, 邓锋, 等. 发酵肉制品抗氧化研究进展[J]. 食品与发酵工业, 2010, 36(7): 122-126. DOI:10.13995/j.cnki.11-1802/ ts.2010.07.021.
[4] 孙文静, 卫飞, 袁军, 等. 酸肉发酵中脂肪的变化及对小鼠血脂的影响[J]. 食品科学, 2013, 34(11): 263-267. DOI:10.7506/spkx1002-6630-201311057.
[5] WANTKE F, GOTZ M, JARISCH R, et al. Histamine-free diet:treatment of choice for histamine-induced food intolerance and supporting treatment for chronical headaches[J]. Clinical and Experimental Allergy, 1993, 23(12): 982-985. DOI:10.1111/j.1365-2222.1993.tb00287.x.
[6] SHALABY A R. Signif i cance of biogenic amines to food safety and human health[J]. Food Research International, 1996, 29(7): 675-690. DOI:10.1016/S0963-9969(96)00066.x.
[7] NAIL A A, FLINT S, FLETCHER G, et al. Control of biogenic amines in food-existing and emerging approaches[J]. Food Science, 2010, 75(7): 139-150. DOI:10.1111/j.1750-3841.2010.01774.x.
[8] TODA M, YAMAM M, UNEYA M C, et al. Histamine food poisoning in Japan and other countries[J]. Bulletin of National Institute of Health Sciences, 2009, 127: 31-38.
[9] 夏威, 徐正龙, 于颖慧. 一起组胺中毒的调查报告[J]. 河南预防医学杂志, 2013, 24(2): 160-161. DOI:10.13515/j.cnki.hnjpm.2013.02.026.
[10] HUANG Y, LIU K, HSIEH H. Histamine level and histamineforming bacteria in dried fish products sold in Penghu Island of Taiwan[J]. Food Control, 2010, 21(9): 1234-1239. DOI:10.1016/ j.foodcont.2010.02.008.
[11] XIN H W, HONG Y R, WEI W, et al. Evaluation of key factors influencing histamine formation and accumulation in fermented sausages[J]. Journal of Food Safety, 2015, 35: 395-402. DOI:10.1111/ jfs.12187.
[12] CHANG S C, KUNG H F, CHEN H C, et al. Determination of histamine and bacterial isolation in swordf i sh fi llets (Xiphias gladius) implicated in a food borne poisoning[J]. Food Control, 2008, 19(1):16-21. DOI:10.1016/j.foodcont.2007.01.005.
[13] 孙霞, 巩洋, 杨勇, 等. 传统自然发酵四川香肠加工贮藏过程中生物胺含量变化[J]. 食品与发酵工业, 2015, 41(8): 215-219. DOI:10.13995/j.cnki.11-1802/ts.201508040.
[14] SHUKL A S, PARK H, KIM J, et al. Determination of biogenic amines in Korean traditional fermented soybean paste (Doenjang)[J]. Food and Chemical Toxicology, 2010, 48(5): 1191-1195. DOI:10.1016/ j.fct.2010.01034.
[15] 王永丽, 李锋, 陈肖. 传统发酵肉制品中生物胺形成机理及检测控制技术[J]. 肉类研究, 2013, 27(6): 39-43.
[16] 胡鹏, 索化夷, 阚建全, 等. 中国传统发酵豆豉中生物胺含量[J].食品科学, 2013, 34(20): 108-112. DOI:10.7506/spkx1002-6630-201320021.
[17] 刘振锋, 魏云潇, 张进杰, 等. 高效液相色谱法检测中国传统发酵豆腐制品中的生物胺[J]. 中国食品学报, 2010, 10(4): 253-259. DOI:10.16429/j.1009-7848.2010.04.038.
[18] 廖国周, 王桂瑛, 曹锦轩, 等. 宣威火腿中生物胺的HPLC测定[J].食品与发酵工业, 2011, 37(12): 130-132. DOI:10.13995/ j.cnki.11-1802/ts.2011.12.013.
[19] WANG X H, REN H Y, WANG W, et al. Evaluation of key factors influencing histamine formation and accumulation in fermented sausages[J]. Food Safety, 2015, 35(3): 395-402. DOI:10.1111/ jfs.12187.
[20] 李思宁, 唐善虎, 王柳, 等. 四川区域自然发酵香肠及人工接种牦牛肉发酵香肠中生物胺含量的研究[J]. 食品科学, 2016, 37(11): 197-201. DOI:10.7506/spkx1002-6630-201611034.
[21] 孙霞, 杨勇, 巩洋, 等. 市售四川香肠中生物胺含量比较分析[J].食品与发酵工业, 2015, 41(10): 147-151. DOI:10.13995/ j.cnki.11-1802/ts.201510027.
[22] 卫生部, 食品卫生监督检验所. 食品卫生检验方法 理化部分 总则:GB/T 5009.1—2003[S]. 北京: 中国标准出版社, 2003.
[23] FDA (Food and Drug Administration, USA). Decomposition and histamine: raw frozen tuna and mahi-mahi; Canned tuna; and Related species: availability of revised compliance policy guide[S]. FDA:Federal Registration, 1995.
[24] European Commission (EC). Commision recommendation of10 January 2003 concerning a coordinated programme for the official control of foodstuffs for 2003[S]. Official Journal of the European Commission, 2003.
[25] 王正, 刘军伟, 张红, 等. 鲜(冻)动物性水产品卫生标准: GB 2733—2005[S]. 北京: 中国标准出版社, 2005.
[26] 王翔, 卢士玲, 徐幸莲, 等. 发酵肉制品中生物胺的形成及影响因素研究进展[J]. 食品与发酵工业, 2010, 36(11): 133-136. DOI:10.13995/j.cnki.11-1802/ts.2010.11.033.
[27] KIM J Y, KIM D, PARK P, et al. Effects of storage temperature and time on the biogenic amine content and microf l ora in Korean turbid rice wine, Makgeolli[J]. Food Chemistry, 2011, 128(1): 87-92. DOI:10.1016/j.foodchem.2011.02.081.
[28] WEI C I, CHEN C M, KOBURGER J A, et al. Bacterial growth and histamine production on vacuum packaged tuna[J]. Food Science, 1990, 55(1): 59-63. DOI:10.1111/j.1365-2621.1990.tb06016.x.
[29] 张潇, 龚吉军, 唐静, 等. 不同发酵剂与发酵条件对鲊鱼生物安全性的影响[J]. 食品工业科技, 2016, 37(4): 205-210. DOI:10.13386/ j.issn1002-0306.2016.04.033.
[30] RUIZ C C, JIMÉNEZ C F. Biogenic amines in meat and meat products[J]. Critical Reviews in Food Science and Nutrition, 2004, 44:489-499. DOI:10.1080/10408690490489341.
Determination of Histamine Content in Suanzharou, a Unique and Traditional Fermented Meat Product of the Tujia Nationality in Southeastern Chongqing by High Performance Liquid Chromatography
RAN Chunxia1,2, CHEN Guangjing3, HU Jiang4
(1. Department of Medical Technology, Chongqing Three Gorges Medical College, Chongqing 404120, China; 2. Chongqing Engineering Research Center of Antitumor Natural Drugs, Chongqing 404120, China; 3. School of Food Science, Univerisity of Southwest, Chongqing 400715, China; 4. Chongqing District of Wanzhou City Agricultural Products Quality Safety Supervision and Inspection Center, Chongqing 404120, China)
Abstract:The purpose of this study was to establish a high performance liquid chromatography (HPLC) method for the qualitative and quantitative detection of histamine in Suanzharou, a unique and traditional fermented meat product of the Tujia nationality in southeastern Chongqing. 1,7-Heptanediamine was used as an internal standard substance. Dansyl chloride was used as a derivatization agent. The chromatographic separation was accomplished using an Agilent C18column as stationary phase and a mixture of 70% methanol and 30% ultra pure water as mobile phase, and the UV detector was set at 254 nm. The analyte was extracted with 0.4 mol/L HClO4solution and analyzed by HPLC. Results showed that the peaks for 1,7-heptanediamine and histamine dihydrochloride appeared at 4.335 min and 7.723 min, respectively, and an acceptable separation was achieved. The proposed method showed a good linearity between the ratio of peak area (histamine dihydrochloride and 1,7-heptanediamine) and the mass concentration of histamine. The recovery of spiked samples was between 98.5%-102.2%, the instrumental limit of detection (LOD) was 0.50 mg/L and the limit of quantitation (LOQ) was 1.00 mg/L. The precision expressed as relative standard deviation (RSD) was 1.0%. The histamine content of10 real samples was detected to be in the range of 19.68-44.15 mg/kg, with significant differences existing among these samples (P < 0.05). In conclusion, this method is reliable for the detection of histamine in Suanzharou with high sensitivity and precision.
Key words:southeastern Chongqing; Suanzharou; histamine; HPLC
DOI:10.7506/spkx1002-6630-201712044
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)12-0286-06
收稿日期:2016-07-30
基金项目:重庆市教委科学技术研究项目(KJ1502608)
作者简介:冉春霞(1985—),女,讲师,硕士,研究方向为食品化学与营养学、食品安全与质量控制。E-mail:chunxiaran@126.com
引文格式:冉春霞, 陈光静, 胡江. HPLC法测定渝东南地区传统土家特色酸鲊肉中的组胺含量[J]. 食品科学, 2017, 38(12):286-291.
DOI:10.7506/spkx1002-6630-201712044. http://www.spkx.net.cn
RAN Chunxia, CHEN Guangjing, HU Jiang. Determination of histamine content in Suanzharou, a unique and traditional fermented meat product of the Tujia nationality in southeastern Chongqing by high performance liquid chromatography[J]. Food Science, 2017, 38(12):286-291. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201712044. http://www.spkx.net.cn