张怡一,徐 茜,陈 琳,姚轶俊,鞠兴荣,王立峰*
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
摘 要:利用葡聚糖凝胶将薏米中两类多酚类物质进行分离纯化,从而得到6 个不同的组分。采用Folin-Ciocalteu法测定该6 个组分总酚含量,采用氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)、过氧化氢自由基清除能力(peroxyl radical scavenging capacity,PSC)和细胞内抗氧化能力(cellular antioxidant activity assay,CAA)分析法测定所得6 个组分抗氧化能力。在所得的6 个组分中选择抗氧化活性最强的3 个组分进行半制备,可制得4 种薏米多酚纯化物,并测定其4 种纯化物的抗氧化活性。结果发现,所分离的6 个组分中,薏米中的多酚主要存在于组分2、组分3及组分5中,其总酚含量分别为(30.56±2.25)、(17.40±2.76)、(25.18±1.10)mg GAE/100 g薏米粉末,结合型酚类化合物占薏米总酚含量1/3以上。组分2、组分3及组分5薏米多酚的抗氧化能力较强。经过半制备液相得到的4 种多酚纯化物质分别为N1,N5-双(对香豆酰)亚精胺、对香豆酸、阿魏酸及芦丁,其中N1,N5-双(对香豆酰)亚精胺为游离型多酚的主要物质,而阿魏酸为结合型多酚的主要物质,但在游离型多酚中也有少许存在。4 种酚类化合物均具有强抗氧化活性,是薏米中多酚类物质发挥抗氧化作用的主要活性成分。
关键词:薏米;多酚;分离纯化;抗氧化活性
薏米(Coix lacryma-jobi)又名薏苡,属于禾本科薏苡属草本植物,在中国、越南、巴西、日本等许多国家都有种植,我国南北方都种植薏米,主要产地为福建、河北、辽宁等地。薏米富含蛋白质、脂肪、碳水化合物、维生素等多种营养物质以及磷、铁、钙、锌、钾等矿质元素,被誉为“世界禾本科植物之王”。目前研究较多的薏米药理作用主要为抗肿瘤研究[1-3],除此以外,薏米还有消炎抗敏、降血压降血脂、瘦身美白等功效[4-7]。
薏米属于药食两用物质,在发挥诸多药理作用的同时具有很高的食用安全性,这归功于薏米中较多的植物化学物质[8-9]。多酚是一类广泛存在于植物内的多元酚化合物,具有很强的抗氧化能力[10-12],薏米中的多酚类物质也是薏米发挥诸多生理功能的主要活性物质之一。薏米中的多酚类物质分为游离型酚类化合物和结合型酚类化合物,关于谷物中的结合型分类化合物研究较少,Adom等[13]的研究中指出,全谷物食品中的多酚含量由于忽略了结合型酚类化合物而被大大低估。王立峰等[14]曾比较了3 种不同产地的薏米中总酚含量和抗氧化能力,其中薏米提取物中结合型多酚含量接近游离型多酚,但结合型多酚的抗氧化能力则明显高于游离型部分,而该提取物并没有进行分离纯化,也就是说两类酚类化合物真正发挥抗氧化作用的物质暂时还未可知。本研究将薏米中的游离型与结合型酚类化合物进行进一步分离得到不同组分,并对活性成分最高的几个组分进行纯化,研究其所得纯化物的抗氧化活性,为今后对薏米多酚的进一步研究做铺垫与准备。
1.1 材料与试剂
薏米品种为贵州小薏米。
石油醚、乙醇、乙酸乙酯、乙酸、丙酮(均为分析纯) 国药集团化学试剂有限公司;没食子酸、儿茶素、绿原酸、对羟基苯酸、香草酸、香草醛、对香豆酸、阿魏酸、芦丁、槲皮素、山柰酚、N1,N5-双(对香豆酰)亚精胺和没食子酸甲酯标准品为色谱纯 美国Sigma公司;乙腈(色谱级) 德国默克公司;葡聚糖凝胶LH-20填料 瑞典GE公司。
1.2 仪器与设备
SX-500快速自动高压灭菌锅 日本Tomy Digital Biology公司;FW100高速粉碎机 天津泰斯特仪器有限公司;J6高速冷冻离心机 美国Beckman Coulter公司;pHS-3C型精密数显pH计 上海精密科学仪器厂;TP-214电子分析天平 丹佛仪器北京有限公司;THZ-D台式恒温振荡器 江苏太仓市强乐实验设备有限公司;HH-6数显恒温水浴锅 国华电器有限公司;ULT1386-5-V超低温冰箱 美国Thermo Scientific公司;ALpHA2-4型真空冷冻干燥机 德国Christ公司;QL-861漩涡振荡器 海门市其林贝尔仪器制造有限公司;Milli-Q Academic超纯水系统 美国Millipore公司;层析柱(1.5 cm×76 cm) 瑞典GE公司;玻璃砂芯过滤装置 天津津腾实验设备有限公司;Anke TDL-5-A离心机 上海安亭科学仪器厂;SHZ-D III予华牌循环水真空泵 巩义市予华仪器有限责任公司;旋转蒸发仪上海亚荣化学仪器厂;HD-3紫外检测仪、HL-2恒流泵、XWT-S小型台式记录仪、BSZ-100自动收集器 上海沪西分析仪器厂;2707自动进样器、高效液相色谱仪1525二元泵、2998检测器、馏分收集器 美国Waters公司;SpectraMax M2酶标仪 美国Molecular Devices公司;Dionex Ultimate 3000 美国Thermo Fisher公司。
1.3 方法
1.3.1 薏米多酚提取物的制备
薏米样品中游离型和结合型多酚类化合物的提取采用丙酮提取法和NaOH消化法[13,15],并稍作修改。共2 kg脱脂薏米粉分多次以料液比1∶10(m/V)的比例用80%的丙酮水溶液振荡提取1 h,混合液在3 000 r/min条件下离心25 min,收集上清液,残渣用相同的方法重复提取3 次,将上清液合并收集,在40 ℃条件下用旋转蒸发仪真空浓缩,经浓缩后的提取液再经冷冻干燥,得到薏米游离多酚粗提物干粉,将干粉置于-20 ℃条件下保存。剩余薏米残渣采用NaOH消化法,首先将残渣与20 mL 2 mol/L的NaOH溶液混匀,振荡1 h进行消化处理,加入浓盐酸调节pH值为2,按料液比1∶3(m/V)加入乙酸乙酯,于冷冻离心机3 500 r/min提取结合多酚,重复5 次,于旋转蒸发仪旋干,溶于去离子水,用冷冻干燥机冻干样品至粉末状,保存于-20 ℃条件下,即薏米结合多酚粗品。
1.3.2 薏米多酚的分离与纯化
参考Wang Lifeng等[16]的方法,将1.3.1节所得游离粗提物及结合粗提物粉末分别溶于10 mL甲醇,置于葡聚糖凝胶LH-20进行分离(1.5 cm×76 cm,40~120 µm),流速40 mL/h,由成分收集器收集,吸收波长调节至280 nm。
1.3.3 总酚含量的测定
所有组分的总酚含量测定选用Singleton等[17]所描述的Folin-Ciocalteu比色法,并稍作改动。经葡聚糖凝胶分离后的所有组分冻干成粉末后,取一定量溶于去离子水中,并使其可读取范围在标准曲线0.0~600.0 µg GAE/mL范围内。之后与Folin-Ciocalteu试剂反应,一定时间后使用碳酸钠终止反应。室温条件下放置90 min后,用酶标仪于760 nm波长处测定吸光度。总酚含量以每100 g干质量等同于没食子酸的毫克数(mg GAE/100 g)表示。
1.3.4 氧自由基吸收能力的测定
所有组分的氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)值参照Huang Dejian[18]、Zhang Mingwei[19]等的方法并稍作改动。具体操作方法如下:经葡聚糖凝胶分离后的所有组分冻干成粉末后,溶于pH 7.4浓度为75 mmol/L的磷酸缓冲溶液进行稀释,于96 孔板各孔中加入20 µL样品或者Trolox标准溶液(0.00、6.25、12.50、25.00、50.00 µg/mL)后将96 孔板置于酶标仪中37 ℃温育20 min,之后每孔加入200 µL Fluorescein荧光指示剂(0.96 µmol/mL),再次将96 孔板置于酶标仪中37 ℃温育20 min,然后每孔注入20 µL 2,2’-偶氮二(2-脒基丙烷)二盐酸盐(2,2’-azobis-2-amidinopropane-dihydrochloride,AAPH),设定酶标仪在485 nm波长处激发,于520 nm波长处测定,每1 min记录读数,共记录100 min。曲线下面积由SoftMax Pro(Version 5.4.1)计算而得。各组分ORAC值以每100 g干质量薏米粉末等同于Trolox的毫克数表示;纯化物ORAC值以每克干质量纯化物等同于Trolox的毫克数表示。
1.3.5 清除过氧化自由基能力测定
所有组分的清除过氧化自由基能力(peroxyl radical scavenging capacity,PSC)测定参照Adom等[20]的方法并稍作改动。经葡聚糖凝胶分离后的所有组分冻干成粉末后,溶于pH 7.4浓度为75 mmol/L的磷酸缓冲溶液。将2.5 mg二氯二氢荧光素二乙酸酯(2’,7’-dichlorofluorescin diacetate,DCFH-DA)溶于2 mL甲醇(A溶液),取400 µL A溶液溶于3.74 mL甲醇(B溶液),取11 µL B溶液混合于989 µL的KOH,避光反应5 min后,用75 mmol/L磷酸缓冲溶液定容到8 mL,得到DCFH溶液。取96 孔板,对照区域加入250 µL蒸馏水,样品区域加入100 µL样品以及100 µL DCFH溶液和50 µL的200 mmol/L的AAPH,标准品区域加入不同质量浓度Trolox标准溶液(3.125、6.250、12.500、25.000、50.000 µg/mL)以及100 µL DCFH溶液和50 µL的200 mmol/L的AAPH,反应在37 ℃进行,设定酶标仪在485 nm波长处激发,于538 nm波长处测定,每1 min记录读数,共记录40 min。PSC根据式(1)计算。
式中:各组分PSC值以每100 g干质量薏米粉末等同于Trolox的毫克数表示;纯化物PSC值以每克纯化物干质量等同于Trolox的毫克数表示;As为样品或者标准品的曲线下面积;Ac为空白对照的曲线下面积;本实验中的半最大效应浓度(concentration for 50% of maximal effect,EC50)由PSC的计算得出,即每个组分和纯品引起50%抑制DCFH的氧化作用所需要的剂量。
1.3.6 细胞培养
细胞生长培养基由DMEM培养基,混合10%胎牛血清(fetal bovine serum,FBS)、50 U/mL青霉素和50 µg/mL链霉素构成,细胞放置在37 ℃、5% CO2环境下培养。本实验使用细胞代数在22~32 代之间。
1.3.7 细胞毒性实验
细胞毒性分析采用噻唑蓝(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT)法[21],具体操作步骤为:将HepG2细胞以6×104个/孔的数量接种到96 孔板中,并于CO2培养箱中培养24 h。把粗提物、各组分和纯化物用培养液溶解,并将96 孔板中的培养液弃掉,换成100 µL含有不同质量浓度样品的培养液继续孵育,不含样品的培养液视为对照组。24 h后,吸出培养液,每孔加入20 µL的MTT溶液(5 mg/mL),继续在37 ℃条件下培养4 h。之后吸出MTT溶液,每孔加入150 µL的二甲基亚砜(dimethyl sulphoxide,DMSO)溶液,将孔板置于恒温振荡箱中振荡反应30 min。利用多功能酶标仪测定吸光度,最大吸收波长设置在570 nm。当细胞的死亡率与对照组相比超过10%的时候就认为该质量浓度下的样品具有毒性[18]。
1.3.8 细胞抗氧化活性测定
细胞抗氧化活性(cellular antioxidant activity,CAA)测定采用Wolfe等[22]建立的方法并根据特定的样品做了细微的改动,具体操作步骤如下:抗氧化处理液的配制:将DMEM溶液与2 mmol/L L-谷氨酰胺和10 mmol/L 4-羟乙基哌嗪乙磺酸4-羟乙基哌嗪乙磺(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)溶液混合。氧化处理液的配制:将Hank’s平衡盐溶液溶液与10 mmol/L的HEPES溶液混合。DCFH-DA工作液的配制:先用甲醇配制20 mmol/L的DCFH-DA储存液,将50 µL DCFH-DA储存液与20 mL抗氧化处理液混合均匀,置于-20 ℃条件下备用。200 mmol/L AAPH储存液的配制:将0.542 3 g AAPH粉末溶于10 mL去离子水中并置于-40 ℃条件下备用。600 µmol/L AAPH工作液的配制:将21 µL AAPH储存液添加到7 mL氧化处理液中混匀备用。
将HepG2细胞以6×104个/孔的数量种到96 孔板中,由于孔板最外层的孔的数值变化大,所以最外层不培养细胞。将粗提物、各组分和纯化物溶在DMEM培养液中。细胞在培养大约24 h后,将培养液弃掉,每孔用100 µL的磷酸盐缓冲液清洗一次,并加入100 µL含有25 µmol/L DCFH-DA的样品液处理1 h。之后弃掉样品液,加入100 µL 600 µmol/L的AAPH工作液。96 孔板立即置于多功能酶标仪上读取荧光值,温度设置在37 ℃。发射波长设置在538 nm,激发波长设置在485 nm,每5 min测定1 次,总共测定1 h。每个孔板都要设置空白组和对照组,对照组不添加样品,只添加DCFH-DA工作液和AAPH工作液;而空白组只添加DCFH-DA工作液。
采用曲线下峰面积来计算CAA,公式如式(2)所示。
式中:∫As为样品组的峰面积;∫Ac为对照组的峰面积。
槲皮素在本实验中作为标准品使用,样品的CAA定义为:各组分CAA值以每100 g干质量薏米粉末等同于槲皮素的物质的量表示;纯化物CAA值以每克纯化物干质量等同于槲皮素的物质的量表示。
1.3.9 半制备RP-HPLC的分离及HPLC-DAD分析薏米多酚纯化物
组分2、3及组分5采用半制备反相-高效液相色谱(reversed phase high-performance liquid chromatography,RP-HPLC)进一步分离纯化,该半制备RP-HPLC连接有二极管阵列检测器(diode array detector,DAD)、四元泵、柱温箱、自动进样器和样品收集系统。制备柱采用Waters C18柱,柱温为30 ℃。其中组分2、组分3的条件为:流动相A为水溶液,B为乙腈,梯度洗脱的方法为:0~15 min,0%~17% B、100%~83% A;15~50 min,17%~28% B、83%~72% A;50~65 min,28%~80% B、72%~20% A;65~75 min,80%~0% B、20%~100% A;75~80 min,100% A;流动相的流速为3.5 mL/min。样品溶于甲醇,进样前需过0.22 µm滤膜,质量浓度为10 mg/mL,单次进样100 µL,最佳吸收波长设置为280 nm。分离所得薏米多酚纯化物于HPLC-DAD进行分析并与所购标准品进行比较。分析柱使用Acclaim 120型C18柱,柱温为25 ℃。流动相A为0.1%的乙酸-水溶液,B相为乙腈溶液。优化后的梯度洗脱程序为:0~15 min,0%~17% B、100%~83% A; 15~50 min,17%~28% B、83%~72% A;50~65 min,28%~80% B、72%~20% A;65~75 min,80%~0% B、20%~100% A;75~80 min,100% A。进样量为10 µL,流速设置为0.5 mL/min。紫外吸收波长设置为280 nm,样品溶于甲醇,进样前需过0.22 µm滤膜。
1.4 统计分析
每个实验至少重复3 次,实验结果以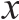 ±s表示,采用SPSSversion 17.0软件进行显著性分析。
±s表示,采用SPSSversion 17.0软件进行显著性分析。
2.1 多酚粗提物的分离
薏米经研磨脱脂后,提取所需样品,100 g薏米粉末可得1.5 g游离型多酚粗提物以及0.2 g结合型多酚粗提物。如图1所示,游离型多酚经葡聚糖LH-20凝胶分离后可得3 个不同的组分,分别为组分1、组分2及组分3,而结合型多酚经葡聚糖LH-20凝胶分离后也可得3 个不同的组分,分别为组分4、组分5及组分6。
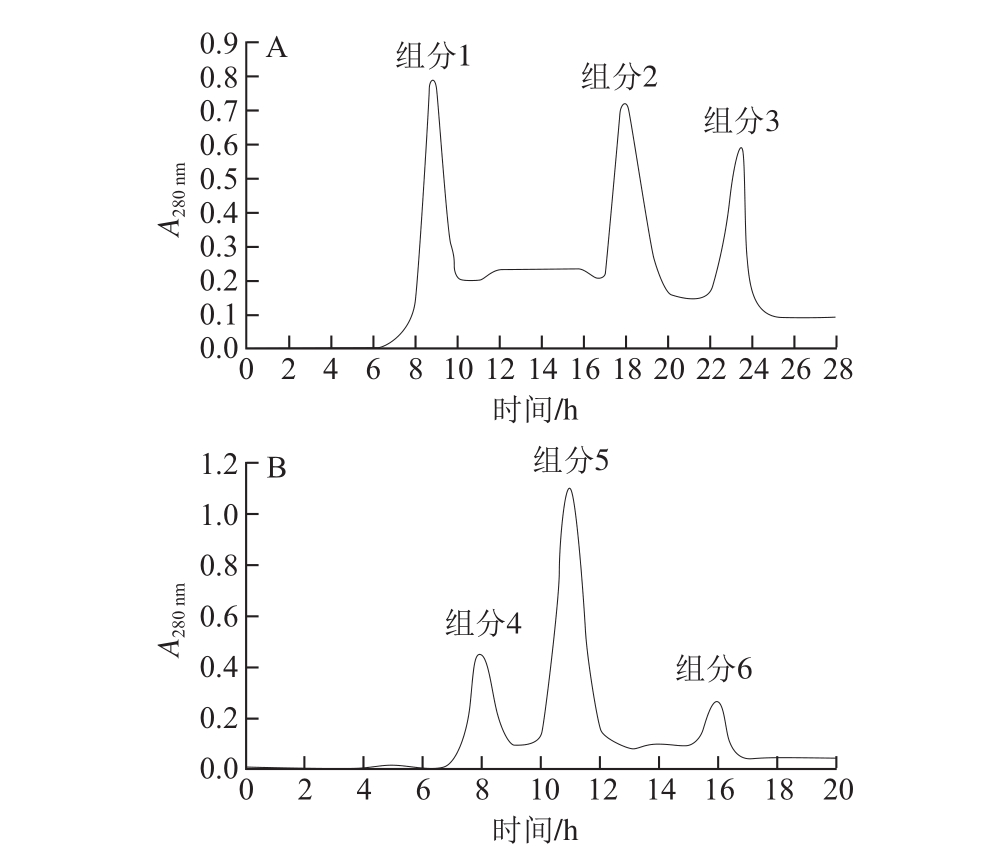
图1 葡聚糖LH-20凝胶分离薏米游离型多酚粗提物(A)及结合型多酚粗提物(B)
Fig. 1 Sephadex LH-20 chromatogram of free polyphenols (A) and bound polyphenols (B) in adlay
2.2 薏米中的总酚含量分析
Adom等[13,20]的研究指出,在全谷物化合物中,除了游离型的多酚外,还含有较多的结合型多酚。而总酚含量与抗氧化活性之间具有显著正相关关系。因而总酚含量也能间接反映各组分的抗氧化活性[23-24]。因此除了薏米中的游离型酚类物质发挥抗氧化作用,还应当将结合型酚类化合物考虑在内。薏米中酚类化合物经葡聚糖凝胶分离后的6 个组分的总酚含量分别见表1,组分2的总酚含量最高,为(30.56±2.25) mg GAE/100 g薏米粉末,组分5和组分3的总酚含量次之,分别为(25.18±1.10) mg GAE/100 g及(17.40±2.76)mg GAE/100 g,而其余的组分1、4、6中的多酚含量均较低,也就是说,薏米中多酚类物质大部分存在于组分2、3、5中。组分1、2、3的总酚含量之和与组分4、5、6的总酚含量之和相差不大,间接证明结合型酚类物质多酚含量是计算薏米中总酚含量不可忽视的一部分,该结果与Adom等[13,20]的结果一致。
表1 薏米多酚各组分ORAC、PSC、 CAA、EC50和细胞毒性(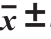 s,n=3)
s,n=3)
Table 1 ORAC, PSC, CAA, EC50, cellular antioxidant activity and cytotoxicity of different fractions from adlay (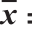 ±s,n= 3)
±s,n= 3)

注:同列肩标小写字母不同表示差异显著(P<0.05)。表4同。
2.3 薏米总酚抗氧化活性分析
ORAC法是目前评价抗氧化活性最为简单、灵敏的方法[25]。它具有生物相关性强、可以通过改变自由基和反应体系的溶剂测定脂溶性和水溶性物质的抗氧化活性、方法的专一性强等优点[26]。由表1可知,经过葡聚糖凝胶分离后的各组分中,组分2的ORAC最高,为(194.70±10.79) mg TE/100 g(以干质量计,下同),组分5的抗氧化活性次之,为(181.53±5.32)mg TE/100 g,且两者之间差异性不显著(P>0.05)。组分3也表现出较高的抗氧化活性,其ORAC为(122.06±17.95)mg TE/100 g。组分1、4、6的的抗氧化活性则远小于组分2、3、5,其值分别为(17.80±2.81)、(0.34±0.06)、(0.99±0.09)mg TE/100 g。ORAC与总酚含量表现出极显著正相关(P<0.01),相关系数为0.993(表2)。所以无论在游离型多酚粗提物中还是在结合型多酚粗提物中,总酚含量最高的组分2表现出了最高ORAC,总酚含量最低的结合型粗提物组分4表现出了最低的ORAC,这与前人研究相符合[23]。
表2 各指标相关性分析
Table 2 Correlation analysis among antioxidant parameters

注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
2.4 PSC和EC50的确定
由表1可知,组分4的EC50最高,为(190.54±11.29) µg/mL,组分2最低,为(24.25±2.12)µg/mL,其中,组分2、3、5的EC50没有显著性差异(P>0.05),即抗氧化能力相近。PSC与EC50值呈显著负相关(P<0.05),由表2可见,其相关系数为-0.900。从表1的PSC数据可知,粗品中萃取的各组分中,组分2的PSC最强(77.64±7.12)mg TE/100 g,其次为组分5(64.78±5.88) mg TE/100 g,组分3(54.53±1.90)mg TE/100 g。其余组分并没有展现较强的PSC。其结果与ORAC实验结果相似,从表2可知,ORAC与PSC的相关系数为0.990,极显著相关(P<0.01)。从以上两个抗氧化实验中发现,组分2、3、5的抗氧化能力较强,因此进一步进行CAA实验。
2.5 薏米总酚CAA结果
化学抗氧化方法被广泛地用于测定纯品化合物与植物提取物的抗氧化能上,然而这种方法不能准确地反映体内抗氧化的具体情况。而以动物模型和人体实验为基础的体内抗氧化实验虽然方法先进,但花费高、耗时长,且不适用于测定最基本的抗氧化性能[27]。CAA法是以细胞的吸收、传质和代谢为基础建立的一种细胞内抗氧化方法,这种方法能克服化学抗氧化方法的不足,更具有生物相关性,同时比动物和人体实验花费更低、耗时更短、操作更为方便[28]。在CAA实验之前进行了MTT实验,由表1可知,各组分细胞毒性均超过0.1 mg/mL,本实验所用各组分质量浓度均在0.1 mg/mL内。由表1可知,经过分离后的组分中,组分2、组分3以及组分5的CAA比较突出,其值分别为(5.85±1.22)、(4.57±1.34)、(3.38±0.93)µmol QE/100 g薏米粉末。这一结果与总酚含量呈现显著正相关(P<0.05),其相关性系数达0.858。
从上述3 个抗氧化实验可以得知,各组分的总酚含量与抗氧化呈现显著正相关(P<0.05,P<0.01),且组分2、3、5中含有薏米中存在的绝大部分的多酚化合物。
2.6 半制备RP-HPLC分离纯化及HPLC分析薏米多酚
半制备RP-HPLC技术是分离纯化天然产物有效成分的一种必备方法,这种方法分离效果好、所得组分纯度高,但也有着分离样品少、成本高的缺点。本研究将半制备液相法作为最终的纯化方法来制备分离上述3 个组分,以期获得薏米多酚单体化合物。从图2可知,组分2与组分5中多酚种类较为单一,皆可分离出一种主要的多酚类物质,组分3中则可分离出4 种多酚类物质。游离型多酚中,4 种纯化物已被鉴定,分别为N1,N5-双(对香豆酰)亚精胺、对香豆酸、阿魏酸及芦丁[3]。为此,将所纯化的6 种多酚物质与标准品出峰时间进行对比。如图3所示,化合物1与2出峰时间皆为39.1 min,与标准品N1,N5-双(对香豆酰)亚精胺出峰时间一致。化合物3出峰时间为50.8 min,该出峰时间则对应标准品对香豆酸。化合物4与化合物6(皆为棕黄色粉末)出峰时间皆为55.5 min,与阿魏酸出峰时间一致,说明薏米游离型多酚与结合型多酚均含有阿魏酸。化合物5的出峰时间为60.5 min,对应芦丁。半制备液相中获取该4 种多酚纯化物其得率见表3,由表3可以看出,在4 种薏米多酚纯化物中,N1,N5-双(对香豆酰)亚精胺与阿魏酸得率最高,薏米游离型多酚主要为N1,N5-双(对香豆酰)亚精胺,而薏米结合型多酚主要为阿魏酸。
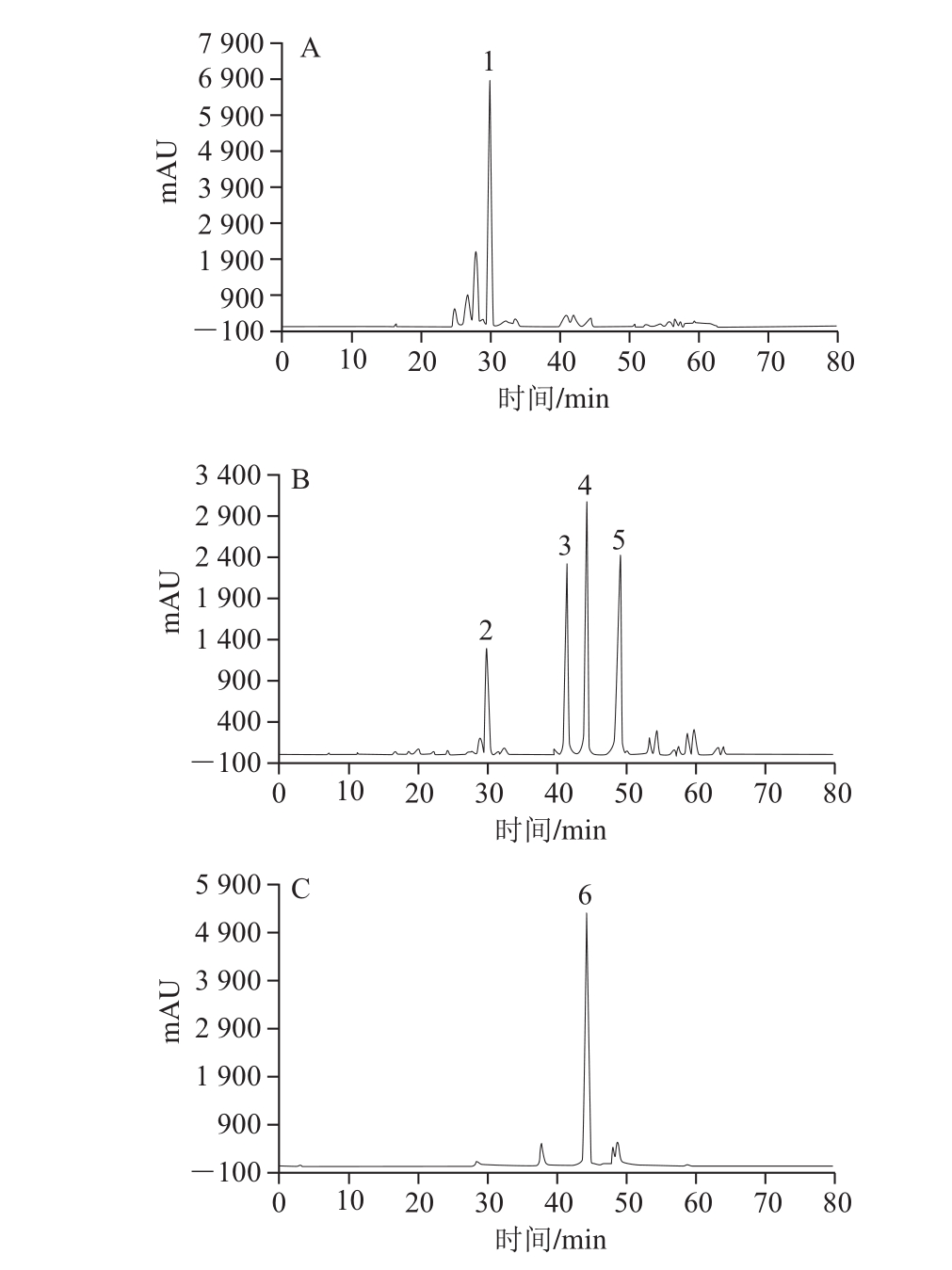
图2 半制备RP-HPLC分离组分2(A)、组分3(B)、组分5(C)
Fig. 2 Semi-preparative HPLC chromatogram of fraction Ⅱ (A),Ⅲ (B) and Ⅴ (C)
表3 薏米多酚纯化物占粗提物的得率( ±s,n=3)
±s,n=3)
Table 3 Yields of phenolic compounds from crude extract ±s,n= 3)
±s,n= 3)
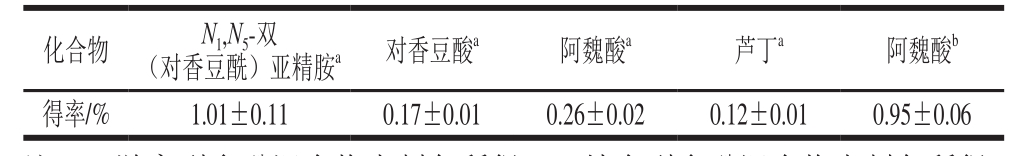
注:a.游离型多酚混合物半制备所得;b.结合型多酚混合物半制备所得。
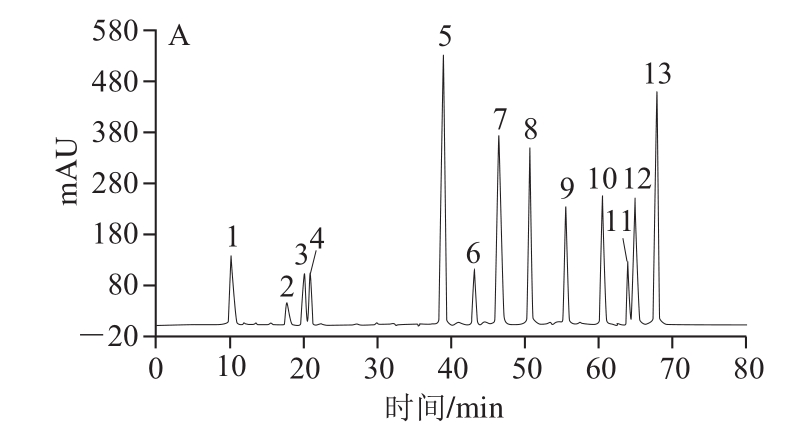
图3 混合标准品溶液(A)及6 个纯化物(B~G)的高效液相色谱图
Fig. 3 HPLC chromatograms of mixed phenol standard compounds (A) and six purified compounds (B–G)
2.7 薏米多酚纯化物的抗氧化活性分析
表4 薏米多酚纯化物ORAC、PSC、CAA、EC50和细胞毒性( s,n=3)
s,n=3)
Table 4 ORAC, PSC, cytotoxicity concentrations, EC50, cellular antioxidant activity and CAA of different purified phenolic compounds from adlay ( ±s,n= 3)
±s,n= 3)
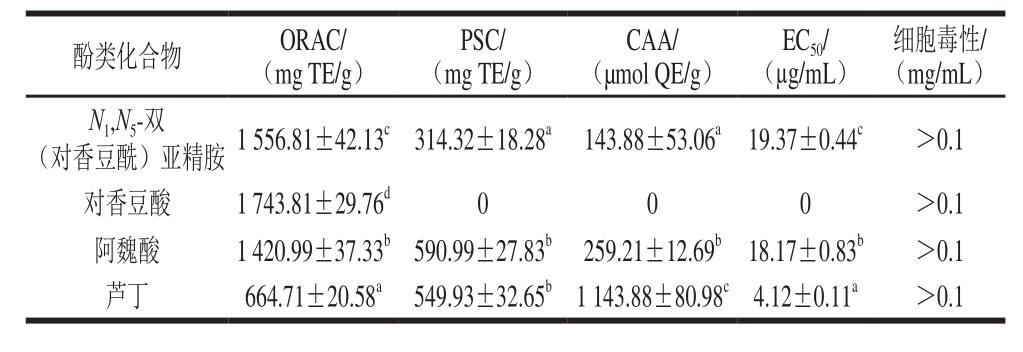
表4显示了4 种薏米多酚纯化物的抗氧化能力。该4 种纯化物ORAC最高的化合物是对香豆酸,为(1 743.81±29.76) mg TE/g,其他依次为N1,N5-双(对香豆酰)亚精胺(1 556.81±42.13)mg TE/g、阿魏酸(1 420.99±37.33)mg TE/g和芦丁(664.71±20.58)mg TE/g。Eom等[29]的研究结果表明,酚类化合物上的—OCH3能增强其抗氧化活性,然而在本研究中,对香豆酸的ORAC高于阿魏酸,阿魏酸比对香豆酸多一个—OCH3取代基,这可能是由于使用的抗氧化测定方法不同所致。而本次研究结果与Zhao Mouming等[30]的研究结果一致。
薏米多酚纯化物的PSC具有显著性差异(P<0.05),PSC由强到弱顺序如下:阿魏酸>芦丁>N1,N5-双(对香豆酰)亚精胺,而对香豆酸PSC为0。此外,对4 种化合物的CAA进行了测定,其中芦丁具有最强的CAA,为(1 143.88±80.98) µmol QE/g,其他依次为阿魏酸(259.21±12.69) µmol QE/g和N1,N5-双(对香豆酰)亚精胺(143.88±53.06) µmol QE/g,与PSC分析相同,对香豆酸也没有显示出细胞抗氧化能力。
本实验首先分别提取薏米中游离型与结合型的酚类粗提物,两者多酚含量较为相近,说明薏米结合型多酚的含量是薏米总酚含量不可忽视的一部分。薏米总酚含量与抗氧化活性呈正相关,因此,结合型酚类化合物也是薏米发挥抗氧化作用的活性成分之一。本实验利用葡聚糖LH-20凝胶柱将薏米中游离型酚类化合物和结合型酚类化合物进行分离得到6 个不同的组分,选择其中抗氧化活性最佳的3个组分进行半制备后,得到4 种薏米多酚纯化物。薏米游离型多酚包括:N1,N5-双(对香豆酰)亚精胺、对香豆酸、阿魏酸及芦丁,且N1,N5-双(对香豆酰)亚精胺为主要成分。而所提取薏米结合型多酚粗提物杂质少并且所含多酚类物质单一,主要为阿魏酸。利用ORAC、PSC、CAA 3 个方法继续对该4 种纯化物质进行抗氧化活性测定后,证明了该4 种酚类化合物具有较强的抗氧化活性,确定为薏米多酚类物质发挥抗氧化作用的活性成分,本研究结果可为薏米多酚发挥抗氧化作用提供理论依据。
参考文献:
[1] 金黎明, 刘垠孜. 薏苡仁有效成分研究进展[J]. 安徽农业科学, 2011, 39(10): 5734; 5750. DOI:10.3969/j.issn.0517-6611.2011.10.024.
[2] 杜萌, 丁安伟, 陈彦. 薏苡仁化学成分及其防治肿瘤作用机制研究[J].吉林中医药, 2012, 32(2): 195-201. DOI:10.13463/j.cnki.jlzyy.2012.02.041.
[3] CHEN C, ZHANG Y Y, GAO Y L, et al. Indentification and antitumor activities of phenolic compounds isolated from defatted adlay (Coix lacryma-jobi L.var.ma-yuen-Staph) seed meal[J]. Journal of Functional Foods, 2016, 26: 394-405.
[4] 李红艳, 曹阳, 陶小军, 等. 薏苡仁水提取物的抗炎、镇痛、镇静作用研究[J]. 亚太传统医药, 2013, 9(12): 58-60.
[5] 陶小军, 闫宇辉, 徐志立, 等. 薏苡仁油抗炎消肿作用研究[J].辽宁中医药大学学报, 2015, 17(1): 45-46. DOI:10.13194/j.issn.1673-842x.2015.01.016.
[6] 褚娟红, 叶骞. 薏苡仁的药理及临床研究概况[J]. 辽宁中医药大学学报, 2008, 10(4): 159-160. DOI:10.13194/j.jlunivtcm.2008.04.161.chujh.089.
[7] 王立峰, 陈静宜, 谢慧慧, 等. 薏米多酚细胞抗氧化及HepG2细胞毒性和抗增殖作用[J]. 中国农业科学, 2013, 46(14): 2990-3002. DOI:10.3864/j.issn.0578-1752.2013.14.015.
[8] 王立峰, 何荣, 袁建, 等. 薏米中酚类提取物测定及抗氧化能力指数分析[J]. 食品科学, 2012, 33(1): 72-76.
[9] POUTANEN K. Past and future of cereal grains as food for health[J]. Trends in Food Science & Technology, 2012, 25: 58-62. DOI:10.1016/ j.tifs. 2012.02.003.
[10] 李建科, 李国秀, 赵艳红, 等. 石榴皮多酚组成分析及其抗氧化活性[J]. 中国农业科学, 2009, 42(11): 4035-4041. DOI:10.3864/ j.issn.0578-1752.2009.11.034.
[11] 路欣, 杨小兰. 啤酒花多酚提取物体内外抗氧化活性研究[J]. 食品科学, 2015, 36(1): 13-18. DOI:10.7506/spkx1002-6630-201501003.
[12] 古绍彬, 吴影, 董红敏, 等. 苹果多酚抗氧化作用及其清除自由基能力的研究[J]. 中国粮油学报, 2013, 28(4): 58-61; 128. DOI:10.3969/ j.issn.1003-0174.2013.04.012.
[13] ADOM K K, SORRELLS M E, LIU R H. Phytochemical profiles and antioxidant acitivity of wheat varities[J]. Journal of Agricultural and Food Chemistry, 2003, 51(26): 7825-7834.
[14] 王立峰, 鞠兴荣. 3 种薏米的多酚提取物清除过氧化氢自由基抗氧化能力评价[J]. 食品科学, 2012, 33(19): 39-44.
[15] WANG L F, CHEN J Y, XIE H H, et al. Phytochemical profiles and antioxidant activity of adlay varieties[J]. Journal of Agricultural and Food Chemistry, 2013, 61(21): 5103-5113.
[16] WANG Lifeng, CHEN Chao, SU Anxiang, et al. Structural characterization of phenolic compounds and antioxidant activity of the phenolic-rich fraction from defatted adlay (Coix lachryma-jobi L. var. ma-yuen Stapf) seed meal[J]. Food Chemistry, 2016, 196: 509-517.
[17] SINGLETON V L, ORTHOFER R, LAMUELA R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J]. Methods in Enzymology, 1999, 299: 152-178. DOI:10.1016/S0076-6879(99)99017-1.
[18] HUANG Dejian, OU Boxin, HAMPSCH-WOODILL M, et al. Highthroughput assay of oxygen radical absorbance capacity (ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format[J]. Journal of Agricultural and Food Chemistry, 2002, 50(16): 4437-4444. DOI:10.1021/jf0201529.
[19] ZHANG Mingwei, ZHANG Ruifeng, ZHANG Fangxuan, et al. Phenolic profiles and antioxidant activity of black rice bran of different commercially available varieties[J]. Journal of Agricultural and Food Chemistry, 2010, 58(13): 7580-7587. DOI:10.1021/jf1007665.
[20] ADOM K K, LIU R H. Rapid peroxyl radical scavenging capacity (PSC) assay for assessing both hydrophilic and lipophilic antioxidants[J]. Journal of Agricultural and Food Chemistry, 2005, 53(17): 6572-6580. DOI:10.1021/jf048318o.
[21] YU H, HUANG Q. Enhanced in vitro anti-cancer activity of curcumin encapsulated in hydrophobically modified starch[J]. Food Chemistry, 2010, 119(2): 669-674. DOI:10.1016/j.foodchem.2009.07.018.
[22] WOLFE K L, LIU R H. Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements[J]. Journal of Agricultural and Food Chemistry, 2007, 55(22): 8896-8907. DOI:10.1021/jf0715166.
[23] 徐金瑞, 张名位, 刘兴华, 等. 黑大豆种质抗氧化能力及其与总酚和花色苷含量的关系[J]. 中国农业科学, 2006, 39(8): 1545-1552. DOI:10.3321/j.issn:0578-1752.2006.08.005.
[24] 刘海英, 仇农学, 姚瑞祺, 等. 我国86 种药食两用植物的抗氧化活性及其与总酚的相关性分析[J]. 西北农林科技大学学报(自然科学版), 2009, 37(2): 173-180.
[25] THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition and Analysis, 2006, 19(6/7): 669-675. DOI:10.1016/j.jfca.2006.01.003.
[26] 王会, 郭立, 谢文磊. 抗氧化剂抗氧化活性测定方法(二)[J]. 食品与发酵工业, 2006, 32(4): 98-102.
[27] LIU R H, FINLEY J. Potential cell culture models for antioxidant research[J]. Journal of Agricultural and Food Chemistry, 2005, 53(10): 4311-4314. DOI:10.1021/jf058070i.
[28] BLASA M, ANGELINO D, GENNARI L, et al. The cellular antioxidant activity in red blood cells(CAA-RBC). A new approach to bioavailability and synergy of phytochemicals and botanical extracts[J]. Food Chemistry, 2011, 125(2): 685-691. DOI:10.1016/ j.foodchem.2010.09.065.
[29] EOM T K, SENEVIRATHNE M, KIM S K. Synthesis of phenolic acid conjugated chitooligosaccharides and evaluation of their antioxidant activity[J]. Environmental Toxicology & Pharmacology, 2012, 34(2): 519-527.
[30] ZHAO Mouming, ZHU Dashuai, SUN W D X, et al. In vitro and in vivo studies on adlay-derived seed extracts: phenolic profiles, antioxidant activities, serum uric acid suppression, and xanthine oxidase inhibitory effects[J]. Journal of Agricultural and Food Chemistry, 2014, 62(31): 7771-7778. DOI:10.1021/jf501952e.
Isolation and Purification of Polyphenols from Adlay and Their Antioxidant Activity
ZHANG Yiyi, XU Qian, CHEN Lin, YAO Yijun, JU Xingrong, WANG Lifeng*
(Jiangsu Key Laboratory for Grain and Oil Quality Control and Further Processing Technology, Jiangsu Collaborative Innovation Center for Modern Grain Circulation and Safety, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
Abstract:In this study, Sephadex LH-20 column chromatography was used to separate and purify six polyphenol fractions from adlay. The Folin-Ciocalteu method was used for the determination of the total phenolic content in each fraction. Three different antioxidant assays namely, oxygen radical absorbance capacity (ORAC), peroxyl radical scavenging capacity (PSC) and cellular antioxidant activity (CAA) were carried out to evaluate antioxidant capacity of six fractions. Among these, three fractions (Ⅱ, Ⅲ and V) with the strongest antioxidant activity were purified by semi-preparative HPLC to obtain four polyphenol compounds, whose antioxidant activity was investigated. The results indicated that polyphenols were mainly distributed in fraction Ⅱ, Ⅲand V, with total phenolic contents of (30.56 ± 2.25), (17.40 ± 2.76) and (25.18 ± 1.10) mg GAE/100 g md. It was also found that bound phenolic compounds accounted for more than one third of the total phenolics in adlay. The purified phenolics were identified as N1,N5-double (p-coumaroyl) spermine, p-coumaric acid, ferulic acid and rutin, with N1,N5-double (p-coumaroyl) spermine being the major free phenolic compound and ferulic acid being the major bound one, which also existed in a small quantity in the bound form. All these phenolics were the main active compounds responsible for the strong antioxidant activity of polyphenols from adlay.
Key words:adlay; polyphenols; isolation; antioxidant activity
DOI:10.7506/spkx1002-6630-201713005
收稿日期:2016-10-29
基金项目:国家自然科学基金面上项目(31571766);江苏省自然科学基金面上项目(BK20141485);江苏省高校自然科学重大项目(15KJA550002)
作者简介:张怡一(1993—),女,硕士研究生,主要从事食品安全与营养研究。E-mail:Zhangyiyi_happy@163.com
*通信作者:王立峰(1977—),男,教授,博士,主要从事活性蛋白肽及植物多酚的研究与开发。E-mail:wanglifeng_8@163.com
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)13-0026-08
引文格式:
张怡一, 徐茜, 陈琳, 等. 薏米中多酚化合物的分离纯化及抗氧化活性分析[J]. 食品科学, 2017, 38(13): 26-33.
DOI:10.7506/spkx1002-6630-201713005. http://www.spkx.net.cn
ZHANG Yiyi, XU Qian, CHEN Lin, et al. Isolation and purification of polyphenols from adlay and their antioxidant activity[J]. Food Science, 2017, 38(13): 26-33. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201713005. http://www.spkx.net.cn