冯炎雯,李 娜,徐纪璇,邬琰泽,韩剑众,刘玮琳*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
摘 要:建立体外模拟婴儿胃肠道消化体系(成人为对照),研究脂质体在胃部的氧化应激效应和在小肠环境的脂解动力学。结果表明:脂质体消化后平均粒径明显减小、Zeta电位负电性增加;脂质体经胃部消化磷脂膜氧化程度(硫代巴比妥酸值)明显提高;在小肠消化过程中不断释放游离脂肪酸,且婴儿胃肠道环境水解率(38%)明显低于成人(80%),释放过程符合伪一级方程;傅里叶变换红外光谱研究发现,磷脂特征官能团(C=O、P=O、—CH2)峰值发生改变,脂质体在婴儿胃肠道环境膜结构破坏程度低于成人。研究结果为脂质体运载营养素应用于婴儿配方食品提供了理论指导。
关键词:脂质体;体外消化;婴儿;膜结构;稳定性
脂质体是一种人工合成的、兼溶于水相和油相的脂质双分子层囊泡,因具有良好的包封、运载、靶向及控释等特性,被广泛应用于基因遗传、癌症治疗和化妆品等领域[1]。近年,通过包裹营养物质和功能因子从而达到克服异味、提高溶解性和吸收利用率等目的,脂质体技术已逐渐在食品行业崭露头角。Wechtersbach等[2]发现脂质体的包裹可大大降低VC的氧化速率;Toniazzo等[3]应用脂质体包埋技术使β-胡萝卜素的保存期达到95 d,其可代替部分人造色素添加到酸奶中;Tan Chen等[4]研究了用壳聚糖脂质体包埋类胡萝卜素,并将其应用到功能性食品中的可能性。Gibis等[5-6]用脂质体对木槿花精华、葡萄籽等物质进行包埋,其被认为是一种高效的负载系统。Cui Haiying[7]等用脂质体包埋丁香油,并将其应用于豆腐中,该体系对金黄色葡萄球菌具有高效抑菌作用。
然而,脂质体的易氧化、水解等因素影响其稳定性,严重制约脂质体的广泛应用。脂质的氧化降解产物是某些心血管疾病如动脉粥样硬化的关键诱因,而且脂质体在小肠中的水解作用易使被包埋的营养素释放,降低了其生物利用率。胃肠道是脂质体摄入体内后发生氧化、降解最明显的部位。胃内低酸环境和溶解氧是促进脂质体氧化的主要因素[8];另外,前期研究亦表明小肠中的胰酶易导致脂质体水解,胆酸盐亦可用作乳化剂增加脂质的分散性,增加酶与脂质的接触面积,从而加快脂质体降解[9]。然而,当前对食品级脂质体在模拟胃肠道消化的研究较少,更鲜有针对特殊人群如婴儿环境的报道。
婴儿食品的营养均衡调配一直是人们的关注焦点,而通过建立婴儿体外胃肠道模型探讨各类营养素的消化利用率是近几年的研究热点,如Moscovici等[10]比较了成人和婴儿体外消化中的美拉德反应,发现该反应可改变蛋白的消化行为和生物活性;Shani-Levi[11]研发了一种体外模型,监控pH值在成人和婴儿胃部环境中的动态变化,以此反映营养物质(β-胡萝卜素、乳铁蛋白和乳状液)的消化行为。前期研究了脂质体包裹营养素(乳铁蛋白、血清蛋白)在体外消化过程中的结构变化[12],但关注点是成人环境而未涉及婴儿体系。婴儿和成人消化环境有较大区别,主要是胃液pH值的差异以及消化酶及其质量浓度不同,婴儿体系pH值(pH 3.0)较成人体系(pH 1.5)偏高,且其胃蛋白酶量(0.8 mg/mL)仅为成人体系(3.2 mg/mL)的1/4[13]。因此,针对脂质体在婴儿消化环境中行为的研究具有非常重要的意义。
综上所述,本实验采用经典薄膜分散法制备脂质体并表征其物化性质(微观形貌、粒径、电位);以成人为对照,建立婴儿体外消化模型,以消化前后脂质体粒径电位的变化、硫代巴比妥酸值(thiobarbituric acid reactive substances,TBARS)和过氧化值(peroxide value,POV)研究脂质体在胃部消化过程中脂质的氧化程度;通过游离脂肪酸的释放和傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)的表征探讨脂质体在小肠消化的脂解特性和官能团结构变化,获得脂质体在婴儿体外消化的膜结构稳定性信息,为研究和开发脂质体相关运载体系应用于婴儿食品提供理论参考。
1.1 材料与试剂
大豆卵磷脂、胆固醇、吐温-80、VE、胃蛋白酶、胰酶、胆酸盐(均为分析纯) 美国Sigma公司;三氯乙酸、碳酸氢铵、硫氰酸铵、TBARS、四水合氯化亚铁、三氯化铁(均为分析纯) 上海阿拉丁试剂公司;二叔丁基对甲酚(分析纯) 国药(上海)集团化学试剂公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Titrando 907恒pH电位滴定仪 瑞士Metrohm公司;UV3600紫外分光光度仪 日本岛津公司;纳米级粒径电位仪 英国Malvern公司;JEM-2100透射电子显微镜 日本JEOL公司;ALPHA 2-4 LD Plus冷冻干燥机德国Christ公司;AntarisⅡ FT-IR仪 美国Thermo Fisher Scientific公司;RE52-98旋转蒸发仪 上海亚荣生化仪器厂;FE20K台式酸度计 上海Mettler-Toledo公司。
1.3 方法
1.3.1 脂质体的制备
参照Liu Weilin等[14]的研究,采用薄膜分散法制备脂质体:分别称取大豆磷脂、胆固醇、吐温-80、VE (6∶1∶1.8∶1.125∶0.12,m/m)溶于无水乙醇,在40 ℃恒温水浴锅中避光溶解。待完全溶解后,用旋转蒸发仪在避光、真空条件下除去乙醇,加入适量0.05 mol/L pH 7.4的磷酸盐缓冲液,在常压条件下将脂质体膜水化,形成淡黄色均匀悬浊液即为脂质体。
1.3.2 模拟胃肠液的制备
模拟胃液和肠液的配制方法参照Liu Weilin[9]、Dupont[15]等的报道。
模拟胃液(simulated gastric fluid,SGF):称取2 g氢氧化钠溶于约800 mL的去离子水中,通过滴加浓盐酸调节pH值,成人模拟胃液pH 1.5,婴儿模拟胃液pH 3.0,将溶液定容至1 L。成人和婴儿环境中胃蛋白酶质量浓度分别为3.2 mg/mL和0.8 mg/mL。
模拟肠液(simulated intestinal fluid,SIF):准确称取6.8 g磷酸氢二钾,用800 mL去离子水溶解,将pH值调节至7.4后定容至1 L。其中,成人组中胰酶和胆盐质量浓度分别为3.2、5.0 mg/mL;婴儿组则为0.32、1.20 mg/mL。胃酶和胰酶均在反应开始时加入。
1.3.3 脂质体物化性质的测定
新鲜制备的脂质体通过透射电子显微镜表征其微观形貌、粒径电位仪测量平均粒径和表面电位。透射电子显微镜表征:用蒸馏水将脂质体稀释至1 mg/mL,将样品滴加到铜网,而后用醋酸双氧铀溶液(2%)染色4 min,吸去多余的液体后,在室温条件下晾干,用透射电子显微镜表征其微观结构。粒径、电位测定:取1 mL脂质体用纯水稀释至10 mL,混匀后取样放入样品池中进行测定,测定条件为20 ℃,磷脂和分散介质的折射率的比值为1.120。每个样品至少平行测定3 次。
1.3.4 脂质体在体外模拟胃部消化的氧化应激
将脂质体和模拟胃液以1∶3的体积比混合,加入胃蛋白酶瞬间开始计时。根据Kristinova等[16]的方法,将混合液移入注射器内,在其中预留5 mL空气,注射器避光放置于37 ℃恒温摇床中,转速为95 r/min。每隔30 min取1 mL反应样品于试管中,滴加碳酸氢铵调节pH值至中性,进行灭酶处理,消化总时间为2.5 h。
1.3.4.1 TBARS值的测定
TBARS值的测定参照Kristinova等[16]的方法并适当修改。取205 μL上述反应物,加入0.3 mL 2%二叔丁基对甲酚乙醇溶液和10 mL TBARS/三氯乙酸储备液(15 g/100 mL三氯乙酸和0.375 g/100 mL TBARS,用0.25 mol/L HCl溶解),用紫外分光光度法测定其与脂质体的反应产物在532 nm波长处的吸光度,由公式(1)计算得到TBARS值,从而反映氧化应激指数。
式中:A为反应物吸光度;f为样品的稀释倍数(200);V为脂质体体积/mL;ε为吸光系数(156 000 L/(mol·cm));L为光路宽(1 cm);m为脂质总质量/kg。
1.3.4.2 POV的测定
POV的测定参照Waraho等[17]的方法并适当修改。取160 μL上述反应物,依次加入8 mL 96%乙醇、320 μL 4%二叔丁基对甲酚乙醇溶液、160 μL 0.4 mol/L乙醇化硫氰酸铵和160 μL 4.5 mmol/L FeSO4·7 H2O溶液(以2 mol/L盐酸为溶剂),静置10 min后于500 nm波长处测定吸光度。由公式(2)计算得到POV。
式中:At是反应物吸光度;A0为空白的吸光度;V为脂质体的体积/mL;S是标准曲线的斜率/μg;m是160 μL中磷脂的质量/g;55.845是铁离子的摩尔质量/(g/mol);1 000用于单位转换,2为校正因子。
1.3.5 脂质体在体外模拟小肠消化的膜结构变化
1.3.5.1 脂质体脂解动力学
将脂质体分别与模拟成人和婴儿小肠液按体积比1∶3混合,调节pH值为7.4,置于水浴锅中恒温至37 ℃。然后将混合液转移至恒pH值酸碱滴定仪,在加入胰酶的瞬间开始计时,通过滴加NaOH(0.05 mol/L)控制混合液在反应过程始终保持pH 7.4,消化反应时间为60 min,记录混合体系最终所消耗NaOH溶液的体积,表征脂质体的水解动力学。
其中,脂解标准曲线通过测量不同浓度梯度油酸标准品消耗NaOH的体积获得。具体操作为:分别称取油酸品溶于异丙醇-甲苯混合液(1∶1,V/V),得到浓度分别为1、2、4、8、16 μmol/L的油酸溶液35 mL,通过滴加0.05 mol/L的NaOH溶液至pH值为7.4,记录油酸各浓度条件下所消耗的碱液体积,再根据浓度和体积绘制标准曲线。
1.3.5.2 FT-IR法表征官能团结构变化
分别取消化前后脂质体样品于-80 ℃超低温冰箱预冻4 h,转移至冷冻干燥机冷冻干燥48 h,得到脂质体的粉末状样品,然后与1%溴化钾粉末混合、压片,用FT-IR仪扫描32 次,脂质体样品的光谱采集范围是400~4 000 cm-1。
2.1 脂质体消化前后的物化性质表征
2.1.1 消化前脂质体的透射电子显微镜图

图1 脂质体的透射电子显微镜图片
Fig. 1 Transmission electron microscopic photos of liposomes
由图1透射电子显微镜结果可知,脂质体形状规整,呈明显囊泡状,具有球形或椭球形结构,分布较均匀,颗粒间彼此分散、独立,且具有明显的中空结构,粒径约200~1 200 nm。通过纳米粒径电位仪测得制备的粗脂质体平均粒径为(901.5±53.3)nm,表面电位为-(13.3±1.2)mV,粒径大小与透射电子显微镜图结果基本相符。
2.1.2 脂质体在胃肠道消化后平均粒径和表面电位变化
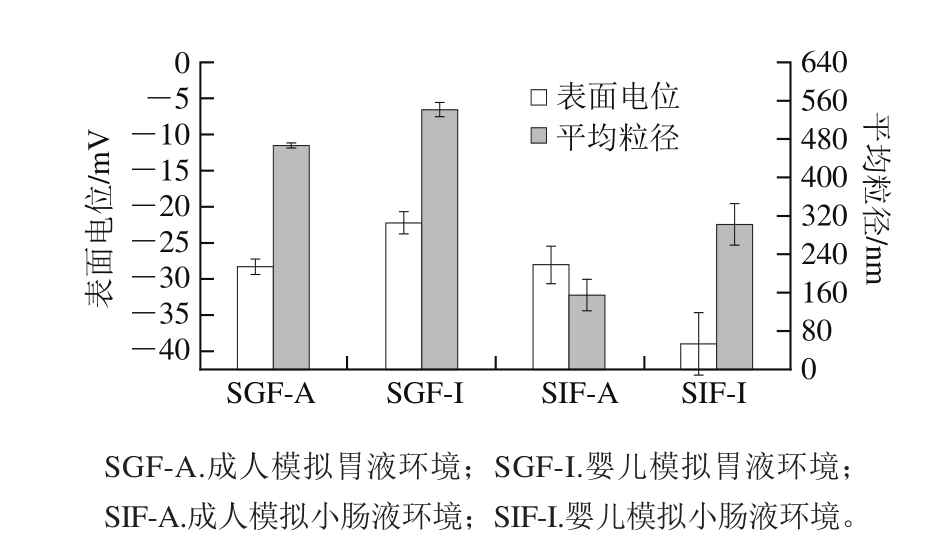
图2 脂质体经胃肠道消化后的平均粒径和表面电位
Fig. 2 Average diameter and zeta potential of liposomes after in vitro digestion
测定脂质体在体外胃肠道消化过程中的粒径和表面电位,发现经模拟成人和婴儿环境胃部消化后SGF-A、SGF-I脂质体平均粒径分别减小至(466.4±5.3)nm 和(541.4±14.8)nm,这与已报道的研究结果一致[9]。在低酸条件下,环境渗透压大于脂质体内部压力,压差使脂质体双层膜收缩,从而导致粒径减小。经胃部消化后脂质体表面负电荷量为:成人组(-28.3±1.0)mV、婴儿组(-22.2±1.5) mV。经模拟小肠消化后,成人组和婴儿组SIF-A、SIF-I的平均粒径分别降至(155.3±32.5)nm和(302.1±43.9)nm;表面负电荷分别为(-28.0±2.5)mV和(-39.0±4.3)mV。与胃部环境相比,脂质体在小肠环境中粒径降低,但不显著(P>0.05),其遭到的结构破坏程度略高。在小肠环境中脂质体粒径的急剧下降可能是由于胆酸盐的存在:胆酸盐具有表面活性剂的性质,会破坏脂质体的磷脂双分子层[18];此外,经过一段时间的消化,游离脂肪酸、胆酸盐和磷脂组成胶体结构也可能引起脂质体的平均粒径减小。在模拟小肠液中,经胆盐的作用磷脂的疏水基团移向水溶液表面,这可能导致小肠消化后脂质体表面负电荷升高,同时,脂质体壁材磷脂的水解也可能引起负电荷的增加[19]。
2.2 脂质体在胃部消化的氧化应激
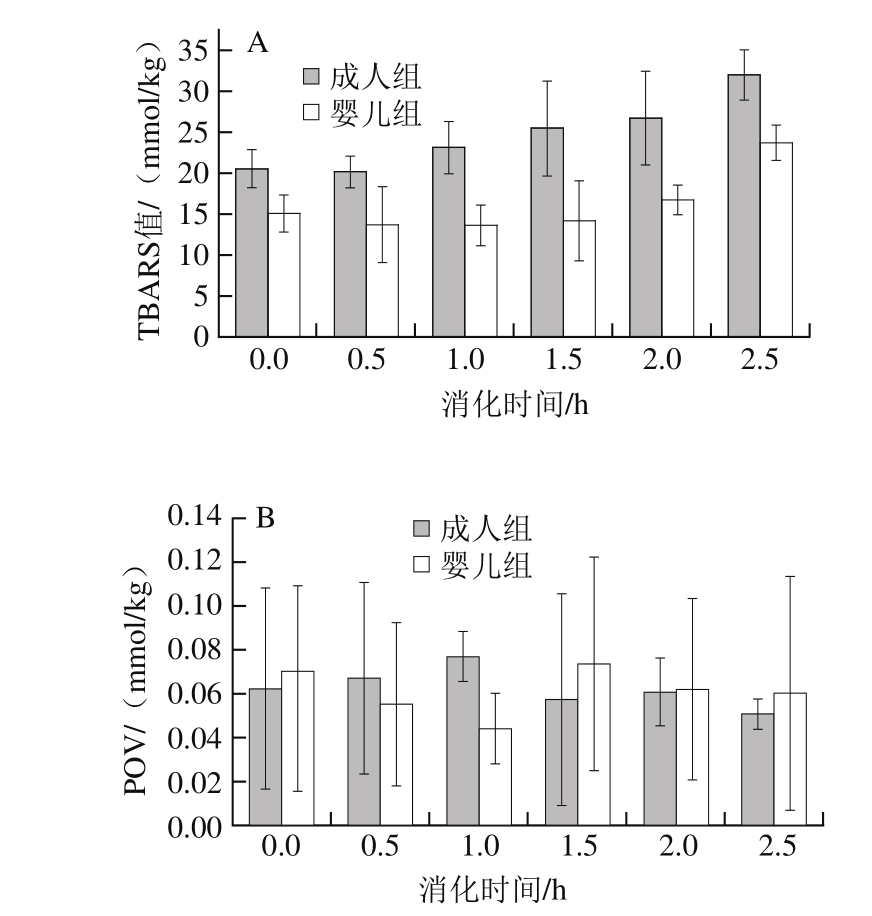
图3 消化过程中脂质体的TBARS值(A)和POV(B)
Fig. 3 TBARS (A) and POV (B) of liposomes during in vitro digestion
TBARS法广泛应用于脂肪氧化酸败程度的表征,其反应原理是脂肪氧化产物丙二醛(malondialdehyde,MDA)与TBA反应生成的MDA-TBA红色复合物,在532 nm波长处有紫外吸收[20],吸收度与复合物生成量成正比。脂肪在氧化过程中会产生一系列的化合物,而氢过氧化物是其最初的氧化产物。可由分光光度法测定氢过氧化物的产量:在酸性条件下,氢过氧化物可将Fe(Ⅱ)氧化成Fe(Ⅲ),通过测定Fe(Ⅲ)与硫氰酸盐反应生成的红色硫氰酸铁络合物在500 nm波长处的吸光度[21],可反映脂肪的氧化程度。由图3A可知,无论是成人对照组还是婴儿环境,随着消化时间的延长,TBARS值逐渐增加:婴儿组由最初的15.06(0 h)mmol/kg上升至反应终点的23.70 mmol/kg(2.5 h),成人组则从20.51 mmol/kg上升到32.02 mmol/kg,脂质体的TBARS值在成人环境整个消化过程中始终高于婴儿环境,且差异显著(P<0.01)。胃内的低酸环境和溶解氧以及金属离子等复杂的成分,易促进脂类发生氧化应激[15,22]。酸性条件下,Fe2+能够催化脂质产生自由基以促进氧化[23-24]。若环境中的pH值高,则TBARS值越低,说明高pH值能抑制脂质氧化,可能是较高的pH值环境抑制了金属离子的催化活性[25]。由于模拟婴儿胃液(pH3.0)的pH值比成人(pH1.5)高,因此模拟婴儿胃部消化过程中脂质体的氧化程度比成人环境低。由图3B可知,脂质体在婴儿和成人的模拟胃液中有不同程度的氧化,但产生氢过氧化物并不明显,其氧化程度甚至有下降趋势,且在成人和婴儿环境中反应物产量的差异并不显著(P>0.05)。在成人胃部消化过程中,POV在开始消化后的1.0 h达到最大,而后又缓慢下降,在婴儿体系中,脂质体的氧化趋势先升后降,可能是在消化后期注射器中氧气已被利用完全,或者是氧化产物在消化或测定过程中由于温度变化或遇光分解所致[26],氢过氧化物易受环境因素影响,分解生成小分子碳水化合物及其他物质,其生成速度低于分解速度,使POV降低[27]。
2.3 脂质体在小肠的脂解动力学
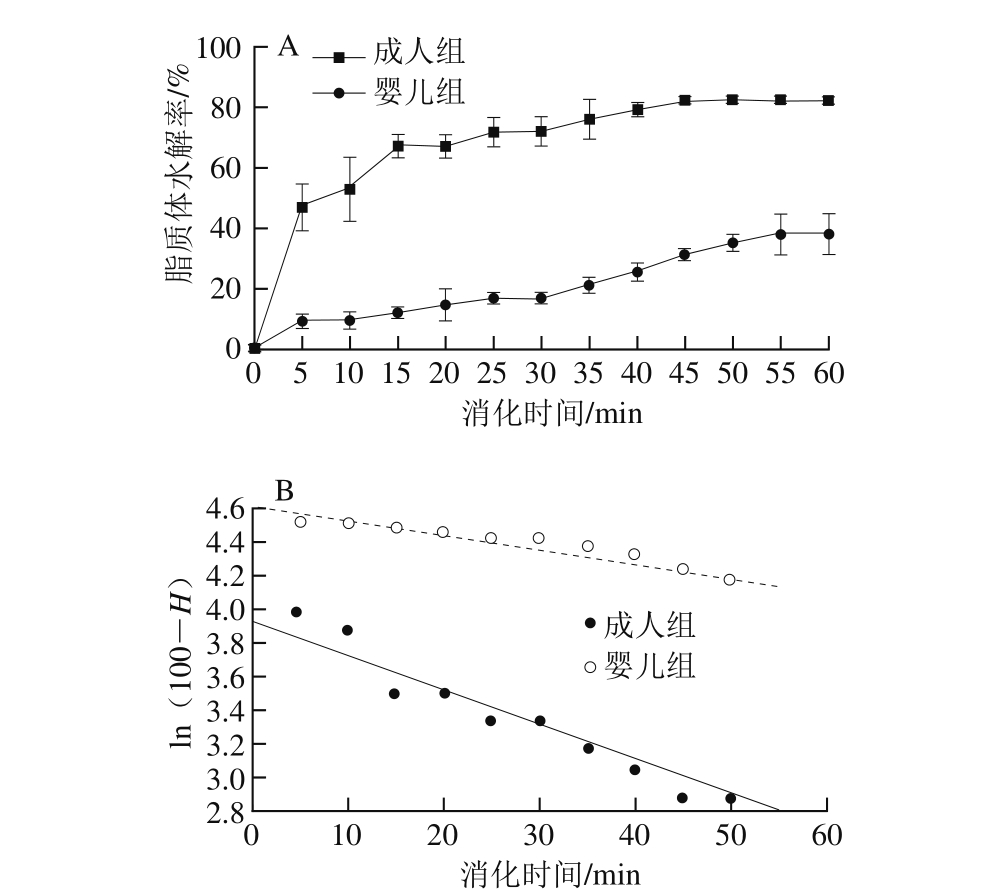
图4 在模拟小肠液中随着时间延长脂质体水解率(A)和脂质体脂解的一级动力学曲线(B)
Fig. 4 Percentage of lipid digested against time during incubation of liposomes in simulated intestinal fluid (A) and pseudo-first order kinetic plots for liposomes (B)
脂质体在胰蛋白酶和胆酸盐的作用下易发生水解,释放游离脂肪酸,降低环境总体pH值;采用恒pH值电位滴定仪滴加已知浓度的NaOH溶液以保持模拟肠液的中性pH值,通过记录消耗的NaOH溶液的量,间接反映脂质体在小肠环境中的脂解程度。由图4A可知,随着消化时间的延长,婴儿和成人环境中游离脂肪酸的释放量都逐渐增加,并且婴儿环境中脂质体的水解程度远远低于成人环境。在0~15 min,成人环境中游离脂肪酸的释放率明显高于15~45 min时间段的释放率,但在45 min后游离脂肪酸几乎停止释放,脂质体水解率达到最大,约80%。而婴儿模拟肠液中的游离脂肪酸释放量始终缓缓上升,1 h后总体水解率约为38%,到达消化终点时脂质体在成人与婴儿环境中的水解率差异显著(P<0.01)。小肠中的胰酶主要成分为脂肪酶、磷脂酶A2和胆固醇酶,均能水解脂质。其中,胰脂肪酶能够催化磷脂中脂肪酸的水解反应,释放出脂肪酸和一酰基溶血磷脂[28];磷脂酶A2能够催化磷脂的sn-2酯键的水解,产生甘油磷酸和溶血磷脂;胆固醇酯酶,又称胆盐刺激性脂酶,也能水解磷脂[29]。此外,小肠液中的胆酸盐成分也对脂解有一定的催化作用。因此,在小肠胰酶和胆盐的作用下,脂质体的膜结构严重遭到破坏,稳定性显著下降。由于婴儿环境中胰酶和胆盐的浓度均低于成人环境,使得游离脂肪酸的释放量亦小于成人。可用伪一级动力学模型描述脂质体的水解[30],如公式(3)所示:
式中:Lt为脂质随时间变化的水解量/%;Lo为脂质的初始量/%;k为伪第一阶模型的降解速率常数/s-1;R为通用气体常数(8.314 J/(mol·K));T为绝对温度/K。
根据公式(3)获得脂质体游离脂肪酸的释放动力学曲线,如图4B所示。婴儿组和成人组的曲线在0~55 min内均比较吻合伪一级动力学方程,相关系数(R2)可达到0.96。此外,婴儿体系中的k的绝对值(0.007 9 s-1)比成人环境值(0.024 2 s-1)小,即婴儿体系中脂解速率较成人低(表1)。
表1 脂质体脂解的一级动力学方程参数
Table 1 Pseudo-first order kinetic parameters for liposomes

2.4 脂质体在小肠部位消化前后官能团变化
由图5可知,脂质体磷脂膜官能团特征峰的波数和峰形在消化前后均有变化。其中,脂质体消化后亚甲基(—CH2)的吸收峰变弱,但婴儿组的峰形变化弱于成人组。经成人小肠消化后亚甲基的吸收波数发生位移,从2 925.5 cm-1移至2 927.4 cm-1,婴儿组的波数仍为2 925.5 cm-1。原样(消化前脂质体)磷脂酯键(C=O)的吸收波数为1 737.5 cm-1,消化后婴儿环境脂质体峰形改变较小,而成人环境峰形明显减弱。磷氧键(P=O)的吸收波数为1 241.9 cm-1,与消化样品对比,婴儿环境的变化微小,而经成人环境消化后峰形变宽,说明磷氧官能团受到较明显的破坏。综上,成人较婴儿条件下磷脂膜结构被破坏的程度更严重,这与上述脂解动力学结果一致。引起消化后脂质体官能团变化的原因除了提到的小肠胰酶外,还包括胆酸盐的作用。胆酸盐有乳化效果,能够降低脂质体的表面张力,使其乳化成小液滴,增强分散性,增加胰酶的作用面积,从而促进胰酶的水解作用[9]。
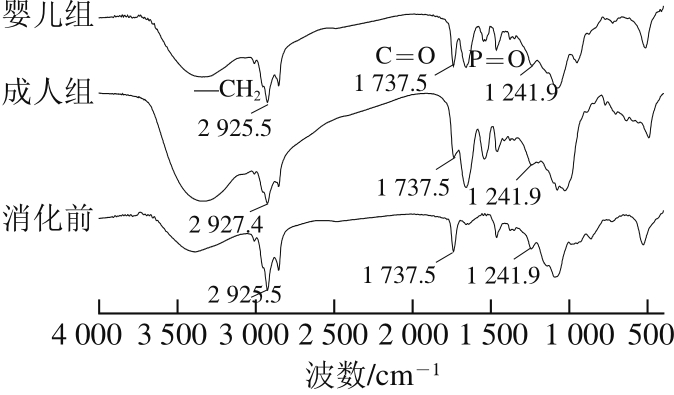
图5 脂质体在消化后的FT-IR红外光谱图
Fig. 5 FT-IR spectra of liposomes before and after digestion
本实验通过研究脂质体在胃肠道消化后粒径和电位的改变,及其壁材磷脂在胃部的氧化应激和在小肠的脂解动力学和官能团变化,发现到达消化终点时,脂质体的结构均遭到一定程度的破坏,在成人小肠环境中遭到的破坏程度大;随着消化时间的延长脂质体在胃部的氧化程度升高,且婴儿环境中的氧化程度小于成人;磷脂被小肠中的胰酶水解释放出游离脂肪酸的量随着消化时间的延长而增加,同时,FT-IR图结果表明磷脂的特征官能团亚甲基(—CH2)、磷脂酯键(C=O)、磷氧键(P=O)的吸收峰值和峰形均发生一定程度的改变,且婴儿中磷脂膜结构破坏程度明显低于成人环境。该研究可为脂质体应用于婴儿必须的功能因子靶向供应提供理论参考,也可为开发营养强化型婴儿配方食品提供技术参考。
参考文献:
[1] IRVINE D J. Drug delivery: one nanoparticle, one kill[J]. Nature Materials, 2011, 10(5): 342-343. DOI:10.1038/nmat3014.
[2] WECHTERSBACH L, ULRIH N P, CIGIĆ B. Liposomal stabilization of ascorbic acid in model systems and in food matrices[J]. LWT -Food Science and Technology, 2012, 45(1): 43-49. DOI:10.1016/ j.lwt.2011.07.025.
[3] TONIAZZO T, BERBEL I F, CHO S, et al. β-carotene-loaded liposome dispersions stabilized with xanthan and guar gums: physicochemical stability and feasibility of application in yogurt[J]. LWTFood Science and Technology, 2014, 59(2): 1265-1273. DOI:10.1016/ j.lwt.2014.05.021.
[4] TAN Chen, FENG Biao, ZHANG Xiaoming, et al. Biopolymer-coated liposomes by electrostatic adsorption of chitosan (chitosomes) as novel delivery systems for carotenoids[J]. Food Hydrocolloids, 2016, 52: 774-784. DOI:10.1016/j.foodhyd.2015.08.016.
[5] GIBIS M, ZEEB B, WEISS J. Formation, characterization, and stability of encapsulated hibiscus extract in multilayered liposomes[J]. Food Hydrocolloids, 2014, 38: 28-39. DOI:10.1016/ j.foodhyd.2013.11.014.
[6] GIBIS M, THELLMANN K, THONGKAEW C, et al. Interaction of polyphenols and multilayered liposomal-encapsulated grape seed extract with native and heat-treated proteins[J]. Food Hydrocolloids, 2014, 41: 119-131. DOI:10.1016/j.foodhyd.2014.03.024.
[7] CUI Haiying, ZHAO Chengting, LIN Lin. The specific antibacterial activity of liposome-encapsulated Clove oil and its application in tofu[J]. Food Control, 2015, 56: 128-134. DOI:10.1016/ j.foodcont.2015.03.026.
[8] KANNER J, LAPIDOT T. The stomach as a bioreactor: dietary lipid peroxidation in the gastric fluid and the effects of plant-derived antioxidants[J]. Free Radical Biology & Medicine, 2001, 31(11): 1388-1395. DOI:10.1016/S0891-5849(01)00718-3.
[9] LIU Weilin, YE Aiqian, LIU Chenmei, et al. Structure and integrity of liposomes prepared from milk- or soybean-derived phospholipids during in vitro digestion[J]. Food Research International, 2012, 48(2): 499-506. DOI:10.1016/j.foodres.2012.04.017.
[10] MOSCOVICI A M, JOUBRAN Y, BRIARD-BION V, et al. The impact of the Maillard reaction on the in vitro proteolytic breakdown of bovine lactoferrin in adults and infants[J]. Food & Function, 2014, 5(8): 1898-1908. DOI:10.1039/c4fo00248b.
[11] SHANI-LEVI C, LEVI-TAL S, LESMES U. Comparative performance of milk proteins and their emulsions under dynamic in vitro adult and infant gastric digestion[J]. Food Hydrocolloids, 2013, 32(2): 349-357. DOI:10.1016/j.foodhyd.2013.01.017.
[12] LIU Weilin, YE Aiqian, LIU Wei, et al. Stability during in vitro digestion of lactoferrin-loaded liposomes prepared from milk fat globule membrane-derived phospholipids[J]. Journal of Dairy Science, 2013, 96(4): 2061-2070. DOI:10.3168/jds.2012-6072.
[13] NGUYEN T T P, BHANDARI B, CICHERO J, et al. A comprehensive review on in vitro digestion of infant formula[J]. Food Research International, 2015, 76: 373-386. DOI:10.1016/j.foodres.2015.07.016. [14] LIU Weilin, YE Aiqian, LIU Wei, et al. Behaviour of liposomes loaded with bovine serum albumin during in vitro digestion[J]. Food Chemistry, 2015, 175: 16-24. DOI:10.1016/j.foodchem.2014.11.108.
[15] DUPONT D, MANDALARI G, MOLLE D, et al. Comparative resistance of food proteins to adult and infant in vitro digestion models[J]. Molecular Nutrition & Food Research, 2009, 54(6): 767-780. DOI:10.1002/mnfr.200900142.
[16] KRISTINOVA V, STORRØ I, RUSTAD T. Influence of human gastric juice on oxidation of marine lipids in vitro study[J]. Food Chemistry, 2013, 141(4): 3859-3871. DOI:10.1016/j.foodchem.2013.06.011.
[17] WARAHO T, McCLEMENTS D J, DECHER E A. Impact of free fatty acid concentration and structure on lipid oxidation in oil-in-water emulsions[J]. Food Chemistry, 2011, 129(3): 854-859. DOI:10.1016/ j.foodchem.2011.05.034.
[18] O’CONNOR C J, WALLACE R G, IWAMOTO K, et al. Bile salt damage of egg phosphatidylcholine liposomes[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1985, 817(1): 95-102. DOI:10.1016/0005-2736(85)90072-0.
[19] MAKINO K, YAMADA T, KIMURA M, et al. Temperature- and ionic strength-induced conformational changes in the lipid head group region of liposomes as suggested by zeta potential data[J]. Biophysical Chemistry, 1991, 41(2): 175-183. DOI:10.1016/0301-4622(91)80017-L.
[20] 赵淑娥. 硫代巴比妥酸法(TBA模型)预测鱼糜制品保藏货架期研究[J]. 江西食品工业, 2012(2): 26-27. DOI:10.3969/ j.issn.1674-2435.2012.02.009.
[21] 余辉, 陈洁. 可见分光光度法测定乳状液过氧化值的研究[J]. 食品科学, 2007, 28(11): 401-404. DOI:10.3321/j.issn:1002-6630.2007.11.092.
[22] ZHANG Xin, XIONG Youling L., CHEN Jie, et al. Synergistic inhibition of lipid oxidation by pea protein hydrolysate coupled with licorice extract in a liposomal model system[J]. Journal of Agricultural and Food Chemistry, 2013, 61(35): 8452-8461. DOI:10.1021/ jf402256k.
[23] 刘玲, 孟令洁, 孙克杰, 等. 提高大豆油水乳状液氧化稳定性的研究[J]. 食品科学, 2005, 26(4): 187-190. DOI:10.3321/ j.issn:1002-6630.2005.04.043.
[24] 张勇, 沈恂. 铝离子对二价铁离子启动的卵磷脂脂质体脂质过氧化的影响[J]. 生物物理学报, 1999, 15(3): 556-564. DOI:10.3321/ j.issn:1000-6737.1999.03.020.
[25] YASOSKY J J, ABERLE E D, PENG I C, et al. Effects of pH and time of grinding on lipid oxidation of fresh ground pork[J]. Journal of Urology, 1984, 49(6): 1510-1512. DOI:10.1111/j.1365-2621.1984. tb12832.x.
[26] 周世龙, 许安君, 张榴萍. 不同储存方式对油脂样品过氧化值的影响研究[J]. 粮油加工(电子版), 2015(10): 29-32. DOI:10.3969/ j.issn.2095-6495.2015.10.006.
[27] 王超, 席军, 章建浩, 等. 葡萄籽提取物对火腿发酵成熟过程脂质氧化的影响[J]. 食品工业科技, 2009, 30(12): 68-72.
[28] HAAS G H D, SARDA L, ROGER J. Positional specific hydrolysis of phospholipids by pancreatic lipase[J]. Biochimica Et Biophysica Acta, 1965, 106(3): 638-640. DOI:10.1016/0005-2760(65)90082-2.
[29] HOWLES P N, CARTER C P, HUI D Y. Dietary free and esterified cholesterol absorption in cholesterol esterase (bile salt-stimulated lipase) gene-targeted mice[J]. Journal of Biological Chemistry, 1996, 271(12): 7196-7202. DOI:10.1074/jbc.271.12.7196.
[30] MOHANRAJ V J, BARNES T J, PRESTIDGE C A. Silica nanoparticle coated liposomes: a new type of hybrid nanocapsule for proteins[J]. International Journal of Pharmaceutics, 2010, 392(1/2): 285-293. DOI:10.1016/j.ijpharm.2010.03.061.
Membrane Stability of Liposomes during in Vitro Simulated Infant Gastrointestinal Digestion
FENG Yanwen, LI Na, XU Jixuan, WU Yanze, HAN Jianzhong, LIU Weilin*
(School of Food Science and Biotechnology, Zhejiang Gongshang University, Hangzhou 310018, China)
Abstract:In order to study the effect of liposomes on gastric oxidative stress and the lipolysis kinetics of liposomes during gastric and small intestinal digestion, an in vitro infant gastrointestinal system was established, with its adult counterpart as control. Results showed that the average diameter of liposomes was significantly decreased and the negative zeta potential was increased after digestion. The oxidation degree of liposomal membrane, which was characterized by thiobarbituric acid reactive substances (TBARS), significantly increased after gastric digestion. Free fatty acids were released continuously during stimulated intestinal digestion, and the rate of lipolysis in the infant gastrointestinal system (38%) was obviously higher than that in the adult one (80%). The release profiles fitted first-order kinetics. Moreover, Fourier transform infrared spectroscopy (FT-IR) showed that the peaks of characteristic groups in phospholipids (C=O, P=O and -CH2) changed after digestion, and the liposomal membrane in the infant gastrointestinal system was damaged less seriously than in the adult one. This study can provide a theoretical guidance for liposomes as a nutrient carrier in infant formula.
Key words:liposome; in vitro digestion; infant; membrane structure; stability
DOI:10.7506/spkx1002-6630-201713010
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)13-0060-06
引文格式:
冯炎雯, 李娜, 徐纪璇, 等. 脂质体在婴儿体外胃肠道消化的膜结构稳定性[J]. 食品科学, 2017, 38(13): 60-65. DOI:10.7506/spkx1002-6630-201713010. http://www.spkx.net.cn
FENG Yanwen, LI Na, XU Jixuan, et al. Membrane stability of liposomes during in vitro simulated infant gastrointestinal digestion[J]. Food Science, 2017, 38(13): 60-65. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713010. http://www.spkx.net.cn
收稿日期:2016-06-11
基金项目:国家自然科学基金青年科学基金项目(31401482);浙江省食品科学与工程重中之重一级学科开放基金项目(JYTSP20142011);浙江省公益技术应用研究计划项目(2016C32060);浙江省现代食品安全与营养协同创新中心项目(2017SICR103)
作者简介:冯炎雯(1994—),女,硕士研究生,研究方向为食品营养与安全。E-mail:530345371@qq.com
*通信作者:刘玮琳(1984—),女,讲师,博士,研究方向为营养物及其运载体系的生物利用。E-mail:lwl512@zjgsu.edu.cn