
朱桂兰,叶银杉,葛 洁,施晓雪
(合肥师范学院生命科学学院,安徽 合肥 230601)
摘 要:利用质构仪和流变仪对低酰基结冷胶(low acyl gellan,LA)和果胶复配体系的胶体质构和流变性能进行研究。考察不同种类离子(Ca2+、K+)、离子浓度(0、2、4、6、8、10、20、40 mmol/L)以及LA和果胶不同质量比(100∶0、75∶25、50∶50、25∶75)对复配体系质构特性的影响。结果表明,随着离子浓度的增加破坏应力先增大,当达到临界值后开始减小,二价离子(Ca2+)的作用效果要强于一价离子(K+)。复配胶破坏应力随LA比例降低先增加后减少,质量比在75∶25时具有显著协同效应。复配体系的黏度随剪切速率增大而减小;当剪切速率相同时,黏度随LA比例的增加而增加,离子种类和浓度对复配体系黏度的影响与质构特性一致。随着温度的升高,复配体系黏度减小,在相同温度条件下,结冷胶与果胶质量比75∶25时,体系的黏度最大。储能模量G’大于相应质量比损耗模量G”,且G’和G”随LA比例的增加而增大,说明体系的黏性和弹性随LA比例增加而变大。
关键词:低酰基结冷胶;果胶;质构性质;流变性质
在很多的实际应用中,通常将两种甚至多种凝胶剂复配使用来替代食品原料、改善质构、创造复合结构和控制缩水性。复配多糖凝胶一般可形成性质相反的相分离、相互交缠连结、彼此渗透等网络结构[1-2]。如瓜尔豆胶一般情况下是不形成凝胶的,但其与黄原胶在凝胶形成方面具有很好的协同性[3]。其增效机理可能是瓜尔豆胶分子比较平滑,其没有支链的部分可以与黄原胶分子所形成的双螺旋结构以次级键形式结合成三维网状结构。形成的复配胶亲水性会比以上两种单一胶体更好。Miyoshi[4]和Nishinari[5]等研究了结冷胶与魔芋胶水溶液在3∶5时,有协同增效作用。Lau等[6]用质构仪研究了结冷胶和明胶复配的凝胶性能,发现结冷胶的添加可明显提高复配胶的质构性能。
低酰基结冷胶(low acyl gellan,LA)是由少动鞘氨醇单胞菌生产的一种胞外多糖,作为增稠剂、悬浮稳定剂、凝胶剂和成膜剂等广泛地应用在食品工业中。LA形成的凝胶具有良好的风味释放性、高透明度、高热稳定性、在较广的pH值范围内不受影响等特性,但胶体脆性比较大[7-12]。果胶广泛存在于植物细胞壁中,作为一种高分子多糖,其良好的性能受到人们越来越多的关注,而果胶要形成凝胶必须满足一定条件,例如高甲氧基果胶必须在低pH值和高糖浓度中才能形成凝胶[13]。研究发现,结冷胶与其他亲水胶体也具有良好的复配性能,如与魔芋胶、木聚糖、明胶、变性淀粉等。本实验通过将LA和果胶两种胶体进行复配,以研究复配体系是否有利于改善胶体性能,克服两种单一胶体所具有的缺陷,使结冷胶更加广泛地用于工业生产。
1.1 材料与试剂
LA、高甲氧基果胶 美国斯比凯可公司;其他试剂均为国产分析纯。
1.2 仪器与设备
HAAKE RS6000流变仪 美国赛默飞世尔科技有限公司;XTPlus物性测试仪 英国TA仪器公司。
1.3 方法
1.3.1 样品的制备
按照4 种不同LA、果胶质量比(100∶0、75∶25、50∶50、25∶75)制成总胶含量为1%的胶液(在本实验条件下,LA-果胶的质量比为0∶100时无法形成凝胶,因而没对这个体系的特性进行研究)。置于90 ℃恒温水浴锅中充分加热搅拌,直至胶体完全溶解。在加热搅拌的过程中会有水分的散失,因此需要及时补充去离子水。待胶体充分溶解后加入一定浓度的离子(Ca2+、K+浓度分别为2、4、6、8、10、20、40 mmol/L,其中部分流变性能的测定Ca2+浓度为2 mmol/L)混匀。
1.3.2 凝胶的抗压实验
凝胶的抗压实验参照文献[14-16]。将制得的复配胶溶液倒入模具中,置于室温条件下(20~25 ℃)冷却12 h,放入物性测试仪的测试平台上,设定测试速率为3 mm/s,压缩应变为90%,进行抗压实验,从而获得压缩力学曲线,每个样品4 次平行。从压缩力学曲线上,可读出凝胶破裂时所受到的力和压缩距离。通过计算工程应力σeng和工程应变εeng可间接计算出破坏应力σh和破坏应变εh,计算公式如式(1)~(4)所示。

1.3.3 复配胶静态流变学性能测定
复配胶静态流变学性能测定参照文献[17]。静态剪切速率扫描流变学特性测定:流变行为测定采用型号为P35 Ti L(直径35 mm)的平板转子,将温度设置为25 ℃,稳态剪切速率从0.1 s-1增加到100 s-1。每组质量比复配胶重复测定3 次。
1.3.4 静态温度扫描流变特性测定
起始温度设定为20 ℃,终止温度设定为90 ℃,测定静态温度扫描的流变学特性。每组复配胶重复3 次。
1.3.5 动态频率扫描流变学特性测定
扫描应变设置为1%,温度固定在30 ℃,测定储能模量G’和损耗模量G”由低频率(0.1 Hz)至高频率(100 Hz)的变化。
2.1 抗压实验结果
通过抗压实验,作出复配胶体的压缩力学曲线,从而计算出复配体系的相关流变学性质,如破坏应力与破坏应变。而胶体的破坏应力与破坏应变可以作为胶体压缩变形特点的重要参数[15-16]。
2.1.1 LA与果胶质量比及离子浓度对复配胶破坏应力的影响
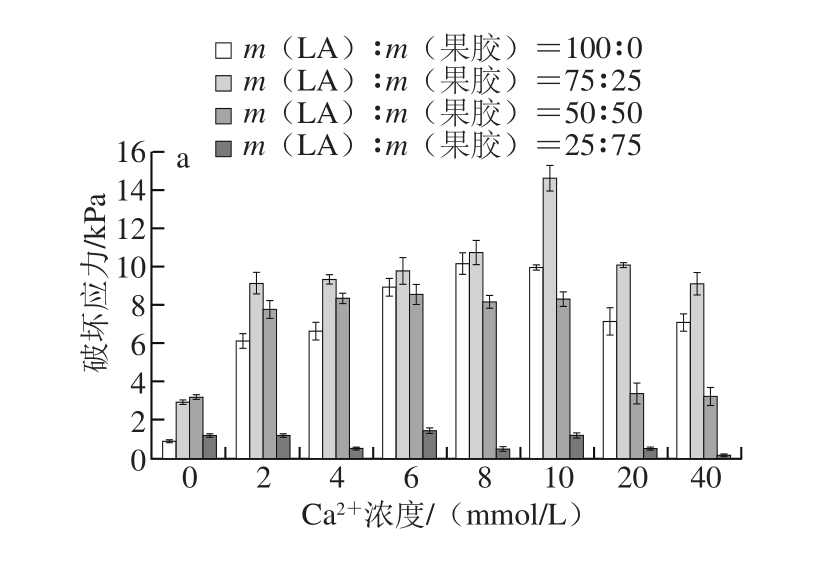
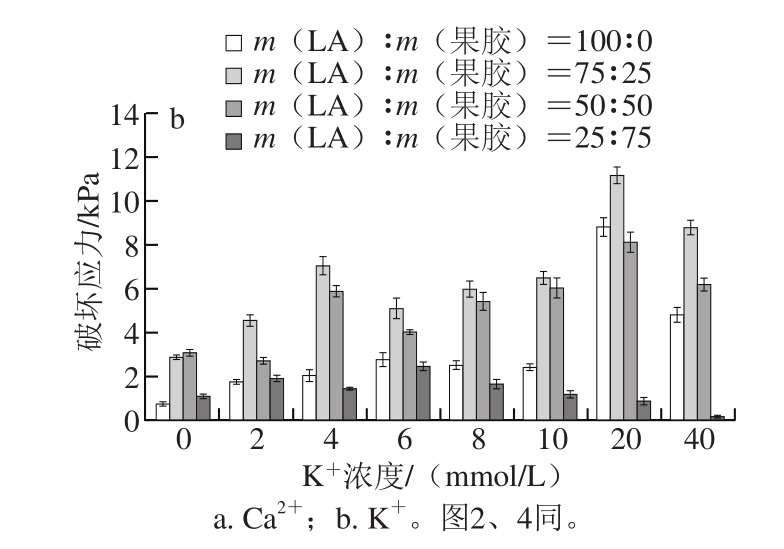
图1 LA与果胶质量比及离子浓度对复配胶破坏应力的影响
Fig. 1 Effect of LA-to-pectin ratio and ion concentration on failure stress of mixed gels
LA形成的凝胶比较硬脆,而果胶形成的凝胶质地较柔软,因此一般推测认为二者形成的复配胶体的破坏应力很可能随着LA质量比的增大而增大。但从图1可以发现,实验结果并不与预期完全一致。在任一离子浓度条件下,随着LA的含量增加,复配体系的破坏应力呈现出先增大后减小的趋势,其中在同一质量比例下,当LA与果胶质量比为75∶25时,复配体系的破坏应力达到最大。随着Ca2+浓度的增加,如图1a所示,复配体系的破坏应力也随之增加,大约在10 mmol/L时达到最大值,但当离子浓度超过这一范围时,破坏应力又开始下降。K+的影响与Ca2+的趋势相似,但其浓度达到20 mmol/L时,破坏应力最大。
综上所述,随着LA的比例增大,复配体系的破坏应力逐渐增大,当LA与果胶质量比为75∶25时破坏应力达到最大,之后,LA比例继续增大,体系的破坏应力随之减少。说明在结冷胶与果胶的质量比为75∶25时,两者之间有着较强的协同作用。在工业生产上,找到合适的复配比例能够很好地提高结冷胶的利用率,节约生产成本。同时,离子的加入对凝胶性能也有一定影响,随着阳离子的加入,复配体系的破坏应力显著增强,但当离子浓度超过一定范围时,破坏应力会随离子浓度增加而减小。根据离子对结冷胶凝胶性能的影响可以推测,加入的阳离子可能促进了胶体分子内部的交联,从而使凝胶性能增强,但当超过一定的离子浓度时,会对凝胶结构的有序性产生影响,而减弱凝胶性能[18]。
另外,二价阳离子对体系破坏应力的影响效果要强于一价阳离子,可见不同离子种类对复配体系的破坏应力的影响是不同的。二价离子在低浓度范围内对体系的破坏应力影响较大,但当达到某一阈值时其影响效果便会减小。而一价离子对体系破坏应力的影响基本上是随离子浓度增加而不断增加的。这一现象可能是由于这两种离子对凝胶的作用机理不同而产生的,根据结冷胶的凝胶机理,二价阳离子能够直接与结冷胶的双螺旋结构发生交联,而一价阳离子需要通过与水间接与胶体相连,实验结果也有力地证明了二价阳离子比一价阳离子对促进凝胶形成方面效果更加显著[19-20]。超过一定离子浓度范围可能会使胶体强度减弱。在实际应用过程中,可通过在复配体系中加入一定浓度的阳离子制得较为理想的胶体,从而有效地降低生产成本。
2.1.2 LA与果胶质量比及离子浓度对复配胶破坏应变的影响
破坏应变是一个与压缩高度相关的变量,体现的是一种单位长度的形变量[21]。从图2可以看出,对于不同比例的复配胶,随着LA含量比例的增加其破坏应变普遍也随之增加,当LA与果胶质量比为100∶0时破坏应变达到最大,相反,LA与果胶质量比为25∶75时破坏应变普遍最小。从离子浓度以及离子类型对破坏应变的影响来看,随着离子浓度的改变,相应质量比的破坏应变波动不是很明显。从离子种类角度来看,随着Ca2+浓度的增加,破坏应变先减少后增加。而K+对复配体系的破坏应力虽有影响,但影响不明显,基本可以忽略。
2.2 静态剪切流变性测定结果
2.2.1 LA和果胶复配比例对复配体系黏度的影响
Ca2+浓度为2 mmol/L,研究LA和果胶的复配比例对复配体系黏度的影响。由图3可以看出,所有样品在剪切过程中黏度随着剪切速率的增大而减小,说明LA与果胶复配体系发生剪切变稀行为,为典型的非牛顿流体[22-24]。在水溶液中,LA在阳离子的存在下可形成螺旋聚合体,当剪切作用发生时,螺旋聚合体的分子结构被拉直取向,从而流动阻力降低而导致表观黏度下降。随着LA比例的增大,黏度增加。LA的质量比例越大,则复配胶的黏度越大。这是因为随着LA质量比例的增加,复配胶体系的网络结构更加密集,在单位体积内结冷胶分子链之间的碰撞和相互缠结的频率增加分子间作用力增加,所以黏度增大[25-26]。

图2 LA与果胶质量比及离子浓度对复配胶破坏应变的影响
Fig. 2 Effect of LA-to-pectin ratio and ion concentration on failure strain of mixed gels
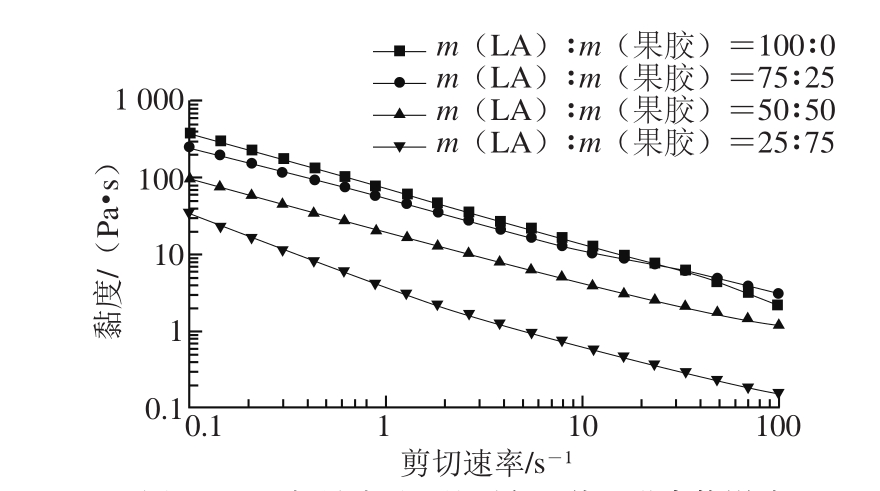
图3 LA与果胶质量比对复配体系黏度的影响
Fig. 3 Effect of LA-to-pectin ratio on the viscosity of mixed gels
2.2.2 离子种类和浓度对复配体系静态流变学性质的影响
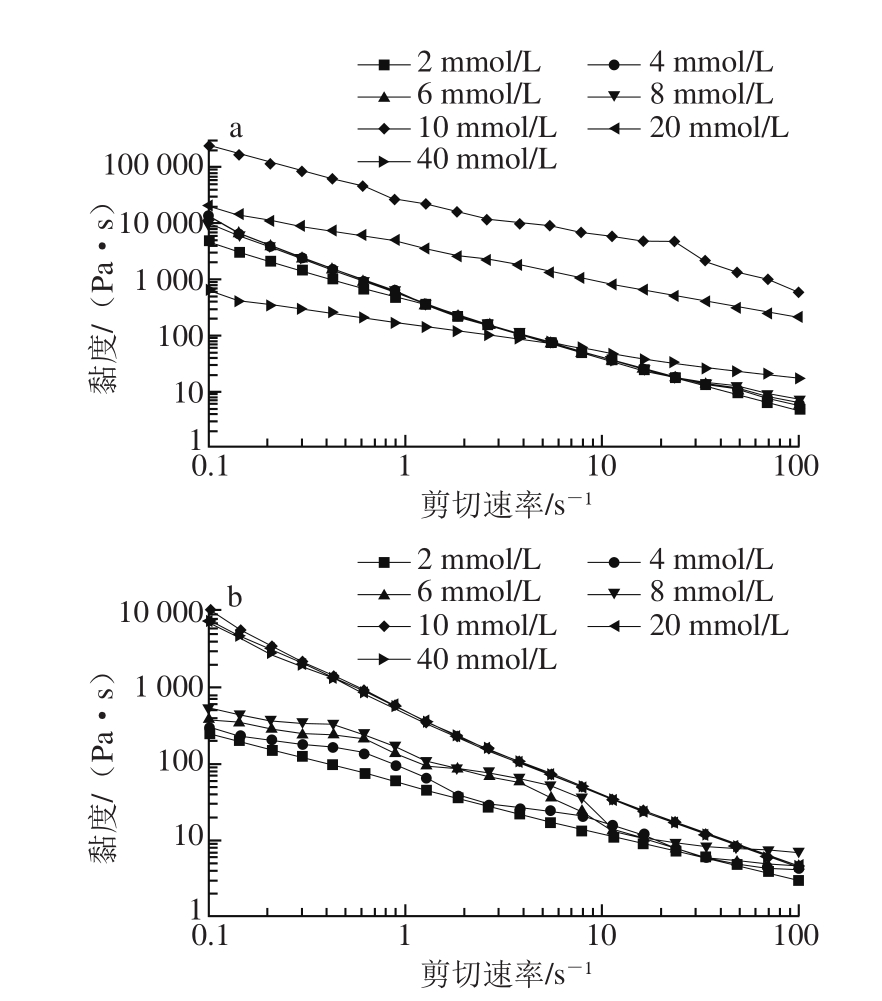
图4 离子种类和浓度对复配体系黏度的影响
Fig. 4 Effect of ion type and concentration on the viscosity of LA-pectin mixed gels
LA与果胶质量比为75∶25时研究离子种类和离子浓度对复配体系黏度的影响,发现不同浓度的Ca2+和K+对复配体系黏度的影响与前面流变性能结果基本一致(图4),在一定范围内,随着离子浓度的增加,复配体系的黏度增大,当Ca2+和K+浓度分别达到10 mmol/L和20 mmol/L时,复配体系的黏度达到最大值,再增加离子浓度,黏度减小。这也进一步说明阳离子会提高胶体的凝胶强度和黏度,很显然二价离子的效果要明显优于一价离子,然而,过多阳离子的加入也会使体系凝胶强度和黏度降低[7],这是由于过多的阳离子会和结冷胶、果胶分子的阴离子结合,从而阻止了聚合物双链的形成。这一结果与之前一些对结冷胶研究结果相一致,在离子浓度较低时,产生的凝胶是单层的、平坦的粒子聚合结构,而在离子浓度较高的情况下,凝胶则会形成并排的双螺旋聚合,从而形成了一种多层的聚合结构,当结冷胶的羧基基团与阳离子结合饱和后,凝胶的黏度或强度最大。因此,LA与果胶复配体系的凝胶机制可能与结冷胶类似。
2.3 静态温度流变性测定结果

图5 温度对LA-果胶复配体系黏度的影响
Fig. 5 Effect of temperature on the viscosity of LA-pectin mixed gels
通过静态温度扫描(图5)可以看出,同一复配胶黏度随着温度的增大而减小,这是由于温度低时,分子运动缓慢,黏度大。温度升高,分子运动加速,导致分子之间的氢键减少,体系黏度降低。随着果胶量的增加,变化越明显。这是因为LA具有较强的热稳定性[27-28],而果胶的流体行为易受到温度影响,当体系的温度升高时,则果胶凝胶的黏度降低明显。
2.4 动态黏弹性测定结果
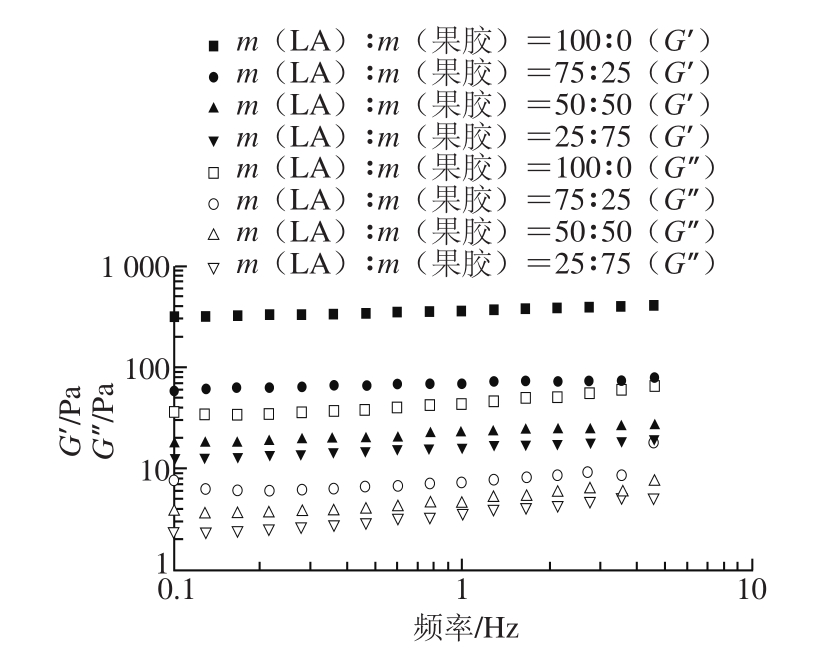
图6 LA-果胶复配体系动态模量的变化
Fig. 6 Dynamic modulus of LA-pectin mixtures
复配胶体系的动态黏弹性与实际应用密切相关。储能模量G’又称为弹性模量,表示由于弹性形变而储存能量的大小,反应物质弹性大小;损耗模量G”又称黏性模量,指物质在发生形变时由于黏性形变而损耗的能量的大小,表明能量消散[29-30]。由图6可以看出,所测样品的G’均远大于相同质量比所对应G”,意味着该复合胶呈现类固性材料特征。G’与G”随频率增加而增加,G’的上升幅度小于G”的上升幅度。复配胶体系的G’和G”随LA比例增加均呈增加趋势,即复配胶的黏性和弹性增加。因为复配胶体系中存在网络结构,并且LA在这种网络结构中占主导地位,随着LA质量比的增加。网络结构更加密集,G’和G”显著增加,即黏性和弹性增加。
Ca2+对体系破坏应力的影响比K+更为显著,随着离子浓度的增加破坏应力先增大,当达到某一浓度范围时,其值开始减小。同时,LA与果胶质量比为75∶25时,具有一定的协同作用,有利于增强胶体的凝胶强度。在不加入离子的条件下,随着结冷胶比例的增大,体系的破坏应变逐渐增大。加入的离子浓度和种类对体系的破坏应变影响不大。
同时,将LA与果胶进行复配,会改变其流变特性。LA与果胶质量比为75∶25与质量比为100∶0时的黏度差很小,不同浓度的Ca2+和K+对质量体系黏度的影响与质构特性基本一致。而且从静态温度扫描可以看出,复配质量比为75∶25时的黏度最大,所以为了减少工业成本,得到相似加工功能,可以选用复配质量比为75∶25的LA-果胶复配体系。
参考文献:
[1] CAIMS P, MILES M J, MORRIS V J, et al. X-ray fibre-diffraction studies of synergistic, binary polysaccharide gels[J]. Carbohydrate Research, 1987, 160(3): 411-423. DOI:10.1016/0008-6215(87)80327-0.
[2] MARTINS J T, CERQUEIRA M A, BOURBON A I, et al. Synergistic effects between κ-carrageenan and locust bean gum on physicochemical properties of edible films made thereof[J]. Food Hydrocolloids, 2012, 29(2): 280-289. DOI:10.1016/ j.foodhyd.2012.03.004.
[3] MUDGIL D, BARAK S, KHATKAR B S. Guar gum: processing, properties and food applications: a review[J]. Journal of Food Science and Technology, 2011, 51(3): 409-418. DOI:10.1007/s13197-011-0522-x.
[4] MIYOSHI E, TAKAYA T, WILLIAMS P A, et al. Rheological and DSC studies of mixtures of gellan gum and konjac glucomannan[J]. Macromolecular Symposia, 1997, 120(2): 271-280. DOI:10.1002/ masy.19971200127.
[5] NISHINARI K, MIYOSHI E, TAKAYA T, et al. Rheological and DSC studies on the interaction between gellan gum and konjac glucomannan[J]. Carbohydrate Polymers, 1996, 30(2/3): 193-207. DOI:10.1016/s0144-8617(96)00092-6.
[6] LAU M H, TANG J, PAULSON A T. Texture profile and turbidity of gellan/gelatin mixed gels[J]. Food Research International, 2000, 33(8): 665-671. DOI:10.1016/s0963-9969(00)00111-3.
[7] MORRIS E R, NISHINARI K, RINAUDO M. Gelation of gellan: a review[J]. Food Hydrocolloids, 2012, 28(2): 373-411. DOI:10.1016/ j.foodhyd.2012.01.004.
[8] VIJAN V, KAITY S, BISWAS S, et al. Microwave assisted synthesis and characterization of acrylamide grafted gellan, application in drug delivery[J]. Carbohydrate Polymers, 2012, 90(1): 496-506. DOI:10.1016/j.carbpol.2012.05.071.
[9] ZHANG J, DONG Y C, FAN L L. Optimization of culture medium compositions for gellan gum production by a halobacterium Sphingomonas paucimobilis[J]. Carbohydrate Polymers, 2015, 115: 694-700. DOI:10.1016/j.carbpol.2014.09.029.
[10] KIRCHMAJER D M, STEINHOFF B, WARREN H, et al. Enhanced gelation properties of purified gellan gum[J]. Carbohydrate Research, 2014, 388(1): 125-129. DOI:10.1016/j.carres.2014.02.018.
[11] PRAJAPATI V D, JANI G K, ZALA B S, et al. An insight into the emerging exopolysaccharide gellan gum as a novel polymer[J]. Carbohydrate Polymers, 2013, 93(2): 670-678. DOI:10.1016/ j.carbpol.2013.01.030.
[12] HUANG J, JIANG S, XU X Q, et al. Effects of carbon/nitrogen ratio, dissolved oxygen and impeller type on gellan gum production in Sphingomonas paucimobilis[J]. Annals of Microbiology, 2012, 62(1): 299-305. DOI:10.1007/s13213-011-0261-2.
[13] ESPITIA P J P, DU W X, AVENA-BUSTILLOSS R J. Edible films from pectin: physical-mechanical and antimicrobial properties: a review[J]. Food Hydrocolloids, 2014, 35(3): 287-296. DOI:10.1016/ j.foodhyd.2013.06.005.
[14] 许永涛, 童群义. 高酰基结冷胶与κ-卡拉胶复配胶的质构特性研究[J].食品工业科技, 2012, 33(22): 159-167.
[15] BANERJEE S, BHATTACHARYA S. Compressive textural attributes, opacity and syneresis of gels prepared from gellan, agar and their mixtures[J]. Journal of Food Engineering, 2011, 102(3): 287-292. DOI:10.1016/j.jfoodeng.2010.08.025.
[16] FOO W T, LIONG M T, EASA A M. Textural and structural breakdown properties of selected hydrocolloid gels[J]. Food Research International, 2013, 52(1): 401-408. DOI:10.1016/ j.foodres.2011.07.044.
[17] XIAO Q, TONG Q Y, LIM L T. Pullulan-sodium alginate based edible films: rheological properties of film forming solutions[J]. Carbohydrate Polymers, 2012, 87(2): 1689-1695. DOI:10.1016/ j.carbpol.2011.09.077.
[18] HUANG Y Q, TANG J M, SWANSON B G, et al. Effect of calcium concentration on textural properties of high and low acyl mixed gellan gels[J]. Carbohydrate Polymers, 2003, 54(1): 517-522. DOI:10.1016/ j.carbpol.2003.08.006.
[19] MIYOSHI E, TAKAYS T, WILLIAMS P A, et al. Effects of sodium chloride and calcium chloride on the interaction between gellan gum and konjac glucomannan[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2486-2495. DOI:10.1021/jf950600v.
[20] TANG J M, TUNG M A, ZENG Y. Gelling properties of gellan solutions containing monovalent and divalent cations[J]. Journal of Food Science, 1997, 62(4): 688-712. DOI:10.1111/j.1365-2621.1997. tb15436.x.
[21] NUSSINOVICH A, AK M M, NORMAND M D, et al. Characterization of gellan gels by uniaxial compression, stress relaxation and creep[J]. Journal of Texture Studies, 1990, 21(1): 37-50. DOI:10.1111/j.1745-4603.1990.tb00463.x.
[22] KHOURYIEH H A, HERALD T J, ARAMOUNI F. Intrinsic viscosity and viscoelastic properties of xanthan/guar mixtures in dilute solutions: effect of salt concentration on the polymer interactions[J]. Food Research International, 2007, 40(7): 883-893. DOI:10.1016/ j.foodres.2007.03.001.
[23] 李懋鸣, 袁妍, 陈青, 等. 高酰基结冷胶水溶液非牛顿流变行为研究[J].食品科技, 2013, 38(3): 243-246.
[24] SONG K W, KIM Y S, CHANG G S. Rheology of concentrated xanthan gum solutions: steady shear flow behavior[J]. Fibers and Polymers, 2006, 7(2): 129-138. DOI:10.1007/BF02908257.
[25] MIYOSHI E, NISHINARI K. Non-newtonian flow behaviour of gellan gum aqueous solutions[J]. Colloidand Polymer Science, 1999, 277(8): 727-734. DOI:10.1007/s003960050446.
[26] NAKAMURA K, TANAKA Y, SAKURAI M. Dynamic mechanical properties of aqueous gellan solutions in the sole gel transition region[J]. Carbohydrate Polymers, 1996, 30(2/3): 101-108. DOI:10.1016/s0144-8617(96)00081-1.
[27] 张雅媛, 洪雁, 顾正彪, 等. 玉米淀粉与黄原胶复配体系流变和凝胶特性分析[J]. 农业工程学报, 2011, 27(9): 357-362. DOI:10.3969/ j.issn.1002-6819.2011.09.062.
[28] 张俊, 刘敏, 王军, 等. 结冷胶水溶液的流变特征及其影响因素研究[J]. 食品工业科技, 2002, 23(11): 28-29. DOI:10.3969/ j.issn.1002-0306.2002.11.011.
[29] VITURAWONG Y, ACHAYUTHAKAN P, SUPHANTHARIKA M. Gelatinization and rheological properties of rice/xanthan mixtures: effects of molecular weight of xanthan and different salts[J]. Food Chemistry, 2008, 111(1): 106-114. DOI:10.1016/ j.foodchem.2008.03.041.
[30] LEE J S, KIM Y S, SONG K W. Transient rheological behavior of natural polysaccharide xanthan gum solutions in start-up shear flow fields: an experimental study using a strain-controlled rheometer[J]. Korea-Australia Rheology Journal, 2015, 27(3): 227-239. DOI:10.1007/s13367-015-0023-y.
Properties of Low Acyl Gellan and Pectin Mixtures
ZHU Guilan, YE Yinshan, GE Jie, SHI Xiaoxue
(Department of Life Science, Hefei Normal University, Hefei 230601, China)
Abstract:The rheological and gel properties of low acyl gellan (LA) and pectin mixtures were studied using a rheometer and a texture analyzer. The effect of different ions (potassium and calcium), different ion concentrations (0, 2, 4, 6, 8, 10, 20, 40 mmol/L) and different LA-to-pectin ratios (100:0, 75:25, 50:50 and 25:75) on mixed gels was investigated. The results showed that calcium ion had a greater effect on failure stress than potassium ion. Failure stress increased with increasing calcium or potassium ion up to the critical level, and then it decreased with further increase in ion concentration. Failure stress of mixed gels increased with decreasing proportion of gellan gum. The strongest interaction occurred when the ratio of LA to pectin was 75 to 25. The viscosity of mixtures decreased with increasing shearing rate. At a content shearing rate, the viscosity was enhanced with increasing LA ratio. Ion type and concentration had identical effects on the viscosity and texture of LA-pectin mixtures. The viscosity was decreased with increasing temperature. For each investigated temperature, the maximum viscosity was observed at a ratio of 75:25. The dynamic rheological results revealed that the storage modulus of mixed gels was greater than the loss modulus, and both of them rose with the increase in LA ratio, indicating that the viscosity and elasticity of mixed systems increased with increasing LA ratio.
Key words:low acyl gellan; pectin; textural properties; rheological properties
DOI:10.7506/spkx1002-6630-201713011
中图分类号:TS201.7
文献标志码:A
文章编号:1002-6630(2017)13-0066-05
引文格式:
朱桂兰, 叶银杉, 葛洁, 等. 低酰基结冷胶-果胶复配体系的性能[J]. 食品科学, 2017, 38(13): 66-70. DOI:10.7506/ spkx1002-6630-201713011. http://www.spkx.net.cn
ZHU Guilan, YE Yinshan, GE Jie, et al. Properties of low acyl gellan and pectin mixtures[J]. Food Science, 2017, 38(13): 66-70. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713011. http://www.spkx.net.cn
收稿日期:2016-06-28
基金项目:国家自然科学基金青年科学基金项目(31401657);安徽省自然科学研究项目(KJ2016A586);合肥师范学院产学研项目(2015xxhz010)
作者简介:朱桂兰(1980—),女,副教授,博士,研究方向为碳水化合物资源开发和利用。E-mail:zhuguilan13@126.com