彭欢欢1,刘小莉2,黄鸿兵3,夏秀东2,周剑忠2,刘 源1,*
(1.上海海洋大学食品学院,上海 201306;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.江苏省淡水水产研究所,江苏 南京 210017)
摘 要:采用5 种不同的低温冻结处理方式,即-20 ℃自然慢冻组、速冻处理组(包括-20、-40、-60 ℃速冻及液氮速冻),进行鲜活整河蟹的冻结,以-20 ℃条件下贮藏期内河蟹肌肉pH值、丙二醛(malondialdehyde,MDA)含量、Ca2+-ATPase活力、总巯基(-SH)含量、表面疏水性为指标,研究不同冻结速率对冷冻贮藏河蟹肌肉生化特性的影响。结果表明,随着冻藏时间的延长,河蟹样品的pH值下降、脂肪氧化产物MDA含量先增大后减小、Ca2+-ATPase活力降低、总巯基含量降低、表面疏水性增大,速冻处理组的样品各指标变化趋势明显低于或迟缓于慢冻组,且-60 ℃和液氮组效果要显著优于-20、-40 ℃处理组,-60 ℃和液氮组之间各指标差异不显著。
关键词:河蟹;冻结速率;蛋白质;脂肪;氧化
河蟹,俗称螃蟹、大闸蟹,学名中华绒螯蟹,是我国及东南亚地区人们十分钟爱的淡水水产珍品,食用价值和经济价值极高。近年来,由于市场需求和经济效益的推动,河蟹养殖业发展迅速,成为特种水产品中最具代表性和最有影响的主导产业[1]。但是由于河蟹是季节性非常强的水产品,只有在每年的农历秋冬之际,蟹才膏肥黄满。在河蟹集中上市季节,对于市场不能及时消化掉的大量积压鲜活蟹,由于无法及时进行加工,一旦失去食用价值,也将是一个很大的浪费[2]。因此,推进河蟹的原料贮藏或加工研究,有助于调节供求关系,对河蟹养殖业健康稳定发展具有重要意义。
冻藏作为主要的保藏方法,广泛应用于水产类的贮藏、运输、销售和加工中[3-6]。低温冻藏条件下,产品货架期较长,能有效抑制微生物和内源酶的作用,但即使在低温条件下水产类脂质中含有的大量高度不饱和脂肪酸以及蛋白质也会氧化或分解变质,改变肌肉的组织、颜色、水合能力和风味等一系列特性[7-10],对其保存、销售和食用产生不良影响。多项研究表明,这些变化与冻结方式密切相关[11-13],研究水产品在冻藏过程中生化特性的变化,寻找合理的冻结方式对生产高质量水产制品具有重要意义。
目前对蟹类产品冻藏或冷藏的研究主要集中于熟制海蟹或生海蟹[14-16],而淡水河蟹方面的研究很少。本研究以鲜活河蟹为研究原料,采用不同的低温冻结处理方式进行整河蟹的冻结,以贮藏期内河蟹肌肉pH值、丙二醛(malondialdehyde,MDA)含量、Ca2+-ATPase活力、总巯基含量、表面疏水性为指标,研究不同冻结速率对冰冻河蟹品质的影响,旨在提高冻藏河蟹的品质,为进一步的加工利用提供原料保障。
1.1 材料与试剂
鲜活公河蟹由江苏省常熟市某公司提供,体质量(150±15) g,江苏省淡水水产研究所鉴定为中华绒螯蟹(Eriocheir sinensis H. Milne-Edwards)。
MDA测定试剂盒、超微量Ca2+-ATPase试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)法蛋白定量试剂盒南京建成生物工程研究所;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)、8-苯胺基-1-奈磺酸铵(1-anilino-napthalene-8-sulfonic acid,ANS) 美国Sigma-Aldrich公司;所有提取用试剂均为国产分析纯。
1.2 仪器与设备
低温试验箱 南京泰斯特试验设备有限公司;医用低温保存箱 海尔集团;多功能酶标仪 美国BioTek仪器有限公司;高速匀浆机 德国IKA公司;pH计上海雷磁仪器厂。
1.3 方法
1.3.1 河蟹预处理、冻结及贮藏
冻藏河蟹定期取样,于4 ℃冰箱中解冻后去除不可食部分。由于蟹膏含量及组分随季节及品种个体差异较大,因此取样时取河蟹腹部及足钳内体肉,进行指标测定。
鲜活河蟹自来水冲洗干净后沥水,分别进行如下冻结处理:慢速冻结:将河蟹直接置于-20 ℃冰箱冷冻层中缓慢冻结;快速冻结:分别设置低温实验箱温度为-20、-40、-60 ℃,待腔体温度稳定至设置值后,将温度探头插入河蟹腹部中心进行冻结至中心温度达-20 ℃;液氮速冻:河蟹至于泡沫箱,倾注液氮使河蟹浸没于液氮中,密封箱盖至中心温度达-20 ℃;将冻结好的河蟹装入保鲜自封袋(厚度0.2 mm),封口,-20 ℃低温保存箱中贮藏。
1.3.2 pH值的测定
取蟹肉5 g,加入9 倍体积(45 mL)的煮沸冷却后的纯水,匀浆,10 000×g离心10 min,测定pH值。
1.3.3 MDA含量的测定
MDA是常用的脂质过氧化指标,可与硫代巴比妥酸(thiobarbituric acid,TBA)缩合,形成红色产物,在532 nm波长处有最大吸收峰。称取一定量的河蟹肉样品,加入5 倍体积去离子水,10 000 r/min匀浆1 min,用于MDA含量的检测。依据TBA法原理采用试剂盒检测,结果以1 mg样品蛋白质中MDA含量(nmol/mg pro)表示。
1.3.4 肌原纤维蛋白的提取
参照Yang Fang等[17]的方法进行肌原纤维蛋白的提取。10 g蟹肉样品加20 mL、4 ℃预冷的去离子水,12 000 r/min匀浆30 s,10 000 r/min、4 ℃离心20 min,弃去上清液,沉淀中加入去离子水,再重复提取一次。沉淀中再加入20 mL、4 ℃预冷的0.05 mol/L磷酸盐缓冲液(pH 7.2)(其中补充0.6 mol/L的NaCl),12 000 r/min匀浆30 s,10 000 r/min、4 ℃离心20 min,收集上清液。沉淀用上述步骤再重复提取一次,合并上清液。蛋白质含量采用BCA试剂盒测定。
1.3.5 Ca2+-ATPase活力测定
采用超微量Ca2+-ATPase活性试剂盒进行测定。
1.3.6 总巯基含量的测定
参考Benjakul等[14]的方法进行总巯基含量的测定。调节上述提取的肌原纤维蛋白溶液蛋白质量浓度至4 mg/mL,取0.5 mL加入4.5 mL 0.2 mol/L三羟甲基氨基甲烷盐酸(Tris-HCl)缓冲液(pH 6.8,含有 8 mol/L脲、2%十二烷基硫酸钠、10 mmol/L乙二胺四乙酸)。上述混合液取1 mL,加入0.1 mL 0.1% DTNB,40 ℃温育25 min。测定412 nm波长处吸光度A412nm。空白样以0.6 mol/L KCl(pH 7.0)代替样品。总巯基含量的计算公式如下:
式中:n为稀释倍数;ε为摩尔吸光系数13 600 L/(mol·cm);ρ为蛋白质质量浓度/(mg/mL)。
1.3.7 表面疏水性的测定
用ANS作为荧光探针进行表面疏水性的测定[14]。提取的蛋白溶液,用10 mmol/L磷酸盐缓冲液(pH 6.0,含0.6 mol/L NaCl)稀释至不同质量浓度0.125、0.250、0.500、1.000 mg/mL。取4 mL上述各质量浓度的肌原纤维蛋白溶液,与30 μL ANS(用0.1 mol/L、pH 7.0的磷酸盐缓冲液溶解,浓度为8 mmol/L)混合。测定ANS-蛋白结合体的荧光强度,激发波长374 nm 、发射波长485 nm。以荧光强度对肌原纤维蛋白质量浓度绘制图线,所得到的曲线斜率即表示为蛋白表面疏水性指数。
1.4 数据分析
本实验数据为3 次重复的平均值。采用SPSS 13.0软件进行数据统计和方差显著性分析。
2.1 冻结速率对河蟹贮藏过程中pH值的影响
pH值是一项肌肉鲜度变化的重要指标。一方面,蛋白质在内源性组织蛋白酶作用下逐渐分解产生氨基酸和其他碱性物质,另外微生物的活动也会使蛋白质、氨基酸及其他一些含氮物质被分解为氨及胺类等腐败产物,使pH值逐渐升高[18]。但另一方面,水产品死亡后,糖原在缺氧环境下酵解生成乳酸,ATP被消耗分解产生无机磷酸,导致pH值的下降[3]。吴燕燕等[19]在对无磷品质改良剂对阿根廷鱿鱼冷冻变性的研究中发现,鱿鱼样品在冻藏过程中pH值总体呈先上升再下降的趋势,维持在6.0~8.0之间。屠冰心等[20]在研究低温速冻处理对大黄鱼冻藏品质的影响中则发现pH值先下降后上升。
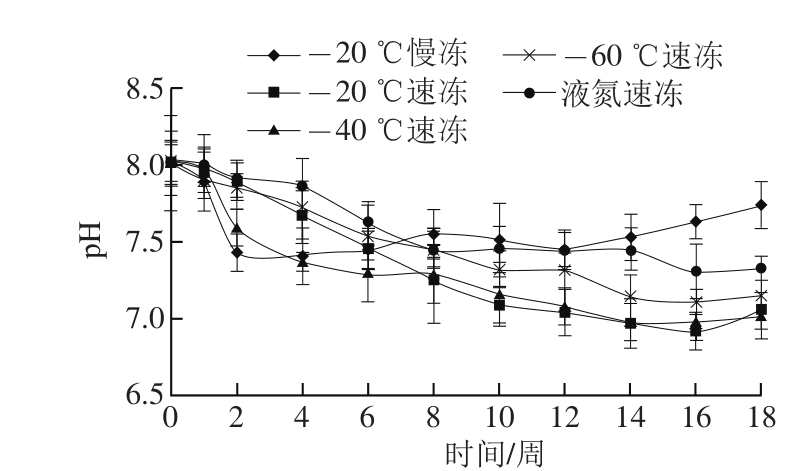
图1 冻结速率对冻藏河蟹pH值的影响
Fig. 1 Effect of freezing rate on pH of crab muscle during storage
河蟹喜欢生长在偏碱性的水中,即pH值在7~9之间,因此河蟹肉pH值一般稍高于淡水鱼类产品,也有的研究表明这是由于蟹肉中高含量的非蛋白氮化合物存在的结果[21]。在Lorentzen等[21]对熟制帝王蟹(Paralithodes camtschaticus)4 ℃冷藏研究中发现,腿肉和肩胸肉的pH值分别由7.3、7.6上升到7.8、7.9。而本研究中河蟹初始pH值较高,为8.0左右。图1结果显示,-20 ℃慢冻处理的河蟹在贮藏初期pH值急速下降,2 周后pH值开始上升,而速冻处理的河蟹则pH值变化趋势较平缓,在冻藏过程中pH值总体为下降趋势,16 周后有上升趋势,其中液氮速冻组的pH值变化趋势最为平缓。不同研究结果间差异可能与蟹品种、生长环境、养殖条件等有关,另外由于本研究中冻藏对象为鲜活河蟹,而非熟制样品,冷冻贮藏的鲜活样品取样时首先需要解冻,解冻过程中不可避免存在汁液流失,另外由于河蟹生理结构复杂的原因,取样时生的肌肉不易从蟹壳中剥离,比较耗时,在此过程中又引起部分汁液流失,而熟制样品在蒸煮过程中由于蛋白质等的加热变性凝固,能将水分锁住,且熟制后肌肉也容易与蟹壳剥离,取样方便,因此生熟两种样品类型也会对pH值的结果产生影响。
2.2 冻结速率对脂肪氧化的影响
河蟹体肉中含有一定含量的脂肪,汤辰婧等[22]研究了中华绒螯蟹在不同生长阶段体肉的脂含量,约为0.16%~0.51%,其中不饱和脂肪酸占70%以上,油酸C18:1ω9含量最高为22.39%~30.1%,ω3/ω6比例为0.88~1.93。由于水产品中含有丰富的不饱和脂肪酸,即使在低温状态下也会氧化变质,其产物自身不仅影响产品的感官品质[23-24],同时也会对蛋白质结构产生影响[25],缩短冷冻水产品的货架期。过氧化物是油脂氧化的初始产物,常用来反映脂质氧化水平。MDA是脂质过氧化作用的产物之一,间接反映机体的活性氧自由基和脂质的过氧化水平,MDA含量越大,说明脂肪的氧化程度越高,酸败就越严重,产生的小分子物质越多。
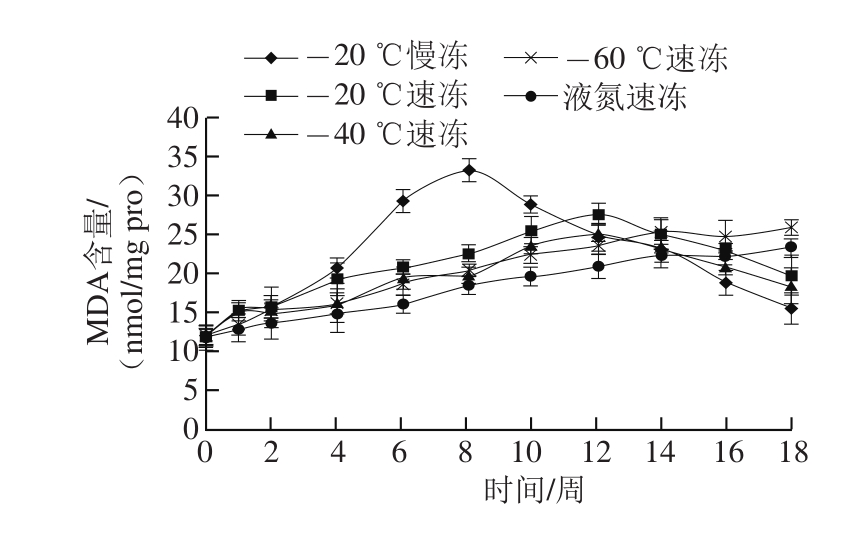
图2 冻结速率对冻藏河蟹MDA含量的影响
Fig. 2 Effect of freezing rate on MDA content of crab muscle during storage
图2 显示,-20 ℃慢冻处理的河蟹其MDA含量在贮藏初期8 周内持续迅速上升,到第8周达到峰值为(33.30±1.51) nmol/mg pro,随后又趋于降低,此阶段二级氧化产物醛、酮类物质可能进一步降解,与蟹肉中其他成分,如蛋白质变性生成的某些低级产物,相互作用而产生不良的气味或色泽。Aubourg等[26]研究也发现次级产物MDA可与鱼肉中的氨基相互作用生成l-氨基-3-氨基丙烯,从而导致MDA含量的下降。其他速冻处理的河蟹MDA含量变化趋势明显不同于慢冻组,-60 ℃及液氮速冻组在18 周贮藏期内MDA含量持续增加,未达到进一步降解而导致MDA含量下降的阶段,-20、-40 ℃速冻组的MDA含量变化模式类似于-20 ℃慢冻组,但MDA含量到达峰值的时间显著延迟至12 周,且随后下降趋势明显减缓,速冻处理对延缓河蟹肉脂肪氧化的影响显著。
2.3 冻结速率对Ca2+-ATPase活性的影响
水产品在冻藏过程中,肌肉蛋白质会发生冷冻变性,导致各项理化指标变化。Ca2+-ATPase活性一般用来表示肌浆球蛋白分子的完整性,肌球蛋白的球状头部结构与Ca2+-ATPase活性有很大关系。冻藏期间的活性下降意味着肌球蛋白的变性,特别是头部区域[14,27]。
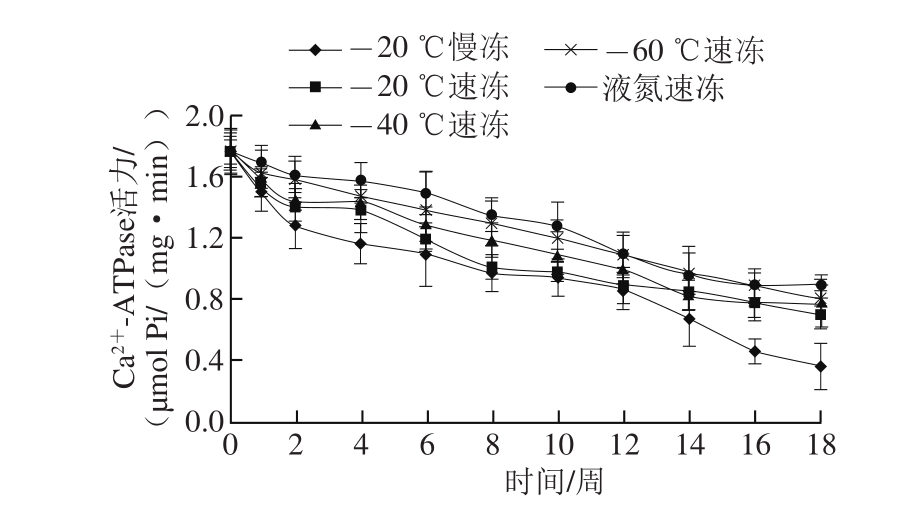
图3 冻结速率对肌原纤维蛋白Ca-ATPase活力的影响
Fig. 3 Effect of freezing rate on Ca2+-ATPase activity of myofibrillar protein in crab muscle during storage
由图3可知,随着冻藏时间的延长,不同冷冻方式处理的河蟹样品中Ca2+-ATPase活力都持续降低,-20 ℃慢冻样品的下降幅度最大,18 周贮藏期结束后残余Ca2+-ATPase活力为0.36 μmol Pi/(mg·min),仅为新鲜样品的20.45%;液氮速冻和-60 ℃速冻样品活性下降趋势较为平缓,残余酶活维持在50%左右,其次为-20 ℃速冻和-40 ℃速冻样品。冻结速率对Ca2+-ATPase活力下降的影响很显著,冻结速率越大,Ca2+-ATPase活力下降程度越小,趋势越平缓。这可能是由于冻藏过程中随着冰晶的产生,细胞环境中离子浓度升高,诱导肌浆球蛋白的变性、以及肌动蛋白-肌浆球蛋白复合体的瓦解,表现为Ca2+-ATPase活力下降。Benjakul等[14]在对锯缘青蟹的冷冻贮藏研究中也发现了Ca2+-ATPase活力的持续下降,且与肌肉类型没有关系。2.4 冻结速率对蛋白质总巯基含量的影响

图4 冻结速率对肌原纤维蛋白总巯基含量的影响
Fig. 4 Effect of freezing rate on total sulfhydryl content of myofibrillar protein in crab muscle during storage
图4 结果显示,冻藏期间,河蟹样品中总巯基含量持续降低,-20 ℃慢冻样品的总巯基含量下降速度最快,到第8周已下降到初始值的50%以下,而速冻处理组总巯基含量下降速度显著减缓,除-20 ℃速冻组在第12周下降到初始值的50%左右,其他速冻组在18 周贮藏期结束后总巯基含量仍维持在初始水平的56%~62%。巯基是蛋白质分子中具有较高反应活性的一个基团,蛋白质巯基上的硫外层具有很多的孤对电子,具有很强的亲核性。巯基对氧化反应比较敏感,巯基的含量变化可显示出蛋白质的变性程度[28]。半胱氨酸中的巯基对氧化反应非常敏感,能直接参与氧化还原反应。游离的巯基易氧化,多肽内部或多肽间形成二硫键,从而掩饰了肌动球蛋白分子上的活性巯基结构,造成蛋白分子内部或蛋白间发生交联,使蛋白质的溶解性、消化率及营养品质下降[29]。阴晓菲等[11]采用-60 ℃冻结24 h后-20 ℃冻藏、-40 ℃冻结24 h后-20 ℃冻藏及-20 ℃直接冻结3 种不同冻结方法进行草鱼鱼片冻藏-冷藏期间蛋白质生化特性的影响研究,发现-60 ℃和-40 ℃低温冻结的前处理相比于-20 ℃直接冻结具有较高的盐溶蛋白质和巯基含量,在一定程度上降低了蛋白质变性的速度。本研究结果同样显示低于-40 ℃速冻处理对延缓蛋白质总巯基含量下降有显著的效果。
2.5 冻结速率对表面疏水性的影响
蛋白质的表面疏水性反映的是蛋白质分子表面疏水性氨基酸的相对含量。蛋白质氧化可以改变肌原纤维蛋白的结构,分子内部的疏水基团和亲水基团相对位置发生改变,疏水的脂肪族和芳香族氨基酸暴露,从而改变其疏水性[30],最终影响到产品的质量品质。氧化程度越高,品质越差,价值降低。

图5 冻结速率对表面疏水性的影响
Fig. 5 Effect of freezing rate on surface hydrophobicity of myofibrillar protein in crab muscle during storage
由图5发现,前2 周内各种冻结处理的样品表面疏水性变化均呈指数性上升,2 周后稍微平缓,与图3中总巯基含量变化趋势吻合。与Benjakul等[14]对锯缘青蟹的冷冻贮藏研究结果不同,他们的研究结果显示贮藏初期周表面疏水性变化不大,4 周后上升,8 周后又下降,这可能是暴露的疏水残基重新通过疏水相互作用发生聚合。
冷冻处理可以将水产品体内大部分水分冻结成冰晶,体积增大,产生内压,且细胞介质中离子强度增大,引起脂肪和蛋白质的氧化,给产品肌肉质地、风味带来变化。速冻温度越低,通过最大冰晶生成带的速度越快,时间越短,形成的冰晶体越小,冻藏效果越好。本研究采用-20 ℃慢冻与4种速冻(-20 ℃、-40 ℃、-60 ℃速冻,液氮速冻)处理对鲜活河蟹进行冻结处理,随着冻藏时间的延长河蟹样品的品质指标呈现pH值下降、脂肪氧化产物MDA含量先增大后减小、Ca2+-ATPase活力降低、总巯基含量降低、表面疏水性增大的趋势,速冻处理组的样品各指标变化趋势明显低于或迟缓于慢冻组,且-60 ℃和液氮组效果要显著优于-20、-40 ℃处理组,-60 ℃和液氮组之间各指标差异不显著。
参考文献:
[1] 刘爱军, 杜林华, 金黎明. 江苏河蟹消费特征研究[J]. 中国渔业经济, 2014, 32(6): 104-108.
[2] 车斌, 王倩倩. 江苏省河蟹养殖产业SWOT分析及对策[J]. 山西农业科学, 2011, 39(7): 736-739.
[3] INDERGÅRD E, TOLSTOREBROV I, LARSEN H, et al. The influence of long-term storage, temperature and type of packaging materials on the quality characteristics of frozen farmed Atlantic Salmon (Salmo Salar)[J]. International Journal of Refrigeration, 2014, 41(5): 27-36. DOI:10.1016/j.ijrefrig.2013.05.011.
[4] CRANE D P, KILLOURHY C C, CLAPSADL M D. Effects of three frozen storage methods on wet weight of fish[J]. Fisheries Research, 2016, 175: 142-147. DOI:10.1016/j.fishres.2015.11.022.
[5] 姚艾东, 何健. 冷冻冷藏食品新技术的应用与前景[J]. 河南工业大学学报(自然科学版), 2006, 27(3): 84-87.
[6] KUROZAWA L E, BARBIN D F, HUBINGER M D. Implications of non-equilibrium states and glass transitions in frozen and dried fish and meat products[M]// RAHMAN M S. Non-Equilibrium states and glass transitions in foods. Woodhead Publishing, 2017: 325-348. DOI:10.1016/B978-0-08-100309-1.00013-4.
[7] OLSSON G B, OFSTAD R, LØDEMEL J B, et al. Changes in waterholding capacity of halibut muscle during cold storage[J]. LWT-Food Science and Technology, 2003, 36(8): 771-778. DOI:10.1016/S0023-6438(03)00098-7.
[8] WANG Z, XU W, KANG N, et al. Microstructural, protein denaturation and water holding properties of lamb under pulse vacuum brining[J]. Meat Science, 2016, 113: 132-138. DOI:10.1016/ j.meatsci.2015.11.015.
[9] PORNRAT S, SUMATE T, ROMMANEE S, et al. Changes in the ultrastructure and texture of prawn muscle (Macrobrachuim rosenbergii) during cold storage[J]. LWT-Food Science and Technology, 2007, 40(10): 1747-1754. DOI:10.1016/j.lwt.2007.01.006.
[10] 汪之和, 王慥, 苏德福. 冻结速率和冻温度对鲢肉蛋白质冷冻变性的影响[J]. 水产学报, 2001, 25(6): 564-569.
[11] 阴晓菲, 范鸿冰, 郑超, 等. 不同冻结方法对草鱼鱼片冻藏-冷藏期间蛋白质生化特性的影响[J]. 中国农业大学学报, 2013, 18(6): 158-163.
[12] 关志强, 宋小勇, 李敏. 冻藏条件对蛤的蛋白质泠冻变性的影响及其改善的实验研究[J]. 食品科学, 2005, 26(9): 166-169.
[13] OHKUMA C, KAWAI K, VIRIYARATTANASAK C, et al. Glass transition properties of frozen and freeze-dried surimi products: effects of sugar and moisture on the glass transition temperature[J]. Food Hydrocolloids, 2008, 22(2): 255-262. DOI:10.1016/ j.foodhyd.2006.11.011.
[14] BENJAKUL S, SUTTHIPAN N. Muscle changes in hard and soft shell crabs during frozen storage[J]. LWT-Food Science and Technology, 2009, 42(3): 723-729. DOI:10.1016/j.lwt.2008.10.003.
[15] ANACLETO P, TEIXEIRA B, MARQUES P, et al. Shelf-life of cooked edible crab (Cancer pagurus) stored under refrigerated conditions[J]. LWT-Food Science and Technology, 2011, 44(6): 1376-1382. DOI:10.1016/j.lwt.2011.01.010.
[16] LORENTZEN G, ROTABAKK B T, OLSEN S H, et al. Shelf life of snow crab clusters (Chionoecetes opilio) stored at 0 and 4 ℃[J]. Food Control, 2016, 59: 454-460. DOI:10.1016/j.foodcont.2015.06.019.
[17] YANG Fang, RUSTAD T, XU Y, et al. Endogenous proteolytic enzymes: a study of their impact on cod (Gadus morhua) muscle proteins and textural properties in a fermented product[J]. Food Chemistry, 2015, 172: 551-558.
[18] 宋丽丽, 郜海燕, 葛林梅, 等. 提高冻藏鮰鱼片解冻品质的研究[J].浙江农业学报, 2010, 22(1): 105-108.
[19] 吴燕燕, 游刚, 李来好, 等. 无磷品质改良剂对阿根廷鱿鱼冷冻变性的影响[J]. 南方水产科学, 2013, 9(5): 19-24.
[20] 屠冰心, 娄永江, 刘永固. 低温速冻处理对养殖大黄鱼冻藏品质的影响[J]. 渔业科学进展, 2014, 35(1): 55-59.
[21] LORENTZEN G, SKULAND A V, SONE I, et al. Determination of the shelf life of cluster of the red king crab (Paralithodes camtschaticus) during chilled storage[J]. Food Control, 2014, 42: 207-213. DOI:10.1016/j.foodcont.2014.02.019.
[22] 汤辰婧, 松前成辉, 付娜, 等. 不同阶段中华绒螯蟹脂含量及脂肪酸组成分析[J]. 食品科学, 2013, 34(22): 174-178. DOI:10.7506/ spkx1002-6630-201322035.
[23] 武华, 洪惠, 罗永康, 等. 冻藏温度对鳙鱼片脂质特性变化的影响[J].中国农业大学学报, 2014, 19(6): 173-178.
[24] 李学英, 刘会省, 杨宪时, 等. 冻藏温度对南极磷虾品质变化的影响[J].现代食品科技, 2014, 30(6): 191-195.
[25] 章银良, 安巧云, 慧杨. 脂肪氧化对蛋白质结构的影响[J]. 食品科学, 2012, 33(1): 25-30.
[26] AUBOURG S P. Interaction of malondialdehyde with biological molecules-new trends about reactivity and significance[J]. International Journal of Food Science and Technology, 1993, 28(4): 323-335.
[27] 郝淑贤, 吴燕燕, 李来好, 等. 加工条件对淡水鱼肌原纤维Ca2+-ATPase稳定性的影响[J]. 食品科学, 2005, 26(10): 79-82. DOI:10.3321/j.issn:1002-6630.2005.10.013.
[28] 黄楚森, 朱维平, 徐玉芳, 等. 蛋白质巯基及其氧化性修饰的化学检测方法[J]. 药学学报, 2012, 47(3): 280-290.
[29] TOLSTOREBROV I, EIKEVIK T M, BANTLE M. Effect of low and ultra-low temperature applications during freezing and frozen storage on quality parameters for fish[J]. International Journal of Refrigeration, 2016, 63: 37-47. DOI:10.1016/j.ijrefrig.2015.11.003.
[30] GARCÍA-SÁNCHEZ G, SOTELO-ROMERO C R, PACHECOAGUILAR R, et al. Effect of freezing on protein denaturation and gelling capacity of jumbo squid (Dosidicus gigas) mantle muscle[J]. LWT-Food Science and Technology, 2015, 60(2): 737-742. DOI:10.1016/j.lwt.2014.10.051.
Effect of Freezing Rate on Biochemical Characteristics of Freshwater Crab Muscle
PENG Huanhuan1, LIU Xiaoli2, HUANG Hongbing3, XIA Xiudong2, ZHOU Jianzhong2, LIU Yuan1,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Institute of Agro-Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China; 3. Freshwater Fisheries Research Institute of Jiangsu Province, Nanjing 210017, China)
Abstract:In this paper, the effect of different freezing methods including slow fridge freezing at -20 ℃, and rapid freezing at -20, -40 and -60 ℃ and in liquid nitrogen, on biochemical characteristics of freshwater crabs were evaluated in terms of muscle pH and malondialdehyde (MDA) content, and Ca2+-ATPase activity, total sulfhydryl content, and surface hydrophobicity of myofibrillar protein. The results showed that during storage at -20 ℃, pH, Ca2+-ATPase activity and total sulfhydryl content decreased, MDA content increased firstly and then decreased, and surface hydrophobicity increased continuously. All tested parameters changed more slowly or less significantly in rapidly frozen group than in the slowly frozen one. Freezing at -60 ℃ and in liquid nitrogen were significantly better than at -20 ℃ and -40 ℃. Moreover, there was no significant difference in freezing between -60 ℃ and in liquid nitrogen.
Key words:crab; freezing rate; protein; lipid; oxidation
DOI:10.7506/spkx1002-6630-201713019
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2017)13-0113-05
引文格式:
彭欢欢, 刘小莉, 黄鸿兵, 等. 冻结速率对河蟹肌肉生化特性的影响[J]. 食品科学, 2017, 38(13): 113-117. DOI:10.7506/ spkx1002-6630-201713019. http://www.spkx.net.cn
PENG Huanhuan, LIU Xiaoli, HUANG Hongbing, et al. Effect of freezing rate on biochemical characteristics of freshwater crab muscle[J]. Food Science, 2017, 38(13): 113-117. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713019. http://www.spkx.net.cn
收稿日期:2016-06-16
基金项目:江苏省农业科技自主创新资金项目(CX(15)1011)
作者简介:彭欢欢(1991—),女,硕士研究生,研究方向为水产品加工与贮藏。E-mail:lovelylixiao@163.com
*通信作者:刘源(1979—),男,教授,博士,研究方向为食品风味与品质评价。E-mail:yliu@shou.edu.cn