刘 兵,夏秀芳,孔保华*,孙方达,韩 齐,李龙祥
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
摘 要:将纤维蛋白原作为黏结剂应用于重组牛肉中,其中以2.0%血浆蛋白粉、0.3%复合磷酸盐、0.5% NaCl及4.0%水为基础,分别添加0.0%、1.0%、1.5%、2.0%、2.5%的纤维蛋白原混合。测定重组肉的色差、水分活度及解冻损失,通过质构仪测定纤维蛋白原添加量及凝结时间对黏结力的影响,同时应用低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)技术研究纤维蛋白黏结过程中水分子的迁移变化规律,并通过扫描电子显微镜对比以谷氨酰胺转氨酶(transglutaminase,TG)与纤维蛋白原为黏结剂的重组肉微观结构。结果表明,随着纤维蛋白原添加量的不断增加,重组肉的水分活度稍有降低但不显著(P>0.05)、解冻损失率显著减少(P<0.05)、产品的红度值显著增加(P<0.05),亮度值有所减弱;重组肉的黏结力随纤维蛋白原添加量及凝结时间的延长而显著增大(P<0.05)。同时,LF-NMR研究结果显示,纤维蛋白原的添加增加了重组肉黏结过程中水分子的移动性,对重组肉中水分子的束缚能力逐渐增强;电子显微镜检测结果显示,以纤维蛋白原为黏结剂的重组肉比以TG为黏结剂的重组肉微观结构更紧密。上述结果表明,纤维蛋白原可以作为黏结剂应用于重组牛肉加工。
关键词:纤维蛋白原;血浆蛋白粉;复合磷酸盐;低场核磁共振
肉及肉制品的重组技术起源于20世纪60年代,而黏结剂在重组制备中起到关键的作用。黏结剂可以把肉品生产及加工过程中产生的低价值碎肉进行重组,从而形成消费者可接受的高品质产品肉。比较常见的重组肉制品如重组牛排、羊排及烤肉,近几年重组肉产品也趋向于鱼类产品。黏结剂一般可通过在肉中形成大分子的网状结构,减少肉及肉制品的营养和风味的损失,并减少水分渗出[1]。纤维蛋白原早期作为一种商品化的医用生物材料受到重视,其可使分离的机体组织更容易结合在一起。并且血液中来源的纤维蛋白由于具有生物相容性及可生物降解性,不引起炎症、异物反应、组织坏死或广泛的纤维变性,所以纤维蛋白原已被广泛应用于临床,起到其他生物或合成黏结材料所无法比拟的效果[2]。
在肉类生产中,有研究表明血液中的蛋白质具有良好的功能性质,特别是具有较好的溶解性、凝胶性和乳化能力,其中纤维蛋白原起主要的黏结作用[3-4]。血浆蛋白粉与纤维蛋白原可以作为黏结剂的原因,是因为它们在加热过程中可以形成蛋白凝胶,纤维蛋白凝胶可以起到黏合、封闭的作用[5]。Lennon等[6]利用纤维蛋白原制作重组猪肉风干火腿,并确定了不同盐添加量对其稳定性的影响,结果显示添加纤维蛋白原的产品具有较高的黏结力。目前工业生产中比较常见黏结剂主要包括微生物来源的转谷氨酰胺酶(transglutaminase,TG)和海藻酸盐类(多糖物质,其一般与两价离子结合使用)两类,然而它们有一定的不足。由于TG成本高,不能用于重组肉的大规模生产。有研究表明使用海藻酸盐制备重组肉会降低产品的感官质量;与TG制备的重组肉相比,海藻酸盐制备的产品不能形成均匀的肌肉纹理,并且产品风味有所减弱[7]。在重组肉的加工中,一般将纤维蛋白原与血浆蛋白粉混合使用,促进纤维蛋白原形成纤维蛋白凝胶,从而使碎肉达到重组的目的[8]。复合磷酸盐为保水剂,有研究表明NaCl质量分数小于或等于1%时,有助于纤维蛋白凝胶形成[9-10]。
目前关于纤维蛋白原在重组肉中的应用研究相对较少,本实验主要通过将纤维蛋白原与血浆蛋白粉复配为黏结剂,通过在重组牛肉中添加不同质量分数的纤维蛋白原,测定重组肉颜色、黏结力及水分子迁移等指标,探讨纤维蛋白原的添加量对重组肉品质的影响。本实验可为纤维蛋白原在重组肉中的应用提供理论依据。
1.1 材料
碎牛肉、食用盐 哈尔滨市好又多超市;血浆蛋白粉、猪血浆 天津宝迪农业科技(集团)股份有限公司;复合磷酸盐(三聚磷酸盐、焦磷酸钠、六偏磷酸钠) 黑龙江省丰达食品配料有限公司;TG 泰兴市一鸣生物制品有限公司。
1.2 仪器与设备
FE20K pH计 上海梅特勒-托利多仪器设备有限公司;Aqua Lab水分活度测定仪、JD500-2电子天平沈阳龙腾电子称量仪器有限公司;ZE-6000 电子色差仪日本电色工业株式会社;TA-XT Plus质构分析仪适配探头A/SPR、Mq-20低场核磁共振分析仪 德国布鲁克公司;S-3400N型扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 纤维蛋白原的制备
参照李敏康等[11]的方法,利用纤维蛋白原在低温条件下可形成絮状沉淀的性质,采用冻融法从血浆中提取纤维蛋白原。提取方法为:将抗凝血浆在-20 ℃条件下冷冻12 h,经4 ℃解冻后4 ℃、3 000 r/min离心15 min,获得浓缩纤维蛋白原沉淀。使用时需提前在室温条件下缓化、切碎均质成糜状后加入重组肉中。
1.3.2 重组肉的制作
将去除筋膜、筋腱的100g碎牛肉,切成1.0~2.0 cm3的肉块,按照肉块质量添加质量分数2%血浆蛋白粉、0.3%复合磷酸盐及0.5% NaCl为配料,添加不同质量分数(0.0%、1.0%、1.5%、2.0%、2.5%)的纤维蛋白原,混合均匀。4 ℃腌制1.5 h,经模具施加压力后成型,放入-23 ℃冰箱里储藏后,于4 ℃冰箱中缓化,成品待检测。
以TG为黏结剂的重组肉制作方法,将去除筋膜、筋腱的100 g碎牛肉,切成1.0~2.0 cm3的肉块,按照肉块质量添加质量分数0.2% TG、质量分数0.3%酪蛋白酸钠、质量分数0.3%复合磷酸盐及质量分数0.5% NaCl为配料,混合均匀。4 ℃腌制1.5 h,经模具施加压力后成型,放入-23 ℃冰箱里贮藏后,于4 ℃冰箱中缓化,成品待检测。
1.3.3 颜色的测定
色差计可测定物体本身的颜色和光泽及各检测样品之间的色度差值。L*值表示样品的亮度值,该值越大,表示产品的光泽越好;a*值表示样品的红度,该值越大,说明产品颜色越红。将重组牛肉切成2 cm×2 cm×2 cm的肉块,在生鲜状态下使用ZE-6000色差计测定。使用O/D测试头,白板色度值L*值=96.22,a*值=6.03,b*值=15.06。每个样品取3 个平行样,经色差仪检测后,取平均值。
1.3.4 水分活度的测定
水分活度在智能型水分活度仪中进行测定,每个样品测定3 次。
1.3.5 解冻损失率的测定
根据Serrano等[12]略有改动,将重组牛肉切成3 cm×3 cm×2 cm 的肉块,称肉质量(m0/g),室温条件下解冻后,用滤纸吸去表面的水分,称量肉质量(m1/g),解冻损失率(thawing loss,TL)用公式(1)计算。
1.3.6 黏结力及黏结时间的测定
利用质构仪测定重组肉的黏结力,将冷冻后的重组肉制品取出,在4 ℃冰箱中解冻,在中心温度达到0 ℃时将肉样切片(9 cm×2.5 cm×0.5 cm),并用拉断力表示黏结力。质构仪参数设定:取探头A/SPR在质构仪(力臂25 kg)进行拉伸实验,测试速率为1.0 mm/s,测试前后速率为2.0 mm/s,测试模式为Noodle tension,感应力为5 g,断裂感应力20 g。因为拉断样品所需的最大黏结力与样品的横截面积有很大关系,如果样品的截面积越大,则所需的拉力就越大。
并利用计时器测定不同黏结时间。重组肉黏结操作开始到形成稳定的黏结状态所需要的时间定义为黏结时间。因此,取肉片被拉断瞬间所达到的最大黏结力Fmax/(N/cm2),即肉片的拉断应力表示肉片的黏结强度,测定达到最大黏结力所用的黏结时间t/h。重组肉的黏结速率K用公式(2)计算。
1.3.7 应用低场核磁共振技术测定重组肉不同试样水分子的运动状态
参照Aursand等[13]的方法并略作修改,采用低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)技术,将解冻的重组生肉切碎放在专用的测定试管中(试管直径1.8 cm、高度18 cm),LF-NMR分析仪的磁场强度为0.47 T,质子共振频率为20 MHz。采用Carr-Purcell-Meiboom-Gill(CPMG)程序测定纤维蛋白的横向弛豫时间T2,对于每一个样品,测定时自动扫描8 次,每次扫描重复的间隔时间为2 s。测定后的每个样品的T2,通过Contin软件进行反演,反映出相应的弛豫时间(T21、T22和T23),分析水分子在重组肉中的运动情况。
1.3.8 重组肉黏结部位的微观结构测定
通过扫描电子显微镜分析,对比采用TG和采用纤维蛋白原作为黏结剂加工的重组肉黏结部位的微观结构。将凝胶样品切成尽可能薄的薄片(厚度约1~2 mm)后进行实验。首先将样品浸泡在2.5% pH 6.8的戊二醛溶液内过夜进行固定,然后使用0.1 mol/L pH 6.8磷酸盐缓冲液洗涤样品,共洗涤样品3 次,每次10 min。之后将样品分别用体积分数为50%、70%、80%、90%的乙醇浸泡脱水处理,接着进行样品的二次脱水,二次脱水则使用100%乙醇,二次脱水共需要3 次,每次10 min,然后再将样品浸泡在氯仿中脱脂1 h后用按乙醇与叔丁醇1∶1的比例置换一次,最后放入冷冻干燥仪中[14-15]。然后挑选截面平缓的样品黏贴在扫描电子显微镜专用的台面上,黏贴好后对样品表面喷金待检。样品形成的网状结构的放大倍数分别选择:100、500 倍及1 000 倍。扫描电子显微镜加速电压为5 kV。
1.4 数据统计分析
每个实验重复3 次,结果表示为 ±s。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性分析使用Tukey HSD程序[16]。采用Sigmaplot 12.5软件作图。
±s。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性分析使用Tukey HSD程序[16]。采用Sigmaplot 12.5软件作图。
2.1 重组牛肉颜色、水分活度及解冻损失率的变化
表1 不同质量分数纤维蛋白原对重组牛肉的颜色、水分活度(aw)及解冻损失率的影响
Table 1 Effect of fibrinogen concentration on color, water activity and thawing loss of restructured beef

注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
由表1可以看出,随着纤维蛋白原的添加量逐渐增多,重组肉的L*值明显降低,且差异显著(P<0.05),其中纤维蛋白原添加量为2.0%和2.5%时差异不显著(P>0.05),重组肉的a*值明显增高,其中纤维蛋白原添加量0.0%、1.0%、1.5%差异不显著(P>0.05),0.0%与2.0%相比差异性显著(P<0.05),0.0%与2.5%相比差异显著(P<0.05),重组肉的b*值稍有降低但差异不显著(P>0.05),分析由于从血浆中提取纤维蛋原,纤维蛋白原离心沉淀中可能存有少量的血红素蛋白,从而导致以纤维蛋白原形成的重组肉的L*值和a*值的改变。另一种方面是添加的纤维蛋白原进入重组肉后形成的纤维蛋白凝胶可以有效地阻止重组肉中的汁液(包括血红蛋白)的流失,从而与不能形成的凝胶的对照样相比,重组肉颜色更好。
aw是指食品中水分存在的状态,即水分与食品结合程度(游离程度)。aw值越高,结合程度越低,aw值越低,结合程度越高。随着纤维蛋白原添加量的增加,重组肉的aw值稍有降低但差异不显著(P>0.05)。说明纤维蛋白原的添加促使水分与肌肉纤维结合程度越高。
由表1还可以看出,随着纤维蛋白原添加量的逐渐增加,重组肉的解冻损失率逐渐降低且差异显著(P<0.05),这可能是由于纤维蛋白凝胶可以形成大的三维网状结构,这些网状结构可以有效地抑制重组肉在解冻过程中营养成分的流失。以上研究结果与Chen[16]、Aguilera[17]等报道纤维蛋白作为黏结剂可以形成大分子网状结构的纤维蛋白凝胶,这种凝胶可以有效地阻止肉制品中的水分、风味以及营养物质的流失相似。
2.2 重组牛肉黏结力的变化

图1 不同质量分数纤维蛋白原及不同黏结时间对重组肉黏结力的变化
Fig. 1 Effect of fibrinogen concentration and binding time on binding strength of restructured beef
图1 表示在黏结时间超过7.0 h后重组肉黏结力的变化趋势图,可以看出随纤维蛋白原添加量逐渐增加,重组肉的黏结力逐渐增大,且在同一黏结时间内纤维蛋白原添加量2.0%、2.5%与1.0%、1.5%黏结力变化不明显。不添加纤维蛋白原的重组肉没有黏结力。
从黏结时间(0~7 h)进行分析得到,在同一纤维蛋白原添加量时,随着黏结时间的延长黏结力明显增大,并且1.0%和1.5%纤维蛋白原添加量时,5.5 h后黏结力达到稳定,而2.0%和2.5%纤维蛋白原添加量时,6.0 h后黏结力达到稳定。这与Herrero等[18]研究结果类似。没有添加纤维蛋白原的对照样由于不能形成纤维蛋白凝胶,因此没有黏结性。并且随着纤维蛋白原添加量的增加,纤维蛋白形成凝胶的交联反应不断增强,凝胶形成的速度加快,纤维蛋白凝胶增多,从而黏结力增大。纤维蛋白聚合形成凝胶或凝块,由于其形成的三维网状结构,这种结构承受一定的机械外力[18]。并且Ryan[7]、Weisel[19]等也发现纤维蛋白凝胶具有一定刚性及硬度,随黏结时间延长纤维蛋白凝胶强度越大。
表2 不同质量分数纤维蛋白原重组肉的最大黏结力及黏结速率的变化
Table 2 Effect of fibrinogen concentration on maximum binding strength and binding rate restructured beef

表2显示在黏结时间充分的情况下,添加不同质量分数的纤维蛋白原重组肉所达到的最大黏结力及黏结速率变化。随着纤维蛋白原添加量的增加,重组肉的最大黏结力逐渐增大,且差异显著(P<0.05),与对照样相比添加纤维蛋白原组重组肉黏结力差异显著(P<0.05)。且当纤维蛋白原添加量达到2.5%时黏结力达到最大0.46 N/cm2,黏结速率表示纤维蛋白黏合剂在重组肉中纤维蛋白凝胶形成的速率,由表2可以看出,当纤维蛋白原添加量达到2.5%时,凝胶形成速率最大可以达到0.10 N/(cm2·h)。
2.3 重组肉不同试样水分子的运动状态之间的比较
LF-NMR是磁场强度在0.5 T以下进行的核磁共振,主要通过对纵向弛豫时间T1(自旋-晶格),横向弛豫时间T2(自旋-自旋)和自扩散系数的测量,反映出质子(1H)的运动性质,因此可用于分析纤维蛋白原在凝胶过程中水分子的运动情况[20]。由于本实验的研究对象是重组肉中纤维蛋白凝胶体系中,弛豫时间T21对样品的多孔性特别敏感,弛豫时间T21越大样品的孔细越大[21]。因此,通过横向弛豫时间T21分析纤维蛋白凝胶在黏结过程中水分子的运动情况[22-23]。

图2 不同质量分数纤维蛋白原重组肉横向弛豫时间的变化
Fig. 2 Effect of fibrinogen concentration on transverse relaxation time spectrum of water in restructured beef
图2 为添加不同质量分数纤维蛋白原的重组肉弛豫时间变化图。可以看出两个峰范围,T21(10~100 ms)不易流动水和T22(100~1 000 ms)自由水。重组肉中随着纤维蛋白原添加量的增加,T21横向弛豫时间逐渐缩短,随着纤维蛋白原添加量的增大向左偏移,表明纤维蛋白原形成的纤维蛋白凝胶与重组肉交联越来越致密,T22弛豫时间逐渐延长,且随着纤维蛋白原添加量的增大向右偏移,表明形成的纤维蛋白凝胶可以有效地阻隔外界自由水的进入。
表3 添加纤维蛋白原对重组肉横向弛豫时间值及峰面积的影响
Table 3 Effect of fibrinogen concentration on transverse relaxation time and peak area of water in restructured beef

由表3中T21可以看出,重组肉中随着纤维蛋白原添加量的逐渐增多,弛豫时间逐渐缩短,0.0%及1.0%相比差异显著(P<0.05),纤维蛋白原添加量1.5%、2.0%及2.5%弛豫时间逐渐减小,但差异不显著(P>0.05)。A21峰面积逐渐减小且差异显著(P<0.05),T22弛豫时间逐渐延长,但差异不显著(P>0.05)。这与Herrero等[24]通过拉曼光谱及成像低场核磁结果类似,从横向弛豫时间缩短分析,可能是由于添加纤维蛋白原后,肌纤维间形成致密的纤维蛋白凝胶结构,使分子间的作用力变强,对水的束缚作用增高,水分子的运动性减弱,从而导致弛豫时间减小。有研究表明[25]重组肉中纤维蛋白凝胶形成,改变了肌肉的结构,减少了α-螺旋及疏水作用,增加无序结构,蛋白结构的改变导致蛋白与蛋白之间和蛋白与水之间相互作用力的改变,从而间接使纤维蛋白凝胶对水的束缚作用增强。
2.4 重组肉微观结构的对比
经对比后选择2%纤维蛋白原作为最优添加量制作重组牛肉。TG黏结剂在重组肉中的应用原理是其可催化蛋白中谷氨酰胺和赖氨酸残基发生酰基转移反应,从而使蛋白质之间发生交联[26],且肌肉中的肌球蛋白和肌动蛋白都是较适合TG作用的底物,经TG的催化肌肉蛋白分子间可以形成致密的三维网状结构[28-29]。而纤维蛋白原黏合结剂是血浆来源的复合制剂,它是通过模拟血凝的最后反应阶段,形成半刚性纤维蛋白凝块从而使碎肉重组[25]。
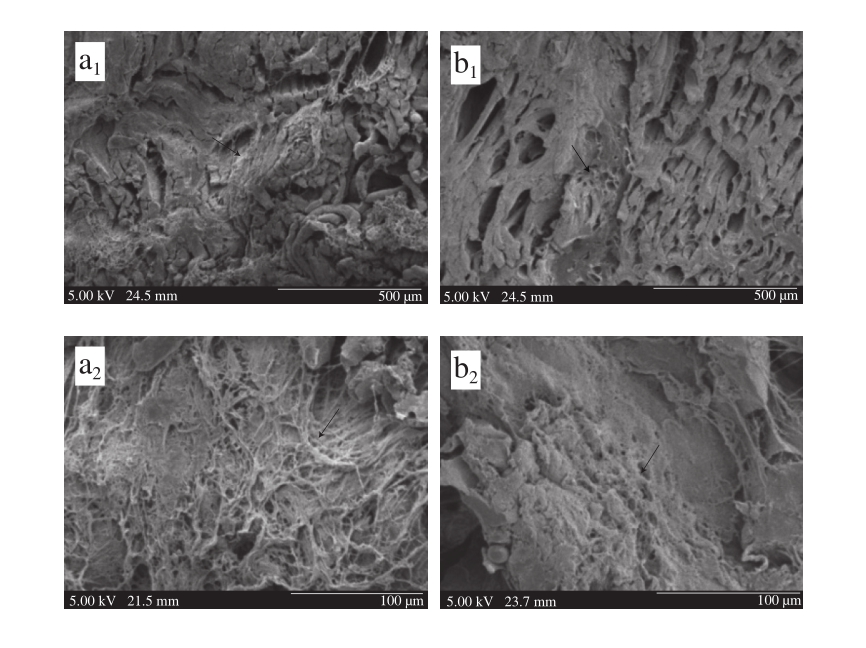

图3 TG与纤维蛋白原形成重组肉的三维网状扫描电子显微镜图
Fig. 3 Three-dimensional network microstructure of restructured beef formed by TG and fibrinogen observed under SEM
由图3可以看出,100 倍电子显微镜图显示出肌肉纤维间纤维蛋白凝胶的黏结区域,从500 倍电子显微镜图观察到同种肌纤维间TG黏结连接区域相对比较大,1 000 倍组电子显微镜图中观察到传统的TG黏结剂在重组肉中形成的网状结构,肌肉纤维之间的蛋白交联网中网丝比较粗糙,网状结构之间空隙明显,并且内部有镂空缝隙。图3b3显示,纤维蛋白原在重组肉中肌肉纤维之间可以形成均匀地有规律的区域,在区域之间纤维蛋白形成类网状的结构与肌肉纤维交织在一起,网丝之间空隙及镂空缝隙相对较少,并且随着扫描倍数的加大,可以看到在交织在肌肉纤维之间的三维网状结构拥有更高的密集度。Herrero等[24]也通过核磁成像设备观察,证实纤维蛋白凝胶在可以形成致密的三维网状结构。
参考文献:
[1] LU G H, CHEN T C. Application of egg white and plasma powders as muscle food binding agents[J]. Journal of Food Engineering, 1999, 42: 147-151. DOI:10.1016/S0260-8774(99)00112-0.
[2] 于伟. 纤维蛋白黏合剂制备及其在羊肉重组中的应用研究[D].南京: 南京农业大学, 2006: 20-35.
[3] ÁLVAREZ C, GARCÍA V, RENDUELES M, et al. Functional properties of isolated porcine blood proteins modified by Maillard’s reaction[J]. Food Hydrocolloids, 2012 28(2): 267-274. DOI:10.1016/ j.foodhyd.2012.01.001.
[4] GENTRY P A. Comparative aspects of blood coagulation[J]. The Veterinary Journal, 2004, 168: 238-251. DOI:10.1016/j.tvjl.2003.09.013.
在重组肉中,纤维蛋白原形成的纤维蛋白凝胶的三维网状结构优于TG,且纤维蛋白凝胶具有有效地防止重组肉中营养及水分的流失等优点,因此纤维蛋白原可以作为黏结剂应用于重组肉加工。纤维蛋白凝胶形成的稳定时间为6.0 h,且根据重组肉的颜色、水分活度、解冻损失率、黏结力及水分迁移变化,并结合纤维蛋白原提取工艺,当纤维蛋白原添加量达到2.0%时,重组牛肉具有较高的品质,此时,可得到重组肉的最大黏结力为0.45 N/cm2,黏结速率为0.09 N/(cm2·h)。
[5] NGARIZE S, ADAMS A, HOWELL N. A comparative study of heat and high pressure induced gels of whey and egg albumen proteins and their binary mixtures[J]. Food Hydrocolloids, 2005, 19(6): 984-996. DOI:10.1016/j.foodhyd.2004.12.008.
[6] LENNON A M, McDONALD K, MOON S S, et al. Performance of cold-set binding agents in re-formed beef steaks[J]. Meat Science, 2010, 85(4): 620-624. DOI:10.1016/j.meatsci.2010.03.014.
[7] RYAN E, MOCKROS L, WEISEL J, et al. Structural origin of fibrin clotrheology[J]. Biophysical Journal, 1999, 77: 2813-2826. DOI:10.1016/S0006-3495(99)77113-4.
[8] ROMERO D Á, ORDÓÑEZ J A, ESCUDERO R, et al. The suitability of plasma powder for cold-set binding of pork and restructured dry ham[J]. Meat Science, 2014, 98(4): 709-717. DOI:10.1016/ j.meatsci.2014.06.014.
[9] SPIRITO D, ARCOVITO M, PAPI G, et al. Small and wide an gleelastic light scattering study of fibrin structure[J]. Journal of Applied Crystallography, 2003, 36: 636-641. DOI:10.1107/ S0021889803003947.
[10] STANDEVEN K F, ARIENS A S A, GRANT P J. The molecular physiology andpathology of fibrin structure/function[J]. Blood Reviews, 2005, 19: 275-288. DOI:10.1016/j.blre.2005.01.003.
[11] 李敏康, 钱冬明. 冻融法提取猪血纤维蛋白原[J]. 分析试验室, 2007(4): 65-68.
[12] SERRANO A, COFRADES S, ENEZ-C J F.Transglutaminase as binding agent in fresh restructured beef steak withadded walnuts[J]. Food Chemistry, 2004, 85(3): 423-429. DOI:10.1016/ j.foodchem.2003.07.021.
[13] AURSAND I G, GALLART J L, ERIKSONU, et al. Water distribution in brine salted cod (Gadusmorhua) and Salmon (Salmosalar): a lowfield1H NMR study[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6252-6260. DOI:10.1016/j.foodchem.2003.07.021.
[14] LIU Wenjie, LANIER T C. Combined use of variable pressure scanning electron microscopy and confocal laser scanning microscopy best reveal microstructure of comminuted meat gels[J]. LWT-Food Science and Technology, 2015, 62(2): 1027-1033. DOI:10.1016/ j.lwt.2015.02.001.
[15] ANTONY B, ANDREU O, JOSEP M V, et al. Scanning electron and optical light microscopy: two complementary approaches for the understanding and interpretation of use wear and residues on stone tools[J]. Journal of Archaeological Science, 2014, 48: 46-593. DOI:10.1016/j.jas.2013.06.031.
[16] CHEN M J, LIN C W. Factors affecting the water-holding capacity of fibrinogen/plasma protein gels optimized by response surface methodology[J]. Journal of Food Science, 2002, 67: 2579-2582. DOI:10.1111/j.1365-2621.2002.tb08780.x.
[17] AGUILERA J M, STANLEY D W. The microstructure of food protein assemblies[J]. Food Reviews International, 1993, 9: 527-550. DOI:10.1080/87559129309540977.
[18] HERRERO A M, ORDOÑEZ J A, de ÁVILA R D, et al. Breaking strength of dry fermented sausages and their correlation withtexture profile analysis (TPA) and physico-chemical characteristics[J]. Meat Science, 2007, 77: 331-338. DOI:10.1016/j.meatsci.2007.03.022.
[19] WEISEL J W. The mechanical properties of fibrin for basic scientists and clinicians[J]. Biophysical Chemistry, 2004, 112: 267-276. DOI:10.1016/j.bpc.2004.07.029.
[20] SIMPSON N E, GRANT S C, BLACKBAND S J, et al. NMR properties of alginate microbeads[J]. Biomaterials, 2003, 24: 4941-4948. DOI:10.1016/S0142-9612(03)00418-6.
[21] CIARA K M, PAUL A, ELAINE D, et al. The effect of salt and fibre direction on water dynamics, distribution and mobility in pork muscle: a low field NMR study[J]. Meat Science, 2013, 95(1): 51-58. DOI:10.1016/j.meatsci.2013.04.012.
[22] ANJA H, HANNE C B. Relationships between sensory perception and water distribution determined by low-field NMR T2 relaxation in processed pork-impact of tumbling and RN-allele[J]. Meat Science, 2005, 69(4): 709-720. DOI:10.1016/j.meatsci.2004.11.003.
[23] HANNE C B, METTE K, HENRIK J A. Functionality of myofibrillar proteins as affected by pH, ionic strength and heat treatment-a low-field NMR study[J]. Meat Science, 2004, 68(2): 249-256. DOI:10.1016/j.meatsci.2004.03.004.
[24] HERRERO A M, de la HOZ L, ORDÓÑEZ J A, et al. Magnetic resonance imaging study of the cold-set gelation of meat systems containing plasma powder[J]. Food Research International, 2009, 42(9): 1362-1372. DOI:10.1016/j.foodres.2009.06.014.
[25] CHEN H H, XU S Y, WANG Z. Interaction between flaxseed gum and meatprotein[J]. Journal of Food Engineering, 2007, 80: 1051-1059. DOI:10.1016/j.jfoodeng.2006.08.017.
[26] 李春强. 肌原纤维蛋白的氧化程度对谷氨酰胺转移酶催化交联作用的影响及其机理研究[D]. 无锡: 江南大学, 2013: 28-40.
[27] 朱威, 应蓓文. 纤维蛋白粘合剂: 科学原理和生产方法[J]. 国外医学·预防·诊断·治疗用生物制品分册, 1997(6): 258-261.
[28] JIRA W, SCHWÄGELE F. A sensitive high performance liquid chromatography-tandem mass spectrometry method for the detection of microbial transglutaminase in different types of restructured meat[J]. Food Chemistry, 2017, 221(15): 1970-1978. DOI:10.1016/ j.foodchem.2016.11.148.
[29] MARIA J M, ESTHER G. Reduced-salt restructured European hake (Merluccius merluccius) obtained using microbial transglutaminase[J]. Innovative Food Science and Emerging Technologies, 2016, 38: 182-188. DOI:10.1016/j.ifset.2016.10.004.
[30] BASAPPA M N, DEEPAK S J, JAGADEESH B, et al. Electrophoresis and tandem mass spectrometry approach compared with DNA-based PCR method for authentication of meat species from raw and cooked ground meat mixtures containing cattle meat, water buffalo meat and sheep meat[J]. Food Chemistry, 2017, 233(15): 311-320. DOI:10.1016/ j.foodchem.2017.04.116.
Effect of Porcine Fibrinogen as Binder on the Quality of Restructured Beef
LIU Bing, XIA Xiufang, KONG Baohua*, SUN Fangda, HAN Qi, LI Longxiang
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Abstract:This study investigated the application of combinations of different amounts (0.0%, 1.0%, 1.5%, 2.0% and 2.5%) of porcine fibrinogen with 2.0% plasma protein, 0.3% compound phosphate, 0.5% NaCl, and 4.0% water as a binder in restructured beef. The effects of fibrinogen concentration on the color parameters (L*, a* and b*), water activity and thawing loss of restructured beef were studied, and the binding strength was measured with a texture analyzer as a function of fibrinogen concentration and binding time. Besides, the mobility of water molecules during the binding process was examined by low-field nuclear magnetic resonance (LF-NMR). The microscopic structure of restructured beef made with tansglutaminase (TG) and fibrinogen as a binder was investigated by scanning electron microscopy (SEM). The results showed that increasing the fibrinogen concentration could slightly reduce water activity without statistical significance (P > 0.05), significantly decrease thawing loss (P < 0.05), significantly increase color a* value (P < 0.05), and lower color L* value. The binding strength significantly increased with increasing binding time in the tested range (P < 0.05). At the same time, the results of LF-NMR showed that fibrinogen could increase the mobility and binding of water molecules in restructured beef. SEM examination showed that fibrinogen provided more compact microstructure of restructured beef than TG. Therefore, fibrinogen can be used as a binder in restructured beef.
Key words:fibrinogen; plasma protein; compound phosphate; low-field nuclear magnetic resonance (LF-NMR)
DOI:10.7506/spkx1002-6630-201713021
中图分类号:TS251.93
文献标志码:A
文章编号:1002-6630(2017)13-0125-06
引文格式:
刘兵, 夏秀芳, 孔保华, 等. 猪血制备的纤维蛋白原黏结剂对重组牛肉品质的影响[J]. 食品科学, 2017, 38(13): 125-130. DOI:10.7506/spkx1002-6630-201713021. http://www.spkx.net.cn
收稿日期:2016-05-27
基金项目:黑龙江省应用技术研究与开发重点计划项目(GA15B302)
作者简介:刘兵(1990—),男,硕士研究生,研究方向为畜产品加工。E-mail:897983806@qq.com
*通信作者:孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh@163.com
LIU Bing, XIA Xiufang, KONG Baohua, et al. Effect of porcine fibrinogen as binder on the quality of restructured beef[J].
Food Science, 2017, 38(13): 125-130. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713021. http://www.spkx.net.cn