肖 瑶,李晓斐,丁 虹*
(武汉大学药学院药理学实验室,湖北 武汉 430072)
摘 要:研究岩藻糖对卡介苗(Bacillus calmette-guerin,BCG)和脂多糖(lipopolysaccharide,LPS)诱导的免疫性肝损伤小鼠的保护作用。将30 只小鼠分为5 组,每组6 只,第1天除正常组外,其余小鼠尾静脉注射BCG;第2天岩藻糖低、高剂量组分别灌胃20、100 mg/(kg·d)岩藻糖,阳性对照组灌胃0.1 mg/(kg·d)地塞米松,正常组和模型组小鼠灌胃等量蒸馏水,连续给药14 d,末次灌胃2 h后,除正常组外其余小鼠尾注射LPS;计算小鼠脏器指数,用试剂盒测定血清中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)及过氧化氢酶(catalase,CAT)活力,检测丙二醛(malondialdehyde,MDA)、NO、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)含量;肝组织苏木精-伊红染色并观察;Western blot法测定肝组织核浆分离后核因子-κB(nuclear factor-κB,NF-κB)、核因子-κB抑制剂α(inhibitor of nuclear factor-κBα,IκBα)含量。结果显示,与模型组相比,高剂量岩藻糖能显著减少脏器指数(P<0.05),显著降低ALT、AST活力和MDA、NO、TNF-α、IL-1β、NF-κB含量(P<0.05),显著提高SOD、CAT活力及IκBα含量(P<0.05);病理切片显示肝脏病变得到逆转,与正常组接近。实验结果表明岩藻糖对免疫性肝损伤小鼠有明显的保护作用,可能通过NF-κB/IκBα信号通路来实现。
关键词:氧化应激;肝损伤;卡介苗;脂多糖;核因子-κB
岩藻糖又称为6-脱氧-L-半乳糖,是广泛存在于海带(Zostera marina L.)和褐藻(Phaeophyta)中的一种单糖,也是众多细胞表面多糖、糖蛋白的组成部分。目前大量研究表明,以岩藻糖为单体组分的多糖具有一定的护肝作用,赵雪等[1]通过实验发现,海带中岩藻聚糖硫酸酯具有抗氧自由基的功效,能对CCl4等引起的肝损伤起到保护作用,朱昱哲等[2]的研究表明海参中岩藻聚糖硫酸酯能够对抗长期饮酒造成的肝损伤,Akao等[3]发现岩藻糖修饰的多聚物能够对抗脂多糖(lipopolysaccharide,LPS)诱导的重型肝炎。而岩藻糖是上述多糖的主要组成成分之一,江晓路等[4]发现褐藻寡糖能影响免疫有关酶的活性,暗示岩藻糖调节免疫的潜能,因其对于免疫性肝损伤(immunological liver injury,ILI)的保护作用鲜少被报道,猜测岩藻单糖也能对抗ILI。
ILI是指由某些生物因素(如病毒入侵等)引起的以肿瘤细胞坏死因子、白细胞介素等炎症因子调节异常为特征的肝脏损伤[5],是目前临床肝硬化、肝脏肿瘤、肝脏纤维化的重要诱导因素[6-7]。临床上治疗肝损伤的药物主要包括抗病毒药物(干扰素)、免疫调节剂或护肝降酶药物(联苯双酯)等,但干扰素使用不便,且存在一定的副作用,而联苯双酯易出现反跳现象,一般只用于辅助性治疗[8]。因此,尽早发现能保肝护肝脏、逆转肝脏损伤的有效成分尤为重要。核因子(nuclear factor,NF)-κB是广泛存在于真核细胞中的转录因子[9],当机体受到某些刺激时,可引起NF-κB通路的激活,介导机体炎症、免疫反应的发生[10-16],贾金雪等[17]研究发现钝化NF-κB活化可抑制ILI大鼠的信号转导,因此本实验通过卡介苗(bacillus calmette-guerin,BCG)与LPS诱导建立小鼠ILI模型,探究岩藻糖对肝脏的保护作用及其与NF-κB信号通路的内在联系。
本实验通过计算不同剂量的岩藻糖对ILI小鼠脏器指数的影响,测定血清中谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活力及丙二醛(malondialdehyde,MDA)、NO、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)含量,观察小鼠肝脏病理切片等方式来探究岩藻糖对小鼠ILI的保护作用,随后检测肝组织核浆分离后NF-κB、核因子-κB抑制剂α(inhibitor of nuclear factor-κBα,IκBα)含量,探讨岩藻糖是否通过抑制NF-κB/IκBα信号通路来保护肝脏。
1.1 动物、材料与试剂
雌性昆明小鼠30 只,体质量(20±2) g,由湖北省实验动物研究中心提供,合格编号42000600010207。
岩藻糖 南京鑫越源生物科技有限公司;地塞米松片 广东三才石岐制药股份有限公司;BCG 上海生物制品研究所;LPS 美国Sigma公司;ALT、AST、SOD、CAT、MDA、NO、TNF-α、IL-1β、蛋白抽提试剂盒、苏木精-伊红(hematoxylin and eosin,HE)染液南京建成生物工程研究所;小鼠NF-κB、IκBα抗体美国CST公司。
1.2 仪器与设备
KHB ST-360酶标仪 上海科华生物工程股份有限公司;ST16R离心机 美国Thermo Fisher公司;FA1004电子分析天平 上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 ILI小鼠模型的建立
参考文献:[18-20]的方法,30 只雌性昆明小鼠,随机分为正常组、模型组、岩藻糖低、高剂量组、阳性对照(地塞米松)组,每组6 只小鼠。造模第1天,模型组、岩藻糖低、高剂量组以及阳性对照组小鼠均由尾静脉注射2.5 mg/kg BCG;正常组小鼠经尾静脉注射等量生理盐水。造模第2天开始,岩藻糖低、高剂量组分别按20、100 mg/(kg·d)灌胃,阳性对照组灌胃给予0.1 mg/(kg·d)地塞米松,正常组和模型组小鼠灌胃给予等量蒸馏水,每天1 次。连续给药14 d,末次给药后2 h,除正常组外,所有小鼠尾静脉注射LPS(0.375 mg/kg),建立ILI小鼠模型。
1.3.2 小鼠肝脏、脾指数的测定
末次给药后禁食16 h,称取小鼠体质量,摘眼球取血、断颈处死,解剖取出肝脏、脾,用4 ℃生理盐水冲洗干净,滤纸吸干,称质量,根据下式计算出肝脏、脾指数。
1.3.3 小鼠血清生化指标的测定
小鼠眼球取血后,放置室温1 h后离心,分离出血清。按照试剂盒说明书操作方法,分别对血清中ALT、AST、SOD、CAT活力及MDA、NO、TNF-α、IL-1β含量进行测定。
1.3.4 组织病理学观察
摘取小鼠肝脏左叶组织,用10%中性福尔马林固定,制作病理切片,HE染色后于光学显微镜下观察肝组织切片的病理学变化。
1.3.5 肝组织NF-κB、IκBα含量的测定
采用Western blot检测小鼠肝脏核浆分离后NF-κB、IκBα的蛋白含量。抽提肝组织细胞核蛋白,测定蛋白浓度,电泳、转膜、封闭,经一抗、二抗孵育,ECL(external cavity laser)显影、定影,扫描并分析NF-κB、IκBα蛋白相对含量。
1.4 数据统计分析
使用SPSS 17.0软件进行统计分析,各测定结果以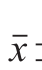 ±s表示,两组间比较采用t检验,P<0.05有统计学意义,P<0.01有极显著差异。
±s表示,两组间比较采用t检验,P<0.05有统计学意义,P<0.01有极显著差异。
2.1 岩藻糖对模型小鼠肝脏、脾指数的影响
表1 小鼠肝、脾脏指数(n=6)
Table 1 Liver and spleen indexes of mice (n= 6)

注:#.相较正常组差异显著(P<0.05);##.相较正常组差异极显著(P<0.01);*.相较模型组差异显著(P<0.05);**.相较模型组差异极显著(P<0.01)。下同。
如表1所示,模型组小鼠的肝、脾指数均显著高于正常组(P<0.01,P<0.05),说明本实验造模成功;阳性对照组与模型组有极显著差异(P<0.01),说明实验方法构建合理。岩藻糖高剂量组能够显著降低肝脏、脾指数(P<0.01,P<0.05),且接近于正常组。
2.2 岩藻糖对模型小鼠血清中ALT、AST、SOD、CAT活力的影响
表2 小鼠血清中ALT、AST、SOD、CAT活力(n=6)
Table 2 Activities of ALT and AST in serum of mice (n= 6)
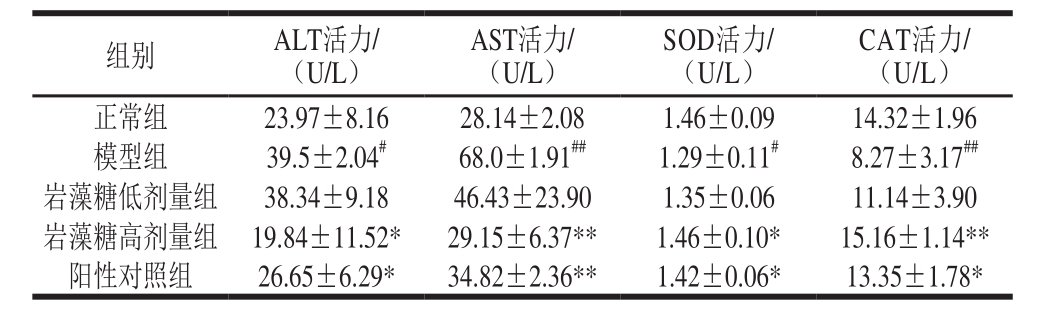
由表2可知,模型组小鼠血清中ALT活力相较正常组显著提高(P<0.05),阳性对照组与模型组相比存在显著差异(P<0.05),验证了实验方法构建的合理性。岩藻糖高剂量组和阳性对照组均能显著降低ALT活力(P<0.05)。此外,模型组小鼠血清中AST活力极显著升高(P<0.01),达正常组的2.5 倍,岩藻糖高剂量组能够极显著降低AST活力(P<0.01),接近于正常值。模型组血清中SOD、CAT活力相较正常组显著降低(P<0.05,P<0.01)。岩藻糖高剂量组和阳性对照组相较模型组能够使SOD、CAT活力明显得到提升(P<0.05,P<0.01)。
2.3 岩藻糖对模型小鼠血清中MDA、NO、TNF-α、IL-1β含量的影响
表3 小鼠血清中MDA、NO、TNF-α、IL-1β含量(n=6)
Table 3 Contents of MDA, NO , TNF-αand IL-1βin serum of mice (n= 6)
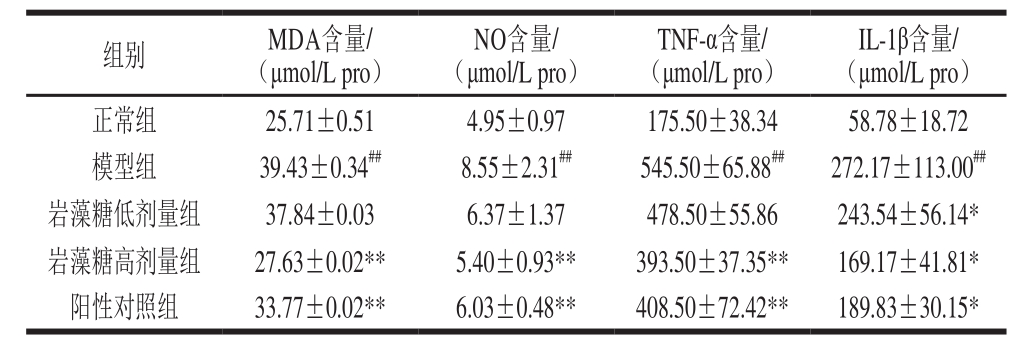
由表3可知,模型组小鼠血清中MDA、NO、TNF-α、IL-1β含量较正常组极显著升高(P<0.01),说明造模成功,阳性对照组相较模型组存在较大差异(P<0.05,P<0.01),说明实验方法构建合理。低剂量岩藻糖能够显著降低血清中IL-1β含量(P<0.05),高剂量岩藻糖能够极显著降低血清中MDA、NO、TNF-α含量(P<0.01),对BCG引起的IL-1β含量升高也能起到显著的抑制作用(P<0.05)。
2.4 模型小鼠肝脏病理切片的观察结果
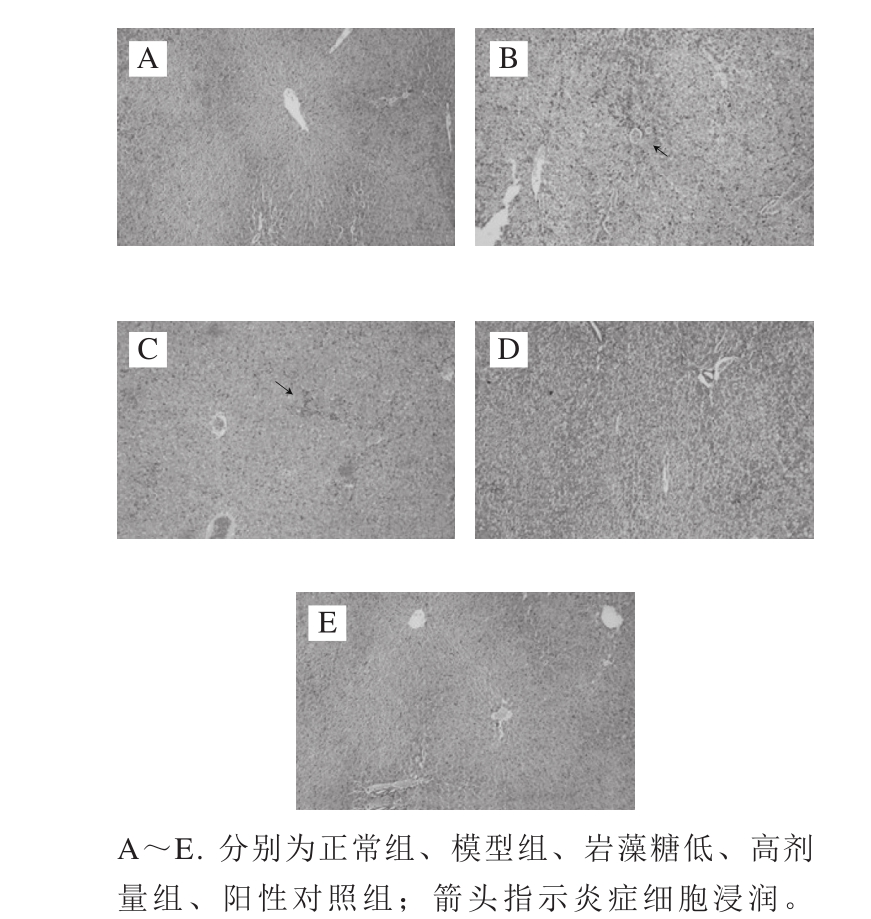
图1 小鼠肝脏病理切片的光学显微镜图(×200)
Fig. 1 Effect of fucose on pathological section of liver of mice (× 200)
各组小鼠肝组织病理切片观察结果如图1所示,正常组(图1A)肝组织结构正常,肝小叶结构完整,肝细胞索呈放射状,整齐排列在肝静脉周围,汇管区少有炎细胞浸润,肝细胞形态正常,无充血坏死现象;模型组(图1B)肝组织遭到破坏,结构异常,肝静脉严重变形,汇管区有大量炎细胞浸润现象,肝细胞充血坏死;岩藻糖低剂量组(图1C)肝脏结构有所改善,但汇管区仍有大量炎细胞浸润,肝细胞仍有少量坏死;岩藻糖高剂量组(图1D)肝脏结构有显著改善,肝脏组织结构趋于正常,仅有极少量炎细胞浸润,区域中出现许多双核肝细胞;阳性对照组(图1E)肝脏结构趋于正常,肝细胞索呈放射状分布,肝静脉形态得以恢复,但仍有一定量炎细胞浸润。
2.5 岩藻糖对模型小鼠肝组织细胞核中NF-κB、IκBα蛋白水平的影响
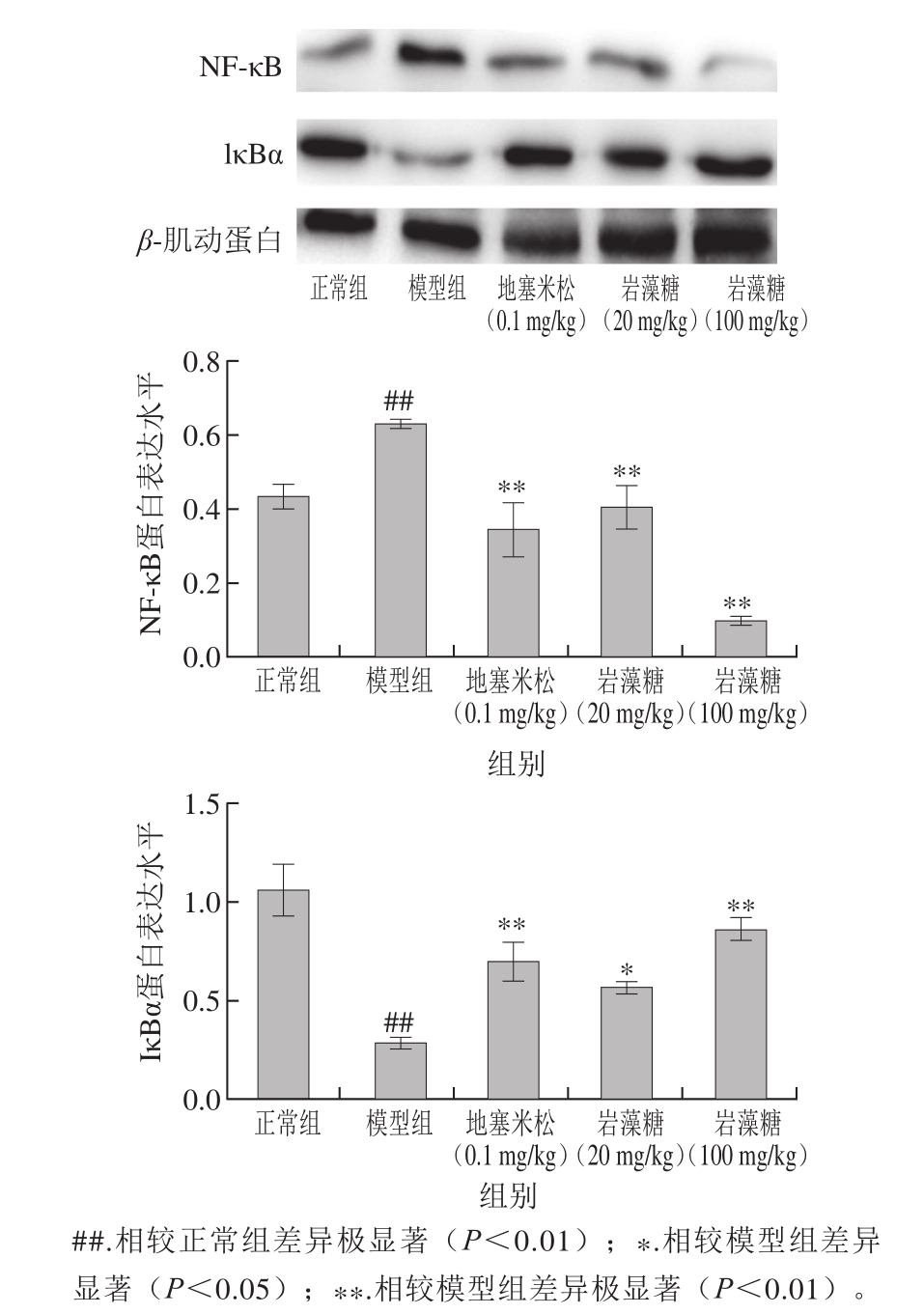
蛋白相对水平
Fig. 2 Contents of NF-
图2 小鼠肝组织中NF-κB、IκBα κB and IκBα in liver tissue of mice
由图2可知,正常小鼠肝脏细胞核中有少量NF-κB表达,模型组小鼠NF-κB相对水平明显增加(P<0.01),岩藻糖高、低剂量组及阳性对照组小鼠NF-κB相对水平相较模型组有极显著性差异(P<0.01),高剂量岩藻糖效果最为显著。模型组小鼠IκBα相对水平较正常组极显著降低(P<0.01),阳性对照组、岩藻糖高剂量组小鼠IκBα相对水平较模型组极显著升高(P<0.01),岩藻糖低剂量组IκBα相对水平显著升高(P<0.05)。
利用BCG、LPS诱导能刺激机体免疫,引起炎症因子分泌,造成肝脏、脾等器官的病变,可制造小鼠ILI模型[21]。本实验采用BCG、LPS对30 只昆明小鼠造模,造模均成功,模型组小鼠肝脏、脾指数相比正常组显著升高(P<0.01,P<0.05),而高剂量岩藻糖能使肝脏、脾指数显著降低(P<0.01,P<0.05),与正常值接近,这说明高剂量岩藻糖能够对ILI起到一定的保护作用。
因肝脏中的ALT、AST水平远高于血清,当肝细胞充血坏死时,即可引起血清中ALT、AST水平成倍增加[22],本实验中模型组ALT、AST活力较正常组有显著提高(P<0.05,P<0.01),而高剂量岩藻糖能使ALT、AST活力恢复接近正常水平,说明高剂量岩藻糖可显著减少肝细胞的坏死,保护肝脏。SOD是能够清除能量代谢中产生的氧自由基的酶,能够有效避免氧自由基引起的细胞膜、线粒体损伤,增强肝细胞抗氧化能力,CAT可以清除歧化反应中产生的过氧化氢,与SOD产生协同作用[23-24]。MDA是脂质过氧化物的分解终产物,会对细胞膜造成一定程度的损伤,其含量反映了肝损伤的程度,高浓度NO也会对肝细胞造成损伤[25],本实验中高剂量岩藻糖能够极显著降低MDA、NO含量(P<0.01),暗示岩藻糖高剂量组小鼠肝损伤程度极大减轻,与肝脏指数一致。张玲等[26]研究发现用药物造肝损伤模型后,TNF-α、IL-1β含量显著升高,故血清中TNF-α、IL-1β含量也能够反映肝细胞损伤程度。本实验中高剂量岩藻糖能显著够降低两者浓度(P<0.01,P<0.05),进一步暗示了其对于肝脏的保护作用,这与病理切片的观察结果一致。正常肝细胞胞质内NF-κB大部分与IκBα结合[27],处于失活状态,当机体受到刺激,引起IκBα磷酸化、泛素化,导致NF-κB被激活,进而进入细胞核中,介导相应基因的转录,导致炎症反应的发生[28]。本实验结果表明岩藻糖能够通过抑制IκBα降解,从而减少NF-κB活化,从而减轻炎症反应,保护肝脏。
目前对于药物对肝损伤作用的研究已有很多,Liang Tao等[29]提出VC对伴刀豆蛋白A诱导的ILI有保护作用,Cho等[30]表明可以通过抗氧化、抗炎来对抗肝损伤,本实验证实了高剂量岩藻糖对ILI的保护作用,其保护机制可能为抑制IκBα降解,从而控制进入核区NF-κB的含量,阻止了后续炎症反应的进一步发生。
参考文献:
[1] 赵雪, 薛长湖, 王静凤, 等. 海带岩藻聚糖硫酸酯低聚糖对小鼠肝损伤的保护作用[J]. 营养学报, 2003, 25(3): 286-289. DOI:10.13325/ j.cnki.acta.nutr.sin.2003.03.018.
[2] 朱昱哲, 王静凤, 石迪, 等. 海参岩藻聚糖硫酸酯对长期饮酒小鼠肝脏保护作用的研究[J]. 营养学报, 2012, 34(5): 474-477. DOI:10.13325/j.cnki.acta.nutr.sin.2012.05.015.
[3] AKAO C, TANAKA T, ONODERA R, et al. Potential use of fucoseappended dendrimer/α-cyclodextrin conjugates as NF-κB decoy carriers for the treatment of lipopolysaccharide-induced fulminant hepatitis in mice[J]. Journal of Controlled Release, 2014, 193, 39(6): 35-41. DOI:10.1016/j.jconrel.2014.07.004.
[4] 江晓路, 杜以帅, 王鹏, 等. 褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J]. 中国海洋大学学报(自然科学版), 2009(6): 1188-1192. DOI:10.3969/j.issn.1672-5174.2009.06.006.
[5] 王华, 魏伟, 岳莉, 等. 白芍总苷对卡介苗加脂多糖引起的小鼠免疫性肝损伤的保护作用[J]. 中国药理学通报, 2004, 20(8): 875-878. DOI:10.3321/j.issn:1001-1978.2004.08.010.
[6] OLLEROS M L, VESIN D, FOTIO A L, et al. Soluble TNF, but not membrane TNF, is critical in LPS-induced hepatitis[J]. Journal of Hepatology, 2010, 53(6): 1059-1068. DOI:10.1016/ j.jhep.2010.05.029.
[7] 张引强, 唐旭东, 郭朋, 等. 荣肝合剂对刀豆蛋白A诱导急性免疫性肝损伤小鼠T淋巴细胞亚群的影响[J]. 中西医结合肝病杂志, 2016, 26(1): 26-29. DOI:10.3969/j.issn.1005-0264.2016.01.010.
[8] 肖小华, 姚闽, 徐丽瑛, 等. 联苯双酯和齐墩果酸对ANIT致小鼠,大鼠肝损伤的作用研究[J]. 实验动物科学, 2015, 32(1): 20-24. DOI:10.3969/j.issn.1006-6179.2015.01.005.
[9] GENTLE I E, WONG W W L, EVANS J M, et al. In TNF-stimulated cells, RIPK1 promotes cell survival by stabilizing TRAF2 and cIAP1, which limits induction of non-canonical NF-κB and activation of caspase-8[J]. Journal of Biological Chemistry, 2011, 286: 13282-13291. DOI:10.1074/jbc.A110.216226.
[10] CHANG Y J, HSU S L, LIU Y T, et al. Gallic acid induces necroptosis via TNF-α signaling pathway in activated hepatic stellate cells[J]. PLoS ONE, 2015, 10(3): e0120713. DOI:10.1371/journal. pone.0120713.
[11] LIN J C, CHANG R L, CHEN Y F, et al. β-Catenin overexpression causes an increase in inflammatory cytokines and NF-κB activation in cardiomyocytes[J]. Cellular Molecular Biology, 2017, 63(1): 17-22. DOI:10.14715/cmb/2017.63.1.4.
[12] KROCK E, CURRIE B, ROSENZWEIG D, et al. (290) Toll-like receptor 2 regulates nerve growth factor through NF-kappaB and MAPK signaling in human intervertebral discs[J]. The Journal of Pain, 2016, 17(Suppl 4): 48. DOI:10.1016/j.jpain.2016.01.196.
[13] PHAM T H, KIM M S, LE M Q, et al. Fargesin exerts antiinflammatory effects in THP-1 monocytes by suppressing PKC-dependent AP-1 and NF-κB signaling[J]. Phytomedicine, 2017, 24: 96-103. DOI:10.1016/j.phymed.2016.11.014.
[14] LEE I S, UH I J, KIM K S, et al. Anti-inflammatory effects of ginsenoside Rg3 via NF-κB pathway in A549 cells and human asthmatic lung tissue[J]. Journal of Immunology Research, 2016, 2016: 7521601. DOI:10.1155/2016/7521601.
[15] WANG L, WANG Y X, CHEN L P, et al. Upregulation of microRNA-181b inhibits CCL18-induced breast cancer cell metastasis and invasion via the NF-κB signaling pathway[J]. Oncology Letters, 2016, 12(6): 4411-4418. DOI:10.3892/ol.2016.5230.
[16] YAO H W, LI J, JIN Y, et al. Effect of leflunomide on immunological liver injury in mice[J]. World Journal of Gastroenterology, 2003, 9(2): 320-323. DOI:10.3748/WJG.v9.i2.320.
[17] 贾金雪, 秦金东, 李学峰, 等. 钝化NF-κB的活化对免疫性肝损伤大鼠CYP2E1的影响[J]. 中国药理学通报, 2015(8): 1076-1080. DOI:10.3969/j.issn.1001-1978.2015.08.010.
[18] 王嫦鹤, 耿庆光, 王雨轩. 白术内酯Ⅰ对免疫性肝损伤的保护作用[J]. 中国中药杂志, 2012, 37(12): 1809-1813. DOI:10.4268/ cjcmm20121224.
[19] 贾玉杰, 赵芳, 张彩华, 等. 中药肝复康对TNF-α介导的炎症性肝损伤和大鼠肝纤维化的抑制作用[J]. 中国微生态学杂志, 2016, 28(2): 146-150. DOI:10.13381/j.cnki.cjm.201602006.
[20] SHUTO Y, KATAOKA M, HIGUCHI Y, et al. Roles of CD14 in LPS-induced liver injury and lethality in mice pretreated with Propionibacterium acnes[J]. Immunology Letters, 2004, 94(1): 47-55. DOI:10.1016/j.imlet.2004.03.008.
[21] 杜宇琼, 赵晖, 车念聪, 等. 不同剂量水红花子对BCG/LPS所致小鼠免疫性肝损伤模型的影响[J]. 吉林中医药, 2011(1): 78-80. DOI:10.3969/j.issn.1003-5699.2011.01.042.
[22] 杨牧祥, 田元祥, 姚树坤, 等. 解酒护肝饮对酒精性肝损伤大鼠血清和肝组织ALT、AST的影响[J]. 河北中医, 2000(10): 793-796. DOI:10.3969/j.issn.1002-2619.2000.10.059.
[23] 王君明, 崔瑛, 王峥涛, 等. 超氧化物歧化酶参与肝损伤的研究进展[J]. 中国实验方剂学杂志, 2011, 17(7): 265-269. DOI:10.3969/ j.issn.1005-9903.2011.07.082.
[24] 韵海霞, 穆志龙, 俞科贤, 等. 帕珠丸对慢性酒精性肝损伤大鼠肝组织SOD、CAT活性及MDA含量的影响[J]. 青海医学院学报, 2014, 35(1): 57-59. DOI:10.13452/j.cnki.jqmc.2014.01.012.
[25] 黄玲, 洪振丰, 周建衡, 等. 粗叶悬钩子根部提取物对急性肝损伤大鼠血清NO和肝组织SOD、MDA的影响[J]. 中国中医药科技, 2008, 15(1): 36-37. DOI:10.3969/j.issn.1005-7072.2008.01.017.
[26] 张玲, 江远, 何金洋, 等. 二甲基亚硝胺诱导小鼠肝损伤模型的建立及其机制研究[J]. 中西医结合肝病杂志, 2010, 20(4): 228-230. DOI:10.3969/j.issn.1005-0264.2010.04.012.
[27] 卫智权, 阎莉, 邓家刚, 等. 芒果苷调控单核细胞NF-κB(P65)与IκBα表达对慢性支气管炎大鼠的保护作用[J]. 药学学报, 2014(5): 596-601. DOI:10.16438/j.0513-4870.2014.05.006.
[28] 秦金东, 薛永志. NF-κB在免疫性肝损伤中的研究进展[J]. 包头医学院学报, 2011, 27(3): 119-121. DOI:10.3969/j.issn.1006-740X.2011.03.069.
[29] LIANG Tao, CHEN Xiaoyu, SU Min, et al. Vitamin C exerts beneficial hepatoprotection against concanavalin A-induced immunological hepatic injury in mice through inhibition of NF-κB signal pathway[J]. Food & Function, 2014, 5(9): 2175-2182. DOI:10.1039/C4FO00224E.
[30] CHO B O, RYU H W, SO Y, et al. Hepatoprotective effect of 2,3-dehydrosilybin on carbon tetrachloride-induced liver injury in rats[J]. Food Chemistry, 2013, 138(1): 107-115. DOI:10.1016/j.foodchem.2012.10.026.
Protective Effects of Fucose on Immunological Liver Injury in Mice
XIAO Yao, LI Xiaofei, DING Hong*
(Pharmacological Laboratory, School of Pharmaceutical Sciences, Wuhan University, Wuhan 430072, China)
Abstract:The protective effects of fucose were studied on immunological liver injury in mice induced by Bacillus calmetteguerin (BCG) and lipopolysaccharide (LPS). Thirty mice were divided into five groups randomly. On the first day, all mice were injected with BCG through tail vein except those in the normal group. Fucose-treated groups were daily administered by gavage at doses of 20 and 100 mg/(kg·d) from the second day, and the positive control group was administered with 0.1 mg/(kg·d) DXM. The normal and model groups synchronously were treated with distilled water at the same amount for 14 days. Two hours after the last gavage, all mice were injected with LPS through tail vein except those in the normal group. The live and spleen indexes of mice were computed. The activities of ALT, AST, SOD and CAT in serum were determined by commercial kits according to the manufacturer’s instructions. The contents of MDA, NO, TNF-α and IL-1β in serum were detected as well. The liver was sliced and pathological examination was implemented via light microscope. The contents of NF-κB and IκBα in liver tissue after nuclear plasma separation were detected through Western blot. In the high-dose fucose group, the increase in liver and spleen indexes were greatly controlled in comparison with the model group, and the activities of ALT, AST and the contents of MDA, NO, TNF-α, IL-1β and NF-κB were reduced, while the activities of SOD and CAT and the content of IκBα were improved (P < 0.05). The hepatopathy of mice was reversed according to the pathological section, which was roughly comparable to the normal group. Immunological liver injury induced by BCG adjuvant can be alleviated or suppressed by fucose via the NF-κB/IκBα pathway.
Key words:oxidative stress; liver injury; Bacillus calmette-guerin; lipopolysaccharide; nuclear factor-κB
DOI:10.7506/spkx1002-6630-201713026
中图分类号:TS254.1
文献标志码:A
文章编号:1002-6630(2017)13-0155-05
收稿日期:2016-05-24
基金项目:国家自然科学基金青年科学基金项目(81273523)
作者简介:肖瑶(1996—),女,本科生,研究方向为药理学。E-mail:913761486@qq.com
*通信作者:丁虹(1964—),女,教授,博士,研究方向为药理学。E-mail:dinghong1106@whu.edu.cn
引文格式:
肖瑶, 李晓斐, 丁虹. 岩藻糖对小鼠免疫性肝损伤的保护作用[J]. 食品科学, 2017, 38(13): 155-159. DOI:10.7506/ spkx1002-6630-201713026. http://www.spkx.net.cn
XIAO Yao, LI Xiaofei, DING Hong. Protective effects of fucose on immunological liver injury in mice[J]. Food Science, 2017, 38(13): 155-159. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713026. http://www.spkx.net.cn