表1 STZ给予前后NC组和DM组大鼠各项指标的变化( s)
s)
Table 1 Changes in body weight and blood parameters of rats in the control and model groups before and after STZ injection ( )
)

注:*.与NC组比较差异显著(P<0.05);**.与NC组比较差异极显著(P<0.01)。
唐华丽1,2,夏 惠1,王 锋1,孙桂菊1,*
(1.东南大学公共卫生学院,教育部环境医学工程重点实验室,江苏 南京 210009;2.重庆三峡学院生命科学与工程学院,重庆 404000)
摘 要:建立适用于血清代谢物谱研究的气相色谱-飞行时间质谱技术,并用于对照组(NC组)、2型糖尿病模型组(type 2 diabetic model group,DM组)及枸杞多糖干预DM大鼠组(Lycium barbarum polysaccharides,LBP组)大鼠血清代谢物谱的分析。采用主成分分析、正交偏最小二乘判别法等模式识别方法对NC组、DM组及LBP组大鼠血清代谢物谱进行分类,并从血清中寻找与2型糖尿病相关结果部分并未出现显著性分析的潜在生物标志物。结果表明,所建立的方法能将3 组大鼠血清代谢物谱分离,DM组大鼠血清中丙氨酸、胸腺嘧啶脱氧核苷酸相对于NC组大鼠降低;LBP干预DM大鼠1 个月后,LBP组大鼠血清中丙氨酸、胸腺嘧啶核苷酸含量有所上升。血清中这丙氨酸、胸腺嘧啶核苷酸可能与氨基酸代谢和核苷酸代谢有关,LBP组与DM组大鼠血清中丙氨酸和胸腺嘧啶核苷酸水平的变化体现了大鼠体内氨基酸和核苷酸代谢的改变。本实验可为进一步研究LBP的降糖作用机制提供参考。
关键词:枸杞多糖;2型糖尿病;代谢组学;生物标志物
代谢组学(metabonomics)是研究生物体受基因改变或环境变化等因素干扰后,其内源性代谢物质种类、数量及其变化规律的一门新兴学科。发展于20世纪90年代中期。重点讨论的是某组织、器官或生物整体的内源性代谢产物的代谢途径及它们在内外因素的影响下随时间变化的规律[1-2]。气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术作为代谢组学研究最常见的分析方法之一,具有灵敏度高、分辨率强、重现性好以及高通量的优点[3-4];适用于对生物样本中氨基酸、有机酸和核苷酸等小分子代谢物质的分析。在代谢组学的分析策略中,不同类型的样品通过不同提取方法及衍生化反应获得相应的GC-MS总离子流图,建立数学模型,从而获得生物体内内源性代谢产物的变量,然后利用MS中强大的谱图解析功能或图谱库检索系统进行识别分析,最后对引起这些代谢物变化的生物学意义进行解释[5-9]。
枸杞子是我国国家公布的药食同源品种之一,作为保健佳品被人类广泛食用或者饮用已有上千年的历史[10]。枸杞多糖(Lycium barbarum polysaccharides,LBP)作为枸杞发挥功效作用的重要活性成分而成为近年来研究的热点,体内外实验均已证实LBP的降糖活性[11-14]。但是与药效学相比,LBP进入机体后代谢生成何种成分,如何影响导致机体血糖波动的代谢途径从而发挥其降糖作用等问题的研究鲜见报道。基于此,本实验利用气相色谱-飞行时间质谱(gas chromatography-time of flight mass spectrography,GC-TOF MS)技术分析2型糖尿病模型大鼠血清代谢谱的变化,研究LBP的血清代谢组学及与其密切相关的小分子生物代谢产物,为LBP的降血糖作用机理研究提供一种新的思路和依据。
1.1 动物、材料与试剂
SPF级SD雄性大鼠30 只,体质量(180±20) g,动物许可证号:SCXK(沪)2012-0006,购自上海思捷实验动物有限公司。
LBP样品(色谱级,纯度>90%,Mw<6 000 D)上海善力键生物有限公司;链脲佐菌素(streptozotocin,STZ,分子式C8H15N3O7) 美国Sigma公司;L-2-氯苯丙氨酸 上海恒柏生物科技有限公司;N,O-(三甲基硅基)三氟乙酰胺(bis-(trimethylsilyl)trifluoroacetamide,BSTFA)、三甲基氯硅烷(chlorotrimethysilane,TMCS) 美国Regis科技有限公司;甲氧胺盐酸盐瑞士Fluka公司;甲醇、吡啶、氯仿、柠檬酸、柠檬酸钠(均为分析纯) 国药集团化学试剂有限公司;葡萄糖氧化酶试剂盒、大鼠胰岛素(insulin,INS)检测试剂盒南京建成生物工程研究所。
1.2 仪器与设备
7890A气相色谱仪 美国Agilent公司;Chroma TOF PEGASUS HT质谱仪 美国LECO公司;色谱柱 美国Restek公司;RE52CS旋转蒸发仪、SHZ-Ⅲ循环水真空泵 上海亚荣生化仪器厂;BSA124S分析天平德国赛多利斯公司;5424R小型台式高速冷冻离心机、加样器 德国Eppendorf公司;Synergy超纯水系统上海百维生物科技有限公司;SHA-B恒温振荡器 金坛市恒丰仪器厂;大鼠代谢笼 苏州新区枫桥实验动物笼具厂。
1.3 方法
1.3.1 2型糖尿病大鼠模型的建立
健康雄性SD大鼠,体质量(180±20) g,适应性喂养7 d。将30 只大鼠随机分为正常对照组(NC组)10 只和糖尿病模型组(DM组)20只。所有大鼠12 h光照,每笼5 只。NC组以普通饲料喂养,DM组喂以高脂饲料(猪油10%、蔗糖10%、蛋黄粉5%、胆固醇0.5%、基础饲料74.5%(均为质量分数),由上海思捷实验动物有限公司提供),持续喂养28 d。于第28天晚禁食过夜(禁食12 h),在第29天上午取尾血测定空腹血糖(葡萄糖氧化酶法)。取样后给予DM组大鼠一次性腹腔注射STZ 35 mg/kg(用0.1 mol/L柠檬酸缓冲液新鲜配制成1%的STZ无菌溶液),NC组仅注射等体积柠檬酸-柠檬酸钠缓冲液。1 d后再次一次性腹腔注射STZ 30 mg/kg,NC组注射等体积柠檬酸-柠檬酸钠缓冲液。一周后,全部大鼠禁食不禁水,12 h后尾部采血测定空腹血糖(葡萄糖氧化酶法);再过2 d复测其空腹血糖值,以葡萄糖(2 g/kg)负荷2 h时的血清葡萄糖浓度大于11.1 mmol/L为成模指标判断其成模率。
1.3.2 LBP对2型糖尿病模型大鼠的干预
将DM组造模成功的大鼠随机分为模型对照组(DM组)和LBP干预组(LBP组),每组6 只。第6周起开始干预实验,每天上午9:00开始灌胃,LBP组按照200 mg/kg剂量[15]灌胃LBP(以体质量计),灌胃体积2 mL,NC和DM组同时灌胃等量蒸馏水,每天1 次,连续给药1 个月。实验期间大鼠自由摄食,饮水,保持动物房温度(22±1) ℃,每天对大鼠行为活动、饮水量、尿量和大便等进行观察。
1.3.3 样本采集与预处理
实验第31天分别对各组大鼠麻醉后股动脉取血,静置30 min血液凝固分层,然后于4 000 r/min离心10 min,取上清液分装至冻存管中,每管0.5 mL,存放于-80 ℃超低温冰箱冻存待测。
1.3.4 大鼠血清样本的GC-TOF MS代谢组学检测
1.3.4.1 代谢物萃取
取血清样品100 μL,先后加入0.35 mL甲醇和20 μL L-2-氯苯丙氨酸,漩涡混匀后于4 ℃,12 000 r/min冷冻离心15 min,小心取0.4 mL上清液于2 mL进样瓶中,同时,取相同体积约20 μL样本于新的2 mL进样瓶中,混匀,混合样品作为质控样本。
1.3.4.2 代谢物衍生化
将盛装样品的进样瓶置于37 ℃真空浓缩器中干燥提取2 h,向干燥后的进样瓶中加入60 μL甲氧胺盐试剂(甲氧胺盐酸盐、吡啶混合物),轻轻混匀后,置于80 ℃烘箱中孵育20 min,然后向各进样瓶中快速加入80 μL BSTFA试剂(含体积分数1%的TMCS),混合物70 ℃孵育1 h,冷却至室温后向混样中加入饱和脂肪酸甲酯标准混合液(FAMEs,溶于氯仿,C8~C16:1 mg/mL;C18~C24:0.5 mg/mL)试剂10 μL,混匀后上机检测。
1.3.5 GC-TOF MS数据采集与分析
1.3.5.1 色谱条件
色谱柱:Rxi-5Sil MS毛细管柱(30 m×250 μm,0.25 μm);前进样口吹扫流量3 mL/min,进样室温度280 ℃,程序升温:初温50 ℃保留1 min,以10 ℃/min升至330 ℃,保留5 min。载气为高纯氦气,流量1 mL/min,不分流进样,进样量体积1.0 μL。
1.3.5.2 质谱条件
EI源,电子能量70 eV,离子源温度250 ℃,溶剂延迟时间366 s,扫描范围30~600 u,扫描速率20 spectra/s,全扫描方式。
1.3.5.3 数据处理及标记物确定
利用Chroma TOF4.3X软件和LECO-Fiehn Rtx5数据库进行数学处理。其处理过程包括基线矫正、峰判别和匹配、消除噪音等。然后获得由样本、保留时间-质荷比和归一化的峰面积组成的三维矩阵图。最后将数学矩阵导入到SIMCA-P+软件包(V14.0,Umetrics AB,Umeå,Sweden)对归一化后的数据进行多元变量模式识别分析。经过数据中心化和Pareto均一化处理后获得具有显著性差异的OPLS-DA图。通过分析找到差异变量,然后利用GC-MS的谱库检索(Fiehn database)和谱图解析以及相应的标准品,结合京都基因与基因组百科全书KEGG(http://www.genome.jp/kegg/)确定变化的代谢途径,从而理解与疾病发生发展相关的生物学信息。
2.1 2型糖尿病大鼠模型的建立
由表1可知,STZ注射前,经高脂高糖喂养4 周以后DM组大鼠的体质量、甘油三酯含量以及总胆固醇含量与NC组大鼠相比均有显著升高(P<0.05),表明高脂高糖饮食能导致大鼠体质量增加以及血脂升高;高脂高糖与普通饲料喂养的大鼠空腹血糖含量没有明显变化,而DM组大鼠血清胰岛素水平有所增加,但未见统计学差异,表明高脂高糖饮食可在大鼠体内引起胰岛素抵抗。STZ给予大鼠以后,DM组大鼠的空腹血糖水平极显著高于普通饲料组(P<0.01),说明高脂高糖饮食不仅可引起脂肪的堆积,还会导致胰岛素敏感性下降,通过STZ的作用,最终可使血糖和胰岛素水平升高,符合2型糖尿病的特征,但是造模过程中,有2 只大鼠死亡,造模成功率为90%。
表1 STZ给予前后NC组和DM组大鼠各项指标的变化( s)
s)
Table 1 Changes in body weight and blood parameters of rats in the control and model groups before and after STZ injection ( )
)

注:*.与NC组比较差异显著(P<0.05);**.与NC组比较差异极显著(P<0.01)。
2.2 大鼠血清GC-TOF MS分析结果

图1 各组血清的GC-TOF MS总离子流图
Fig. 1 GC-TOF MS total ion chromatograms of serum samples in each group
研究中为获得大鼠血清中小分子代谢物的信息,采用GC-TOF MS对血清样本进行分析,各组代表样本的分析结果如图1所示,首先,将经过预处理的GC-MS数据进行PCA,获得各个大鼠血清样本在空间上的分布情况(图2),NC组各样本与DM组和LBP组各样本明显分离,表明NC组与DM组和LBP组的代谢状态明显不同,说明大鼠经高脂高糖膳食与腹腔注射STZ造模后,其血液中正常生理代谢受到严重干扰,认为糖尿病模型成功建立。LBP组各样本点显示出不同程度地向NC组靠近的趋势,说明LBP对2型糖尿病大鼠体内代谢产生了有效的干预作用。而DM组与LBP组各样本分离不显著,而且还存在少量离群样本点,这主要是因为PCA是无监督的模式识别分析技术,分类判别能力较弱,但3大组血清样本都分布在置信区间(95%)内。离群样本点的存在会严重影响聚类结果和生物标志物的寻找结果,然而在代谢组学获得的数据中,由于实验的操作因素或样本本身的原因,经常会有离群样本点存在的现象。为了进一步验证NC、DM和LBP组大鼠血清样本的分离情况,最大化组间分离,并从中识别有效的标志物,对各数据组进行OPLS-DA分析,对样本的代谢全谱进行区分,其得分见图3B。图4中R2代表Y变量的可解释性,Q2代表模型的可预测性,二者越接近1说明OPLS-DA模型越能很好地解释两组样本之间的差异,图4的截距R2=0.944,Q2=-0.058 8,可以很好地体现模型的稳健性。OPLS-DA分析明显提高了数据分类聚合能力,各组样本沿着第1主分分离效果提高,表明与LBP影响有关的分类能力得到提高。载荷图5中距离原点越远说明此因子对分类的贡献系数越大,为潜在的差异标志物。

图2 总体血清样本的PCA得分图
Fig. 2 PCA score plots of total serum samples
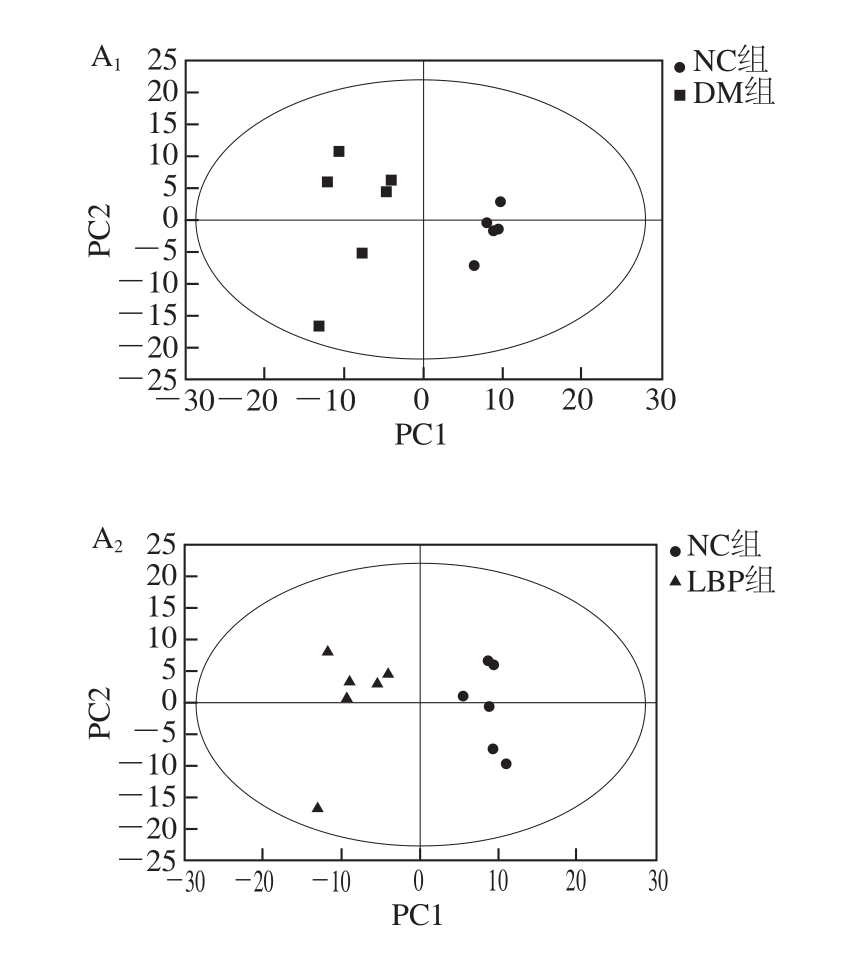
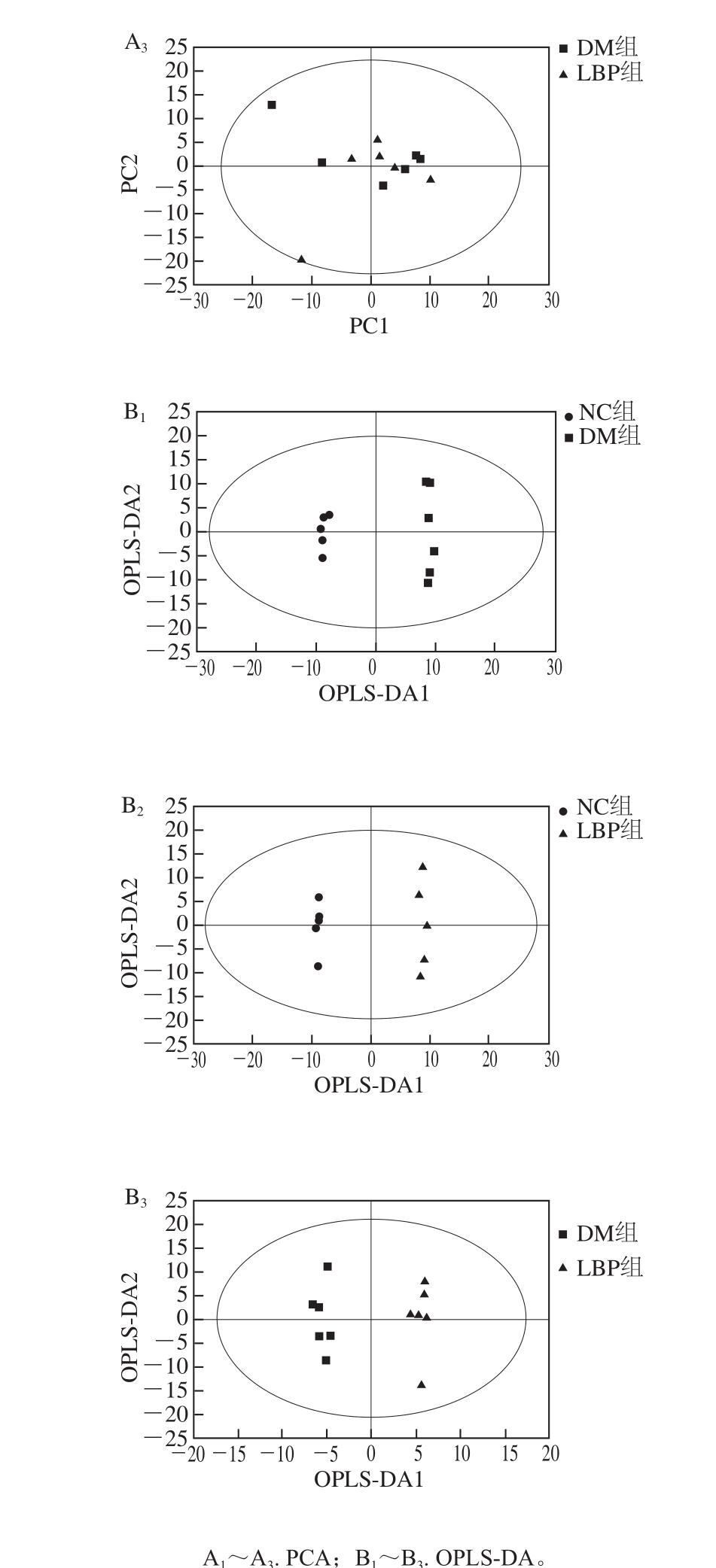
图3 基于糖尿病和正常大鼠血清的PCA和OPLS-DA得分图
Fig. 3 PCA and OPLS-DA score plots of rat serum between DM and NC groups
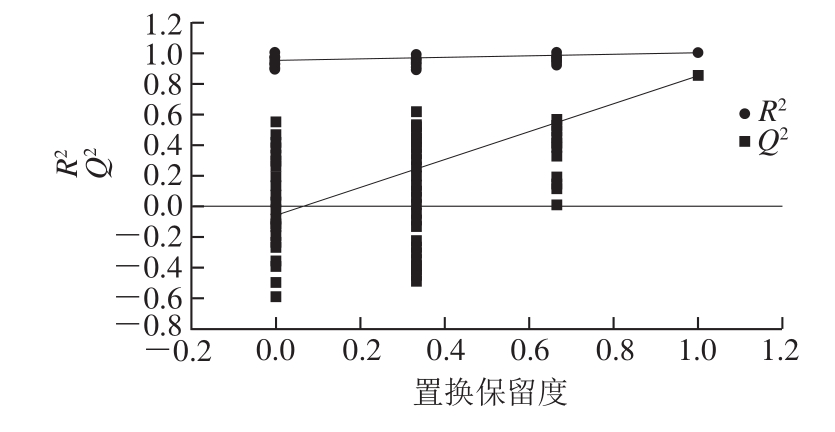
图4 LBP组和DM组血清样本的置换检验图
Fig. 4 Permutation test charts for OPLS-DA model of serum samples between LBP and DM groups
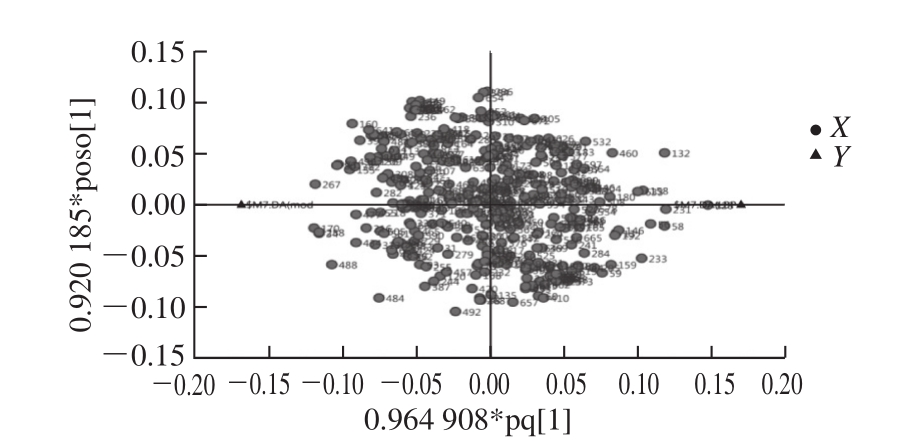
图5 LBP组-DM组血清样本的OPLS-DA载荷图
Fig. 5 OPLS-DA loading plots of serum samples between LBP and DM groups
2.3 差异代谢物的筛选及鉴定
通过OPLS-DA分析过滤掉不相关的正交信号,因而获得的差异性代谢物更加可靠。采用OPLS-DA模型第一主成分的VIP(variable importance in the projection)值(阈值>1),并结合学生氏t检验的P值(阈值0.05)来寻找差异性表达代谢物。
表2 DM组与NC组差异化合物筛选
Table 2 Screening of differentially expressed metabolites between DM and NC groups

表3 LBP组与DM组差异化合物筛选
Table 3 Screening of differentially expressed metabolites between LBP and DM groups

从OPLS-DA结果中筛选出VIP值大于1的变量,并根据载荷分布确定变化方向,对DM组与NC组、LBP组与DM模型组血清样本分别进行比较,差异变量及其变化方向见表2、3。表中相似度为定性出的物质与标准库中物质的匹配程度,满分为1 000,越接近1 000说明定性出的物质越准确。
由表2可知,经STZ造模后,DM组与NC组共发现和鉴定出了20 种特征差异代谢物,DM组大鼠血清中木糖醇、胆固醇、苏氨酸、异亮氨酸、缬氨酸等11 种潜在生物标记物的代谢水平上升;丙氨酸、花生四烯酸、甘氨酸、赖氨酸等9 种潜在生物标记物的代谢水平下调。由表3可知,DM组大鼠灌胃LBP 一个月后,出现了丙氨酸、谷氨酸水平回调升高,这些氨基酸都是糖异生的前体氨基酸,其水平升高表明大鼠体内蛋白质分解水平增加,糖异生途径水平增高。
糖异生主要是由非糖前体物质生成糖的过程,主要意义在于保证某些依赖葡萄糖供能的组织的功能发挥,比如肌肉组织、大脑等。给DM组大鼠灌胃LBP一个月后导致糖异生的生糖氨基酸水平增加,表明为了满足机体正常需求,大鼠机体糖异生水平增加,这与课题组前期研究中LBP能导致机体血糖水平降低的观点一致[16]。因为LBP能使大鼠机体胰岛素敏感性增加,从而导致其血糖水平降低,可是,欲使大鼠大脑与肌肉组织仍然保持正常的血糖水平,那么,其机体的糖异生水平就会增加。
此外,在LBP组有些代谢产物消失,包括一些氨基酸和磷酸葡萄糖酸等,表明LBP组能提高机体的抗氧化能力。其中葡萄糖水平的降低能很好地说明LBP有一定的降血糖效果,而草酰乙酸为三羧酸循环以及柠檬酸-丙酮酸循环的重要中间产物,其浓度降低表明体内糖脂代谢发生紊乱。胸腺嘧啶核苷酸是核苷酸代谢产物,参与嘌呤嘧啶代谢循环,此代谢循环与糖尿病肾病的发病机理十分相关,胸腺嘧啶核苷酸浓度升高可能会引起肾内血管的内皮细胞损伤,造成肾血流动力学异常,从而有引起糖尿病和糖尿病肾病的风险。同时,胸腺嘧啶核苷酸为DNA的合成前体物,其水平升高表明其受体内自由基氧化损伤程度降低[17],说明LBP能有效清除2型糖尿病大鼠体内氧自由基,从而降低胰岛β细胞氧化损伤的风险。
LBP是提取自我国传统中草药枸杞子中的一种水溶性蛋白复合多糖[18-19]。已有研究表明LBP具有很好的降低血糖和血脂、促进胰岛素分泌、改善胰岛素抵抗、增加胰岛素敏感性;改善超氧化物歧化酶、丙二醛、一氧化氮等氧化应激指标的作用[16,20-22],其作用机制可能与上调胰岛素受体底物-1、调节糖代谢相关基因等糖尿病靶器官胰岛功能有关。与其药效学研究相比,LBP被吸收后以何种方式存在、机体受LBP刺激后体内各小分子代谢产物如何变化进而间接影响胰岛素受体底物、调节糖代谢相关基因等问题尚不清楚。
代谢组学是研究生物体受外界因素干扰后,所产生的各种代谢产物的质和量及其变化规律,对生物体代谢过程中的样本进行筛选,检测和分析分子质量在1 000 D以下的小分子化合物组成的方法,较常见的生物样本包括血样、尿样和组织液等。血清常被作为代谢组学分析的一种生物样本,小分子物质含量丰富,其中不仅含有代谢产物,也包括很多代谢中间产物[23-24]。所以本研究选取血清作为实验样本,开展LBP作用于糖尿病大鼠的代谢组学分析研究。Bao Yuqian等[25]利用基于GC-MS联用分析的代谢组学方法分析了82 例新诊断的临床2型糖尿病患者的血清代谢物组的异常,以及在服用二甲双胍、罗格列酮和瑞格列奈3 种临床一线用药随访24 周和48 周的结果,通过与常用的临床指标(FPG、2hPG、HbAlc)对比,发现虽然这3 种药物对血糖以及临床指标的改善相似,但其对血清小分子代谢物的改善作用却各不相同,总体来说以罗格列酮的影响最为显著,从而说明代谢组学的方法不仅可用于临床疾病的诊断和分型,也可以为监测临床药物的效果提供一个全新的视角。由此可见,代谢组学技术对于了解2型糖尿病发病机制、2型糖尿病的早期诊断以及降糖药物的药效学评价方面具有举足轻重的地位。
氨基酸是蛋白质的最终代谢产物,研究表明,糖尿病患者氨基酸谱发生了特征性改变[26-29]。也有研究指出,血液中异亮氨酸、亮氨酸、缬氨酸、酪氨酸和苯丙氨酸5 种氨基酸水平在2型糖尿病早期就会出现异常升高的现象[30]。本实验结果显示,与NC组相比,DM组大鼠血清异亮氨酸和缬氨酸水平上升,说明糖尿病大鼠血糖利用不足,蛋白质分解代谢增强而合成代谢减弱,生糖氨基酸被大量消耗,含量降低。
本研究表明,高脂高糖饮食联合两次小剂量STZ腹腔注射可成功建立2型糖尿病动物模型。多元统计分析发现DM组大鼠血清中众多代谢物浓度与NC组相比均发生了较大变化。其中DM组大鼠血清丙氨酸、胸腺嘧啶脱氧核苷酸水平降低,说明DM组大鼠体内可能存在氨基酸、核苷酸和三羧酸循环代谢的异常。LBP干预DM组大鼠一个月后,在大鼠血清中既有相同标记物,也有不同标记物被发现,LBP可以使得DM大鼠血清中相同的生物标记物向正常水平变化,表明LBP有利于DM组大鼠氨基酸、核苷酸以及三羧酸循环代谢的恢复。
参考文献:
[1] 贾伟, 蒋健, 刘平, 等. 代谢组学在中医药复杂理论体系研究中的应用[J]. 中国中药杂志, 2006, 31(8): 621-624. DOI:10.3321/ j.issn:1001-5302.2006.08.001.
[2] 贾伟. 医学代谢组学[M]. 上海: 上海科学技术出版社, 2011: 1-16.
[3] JIYE A, TRYGG J, GULLBERG J, et al. Extraction and GC/MS analysis of the human blood plasma metabolome[J]. Analytical Chemistry, 2005, 77(24): 8086-8094. DOI:10.1021/ac051211v.
[4] XIAO Y P, WU T X, HONG Q H, et al. Response to weaning and dietary l-glutamine supplementation: metabolomic analysis in piglets by gas chromatography/mass spectrometry[J]. Journal of Zhejiang University: Science B, 2012, 13(7): 567-578. DOI:10.1631/jzus. B1100343.
[5] BIRKEMEYER C, KOLASA A, KOPKA J. Comprehensive chemical derivatization for gas chromatography-mass spectrometry-based multi-targeted profiling of the major phytohormones[J]. Journal of Chromatography A, 2003, 993(1/2): 89-102. DOI:10.1016/S0021-9673(03)00356-X.
[6] SCHMELZ E A, ENGELBERTH J, ALBORN H T, et al. Simultaneous analysis of phytohormones, phytotoxins, and volatile organic compounds in plants[J]. Proceedings of the National Academy of Sciences, 2003, 100(18): 10552-10557. DOI:10.1073/ pnas.1633615100.
[7] CHI A P, ZHANG Y, KANG Y J, et al. Metabolic mechanism of a polysaccharide from Schisandra chinensis to relieve chronic fatigue syndrome[J]. Journal of Biological Macromolecules, 2016, 93: 322-332. DOI:10.1016/j.ijbiomac.2016.08.042.
[8] NI Y, SU M M, QU Y P, et al. ADAP-GC 3.0: improved peak detection and deconvolution of co-eluting metabolites from GC/TOF-MS data for metabolomics studies[J]. Analytical Chemistry, 2016, 88(17): 8802-8811. DOI:10.1021/acs.analchem.6b02222.
[9] WANG G M, SHI D D, PENG Z X, et al. Study on mechanism of costunolide-induced apoptosis in breast cancer MCF-7 cells[J]. Chinese Journal of Analytical Chemistry, 2015, 43(5): 682-688.
[10] 郭琦. 枸杞多糖的提取、分离纯化、溶液性质及其结构的初步研究[D]. 西安: 陕西师范大学, 2012: 1-10.
[11] 孙桂菊, 张勇, 黄杰, 等. 枸杞多糖对Ⅱ型糖尿病大鼠肾脏保护作用及其机制研究[J]. 营养学报, 2006, 28(1): 47-50. DOI:10.3321/ j.issn:0512-7955.2006.01.013.
[12] ZOU S, ZHANG X, YAO W B, et al. Structure characterization and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L.[J]. Carbohydrate Polymers, 2010, 80: 1161-1167. DOI:10.1016/j.carbpol.2010.01.038.
[13] 孙桂菊, 王少康, 张勇, 等. 枸杞多糖、茶叶多糖混合物对Ⅱ型糖尿病大鼠降血糖作用及对糖尿病并发症相关指标的影[J].食品研究与开发, 2003, 24(2): 75-78. DOI:10.3969/ j.issn.1005-6521.2003.02.033.
[14] LUO Q, CAI Y, YAN J, et al. Hypoglycemic and hypolipidemic effects and antioxidant activity of fruit extracts from Lycium barbarum[J]. Life Science, 2004, 76(2): 137-149. DOI:10.1016/j.lfs.2004.04.056.
[15] LI X M. Protective effect of Lycium barbarum polysaccharides on streptozotocin-induced oxidative stress in rats[J]. International Journal of Biological Macromolecules, 2007, 40: 461-465. DOI:10.1016/ j.ijbiomac.2006.11.002.
[16] 蔡慧珍, 刘福康, 卢慧霞, 等. 枸杞多糖对2型糖尿病病人的短期干预[J]. 食品科学, 2012, 33(13): 259-262.
[17] 田晓华, 丛建波, 孙存普, 等. 氧化苦参碱清除·OH自由基作用及对胸腺嘧啶核苷酸辐射防护作用的ESR研究[J]. 解放军预防医学杂志, 1996, 14(6): 412-415.
[18] 陈忱, 蔡慧珍, 唐华丽, 等. 枸杞多糖的组成分析及其荧光标记研究[J]. 时珍国医国药, 2014, 25(10): 2312-2315. DOI:10.3969/ j.issn.1008-0805.
[19] 刘源才, 孙细珍, 许银, 等. 枸杞多糖组成及含量测定方法的改进[J].食品科学, 2013, 34(12): 292-295. DOI:10.7506/spkx1002-6630-201312060.
[20] 蔡慧珍. 枸杞多糖对人胰岛素抵抗及血脂的干预作用及其机制[D].南京: 东南大学, 2012: 38-42.
[21] 宗灿华, 田丽梅. 枸杞多糖对2型糖尿病大鼠胰岛素抵抗及脂联素基因表达的影响[J]. 中国康复理论与实践, 2008, 14(6): 531-532. DOI:10.3969/j.issn.1006-9771.2008.06.014.
[22] TANG H L, CHEN C, WANG S K, et al. Biochemical analysis and hypoglycemic activity of a polysaccharide isolated from the fruit of Lycium barbarum L.[J]. International Journal of Biological Macromolecules, 2015, 77: 235-242. DOI:10.1016/ j.ijbiomac.2015.03.026.
[23] JIA W P. Diabetes: a challenge for China in the 21st Century[J]. Lancet Diabetes Endocrinol, 2014, 2(4): 6-7. DOI:10.1016/S2213-8587(14)70027-0.
[24] ZIMMET P Z, MAGLIANO D J, HERMAN W H, et al. Diabetes: a 21st Century challenge[J]. Lancet Diabetes Endocrinol, 2014, 2(1): 56-64. DOI:10.1016/S2213-8587(13)70112-8.
[25] BAO Yuqian, ZHAO Tie, WANG Xiaoyan, et al. Metabonomic variations in the drug-treated type 2 diabetes mellitus patients and healthy volunteers[J]. Journal of Proteome Research, 2009, 8(4): 1623-1630. DOI:10.1021/pr800643w.
[26] 郭准霄, 张俊清, 董爱梅. 2型糖尿病患者血浆氨基酸浓度的变化及其与血糖和胰岛素的关系[C]//北京医学会糖尿病暨内分泌学会学术年会. 北京: 北京大学第一医院内分泌科, 2012: 292-293.
[27] 皮子凤, 门丽慧, 张静, 等. 五味子治疗大鼠糖尿病肾病作用机制的血清代谢组学研究[J]. 分析化学, 2015, 43(2): 169-175. DOI:10.11895/j.issn.0253-3820.140564.
[28] 张启云, 汤喜兰, 李冰涛, 等. 黄连总生物碱对糖尿病大鼠的血浆代谢组学研究[J]. 中药药理与临床, 2013, 29(6): 42-44.
[29] 宁萌, 李田乐, 段大为, 等. 2型糖尿病早期大鼠血清代谢组学分析[J].生物医学工程与临床, 2016, 20(2): 131-135.
[30] NEWGARD C B, AN J, BAIN J R, et al. A branched-chain amino acid-related metabolic signature that differentiates obese and lean humans and contributes to insulin resistance[J]. Cell Metabolism, 2009, 9(4): 311-326. DOI:10.1016/j.cmet.2009.02.002.
Serum Metabonomics Study of Type 2 Diabetic Rats Administrated with Lycium barbarum Polysaccharides
TANG Huali1,2, XIA Hui1, WANG Feng1, SUN Guiju1,*
(1. Key Laboratory of Environmental Medicine and Engineering, Ministry of Education, School of Public Health, Southeast University, Nanjing 210009, China; 2. School of Life Science and Engineering, Chongqing Three Gorges University, Chongqing 404000, China)
Abstract:Gas chromatography-time of flight-mass spectrometry (GC-TOF-MS) was employed for serum metabolite profiling of rats in the control group (NC), type 2 diabetic model group (DM) and Lycium barbarum polysaccharides (LBP group) treatment groups. Principal component analysis (PCA) and orthogonal partial least squares discriminant analysis (OPLS-DA) were used for clustering serum metabolite profiles and finding potential biomarkers. The results demonstrated that the three groups were successfully separated and serum alanine and thymidine were decreased in the DM group as compared to the NC group. One-month intervention with LBP could increase the levels of alanine and thymidine in serum of type 2 diabetic rats, which may be associated with their amino acid and nucleotide metabolism. These results can provide a reference for further study of the hypoglycemic mechanism of LBP.
Key words:Lycium barbarum polysaccharides; type 2 diabetes mellitus; metabonomics; biomarker
DOI:10.7506/spkx1002-6630-201713027
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)13-0160-07
引文格式:
唐华丽, 夏惠, 王锋, 等. 枸杞多糖作用于2型糖尿病大鼠的血清代谢组学研究[J]. 食品科学, 2017, 38(13): 160-166.
DOI:10.7506/spkx1002-6630-201713027. http://www.spkx.net.cn
TANG Huali, XIA Hui, WANG Feng, et al. Serum metabonomics study of type 2 diabetic rats administrated with Lycium barbarum polysaccharides[J]. Food Science, 2017, 38(13): 160-166. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201713027. http://www.spkx.net.cn
收稿日期:2016-05-31
基金项目:国家自然科学基金面上项目(81273069);江苏省普通高校研究生科研创新计划资助项目(KYLX_0205);重庆市基础与前沿研究计划项目(cstc2016jcyjA0522);重庆市教委项目(KJ1601008)
作者简介:唐华丽(1982—),男,副教授,博士研究生,研究方向为植物化学物与食品功效。E-mail:tanghuali58@163.com
*通信作者:孙桂菊(1963—),女,教授,博士,研究方向为植物化学物与食品功效。E-mail:gjsun@seu.edu.cn