 ±s表示。显著性差异采用SPSS 19.0软件进行交叉设计方差分析与多重比较,显著性水平分别取α=0.05和α=0.01。
±s表示。显著性差异采用SPSS 19.0软件进行交叉设计方差分析与多重比较,显著性水平分别取α=0.05和α=0.01。刘国艳,孙贝贝,张 洁,于苏宁,蒋栋磊,方维明,徐 鑫*
(扬州大学食品科学与工程学院,江苏 扬州 225127)
摘 要:目的:采用高血压发病因子血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)诱导人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)建立高血压损伤模型。方法:使用不同浓度(0.01、0.10、1.00 μmol/L和10.00 μmol/L)Ang Ⅱ诱导HUVECs不同时间(3、6、9、12 h和24 h),通过考察HUVECs形态、活性、功能、微观结构及凋亡程度来评价HUVECs损伤程度,同时采用交叉设计方差分析和多重比较方法得到Ang Ⅱ最适诱导浓度和最佳诱导时间。结果:Ang Ⅱ呈浓度依赖式诱导HUVECs损伤,最佳诱导条件为1.00 μmol/L Ang Ⅱ诱导12 h,此时HUVECs活性为44.85%、NO含量为43.57 μmol/L、总一氧化氮合酶活力为6.99 U/mg pro、内皮型一氧化氮合酶活力为1.89 U/mg pro、丙二醛含量为7.46 nmol/mL、超氧化物歧化酶活力为27.29 U/mg pro、细胞凋亡率为41.5%,微观结构显示核膜皱缩,核仁消失,胞浆内出现大量空泡状结构,线粒体或细小或肿胀,粗面内质网扩张数目较少,部分核糖体丢失,平面内质网扩张,但细胞未解体,仍然保持细胞结构。结论:1.00 μmol/L Ang Ⅱ诱导12 h可以成功诱导HUVECs建立高血压损伤模型。
关键词:血管紧张素Ⅱ(Ang Ⅱ);人脐静脉内皮细胞(HUVECs);高血压;细胞模型
血管内皮细胞受损是引起高血压等心血管疾病的重要原因,其受损程度与高血压的严重程度呈正相关[1]。细胞受损后会导致其分泌功能发生变化,如血管通透性增加、血管收缩因子增加舒张因子降低,导致血管压力增加,形成高血压。高血压又进一步引起内皮细胞损伤,形成恶性循环[2]。目前治疗高血压的化学合成类药物虽效果明显,但存在诸多副作用,因此天然、安全、无副作用的食品功能因子用于干预血压调节是未来发展趋势。Jorge[3]、Jung[4]、Zhang Xiwen[5]和Mladěnka等[6]研究表明食品功能因子具有舒张血管、降低血压的作用。现今食品功能因子干预血压调节的研究手段主要有动物模型[7-9]和细胞模型[10-11],细胞模型因具有操作简便、周期短、体系相对单纯等优点而成为研究各种疾病的首选。
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)与血管内皮细胞有相似的生物学特征,接近人体生理状态,无种属差异、取材容易、来源丰富且符合伦理性[12],被国内外研究者广泛用于建立模拟高血压损伤的细胞模型[13-15]。但有关HUVECs高血压损伤模型尚鲜见系统性研究报道,在模型诱导剂的浓度、时间及模型评价指标的选取上缺乏量化标准和科学依据。本研究根据存在的问题完善现有的模型,针对肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)引起的高血压,选用血管紧张素Ⅱ(angiotensinⅡ,Ang Ⅱ)作为诱导剂,筛选诱导剂浓度、诱导时间,从细胞数量、微观结构、凋亡程度及与高血压相关的功能因子等方面多角度、多指标的综合评价HUVECs高血压损伤模型,以期为食品功能因子干预血压调节的评价及筛选提供参考。
1.1 材料与试剂
HUVECs 南京凯基生物科技发展有限公司;胎牛血清 美国Gibco公司;RPMI 1640基础培养基 美国Sigma公司;胰蛋白酶 美国Amresco公司;Ang Ⅱ美国Anaspec Inc公司;NO、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)、一氧化氮合酶(nitric oxide synthase,NOS)试剂盒南京建成生物工程研究所;总蛋白提取试剂盒、增强型BCA蛋白定量试剂盒 南京诺唯赞生物科技有限公司;cell counting kit(CCK)-8试剂盒 上海碧云天生物技术有限公司。
1.2 仪器与设备
3111CO2培养箱、Multiskan FC酶标仪 美国Thermo Scientific公司;BM-37XBC倒置显微镜 上海波爱姆光学仪器制造有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;CL-22M高速低温离心机 湖南湘仪实验室仪器开发有限公司;CM100透射电子显微镜 荷兰Philips公司;FACSAria llu流式细胞仪 美国BD公司。
1.3 方法
1.3.1 细胞培养
HUVECs用含有10%胎牛血清的RPMI 1640培养液培养,同时加入100 U/mL青霉素和100 μg/mL链霉素,培养条件为37 ℃、5% CO2、饱和湿度。细胞传代采用胰蛋白酶消化法。细胞融合达到80%左右,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤3 次,加入1 mL 0.25%胰蛋白酶消化液,置于CO2培养箱中2 min后在倒置显微镜下观察细胞收缩程度,当细胞变圆,细胞间间隙变大时加入完全培养基终止消化。用移液管轻轻吹打细胞瓶壁使细胞脱落,形成细胞悬液,收集细胞用于传代。取前10 代细胞进行实验。
1.3.2 细胞活力测定
将HUVECs悬液浓度调整至5×104个/mL,接种于96 孔板中,每孔200 μL。培养24 h后换无血清培养基饥饿处理12 h,使细胞同步化。将细胞分为空白组,只加完全培养基;损伤组,分别加入含0.01、0.10、1.00 μmol/L和10.00 μmol/L Ang Ⅱ的培养液组,培养时间为3、6、9、12 h和24 h。达到预定培养时间后,每孔加入10 μL CCK-8溶液, 37 ℃孵育1~4 h后,酶标仪450 nm波长处测量吸光度,每个条件下重复3 个平行,计算细胞活力。
1.3.3 细胞形态观察
诱导相应的时间后在倒置显微镜下观察各组细胞形态并拍照。
1.3.4 细胞内MDA含量、SOD活力、NOS活力测定
按细胞悬液浓度l×105个/mL接种于6 孔培养板,2 mL,按照1.3.2节的方法,将诱导后的细胞消化收集于离心管中,4 ℃、1 000 r/min离心5 min,弃上清液,PBS洗涤2 次。反复冻融法破碎细胞,提取细胞内容物。将细胞置于离心管中,加1 mL无菌水,放入液氮中3~5 s,立即转移到冰上,放置30 s左右,室温解冻,重复3 次。2 000~3 000 r/min离心10 min,收集上清液,即时根据试剂盒说明书分别测定532、450、530 nm波长处的吸光度,即分别代表细胞内MDA含量、SOD活力、NOS活力。1.3.5 培养液中NO含量测定
模型诱导完毕后,无菌离心管收集培养液。2 000~3 000 r/min离心10 min,分装,即时根据测定试剂盒说明书操作,测定550 nm波长处吸光度。
1.3.6 细胞超微结构观察
将消化后的细胞用2.5%的戊二醛先固定2 h以上,样品以1×107个细胞数为宜。PBS清洗3~4 次(15 min/次);1%锇酸再固定2 h后,用PBS清洗3~4 次(15 min/次);用体积分数30%、50%、70%、80%、90%、95%、100%的乙醇梯度脱水,每梯度15 min;100%丙酮浸透15 min后,用加入无水硫酸钠呈饱和状态的100%丙酮浸透15 min;再分别用丙酮-树脂混合液(体积比为2∶1)浸透5 h,丙酮-树脂混合液(体积比为1∶1)浸透过夜,丙酮-树脂混合液(体积比为2∶1)浸透5 h,纯树脂浸透过夜;最后包埋、磨样、切片、透射电子显微镜下观察细胞超微结构后拍照。
1.3.7 细胞凋亡程度测定
诱导结束后,收集细胞,按照Annexin V-FITC细胞凋亡检测试剂盒步骤加入195 μL Annexin V-FITC结合液,轻轻重悬细胞;加入5 μL Annexin V-FITC,轻轻混匀;加入10 μL的碘化丙啶,混匀;室温条件下避光放置10~20 min后进行流式细胞仪检测。
1.4 数据统计分析
所有实验重复3 次,结果以 ±s表示。显著性差异采用SPSS 19.0软件进行交叉设计方差分析与多重比较,显著性水平分别取α=0.05和α=0.01。
±s表示。显著性差异采用SPSS 19.0软件进行交叉设计方差分析与多重比较,显著性水平分别取α=0.05和α=0.01。
2.1 Ang Ⅱ对HUVECs活力的影响
细胞活力反映了细胞的损伤程度,是细胞损伤模型的基本考察指标。通过检测Ang Ⅱ对HUVECs的增殖抑制作用,确定Ang Ⅱ对HUVECs的损伤程度。从图1可以看出,随着Ang Ⅱ浓度的增加,细胞活力呈现降低趋势。0.01 μmol/L Ang Ⅱ对细胞活力影响不显著,而0.10 μmol/L Ang Ⅱ对细胞活力在诱导6 h时有显著影响(P<0.05)。1.00 μmol/L Ang Ⅱ诱导3 h后,相对细胞数量为(58.16±5.90)%,表明HUVECs已经发生极显著损伤(P<0.01);作用6 h后,HUVECs活力极显著下降(P<0.01),相对细胞数量为(49.06±2.72)%;随着诱导时间的延长,Ang Ⅱ对HUVECs的损伤进一步加剧,细胞活力逐渐下降;12 h时相对细胞数量为(44.85±0.98)%,之后下降速率减小。10.00 μmol/L Ang Ⅱ组与1.00 μmol/L Ang Ⅱ组在影响细胞活力上类似。这与Zhang Hong等[16]用1 μmol/L Ang Ⅱ诱导细胞12 h时所得的细胞活力相似。

图1 不同浓度AngⅡ诱导不同时间对HUVECs活力的影响
Fig. 1 Viability of HUVECs induced by different concentration of Ang Ⅱ for different times
2.2 Ang Ⅱ对HUVECs形态变化的影响

图2 HUVECs倒置显微镜图(10×10)
Fig. 2 Inverted phase contrast microscopic images of HUVECs (10 × 10)
Ang Ⅱ对HUVECs作用12h的形态变化如图2所示,空白组(图2a)HUVECs贴壁生长,形态为短梭状或三角形,较为饱满,大小均一,细胞间紧密连接,界限清晰,呈现出单层“鹅卵石”状,与报道的健康HUVECs状态相符合[17]。0.01 μmol/L Ang Ⅱ诱导组(图2b)与空白组相似;0.10 μmol/L Ang Ⅱ诱导组(图2c)部分细胞发生收缩、变圆,但数量变化不够明显;1.00 μmol/L Ang Ⅱ诱导组(图2d)细胞收缩、变圆的数量增多,有少量碎片,部分细胞出现拉丝现象;10.00 μmol/L Ang Ⅱ诱导组(图2e)细胞数量明显减少,细胞形态不一,部分细胞细胞膜降解,细胞死亡严重,可能是由于Ang Ⅱ与其受体结合激活了细胞内的Caspase通路导致细胞死亡,此时多数细胞已发生不可逆损伤[18-19],不适合建立高血压损伤模型,故1.00 μmol/L Ang Ⅱ为较为合适的建立模型浓度。
用倒置相差显微镜观察到的细胞形态只是一个宏观表现,若要进一步判断细胞的损伤程度,还需观察细胞的微观结构,测定相关功能因子的分泌及凋亡程度。
2.3 Ang Ⅱ对HUVECs内MDA含量的影响
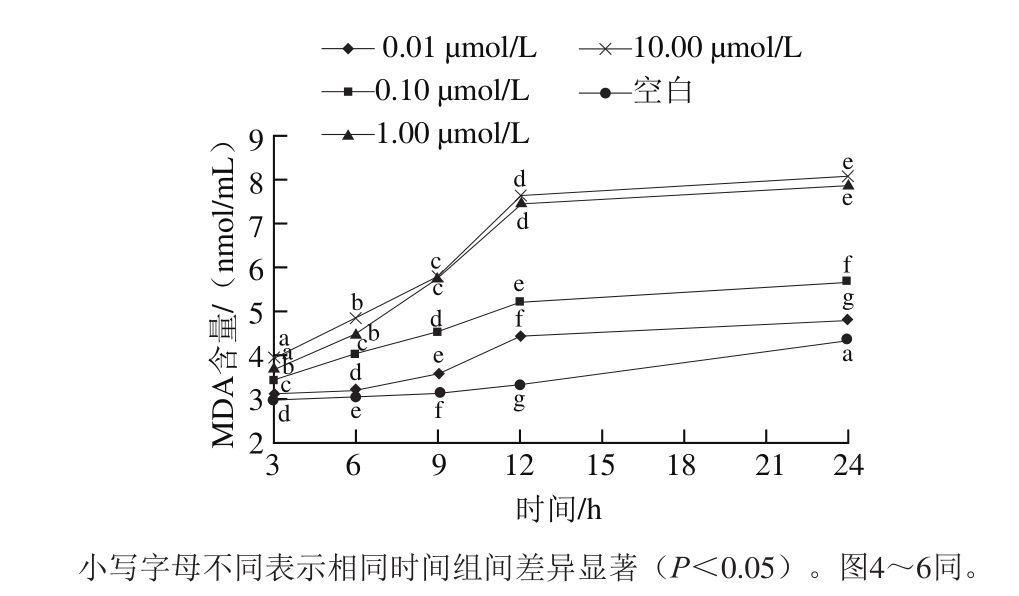
图3 不同浓度AngⅡ诱导不同时间对MDA含量的影响
Fig. 3 Effect of Ang Ⅱ concentration and induction time on MDA conte
Ang Ⅱ对HUVECs内MDA的影响如图3所示。整体来看,随着诱导剂浓度增加和诱导时间的延长,MDA含量呈增加趋势。在6~9 h之间,细胞MDA含量逐渐增加,在12 h时,1.00 μmol/L和10.00 μmol/L的Ang Ⅱ诱导后所产生的MDA含量上升速率较快,与空白组有显著差异(P<0.05)。细胞内逐渐增加的MDA会破坏细胞膜及线粒体膜结构,诱导细胞内活性氧(reactive oxygen species,ROS)含量的增加,加剧氧化应激,导致细胞分泌功能紊乱,进一步引起细胞损伤[20]。结合前面所述,10.00 μmol/L Ang Ⅱ不适合建立高血压损伤模型。根据交叉设计方差分析得出时间F值为99.726,Sig值为0.000;浓度F值为122.173,Sig值为0.000;时间×浓度F值为8.057,Sig值为0.000。主体间效应:浓度>时间>时间×浓度。根据多重比较结果为3、6、9、12、24 h之间MDA含量均有显著性差异。1.00 µmol/L与10.00 µmol/L Ang Ⅱ之间MDA含量没有显著性差异,其余浓度组间均有显著差异(P<0.05),故选取1.00 µmol/L为最佳诱导浓度,最佳诱导时间为12 h。
2.4 Ang Ⅱ对HUVECs内SOD活力的影响
Ang Ⅱ对HUVECs内SOD活力的影响如图4所示。随着诱导剂浓度增加和诱导时间的延长,SOD活力呈下降趋势。在12 h前的下降速率比12 h后要快,可能是由于后期诱导剂被细胞代谢且细胞本身发挥修复作用。SOD活力的下降导致了细胞内氧化和抗氧化反应失衡[21],细胞无法及时清除产生的自由基和MDA,导致细胞内蛋白质、DNA及细胞膜损伤严重[22]。研究证明SOD活性与高血压患者的血压呈负相关[23],SOD和MDA的联合测定可以更好地评价细胞模型损伤程度。10.00 μmol/L Ang Ⅱ损伤组SOD活力下降最快,为了防止细胞过度损伤,造成不可逆修复,所以不可选择10 μmol/L Ang Ⅱ进行诱导。由交叉设计方差分析得时间F值为2.741,Sig值为0.039;浓度F值为10.490,Sig值为0.000;时间×浓度F值为0.338,Sig值为0.990。由多重比较分析得出同一浓度诱导3、6、9、12 h之间细胞中SOD活力均有显著差异,但同一浓度的12 h与24 h无显著性差异,说明12 h是细胞内SOD变化减缓的转折点。在9~12 h之间,从图4可以看出,浓度为1.00 µmol/L时SOD活力下降速率最大,故1.00 µmol/L为最佳诱导浓度,最佳诱导时间为12 h。

Ⅱ诱导不同时间对HUVECs中SOD活力的影响
Fig. 4 Effect of Ang Ⅱ concentrations and induction time on SOD activity
图4 不同浓度Ang
2.5 Ang Ⅱ对HUVECs内NO含量的影响
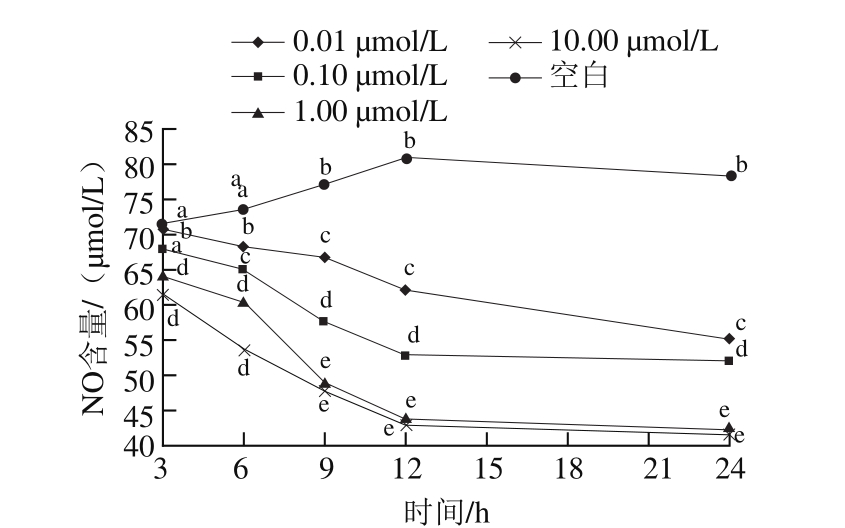
图5 不同浓度Ang Ⅱ诱导不同时间对HUVECs中NO生成的影响
Fig. 5 Effect of Ang Ⅱ concentration and induction time on NO production
Ang Ⅱ对HUVECs内NO含量的影响如图5所示。Ang Ⅱ对NO的释放具有抑制作用,随着Ang Ⅱ浓度的增加和时间的延长,NO含量呈现下降趋势。其中0.01 μmol/L和0.10 μmol/L损伤组NO含量下降较为缓慢,而1.00 μmol/L在6~12 h之间下降速率增大。细胞NO释放量过少,会引起血管收缩,血压增加,导致高血压等心脑血管疾病的发生[24]。10.00 μmol/L与1.00 μmol/L损伤组之间NO含量无显著差异(P>0.05)。故选择1.00 μmol/L Ang Ⅱ来建立高血压损伤模型。NO是内皮损伤模型中最重要的指标,其释放量还需结合NOS活性来阐明其释放机理。进行交叉设计方差分析得出时间F值为14.598,Sig值为0.000;浓度F值为68.740,Sig值为0.000;时间×浓度F值为3.392,Sig值为0.000。主体间效应:浓度>时间>时间×浓度。进行多重比较分析得3 h与6 h、9 h与12 h、9 h与24 h、12 h与24 h之间均无显著差异(P>0.05)。浓度1.00 µmol/L与10.00 µmol/L Ang Ⅱ损伤组之间NO含量没有显著差异,其余浓度组间均有显著性差异,所以选取1.00 µmol/L Ang Ⅱ诱导12 h为最佳诱导条件。
2.6 Ang Ⅱ对HUVECs内NOS活力的影响

图6 不同浓度Ang Ⅱ诱导不同时间对HUVECs中TNOS(A)和eNOS(B)活力的影响
Fig. 6 Effect of Ang Ⅱ concentration and induction time on TNOS (A) and eNOS(B) activity
Ang Ⅱ对HUVECs内NOS含量的影响如图6所示。随着Ang Ⅱ浓度增加和诱导时间延长,总一氧化氮合酶(total nitric oxide synthase ,TNOS)和内皮型一氧化氮合酶(endothelial nitric oxide synthase ,eNOS)活力均呈下降趋势,且eNOS活力下降较快,高浓度Ang Ⅱ时eNOS活性几乎丧失。TNOS在6~12 h时下降最快,12 h后下降变缓,且1.00 µmol/L诱导12 h 的TNOS活力与10.00 µmol/L 12 h时没有显著性差异(P>0.05)。而eNOS活力变化与TNOS有相似的趋势,且下降速率更快,说明高浓度的Ang Ⅱ导致细胞损伤严重,对eNOS活力抑制更明显,而eNOS活力下降直接影响到NO的生成[25],这与前面NO的生成相互呼应。结合TNOS活力来看,在Ang Ⅱ浓度为1.00 μmol/L诱导时间6~9 h之间时,TNOS活力下降速率最大。同理,对于eNOS的活力,在Ang Ⅱ为1.00 μmol/L诱导时间为9 h时,eNOS的活力下降速率最大。
对于TNOS活力,根据交叉设计方差分析得出时间F值为10.158,Sig值为0.000;浓度F值为24.958,Sig值为0.000;时间×浓度F值为1.926,Sig值为0.040。主体间效应为浓度>时间>时间×浓度。进一步进行多重比较发现同一诱导浓度条件下,诱导3 h与6 h、9 h与12 h、9 h与24 h、12 h与24 h之间均无显著差异,而6 h与9 h之间有显著差异(P<0.05)。
对于eNOS活力,交叉设计方差分析得时间F值为28.429,Sig值为0.000;浓度F值为60.934,Sig值为0.000;时间×浓度F值为2.308,Sig值为0.013。主体间效应为浓度>时间>时间×浓度。多重比较发现同一诱导浓度条件下,12 h与24 h之间无显著性差异,其余各诱导时间之间均有显著性差异。在同一时间条件下,浓度1.00 µmol/L与10.00 µmol/L之间没有显著性差异,1.00 µmol/L与0.10、0.01 µmol/L之间均有显著性差异,所以选取1.00 µmol/L、12 h为最佳诱导条件。
2.7 HUVECs微观结构的变化

图7 HUVECs电子显微镜图
Fig. 7 Transmission electron microscopic images of HUVECs
空白组(图7A1、B1)细胞核核膜清晰,核仁完整,细胞器丰富且分布均匀,胞浆内空泡含量较少且小,各细胞器形态正常。而1.00 μmol/L Ang Ⅱ损伤组(图7A2、B2)核膜皱缩,核仁消失,细胞核变长,边缘凹陷、不规则,胞浆内出现大量多筛孔样空泡,线粒体或者细小或者肿胀,粗面内质网扩张数目较少,部分核糖体丢失,平面内质网扩张。当Ang Ⅱ浓度上升到10.00 μmol/L时,由图7A3、B3可以看到细胞核缩为一小块,核仁消失,胞浆内空泡严重,几乎将细胞解体,线粒体或肿胀或细长,粗面内质网数量严重减少,核糖体严重损失,细胞骨架不完整。表明细胞在不同浓度Ang Ⅱ的诱导下出现了不同程度的损伤。
2.8 HUVECs凋亡程度

图8 HUVECs凋亡图
Fig. 8 Early and late apoptotic cells
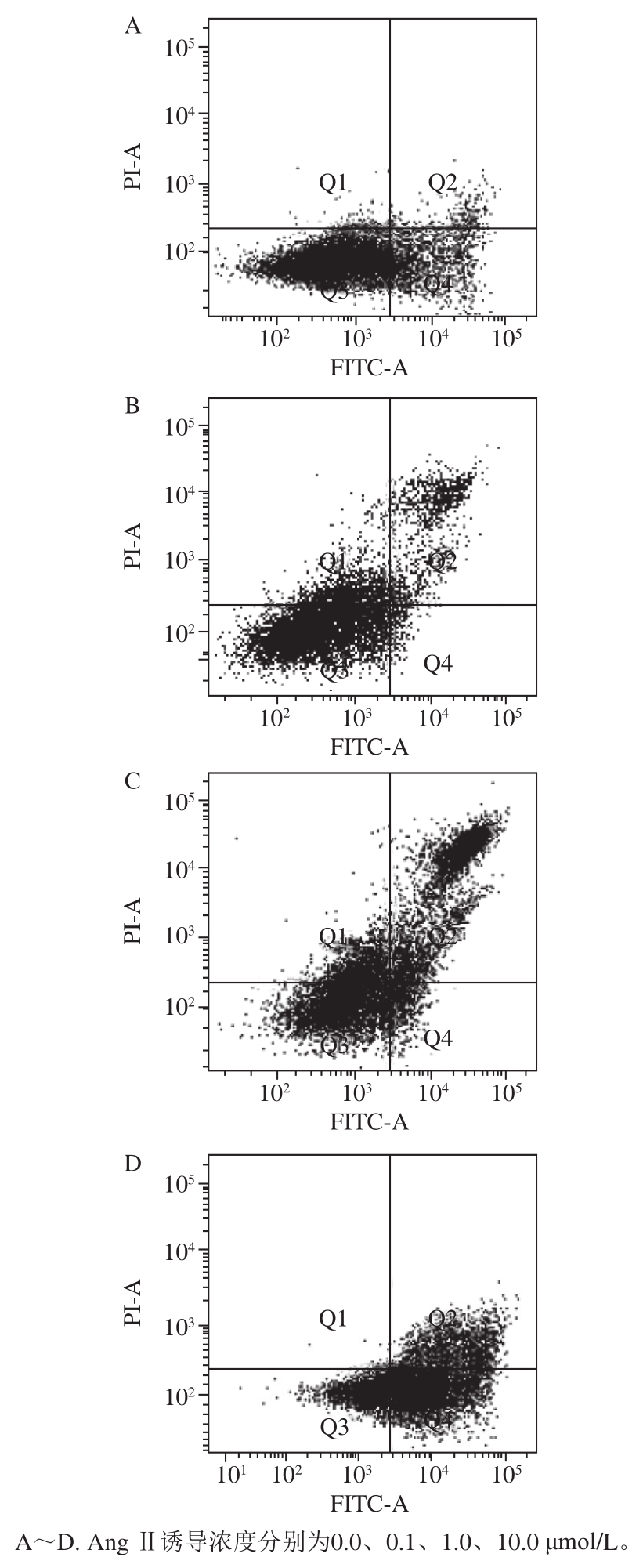
图9 HUVECs流式细胞图
Fig. 9 Flow cytometry scatter plots of HUVECs
由图8、9可以得出,HUVECs受到Ang Ⅱ刺激后,细胞总凋亡数量明显增多,其中0.10 μmol/L损伤组凋亡早期细胞数量与空白组相比显著增加(P<0.05),1.00 μmol/L损伤组凋亡早期细胞数量与空白组相比极显著增加(P<0.01)。10.00 μmol/L损伤组凋亡晚期细胞数量与空白组相比极显著性增加(P<0.01)。空白组正常细胞占(81.3±2.0)%,经过0.10、1.00、10.00 μmol/L Ang Ⅱ诱导后,正常细胞数量下降到(72.4±1.1)%、(44.4±0.8)%、(26.9±0.5)%,与空白组均有显著性差异(P<0.05)。0.10、1.00、10.00 μmol/L Ang Ⅱ损伤组细胞总凋亡率分别为(14.7±1.2)%、(41.5±1.7)%、(68.6±3.5)%,显著高于空白组(7.8±1.5)%(P<0.05)。这直观地说明Ang Ⅱ能诱导细胞凋亡。本实验研究结果与杨慧宇等[2]的研究结果相似。
近年研究表明,血管内皮功能障碍是高血压病的重要病理变化,也是高血压血管损害的始发因素[26]。而高血压也可引起内皮细胞功能损害,患高血压时,由于血流切应力及血流搏动过强刺激血管内皮细胞,造成细胞形态结构的改变和功能的失调,生物活性物质合成、分泌异常,致使内皮依赖性舒张功能减弱和收缩功能增强[27]。该模型的损伤程度与高血压的严重程度呈正相关[28]。内皮细胞损伤后,内皮细胞释放的很多活性物质如凝血酶、ADP、ATP等舒血管作用变为缩血管作用,从而影响Endothelin-1(ET-1)/NO的协调状态,破坏了自身调节体系的平衡,使得ET合成增多,影响NO的合成和释放,导致血管张力调节的紊乱,内皮依赖性舒张功能下降、收缩功能增强,血管壁结构发生变化,导致血压的升高[29]。而在进行血管内皮细胞实验时,通常选用的细胞模型为HUVECs,而不是直接采用静脉血管内皮细胞或动脉血管内皮细胞,原因是脐静脉血管内皮细胞具有干细胞的功能,理论上可以传代50~60 次。而且HUVECs与血管内皮细胞有相似的生物学特征,接近人体生理状态,无种属差异、取材容易、来源丰富且符合伦理性[30],所以本实验选用HUVECs建立高血压损伤体外模型。
迄今为止,HUVECs高血压损伤模型还没有一个统一的评价标准。理想的HUVECs高血压损伤模型应该可靠、容易定量、操作简便、符合人体生理环境。但是由于疾病本身具有复杂性,如高血压可分为轻度、中度及重度,加之高血压患者容易引起并发症,故反映在单独一种细胞模型上,很难满足所有的条件,导致细胞损伤模型的标准很难判定。体外细胞模型能较好控制实验过程,且费用低,但条件难以标准化,实验结果还需进一步的结合体内实验来验证。由此可见,许多实验模型还有待于日后进一步研究和完善,只有借助趋于完善的模型,才能更好地筛选诱导剂的浓度和诱导时间,从而得到更真实、客观、全面的信息。
综合已有研究,HUVECs高血压损伤模型以Ang Ⅱ作为诱导剂成功建立时,诱导剂浓度范围在0.1~1.0 μmol/L之间,诱导时间在6~24 h之间。根据损伤组各浓度Ang Ⅱ对细胞的形态、活性、功能、微观结构及凋亡的影响结果,选取Ang Ⅱ 1.00 μmol/L诱导12 h为最佳诱导条件。本实验中 Ang Ⅱ对细胞的形态、活性及凋亡均有一定的影响,且随着Ang Ⅱ浓度增加,诱导时间延长,HUVECs损伤程度增加,其中1.00 μmol/L Ang Ⅱ诱导HUVECs 12 h时各项指标与空白组相比均有显著差异。本实验选择1 μmol/L Ang Ⅱ诱导12 h作为成功建立HUVECs高血压损伤模型的合适诱导剂浓度及时间,建立的HUVECs高血压损伤模型可以为食品功能因子及药物干预血压调节提供方法学参考。
参考文献:
[1] HUMBER M, MONTANI D, PERROS F, et al. Endothelial cell dysfunction and cross talk between endothelium and smooth muscle cells in pulmonary arterial hypertension[J]. Vascular Pharmacology, 2008, 49(4): 113-118. DOI:10.1016/j.vph.2008.06.003.
[2] 杨慧宇, 杨志明, 边云飞, 等. 血管紧张素(1-7)对血管紧张素Ⅱ诱导人脐静脉内皮细胞凋亡的影响及机制分析[J]. 中国心血管杂志, 2010, 15(5): 384-387. DOI:10.3969/j.issn. 201007-5410.10.05.018.
[3] JORGE V G, ANGEL J R L, ÁDRIAN T S, et al. Vasorelaxant activity of extracts obtained from Apium graveolens: possible source for vasorelaxant molecules isolation with potential antihypertensive effect[J]. Asian Pacific Journal of Tropical Biomedicine, 2013, 3(10): 776-779. DOI:10.1016/S2221-1691(13)60154-9.
[4] JUNG H A, JIN S E, MIN B S, et al. Anti-inflammatory activity of Korean thistle Cirsium maackii and its major flavonoid, luteolin 5-O-glucoside[J]. Food and Chemical Toxicology, 2012, 50(6): 2171-2179. DOI:10.1016/j.fct.2012.04.011.
[5] ZHANG Xiwen, WANG Yao, YANG Weiwei, et al. Resveratrol inhibits angiotensin II-induced ERK1/2 activation by downregulating quinone reductase 2 in rat vascular smooth muscle cells[J]. Journal of Biomedical Research, 2012, 26(2): 103-109. DOI:10.1016/S1674-8301(12)60019-0.
[6] MLADĚNKA P, ZATLOUKALOVÁ L, FILIPSKÝ T, et al. Cardiovascular effects of flavonoids are not caused only by direct antioxidant activity[J]. Free Radical Biology and Medicine, 2010, 49(6): 963-975. DOI:10.1016/j.freeradbiomed.2010.06.010.
[7] CHANG V H S, CHIU T H, FU S C. In vitro anti-inflammatory properties of fermented pepino (Solanum muricatum) milk by γ-aminobutyric acid-producing Lactobacillus brevis and an in vivo animal model for evaluating its effects on hypertension[J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 192-198. DOI:10.1002/jsfa.7081.
[8] ICHIMURA M, KATO S, TSUNEYAMA K, et al. Phycocyanin prevents hypertension and low serum adiponectin level in a ratmodel of metabolic syndrome[J]. Nutrition Research, 2013, 33(5): 397-405. DOI:10.1016/j.nutres.2013.03.006.
[9] GUIMARAES D A, TANUS-SANTOS J E. Combining drugs to optimize the therapy of hypertension: experimental evidence derived from animal models[J]. Hypertension Research, 2015, 38(7): 457-458. DOI:10.1038/hr.2015.52.
[10] CAMPOS J, SCHMEDA-HIRSCHMANN G, LEIVA E, et al. Lemon grass (Cymbopogon citratus (DC) Stapf) polyphenols protect human umbilical vein endothelial cell (HUVECs) from oxidative damage induced by high glucose, hydrogen peroxide and oxidizedlow-density lipoprotein[J]. Food Chemistry, 2014, 151(15): 175-181. DOI:10.1016/ j.foodchem.2013.11.018.
[11] WANG C Y, HE Y H, YANG M, et al. Safflor yellow B suppresses angiotensin II-mediated human umbilical vein cell injury via regulation of Bcl-2/p22phoxexpression[J]. Toxicology and Applied Pharmacology, 2013, 273(1): 59-67. DOI:10.1016/j.taap.2013.08.018.
[12] REICHLIN T, WILD A, DURRENBERGER M, et al. Investigating native coronary artery endothelium in situ and in cell culture by scanning force microscopy[J]. Journal of Structural Biology, 2005, 152(1): 52-63. DOI:10.1016/j.jsb.2005.07.009.
[13] GUO R W, YANG L X, LI M Q, et al. Angiotensin II induces NF-κB activation in HUVEC via the p38MAPK pathway[J]. Peptides, 2006, 27(12): 3269-3275. DOI:10.1016/j.peptides.2006.08.014.
[14] WANG Y K, HONG Y J, HUANG Z Q. Protective effects of silybin on human umbilical vein endothelial cell injury induced by H2O2in vitro[J]. Vascular Pharmacology, 2005, 43(4): 198-206. DOI:10.1016/ j.phrs.2005.02.023.
[15] DIMMELER S, RIPPMANN V, WEILAND U, et al. Angiotensin II induces apoptosis of human endothelial cells protective effect of nitric oxide[J]. Circulation Research, 1997, 81(6): 970-976. DOI:10.1161/01. RES.81.6.970.
[16] ZHANG Hong, SCHMEISSER A, GARLICHS C D, et al. AngiotensinⅡ-induced superoxide anion generation in human vascular endothelial cells: role ofmembrane-bound NADH-/NADPH-oxidases[J]. Cardiovascular Research, 1999, 44(1): 215-222. DOI:10.1016/S0008-6363(99)00183-2215-222.
[17] 陈小翠, 陈邦党, 杨毅宁, 等. 人脐静脉内皮细胞分离培养和鉴定[J].细胞与分子免疫学杂志, 2016, 32(3): 328-331. DOI:10.3969/ j.issn.1007-5062.2016.3.017.
[18] 王嫕, 李林忆, 杨云云, 等. 血管紧张素Ⅱ激活内质网应激促进大鼠血管平滑肌细胞凋亡的研究[J]. 心肺血管病杂志, 2016, 35(3): 229-233. DOI:10.3969/j.issn.1007-5062.2016.3.017.
[19] CHEN J, CHEN W, ZHU M, et al. Propofol attenuates angiotensin II-induced apoptosis in human coronary artery endothelial cells[J]. British Journal of Anaesthesia, 2011, 107(4): 525-32. DOI:10.1093/ bja/aer197.
[20] ZIMMERMAN M C. Angiotensin II and angiotensin-1-7 redox signaling in the central nervous system[J]. Current Opinion in Pharmacology, 2011, 11(2): 138-143. DOI:10.1016/j.coph.2011.01.001.
[21] ZHOU J F, YAN X F, CAI D, et al. Primary studies on heroin abuse and injury induced by oxidation by oxidation and lipoperoxidation[J]. Chinese Medical Journal, 2001, 114(3): 297-302. DOI:10.1089/107999002753536185.
[22] ZHOU Y H, YU J P, LIU Y F, et al. Effects of Ginkgo biloba extract on inflammatory mediators (SOD, MDA, TNF-α, NF-κB, p65, IL-6) in TNBS-induced colitis in rats[J]. Mediators of Inflammation, 2006(5): 1-9. DOI:10.1155/MI/2006/92642.
[23] JIANG T, GAO L, SHI J Q, et al. Angiotensin-(1-7) modulates reninangiotensin system associated with reducing oxidative stress and attenuating neuronal apoptosis in the brain of hypertensive rats[J]. Pharmacological Research, 2013, 67(1): 84-93. DOI:10.1016/ j.phrs.2012.10.014.
[24] FERRONI P, BASILI S, PAOLETTI V, et al. Endothelial dysfunction and oxidative stress in arterial hypertension[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2006, 16(3): 222-233. DOI:10.1016/ j.numecd.2005.11.012.
[25] MILLATT L J, ABDEL-RAHMAN E M, SIRAGY H M. Angiotensin II and nitric oxide: a question of balance[J]. Regulatory Peptides, 1999, 81(1): 1-10. DOI:10.1016/S0167-0115(99)00027-0.
[26] 毛文星, 李冰, 王志梅, 等. 氧化应激、血管内皮功能障碍与高血压[J]. 现代生物医学进展, 2014, 14(19): 3770-3774. DOI:10.13241/ j.cnki.pmb.2014.19.044.
[27] CHI L, HU X, ZHANG W, et al. Adipokine CTRP6 improves PPARγ activation to alleviate angiotensin II-induced hypertension and vascular endothelial dysfunction in spontaneously hypertensive rats[J]. Biochemical and Biophysical Research Communications, 2017, 482(4): 727-734. DOI:10.1016/j.bbrc.2016.11.102.
[28] TENG F, YIN Y, CUI Y, et al. Salvianolic acid A inhibits endothelial dysfunction and vascular remodeling in spontaneously hypertensive rats[J]. Life Sciences, 2015, 144: 86. DOI:10.1016/j.lfs.2015.06.010.
[29] MARTELLI A, TESTAI L, ANZINI M, et al. The novel antiinflammatory agent VA694, endowed with both NO-releasing and COX2-selective inhibiting properties, exhibits NO-mediated positive effects on blood pressure, coronary flow and endothelium in an experimental model of hypertension and endothelia[J]. Pharmacological Research, 2013, 78(12): 1. DOI:10.1016/ j.phrs.2013.09.008.
[30] 陈晶, 刘宁, 张毅杰. 血管内皮细胞功能障碍与原发性高血压[J]. 中国实用医药, 2009, 4(23): 241-242. DOI:10.14163/j.cnki.11-5547/ r.2009.23.082.
Establishment of Angiotensin Ⅱ-Induced Model in Human Umbilical Vein Endothelial Cells
LIU Guoyan, SUN Beibei, ZHANG Jie, YU Suning, JIANG Donglei, FANG Weiming, XU Xin*
(College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China)
Abstract:Objective: This research was aimed to establish a hypertensive damage model in human umbilical vein endothelial cells (HUVECs) induced by angiotensin (Ang) Ⅱ. Methods: HUVECs were induced with different concentrations (0.01, 0.10, 1.00 and 10.00 μmol/L) of Ang Ⅱ for different times (3, 6, 9, 12 and 24 h), respectively. The injury degree of HUVECs was evaluated by cellular morphology, viability, function, microstructure, and apoptosis. The optimal concentration and time were obtained by using variance analysis and multiple comparison tests. Results: Ang Ⅱ induced injury in HUVECs in a dose- and time-dependent manner. The optimal Ang Ⅱ concentration and induction time were respectively 1.00 μmol/L, and 12 h. After 12 h induction by 1 μmol/L Ang Ⅱ induced, the cell viability was 44.85%, nitric monoxide (NO) content was 43.57 μmol/L, total nitric oxide synthase (TNOS) activity was 6.99 U/mg pro, endothelial nitric oxide synthase (eNOS) activity was 1.89 U/mg pro, malonaldehyde (MDA) content was 7.46 nmol/mL, superoxide dismutase (SOD) activity was 27.29 U/mg pro, and apoptosis percentage was 41.5%. The microstructure showed that the nuclear membrane shrivel and nucleolus disappeared, and a large number of air bubbles appeared inside the cytoplasm. Small and swollen mitochondria, only a small number of expanded rough endoplasmic reticula, partial loss of ribosome, and endoplasmic reticulum expansion were observed, but the cells did not collapse, and still maintained their normal structure. Conclusion: Induction with 1.00 μmol/L Ang Ⅱ for 12 h allows successful establishment of a hypertensive damage model in HUVECs.
Key words:angiotensin Ⅱ (Ang Ⅱ); human umbilical vein endothelial cells (HUVECs); hypertension; cell model
DOI:10.7506/spkx1002-6630-201713029
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2017)13-0174-08
收稿日期:2016-05-23
基金项目:国家自然科学基金面上项目(31471578)
作者简介:刘国艳(1979—),女,副教授,博士研究生,研究方向为食品营养与安全。E-mail:liugy@yzu.edu.cn
*通信作者:徐鑫(1977—),男,教授,博士,研究方向为食品营养与安全。E-mail:xuxin@yzu.edu.cn
引文格式:
刘国艳, 孙贝贝, 张洁, 等. Ang Ⅱ诱导人脐静脉内皮细胞建立高血压损伤模型[J]. 食品科学, 2017, 38(13): 174-181.
DOI:10.7506/spkx1002-6630-201713029. http://www.spkx.net.cn
LIU Guoyan, SUN Beibei, ZANG Jie, et al. Establishment of angiotensin Ⅱ-induced model in human umbilical vein endothelial cells[J]. Food Science, 2017, 38(13): 174-181. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201713029. http://www.spkx.net.cn