表1 实验动物分组及设计
Table 1 Experimental design and animal grouping

胡济美1,李倬林2,岳玉兰2,容晨曦2,黄 威2,薛培宇2,李铁柱2,*,张 杰2,*
(1.中国国际工程咨询公司,北京 100048;2.吉林省农业科学院,吉林 长春 130124)
摘 要:通过动物实验对刺玫籽油和刺玫籽原花青素进行降血脂功能性研究。选用昆明雄性小鼠,通过高脂饲料饲喂建立高脂模型小鼠,分别经口灌胃刺玫籽油及原花青素5 周后,检测分析小鼠血清及肝组织匀浆各项指标。结果显示,刺玫籽油及原花青素对小鼠体质量及主要脏器指数无显著影响;中剂量(100 mg/kg)、高剂量(200 mg/kg)的刺玫籽原花青素会显著降低高脂小鼠血清内低密度脂蛋白胆固醇、总胆固醇、甘油三酯含量(P<0.05),显著升高小鼠肝组织内超氧化物歧化酶活力、过氧化氢酶活力、谷胱甘肽过氧化酶水平(P<0.05),显著降低肝组织内丙二醛水平;低剂量(80 mg/kg)刺玫籽油能显著降低高脂小鼠血清内甘油三酯水平(P<0.05)及显著升高小鼠肝组织中过氧化氢酶活力(P<0.05)。研究结果表明,低剂量的刺玫籽油和中、高剂量的刺玫籽原花青素对高脂血症小鼠有一定的降血脂作用。
关键词:刺玫籽油;原花青素;降血脂
随着我国经济稳步发展,人们生活水平快速提高,高胆固醇高油脂类食物大量摄入正影响着人们的身体健康[1-3],人们对具有降血脂功能保健食品的需求日益增长。
刺玫籽作为刺玫加工副产物,富含大量的原花青素及刺玫籽油,具有较高的开发价值。大量研究结果表明,原花青素有能力引导内表面依赖性血管舒张功能,增加胆固醇的逆向转运,降低总胆固醇和低密度脂蛋白[4-7]。刺玫籽油中富含不饱和脂肪酸(如亚油酸、亚麻酸和油酸)以及多种维生素(如VC、VE、VB1和VB2)、β-胡萝卜素)[8-10]。因此,研究刺玫籽油及刺玫籽原花青素降血脂功能,对于刺玫籽油及刺玫籽原花青素类保健食品的开发具有重要意义。
1.1 材料、动物与试剂
刺玫籽油、刺玫籽原花青素由吉林省农业科学院实验室提取制备;豆油 九三粮油工业集团有限公司。
清洁级雄性昆明小鼠(生产许可证SCXK(吉2013-0001)、使用许可证SYXK(吉2013-0005)) 吉林大学基础医学院实验动物中心。饲料:小鼠基础饲料,高脂饲料由1%胆固醇、20%猪油、10%蛋黄粉、69%基础饲料组成。
磷酸二氢钾、磷酸氢二钠、氯化钠、氯化钾 北京化工厂;总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、低密度脂蛋白-胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒、高密度脂蛋白-胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化酶(glutathione peroxidas,GSH-Px)试剂盒、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)试剂盒、白细胞介素-6(interleukin-6,IL-6)试剂盒 上海朗顿生物科技有限公司;牛血清白蛋白测定试剂盒 北京索莱宝科技有限公司。
1.2 仪器与设备
5415D型离心机 德国Eppendorf基因有限公司;705型-80 ℃超低温冰箱、CR3i冷冻型多功能离心机美国Thermo Fisher科技公司;基因型1810a摩尔超纯水器上海摩勒科学仪器有限公司;DHP-9272型电热恒温培养箱 上海一恒科技有限公司;722E可见分光光度计上海光谱仪器有限公司;ELx800全自动酶标仪 美国Biotek公司 ;FSH-II型高速电动匀浆器 江苏金坛金城国盛实验仪器厂。
1.3 方法
1.3.1 实验动物分组设计
小鼠均自由饮食饮水,动物房通风光照良好,自然昼夜光线照明,室温20 ℃左右。
小鼠普通饲料适应喂养6~8 d,自由饮水。适应环境后,将小鼠随机分为2 组,空白对照组饲喂普通饲料,高脂模型组饲喂高脂饲料。4 周后,禁食不禁水12 h,各组抽取3只,测定小鼠血清中TC、TG水平,判定小鼠高血脂模型构造是否成功[11-12]。
待建模成功后,将小鼠进行分组,上午灌胃1 次/d,连续干预5 周,动物分组及灌胃剂量(以体质量计)见表1。
表1 实验动物分组及设计
Table 1 Experimental design and animal grouping

1.3.2 指标测定
1.3.2.1 生理指标的测定
实验第35天(5 周后),小鼠禁食不禁水14~16 h后摘除眼球采血,颈椎脱臼法处死,取肝脏、心脏、肾脏、脾脏、肾周及腹股沟脂肪,用0.02 mol/L的磷酸盐缓冲液冲洗,滤纸吸干,称质量,计算脏器指数公式如下。
1.3.2.2 血清的制备及各指标的测定
将血液置于37 ℃恒温培养箱中静置1 h,待其充分凝固后,放于4 ℃冰箱保存,3 000 r/min低速离心15 min,取上清液即为血清,分离血清后,分装,于-80 ℃冰箱冷冻保存,并于2 d内测定相关指标[13]。切记反复冻融,避免影响各种酶活性。
以血清为材料,测定血脂指标,包括TC、TG、LDL-C、HDL-C含量。测定血清炎症因子指标,包括TNF-α、IL-6含量,按试剂盒说明书操作。每组标准曲线做复孔,设定2 个平行。
1.3.2.3 肝组织匀浆的制备及各指标的测定
用冰冷0.02 mol/L磷酸盐将肝组织漂洗,滤纸吸干,准确称取肝组织0.3 g,剪碎后与9倍质量的磷酸盐缓冲液混合,组织匀浆器进行匀浆。匀浆时注意离心管下端须插入冰浴,充分研磨约20 s,4 ℃离心10 min,转速为4 000 r/min,取上清液,得到10%的肝组织匀浆。将肝组织匀浆用磷酸盐缓冲液稀释为不同梯度,分装后置于-80 ℃保存备用,避免反复冻融[14-15]。
肝组织各指标测定按照试剂盒说明书操作,包括SOD活力、CAT活力、GSH-Px活力、MDA含量。
1.4 数据统计
数据均采用SPSS 19.0统计软件分析处理,进行单因素方差分析(ANOVA),以Duncan’s法进行多重检验。
2.1 高脂血症模型小鼠造模结果
实验期间,空白对照组小鼠精神状态较好,体质量稳定上升;高脂模型组小鼠体质量呈先增长后降低再增长的趋势,实验前期毛发粗糙,微黄色,活跃程度下降,无腹泻。两组都不存在搏斗现象,实验期间无动物死亡状况。由表2可知,实验动物经两种饲料饲喂28 d后,高脂饲料造模组小鼠的体质量相对空白组高出8%,TG、TC水平升高明显,依次比空白组高出9.5%、35%,具有显著性差异(P<0.05),结果表明高脂模型构建成功。
表2 饲养28 d高脂模型小鼠建立与判定(n=3)
Table 2 Establishment and identification of hyperlipidemic mice model (n= 3)

注:同列肩标小写字母不同表示存在显著性差异(P<0.05)。下同。
2.2 刺玫籽油及原花青素对高胆固醇膳食小鼠生理指标的影响
表3 刺玫籽油及原花青素对小鼠肝脏、心脏、脾脏、肾脏及脂肪指数
的影响( ,n=10)
,n=10)
Table 3 Effect of the seed oil and procyanidins on visceral organ indexes and fat index in mice ,n= 10)
,n= 10)
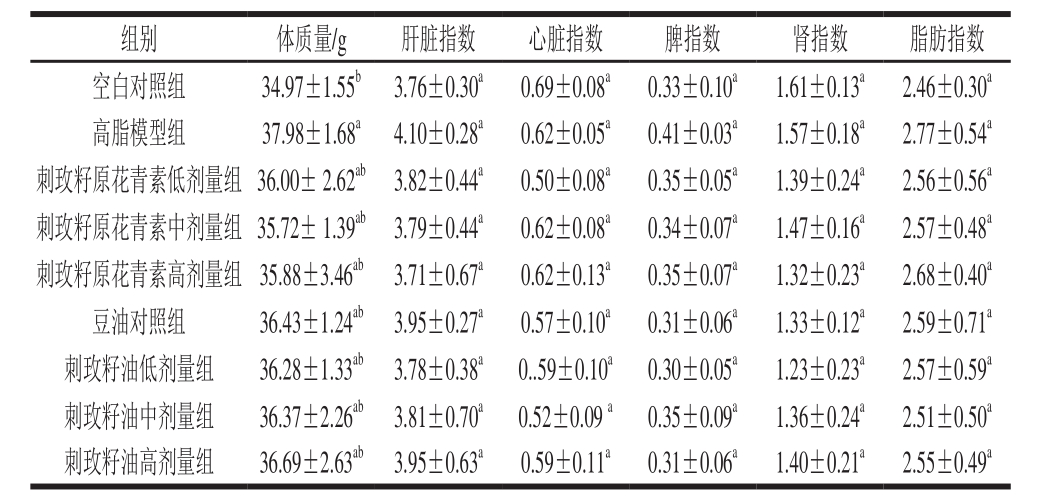
灌胃5 周后,比较各组小鼠体质量可以看出,与空白对照组相比,高脂模型组体质量有显著差异(P<0.05),见表3,表明高脂饲料进食可能会导致小鼠体质量增长速度加快;其他处理组间体质量并未见显著差异(P>0.05),说明豆油、刺玫籽油及原花青素的摄入对小鼠的正常代谢和生长没有显著影响,间接说明小鼠能够适应各组给药剂量。
脏器指数可以反映各组小鼠营养情况和机体脏器的病变情况,当外来物质损害某内脏时,脏器指数会上下浮动,超出正常值。将表3各脏器指数进行差异性分析,发现高脂模型组的肝脏指数、脂肪指数略高于空白对照组以及其他干预组,说明高血脂症小鼠肝脏较肥大,但各干预组小鼠脏器指数和脂肪指数与空白组、高脂模型组、豆油对照组相比,均未见显著性差异(P>0.05),表明刺玫籽油及原花青素对重要器官没有毒副作用,不会造成脏器异常或病变。
2.3 刺玫籽油及原花青素对高胆固醇膳食小鼠血脂指标的影响
HDL-C能够将血液中的胆固醇输送到肝脏中,从而降低血液中胆固醇含量,有效促进胆固醇的输出和代谢,HDL-C水平的提高会减缓动脉粥样硬化病症的进展,起到避免冠心病等心脑血管类疾病的作用,因此HDL-C含量的升高对维持身体机能正常运转是有利的。LDL-C是将肝脏内部合成的胆固醇分子载入动脉壁细胞,运输到血液里,促使机体血液内胆甾醇水平上涨,引起高血脂症发生,因此LDL-C水平的提高对机体是有害的[16]。
表4 刺玫籽油及原花青素对小鼠血脂水平的影响(x±s ,n=10)
Table 4 Effect of the seed oil and procyanidins on serum lipid levels in mice (x±s,n= 10)

从表4可以看出,空白对照组、高脂模型组、豆油对照组、刺玫籽油各剂量组及刺玫籽原花青素各剂量组间HDL-C含量不存在显著差异(P>0.05),说明刺玫籽油及原花青素的摄入不能显著影响HDL-C的含量。高脂模型组小鼠LDL-C含量与刺玫籽原花青素高剂量组相比差异显著(P<0.05),平均降低14.02%,表明一定剂量的刺玫籽原花青素可以降低高血脂症小鼠血清LDL-C的含量,并呈量效关系。刺玫籽油低、中、高剂量小组LDL-C值较高血脂模型对照组、豆油对照组略低,差异不显著(P>0.05),表明刺玫籽油不能显著抑制LDL-C水平的升高。
从表4还可以看出,空白对照组TC含量与高脂模型组、豆油对照组、刺玫籽油高剂量组相比差距极显著(P<0.01),说明高油脂摄入能够引起胆固醇总水平提升;刺玫籽原花青素低剂量组、刺玫籽油低、中剂量组对TC含量影响相似,略高于原花青素中剂量组;刺玫籽原花青素高剂量组显著低于高脂模型组及豆油对照组(P<0.05),说明高剂量的刺玫籽原花青素可以较好地抑制血液中TC含量升高。各组TG含量差异明显,豆油对照组、刺玫籽油高剂量组和高脂模型组TG含量在最高水平,显著高于空白对照组和其他干预组(P<0.01或P<0.05),说明过高的油脂摄入对血清TG含量影响较大;刺玫籽原花青素3 个剂量组、刺玫籽油低剂量组与高脂模型组差异显著(P<0.05),说明刺玫籽原花青素和一定剂量刺玫籽油能较好地调节血清内TG水平。
2.4 刺玫籽油及原花青素对高胆固醇膳食小鼠血清中炎症因子的影响
大量临床研究表明,脂肪组织具有功能复杂的代谢活动,会渗出TNF-α和IL-6等一系列炎症因子,从而影响生命个体代谢和健康状态[17-19]。原因是单核细胞受油脂影响,分化成巨噬细胞,巨噬细胞激活脂肪组织,从而释放出更多的炎症因子包围脂肪,引起能量的过渡蓄积,造成高血脂症或肥胖症患者长期处于低炎症水平,并可能诱发糖尿病,促进动脉硬化[20-23]。
表5 刺玫籽油和刺玫籽原花青素使用对小鼠血清中 TNF-α、IL-6的影响 ,n=10)
,n=10)
Table 5 Effect of the seed oil and procyanidins on serum TNF-αand IL-6 in mice (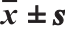 ,n= 10)
,n= 10)
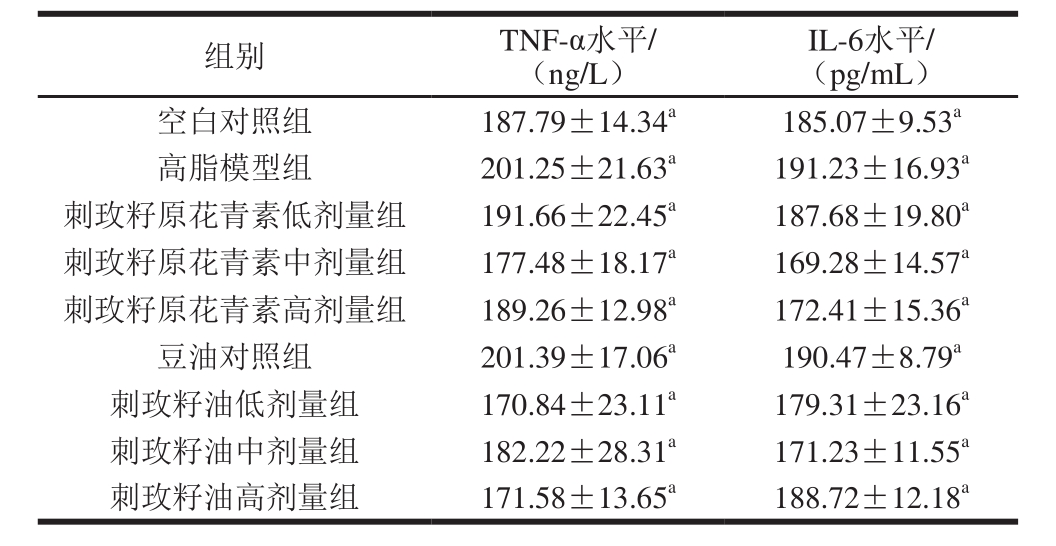
由表5可知,各个干预组之间的动物血清中TNF-α及IL-6水平并不存在显著差异(P>0.05)。说明刺玫籽油及原花青素没有显著降低或提高小鼠炎症因子,分析原因可能是:1)由于所有组别小鼠均参与灌胃,可能会对咽喉造成一定刺激,两种炎症因子含量略高。2)受条件限制,包括实验条件、实验小鼠个体差异明显、刺玫籽油及原花青素实验中使用剂量问题等因素影响实验结果,造成实验数据效果中出现一定范围内偏差。3)刺玫籽油及原花青素不能通过改善小鼠体内炎症的通路来降低血脂含量。以上原因有待后续验证。
2.5 刺玫籽油及原花青素对高胆固醇膳食小鼠肝脏抗氧化系统的影响
SOD活力可以很好地反映生命个体对抗自由基的能力,由表6可知,豆油对照组SOD活力最低,显著低于其他干预组(P<0.05),表明一定剂量大豆油的摄入能够降低机体SOD活力;与高脂模型组相比,刺玫籽原花青素中、高剂量组差异显著(P<0.05),表明一定给药量刺玫籽原花青素可以提高机体SOD活力,使小鼠肝组织抗氧化能力明显增强,从而帮助消除体内氧自由基,并呈量效关系。刺玫籽原花青素低剂量、刺玫籽油3 个剂量与高脂模型组及空白对照组差异不明显(P>0.05),表明刺玫籽油的摄入对小鼠SOD活力影响不大。
表6 刺玫籽油及原花青素对小鼠肝脏抗氧化酶活力的影响( ,n=8)
,n=8)
Table 6 Effect of the seed oil and procyanidins on hepatic antioxidant enzyme activities in mice s,n= 10)
s,n= 10)
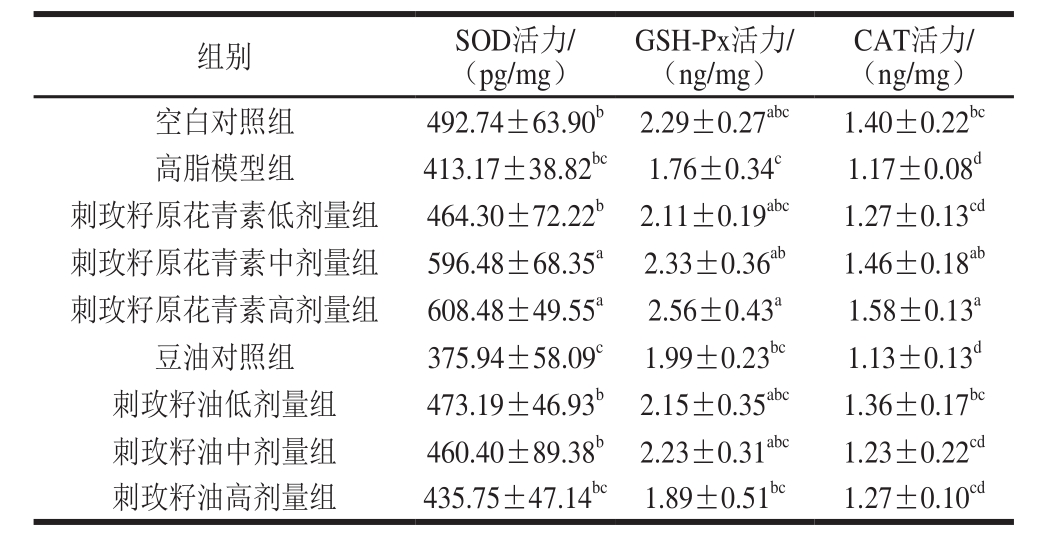
GSH-Px活力可以间接反映肝脏组织的还原能力。刺玫籽原花青素中、高剂量组GSH-Px活力显著高于空白对照组(P<0.05),并呈量效关系,再一次说明刺玫籽原花青素具有良好的抗氧化能力。刺玫籽油高、中、低剂量的GSH-Px水平与刺玫籽原花青素低剂量组(50 mg/kg)相似,均大于高脂模型组,差异性不显著(P>0.05),表明其还原能力较弱,但仍具有一定得抗氧化能力。
由表6可知,各干预组对CAT活力的影响,相比高脂模型组、豆油对照组,刺玫籽原花青素中、高剂量组,刺玫籽油低剂量组的CAT活力显著升高,上升幅度分别为24.79%(P<0.05)、35.04%(P<0.01)、16.24%(P<0.05);刺玫籽原花青素低剂量组,刺玫籽油中、高剂量组的CAT活力与高脂模型组之间并无显著差异(P>0.05)。
脂质在生物个体肝组织中进行过氧化反应,而MDA为脂质氧化的衍生物,同时也是不饱和脂肪酸由自由基氧化后的产物,因此通过检测肝组织中MDA水平可以分析机体受氧自由基破坏的严重性[24-27]。由图1可知,高脂模型组、豆油对照组与空白对照组相比MDA含量显著增加(P<0.05),说明过多油脂的摄入会产生一定危害。与高脂模型组相比,刺玫籽原花青素中、高剂量组MDA水平显著降低(P<0.05),刺玫籽原花青素低剂量组(50 mg/kg)MDA水平略有降低,差异性不显著(P>0.05),说明刺玫籽原花青素可以有效降低实验动物小鼠肝脏组织内MDA水平,减少氧自由基作用。刺玫籽油3个剂量组MDA含量介于空白对照组与高脂模型组、豆油对照组之间,差异性不显著(P>0.05),不呈量效关系,说明刺玫籽油降低MDA值有一定效果,但不显著。

图1 刺玫籽油及原花青素对小鼠肝组织MDA含量的影响
Fig. 1 Effect of the seed oil and procyanidins on MDA content in liver of mice
刺玫籽油及原花青素对高脂血症小鼠体质量及脏器指数无显著干扰(P>0.05),高剂量(200 mg/kg)的刺玫籽原花青素摄入可以显著降低高脂血症模型小鼠血清中LDL-C、TC、TG含量(P<0.05),进一步调节小鼠血脂代谢,有助降低动脉粥样硬化症发展的风险。这与研究报道的葡萄籽原花青素单独使用和联合菸碱酸铬施加能明显影响高脂小鼠胆固醇和甘油三酯水平,以及脂质氧化损伤所形成的硫代巴比妥酸反应物质的结论吻合[28-30]。低剂量(80 mg/kg)的刺玫籽油可以显著下调高脂血症小鼠血清内TG水平(P<0.05),对HDL-C、LDL-C、TC含量并无显著效果(P>0.05)。刺玫籽油及原花青素对高脂血症小鼠血清中TNF-α和IL-6含量无显著影响(P>0.05)。刺玫籽原花青素可以显著升高小鼠肝脏内SOD、GSH-Px、CAT活力(P<0.05),显著降低MDA水平(P<0.05),并显示出量效依赖;刺玫籽油的适当摄入可以显著下调实验动物(小鼠)肝脏中CAT活力(P<0.05),对小鼠肝组织中SOD活力、GSH-Px活力、MDA水平无显著影响,可能是因为刺玫籽油中有效成分较少,不能改善机体抗氧化能力。
实验结果表明,刺玫籽原花青素能够一定程度下调高脂血症小鼠血脂水平,可能是因为刺玫籽原花青素分子具有显著抗氧化的能力,起到消除氧自由基效果,从而防止血脂在动脉壁内堆积沉降,促进血液循环;另一方面,刺玫籽原花青素能够降低LDL-C水平,阻碍LDL-C将肝脏中胆固醇分子带入动脉壁细胞,进一步降低机体血液内胆固醇含量。
参考文献:
[1] BYUN E B, KOREMATSU S, ISHIKAWA T, et al. Apple procyanidins induce hyperpolarization of rat aorta endothelial cells via activation of K+channels[J]. Journal of Infectious Diseases, 2013, 58(1): 1-25. DOI:10.1016/j.jnutbio.2010.12.005.
[2] XU Jiqu, GAO Hui, ZHANG Li, et al. A combination of flaxseed oil and astaxanthin alleviates atherosclerosis risk factors in high fat diet fed rats[J]. Lipids in Health and Disease, 2014, 13(1): 1-7. DOI:10.1186/1476-511x-13-63.
[3] HOLVOET P, MERTENS A, VERHAMME P, et al. Circulating oxidized LDL is a useful marker for identifying patients with coronary artery disease[J]. Arteriosclerosis Thrombosis and Vascular Biology, 2001, 21(5): 844-848. DOI:10.1161/01.ATV.21.5.844.
[4] JESS R. Cranberry flavonoids, atherosclerosis and cardiovascular health[J]. Critical Reviews in Food Science & Nutrition, 2002, 42(3 Suppl 1): 301-316. DOI:10.1080/10408390209351919.
[5] HOU Fuyin, XIAO Min, LI Jian, et al. Ameliorative effect of grape seed proanthocyanidin extract on cadmium-induced meiosis inhibition during oogenesis in chicken embryos[J]. The Anatomical Record, 2016, 229(4): 450-460. DOI:10.1002/ar.23320.
[6] RAYMOND C, D JAMES M, MORRÉ D M. Medicinal benefits of green tea: Part I. review of noncancer health benefits[J]. Journal of Alternative & Complementary Medicine, 2005, 11(3): 521-528. DOI:10.1089/acm.2005.11.521.
[7] ANA R M, AKARI I, KAZUAKI M, et al. Blueberry intervention improves vascular reactivity and lowers blood pressure in highfat, high-cholesterol-fed rats[J]. British Journal of Nutrition, 2013, 109(10): 1-9. DOI:10.1017/S0007114512003911.
[8] MACHMUDAH S, KONDO M, SASAKI M, et al. Pressure effect in supercritical CO2extraction of plant seeds[J]. Journal of Supercritical Fluids, 2008, 44(3): 301-307. DOI:10.1016/j.supflu.2007.09.024.
[9] KIM W C, MAZNAH I. Supercritical carbon dioxide fluid extraction of Hibiscus cannabinus L. seed oil: a potential solvent-free and high antioxidative edible oil[J]. Food Chemistry, 2008, 114(3): 970-975. DOI:10.1016/j.foodchem.2008.10.055.
[10] ZLATANOV M D. Lipid composition of Bulgarian chokeberry, black currant and rose hip seed oils[J]. Journal of the Science of Food and Agriculture, 1999, 79(12): 1620-1624.
[11] 文镜, 张静, 桑婷婷, 等. 用高血脂小鼠模型评价降血脂保健食品可行性的探讨[J]. 食品科学, 2006, 27(11): 479-482. DOI:10.3321/ j.issn:1002-6630.2006.11.118.
[12] 刘靖, 陆大祥, 戚仁斌, 等. 性别对小鼠高脂血症动物模型的影响[J]. 中国比较医学杂志, 2010, 20(9): 16-18. DOI:10.3969/ j.issn.1671-7856.2010.09.005.
[13] 程霜, 郭长江, 杨继军. 石榴皮多酚提取物降血脂效果的实验研究[J]. 解放军预防医学杂志, 2005, 23(3): 160-163. DOI:10.13704/ j.cnki.jyyx.2005.03.002.
[14] 梅秀明, 潘道东. 乳酸菌胞外多糖的纯化及对小鼠血清和肝组织抗氧化性的影响[J]. 食品科学, 2009, 30(7): 220-224. DOI:10.3321/ j.issn:1002-6630.2009.07.050.
[15] 王晓炜, 王峰, 陶明煊, 等. 大球盖菇提取物对CC14所致肝损伤小鼠的抗氧化作用研究[J]. 食品科学, 2008, 29(12): 663-667. DOI:10.3321/j.issn:1002-6630.2008.12.155.
[16] 邓利群, 胡玉萍. 降脂胶囊对高脂血症大鼠血脂水平的影响及机理研究[J]. 陕西中医, 2009, 30(5): 632-633. DOI:10.3969/ j.issn.1000-7369.2009.05.090.
[17] 李江波, 呼和朝鲁, 郑凯骏, 等. 脂肪组织慢性炎症与动脉硬化研究新进展[J]. 中国医药导报, 2010, 7(8): 13-14. DOI:10.3969/ j.issn.1673-7210.2010.08.010.
[18] CAWTHORN W P, SETHI J K. TNF-α and adipocyte biology[J]. Febs Letters, 2008, 582(1): 117-131. DOI:10.1016/j.febslet.2007.11.051.
[19] STIENSTRA R, DUVAL C, KERSTEN S. PPARs, obesity, and inflammation[J]. Ppar Research, 2007, 2: 277-279. DOI:10.1155/2007/95974.
[20] 王华龙, 袁其云, 史志远. 黄连解毒汤对高脂血症小鼠血脂及炎症因子的影响[J]. 中国卫生标准管理, 2016(2): 185-186. DOI:10.3969/ j.issn.1674-9316.2016.02.137.
[21] GAAL L F V, MERTENS I L, BLOCK C E D. Mechanisms linking obesity with cardiovascular disease[J]. Nature, 2006, 444(14): 875-880. DOI:10.1038/nature05487.
[22] SCHIEFFER B, SCHIEFFER E, HILFIKER-KLEINER D, et al. Expression of angiotensin II and interleukin 6 in human coronary atherosclerotic plaques: potential implications for inflammation and plaque instability[J]. Circulation, 2000, 101(12): 1372-1378. DOI:10.1016/j.tips.2004.04.001.
[23] QURESHI A A, REIS J C, PAPASIAN C J, et al. Tocotrienols inhibit lipopolysaccharide-induced pro-inflammatory cytokines in macrophages of female mice[J]. Lipids in Health and Disease, 2010, 9(4): 1-15. DOI:10.1186/1476-511X-9-143.
[24] SUN Daqing, LI Aiwu, LI Ju, et al. Changes of lipid peroxidation in carbon disulfide-treated rat nerve tissues and serum[J]. Chemico-Biological Interactions, 2009, 179(2/3): 110-117. DOI:10.1016/ j.cbi.2008.11.014.
[25] WANG Qingshan, XIE Keqin, ZHANG Cuili, et al. Allyl chlorideinduced time dependent changes of lipid peroxidation in rat nerve tissue[J]. Neurochemical Research, 2005, 30(11): 1387-1395. DOI:10.1007/s11064-005-8391-1.
[26] HE Yingzhong, GU Xuefan, LU Lihua, et al. NOX, the main regulator in oxidative stress in experimental models of phenylketonuria[J]. Journal of Pediatric Endocrinology and Metabolism, 2013, 26(7/8): 675-682. DOI:10.1515/jpem-2012-0387.
[27] BRAY T M. Antioxidants and oxidative stress in health and disease: introduction[J]. Proceedings of the Society for Experimental Biology and Medicine, 1999, 222(3): 195. DOI:10.1046/j.1525-1373.1999.d01-135.x.
[28] VINSON J A, MANDARANO M L, BAGCHI M, et al. Beneficial effects of a novel IH636 grape seed proanthocyanidin extract and a niacin-bound chromium in a hamster atherosclerosis model[J]. Molecular and Cellular Biochemistry, 2002, 240(1/2): 99-103. DOI:10.1023/A:1020611925819.
[29] BANERJEE B, BAGCHI D. Beneficial effects of a novel IH636 grape seed proanthocyanidin extract in the treatment of chronic pancreatitis[J]. Digestion, 2001, 63(3): 203.
[30] JAIN S K, RAINS J L, CROAD J L. Effect of chromium niacinate and chromium picolinate supplementation on lipid peroxidation, TNF-alpha, IL-6, CRP, glycated hemoglobin, triglycerides, and cholesterol levels in blood of streptozotocin-treated diabetic rats[J]. Free Radical Biology and Medicine, 2007, 43(8): 1124-1131. DOI:10.1016/ j.freeradbiomed.2007.05.019.
Hypolipidemic Activity of Seed Oil and Procyanidins of Rosa davurica Pall.
HU Jimei1, LI Zhuolin2, YUE Yulan2, RONG Chenxi2, HUANG Wei2, XUE Peiyu2, LI Tiezhu2,*, ZHANG Jie2,* (1. China International Engineering Consulting Corporation, Beijing 100048, China; 2. Jilin Academy of Agricultural Sciences, Changchun 130124, China)
Abstract:The hypolipidemic activity of the seed oil and procyanidins of Rosa davurica Pall. was investigated by animal tests. Kunming male mice fed a high fat diet were used as a hyperlipidemic animal model. After oral administration for 5 weeks, serum and liver homogenate were collected for the measurement of parameters of interest. Compared with the hyperlipidemic model group, both drugs had no significant effect on body weight and visceral organ indexes in mice. The proanthocyanidins at middle (100 mg/kg) and high doses (200 mg/kg) could significantly reduce serum LDL-C, TC and TG (P < 0.05), significantly improve liver superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GSH-Px) levels (P < 0.05), and significantly decrease liver MDA level. The oil at low dose (80 mg/kg) could evidently reduce serum TG levels in hyperlipidemic mice (P < 0.05) and significantly increase in liver CAT activity (P < 0.05). Therefore, the seed oil at low dose and the procyanidins at middle and high doses play a role in reducing blood lipids in hyperlipidemic mice.
Key words:Rosa davurica Pall. seed oil; procyanidins; lipid-lowering activity
DOI:10.7506/spkx1002-6630-201713035
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)13-0213-06
引文格式:
胡济美, 李倬林, 岳玉兰, 等. 刺玫籽油及原花青素降血脂作用[J]. 食品科学, 2017, 38(13): 213-218. DOI:10.7506/ spkx1002-6630-201713035. http://www.spkx.net.cn
HU Jimei, LI Zhuolin, YUE Yulan, et al. Hypolipidemic activity of seed oil and procyanidins of Rosa davurica Pall.[J]. Food Science, 2017, 38(13): 213-218. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713035. http://www.spkx.net.cn
收稿日期:2016-06-16
基金项目:吉林省科学技术厅重点科技攻关项目(20140204051YY);吉林省科技厅重大科技攻关专项(20140203014NY)
作者简介:胡济美(1985—),男,工程师,硕士,研究方向为天然产物化学与利用。E-mail: hujimei2002@163.com
*通信作者:李铁柱(1978—),男,副研究员,博士,研究方向为保健食品开发。E-mail:ltzjlu@126.com
张杰(1983—),男,助理研究员,博士,研究方向为保健食品开发。E-mail:narcc2007@163.com