表1 菌群的引物序列和产物大小
Table 1 Primer and amplicon length

王晓成1,张 明2,陈善斌3,孙亚楠3,任发政3,仝其根1,*
(1.北京农学院食品科学与工程学院,北京 102206;2. 北京工商大学食品学院,北京 100048;3. 教育部北京市共建功能乳品重点实验室,北京 100083)
摘 要:目的:评价副干酪乳杆菌L9对健康小鼠肠道内短链脂肪酸(short chain fatty acids,SCFAs)含量的影响。方法:选取3 周龄BALB/c雄性小鼠50 只,随机分为副干酪乳杆菌L9高、中、低剂量组、阳性对照组(商业菌株Lactobacillus casei strain Shirota)、阴性对照(生理盐水)组共5 组,以0.2 mL/d的剂量连续灌胃小鼠21 d并收集第0、21天小鼠粪便。第21天处死小鼠后搜集收集盲肠内容物,利用气相色谱仪观察内容物中SCFAs的变化,并且利用实时定量聚合酶链式反应(real-time polymerase chain reaction,RT-PCR)分析肠道菌群数量的变化。结果:与第0天相比,第21天小鼠粪便中SCFAs中乙酸、丙酸含量极显著上升(P<0.01),Bifidobaceterium spp.、Lactobacillus属数量和丁酰辅酶A转移酶(butyryl-CoA:acetate CoA-transferase,CoAT)基因的表达量显著升高(P<0.05);盲肠内容物中,低剂量组和高剂量组中的Bifidobaceterium spp.数量和CoAT基因表达量分别与第0天和阴性对照组相比有显著差异(P<0.05)。实验结果表明:副干酪乳杆菌L9可以调节肠道菌群,促进健康小鼠肠道中SCFAs的产生,并且与商业菌株Lactobacillus casei strain Shirota相比,副干酪乳杆菌L9对肠道内丙酸、丁酸的含量和肠道中Bifidobaceterium spp.的数量有更好的促进作用。
关键词:副干酪乳杆菌L9;短链脂肪酸;肠道菌群
肠道短链脂肪酸(short chain fatty acids,SCFAs)是肠道细菌发酵未消化碳水化合物的主要产物,是肠道菌群代谢产物中最主要的标志物之一[1],主要由乙酸、丙酸和丁酸组成,三者含量占肠道SCFAs总量的90%~95%。肠道内SCFAs的含量高低不仅反映肠道细菌的活力,还对肠道上皮细胞的代谢具有重要影响。乙酸主要来源于盲肠,经过肠上皮吸收后流入门静脉[2]参与肌肉、脾脏、心脏和脑内的代谢,是机体从小肠不能吸收的碳水化合物中获取能量的主要途径[3]。丙酸作为肝脏代谢的能源并能够抑制胆固醇的合成[4]。丁酸是厚壁菌门的主要代谢产物,可以被结肠的上皮细胞吸收利用,是结肠和盲肠重要的能量来源[5],在细胞分化和生长有着重要的作用[6],并且可减少肠道上皮细胞的肿瘤坏死因子的分泌[7]。因此,SCFAs对机体肠道具有调节肠道菌群平衡及改善肠道功能[8],肠道内SCFAs含量的调控与机体的肠道健康紧密相关[9]。
丁酰辅酶A转移酶途径途径(butyryl-CoA:acetate CoA-transferase,CoAT)是人体内微生物产丁酸的主要途径[10]。Louis等[11]对在人体粪便中分离的38 株产丁酸菌株进行相关酶活力及其基因的检测,发现仅有4 株存在丁酸激酶活性及其基因,而CoAT活性及其基因存在于全部菌株中,由此可知在人体肠道中,CoAT途径可能是丁酸产生的主要途径。检测CoAT含量的变化,可以更加准确地反映丁酸含量的变化。
益生菌是指一类活的微生物,当摄入足够数量时,起到有益宿主健康的作用[12],具有很好地促进肠道发育、调节肠道菌群的功能。而这些功能的发挥很大程度上依赖于益生菌对肠道SCFAs含量的调节。益生菌定殖于肠道后,改变了肠道菌群的结构与组成,使产SCFAs的有益菌群增多,降低了肠内pH值对酸性环境敏感微生物的生长抑制,从而减少肠道内致病微生物[13]。Schneider等[14]研究发现,肠道疾病患者的粪便丁酸含量低于健康人的水平,连续服用酵母菌Saccharomyces boulardii 6 d,发现患者粪便中的丁酸含量明显升高,总SCFAs的水平也有所提高,并且有效地预防患者腹泻。Sakata等[15]将4 种益生菌添加到猪饲料中,对猪喂养一段时间后测定盲肠内容物中SCFAs的含量,发现SCFAs和乳酸盐的含量明显增加。SCFAs含量的变化成为了研究益生菌对肠道影响的重要指标[16]。
副干酪乳杆菌L9(Lactobacillus paracasei L9)是一株从长寿老人粪便中分离得到的益生菌株,前期实验证明该菌株具有较高的安全性[17]及调节小鼠肠道免疫功能的生物活性[18],对小鼠溃疡性结肠炎具有预防作用[19]。有研究证明副干酪乳杆菌L9具有缓解小鼠便秘的功效,对便秘小鼠连续15 d灌胃副干酪乳杆菌L9后,小鼠便秘现象得到改善[20],可以推测副干酪乳杆菌L9可以通过改善便秘小鼠的肠道菌群及内环境从而改善机体的便秘现象。而该菌株对肠道中SCFAs的含量有何影响尚且研究较少。盲肠是大肠的起始肠段,粪便是大肠最终消化产物,盲肠内容物和粪便中SCFAs和菌群差异,可以反映整个大肠肠道功能的变化。本实验通过对健康小鼠灌胃副干酪乳杆菌L9,取大肠起始肠段盲肠中的内容物以及大肠道消化最终产物粪便,检测小鼠肠道SCFAs含量及菌群数量,以进一步探讨益生菌调节肠道功能的作用和机制。
1.1 动物、材料与试剂
SPF级近交系BALB/c小鼠50 只,雄性,3 周龄,购自北京维通利华实验动物技术有限公司。
普通饲料 北京维通利华实验动物技术有限公司;无菌垫料 中国军事科学医学院;商业菌株干酪乳杆菌代田菌(Lactobacillus casei strain Shirota,LcS) 养乐多(中国)投资有限公司。
DNA胶回收试剂盒 美国Zymo Research公司;SYBR Premix Ex Taq实时定量聚合酶链式反应(realtime polymerase chain reaction,RT-PCR)试剂盒 日本Takara公司。
1.2 仪器与设备
5418R低温高速离心机 德国Satorious公司;实时定量PCR仪 英国Techne公司;迷你离心机 美国Benchmark公司;MS2漩涡振荡仪 德国IKA公司。
1.3 方法
1.3.1 菌液的制备
副干酪乳杆菌L9于MRS液体培养基37 ℃培养12 h后,4 200 r/min离心10 min,除去上清液,菌体沉淀重悬于生理盐水中,配制浓度为106、108、1010CFU/mL的菌悬液。菌株LcS按相同方法制备菌体沉淀后,重悬于生理盐水中,配制108CFU/mL的菌悬液。
1.3.2 动物分组及处理
实验小鼠随机分为5 组,分别为阴性对照组(灌胃生理盐水)、阳性对照组(灌胃108CFU/mL 菌株LcS菌悬液)、副干酪乳杆菌L9高、中、低剂量组(灌胃1010、108、106CFU/mL副干酪乳杆菌L9菌悬液),小鼠每日灌胃0.2 mL样品,连续21 d,分别于实验第0、21天采集小鼠粪便样并在第21天处死后采集小鼠盲肠内容物进行SCFAs含量及肠道主要菌群数量的测定。
1.3.3 样品中SCFAs含量的测定
粪便中SCFAs的提取和测定参考Goossens等[21]的方法。采用HP-FFAP毛细管柱(25 m×0.32 mm,0.5 μm),吸取2 µL样品,火焰离子检测器进行检测。气相色谱程序:50 ℃保持3min,以5 ℃/min升温至140 ℃,保持1 min,以30 ℃/min升至240 ℃,保持3 min;进样口温度是230 ℃,氮气作为载气,不分流进样。配制含有1、2、3、5、10、20、40 mmol/L乙酸的乙醚溶液、含丙酸的乙醚溶液和含丁酸的乙醚溶液。以庚酸为内标,庚酸的浓度为5 mmol/L。得到各浓度对应的色谱峰面积,以乙酸、丙酸、丁酸与庚酸的峰面积比作为纵坐标,以乙酸、丙酸、丁酸含量为横坐标绘制标准曲线。
1.3.4 小鼠粪便、盲肠DNA的提取
将约0.3 g粪便样品和盲肠内容物置于2 mL已加入适量无菌玻璃珠(直径3 mm)并灭菌的RNAlater中,并按照酚-氯仿法提取粪便和盲肠内容物的总DNA[22]。
1.3.5 肠道菌群数量的测定
使用特异性引物(表1)对粪便样品、盲肠内容物DNA进行RT-PCR,将其扩增产物进行琼脂糖凝胶电泳(体积分数2%的琼脂糖),用无菌手术刀将单一的目标条带切下,Zemo胶回收后,根据试剂盒说明书进行DNA回收,得到标准DNA的模板。1%琼脂糖电泳检测回收的DNA,并于-20 ℃保存备用。
标准DNA模板浓度测定:切胶回收的标准DNA模板,利用Qubit Assasys测定其DNA浓度。根据1 μg 1000 bp dsDNA = 1.52 pmol = 9.1×1011拷贝数以及标准DNA大小(表1),计算出每个PCR组的标准DNA模板的拷贝数浓度。
表1 菌群的引物序列和产物大小
Table 1 Primer and amplicon length

标准曲线的绘制:用TE缓冲液稀释标准菌株DNA,10 倍稀释8 个梯度作为RT-PCR的标准曲线。RT-PCR反应体系(20 μL):模板DNA 1 μL、10 μmol/L上下引物各0.5 μL、无菌水8 μL、SYBR Premix Ex Tap 10 μL。RT-PCR反应程序:95 ℃预变性30 s、95 ℃变性15 s、退火30 s、72 ℃延伸30 s、在76~82 ℃间选择合适的温度反应5 s去除二聚体荧光信号干扰,并收集该循环的荧光信号,PCR 40~45 个循环。循环结束后,从60 ℃逐渐升温到95 ℃,升温速率为0.1 ℃/s,每次循环过程末期检测SYBR Green信号,绘制溶解曲线。每个样品做2 个平行。
1.4 数据统计分析
釆用Excel软件统计每克粪便和盲肠中各细菌组和总菌的DNA拷贝数,结果用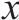 ±s表示,SPSS 21.0统计软件做t检验,P<0.05为差异显著,P<0.01为差异极显著。
±s表示,SPSS 21.0统计软件做t检验,P<0.05为差异显著,P<0.01为差异极显著。
2.1 SCFAs标准曲线的建立及线性相关方程
利用气相色谱测定乙酸、丙酸和丁酸含量的标准曲线,得到线性相关方程和相关系数(R2)分别为:乙酸(庚酸为内标):y=0.023 2x-0.028 2,R2=0.999 6;丙酸(庚酸为内标):y=0.049 3x-0.049,R2=0.991;丁酸/庚酸:y=0.074 1x-0.017 2,R2=0.997 1。R2结果表明所得标准曲线的相关性强,所得结果具有参考价值。
2.2 灌胃副干酪乳杆菌L9对小鼠粪便和盲肠中SCFAs含量的影响
2.2.1 小鼠粪便中SCFAs含量


图1 灌胃副干酪乳杆菌L9对小鼠粪便中SCFAs含量的影响
Fig. 1 Effect of Lactobacillus paracasei L9 on SCFAs contents in feces of mice
如图1所示,对健康小鼠灌胃副干酪乳杆菌L9菌液21 d的生理盐水(阴性对照组)小鼠粪便中的乙酸、丙酸、丁酸的含量与第0天相比没有明显差异(P>0.05),这表明生理盐水对小鼠粪便SCFAs含量没有影响。阳性对照组中乙酸、丙酸、丁酸的含量与第0天相比具有极显著差异(P<0.01),表明对小鼠灌胃LcS菌液21 d后,增加了小鼠肠道的SCFAs的含量。副干酪乳杆菌L9灌胃21 d后,小鼠粪便中乙酸、丙酸含量在高、中、低3 个剂量组中都与第0天有极显著差异(P<0.01);小鼠粪便中丁酸的高、低剂量组与第0天有极显著差异(P<0.01),而中剂量组虽然与第0天相比含量增加,但是没有显著差异(P>0.05)。并且第21天时,副干酪乳杆菌L9灌胃各剂量组与阳性对照组相比,乙酸、丙酸、丁酸含量都没有显著差异(P>0.05)。由图1还可知,3 个剂量组的副干酪乳杆菌L9菌液灌胃21 d对小鼠粪便SCFAs的含量没有明显的剂量效应,但是与生理盐水阴性对照组和LcS阳性对照组相比,副干酪乳杆菌L9对小鼠肠道中SCFAs的乙酸、丙酸、丁酸的合成具有促进作用。
2.2.2 小鼠盲肠中SCFAs含量

图2 盲肠内容物中SCFAs含量的变化
Fig. 2 Effect of Lactobacillus paracasei L9 on SCFAs concentrations in cecum contents
盲肠是小肠和大肠的联络点并且SCFAs的主要吸收发生在盲肠部位[26],因此盲肠内容物中SCFAs的含量较高[4]。因此检测小鼠盲肠内容物中SCFAs含量更准确地反映益生菌对肠道中SCFAs的影响。如图2所示,灌胃副干酪乳杆菌L9的各剂量组和阳性对照组、阴性对照组相比,盲肠内容物中乙酸的含量虽然有一定的升高,但是没有显著差异(P>0.05),且副干酪乳杆菌L9对乙酸的产生有促进作用,但没有剂量-效应关系;各剂量组与阳性对照组均可增加乙酸含量,可以说副干酪乳杆菌L9具有促进乙酸含量升高的效果,且与菌株LcS促进乙酸产生的效果没有显著差异性(P>0.05)。
盲肠内容物中灌胃副干酪乳杆菌L9各剂量组与阴性对照组相比,丙酸含量有显著上升(P<0.05,P<0.01),并且高剂量组具备极显著差异(P<0.01)。阳性对照组与阴性对照组相比较,丙酸含量没有显著性差异。表明副干酪乳杆菌L9可能比菌株LcS能更好地促进肠道内丙酸的产生。
灌胃副干酪乳杆菌L9高剂量组和低剂量组小鼠盲肠内容物中丁酸含量与阴性对照组相比有显著差异(P<0.05),中剂量组和阳性对照组中丁酸含量与其相比有一定的升高但是没有显著差异(P>0.05)。灌胃副干酪乳杆菌L9各剂量组与阳性对照组相比,除高剂量组有显著性差异外(P<0.05),低、中剂量组都有升高但没有显著差异(P>0.05)。表明副干酪乳杆菌L9对丁酸影响与商业菌株LcS对丁酸的促进作用相近,具有商业研究价值。
2.3 灌胃副干酪乳杆菌L9对小鼠肠道中益生菌群的影响
2.3.1 小鼠粪便中益生菌变化

图3 副干酪乳杆菌L9对小鼠粪便中益生菌群的影响
Fig. 3 Effect of Lactobacillus paracasei L9 on probiotic populations in feces of mice
肠道益生菌主要包括Lactobacillus属和Bifidobaceterium spp.[27],大量的Lactobacillus属和Bifidobaceterium spp.在肠道中通常是健康肠道的象征。SCFAs主要由肠道中Lactobacillus属和Bifidobaceterium spp.等有益菌群酵解膳食纤维、抗性淀粉、低聚糖等不易消化的糖类产生的。观察两个菌群的数量变化可以更加全面地了解SCFAs的变化。实验对小鼠连续灌胃21 d,灌胃前后粪便中Lactobacillus属和Bifidobaceterium spp. DNA数量的变化如图3所示。灌胃21 d后,副干酪乳杆菌L9各剂量组Lactobacillus属和Bifidobaceterium spp.的DNA数量与第0天相比都有极显著差异(P<0.01),各剂量组与阳性对照相比Bifidobaceterium spp.的DNA数量虽然没有显著差异(P>0.05),但是有所增多。这表明副干酪乳杆菌L9对肠道Lactobacillus属和Bifidobaceterium spp.具有一定的增殖作用,并且对肠道Bifidobaceterium spp.的增殖效果比商业菌株LcS对肠道中Bifidobaceterium spp.的增殖效果更加显著。
2.3.2 小鼠盲肠内容物中益生菌变化

图4 副干酪乳杆菌L9对小鼠盲肠内容物中益生菌群的影响
Fig. 4 Effect of Lactobacillus paracasei L9 on probiotic populations in cecum contents of mice
由图4可知,Lactobacillus属的DNA数量在盲肠内容物中各组间没有显著差异(P>0.05),但是高、中、低剂量组与阴性对照组相比,DNA数量有略微增加。低、高剂量组、阳性对照组中Bifidobaceterium spp.的DNA数量与阴性对照组相比有显著差异(P<0.05),阳性对照组的DNA拷贝数与中剂量组相比有显著升高(P<0.05),由此推测在盲肠中LcS对Bifidobaceterium spp.的效应比副干酪乳杆菌L9对Bifidobaceterium spp.的效应要好,副干酪乳杆菌L9对小鼠肠道Lactobacillus属的数量没有明显的效应,与菌株LcS的作用效果一致。
2.4 灌胃副干酪乳杆菌L9对小鼠肠道中CoAT基因表达量的影响
2.4.1 小鼠粪便中CoAT基因表达量的变化
体外实验表明,丁酸不仅具有抑制致病菌的“天然抗生素”功能,还能抑制肿瘤细胞增殖和诱导其凋亡,并抑制新生血管在肿瘤部位形成[4]。所以,肠道内SCFAs尤其是丁酸的含量与人体肠道健康是紧密相关的[28]。由图1、2可知,灌胃副干酪乳杆L9后盲肠内容物及粪便中丁酸含量变化明显,为了进一步研究肠道中丁酸含量的变化,通过CoAT基因表达量变化来更直接地观察丁酸浓度含量肠道菌群中产丁酸细菌丰度的变化。由图5可知,灌胃21 d后,低剂量组、中剂量组、阳性对照组中粪便CoAT基因表达量与第0天相比较都有显著性差异(P<0.05),高剂量组与第0天相比有极显著差异(P<0.01)。灌胃副干酪乳杆L9各剂量组与阳性对照组之间没有显著差异(P>0.05)。这表明菌株L9对肠道中产丁酸细菌的丰度有促进作用,与SCFAs中丁酸测定中变化趋势一致。

图5 副干酪乳杆菌L9对小鼠粪便中CoAT基因表达量的影响
Fig. 5 Effect of Lactobacillus paracasei L9 on the expression level of CoAT in feces of mice
2.4.2 小鼠盲肠内容物中CoAT基因表达量的变化

图6 副干酪乳杆菌L9对小鼠盲肠内容物中CoAT基因表达量的影响
Fig. 6 Effect of Lactobacillus paracasei L9 on the expression level of CoAT in cecum contents of mice
实验小鼠盲肠内容物中CoAT基因表达量变化如图6所示,低、高剂量组与阴性对照组有显著差异(P<0.05),而中剂量组和阳性对照组与其没有显著差异(P>0.05),这表明在盲肠中副干酪乳杆菌L9对丁酸的影响并不稳定,但相对于菌株LcS在盲肠中对丁酸的影响要显著一些。并且,图6中盲肠内容物CoAT基因的表达量变化与图2中盲肠内容物中丁酸的含量变化趋势一致。说明CoAT基因的表达量可以用来准确反映丁酸含量的变化。
综上所述,健康小鼠灌胃副干酪乳杆菌L9菌悬液21 d后,明显促进健康小鼠肠道益生菌Bifidobacterium spp.和Lactobacillus属增殖,提高肠道中SCFAs的含量和CoAT基因的表达量。Koebnick等[29]研究表明,慢性便秘的病人饮用含Lactobacillus casei strain Shirota的益生菌饮料后,便秘程度和粪便的状态得到了显著改善。Beniwal等[30]报道了饮用含有Lactobacillus acidophilus、Lactobacillus bulgarius和Symbiobacterium thermophilu 3 种益生菌的酸奶可显著减少与抗生素相关腹泻的发生和持续时间。因此本实验将副干酪乳杆菌L9与商业菌株LcS相比较,证明副干酪乳杆菌L9对小鼠肠道益生菌及SCFAs的作用与菌株LcS具有一致性,且副干酪乳杆菌L9在促进小鼠肠道分泌丙酸、丁酸的含量及增加小鼠肠道中Bifidobacterium spp.数量上比菌株LcS效果更显著。由此推断副干酪乳杆菌L9具有潜在的益生作用,有必要对其益生作用机制进行更深入的研究,为其在应用开发功能性乳品制品提供更充分的依据。
参考文献:
[1] 王玉蕾, 郑跃杰. 肠道中短链脂肪酸与过敏性疾病关系的研究进展[J].中国微生态学杂志, 2013, 25(1): 104-108. DOI:10.13381/j.cnki. cjm.2013.01.032.
[2] 任傲, 童勤, 张彬. 短链脂肪酸的生成及其吸收机制[J]. 广东饲料, 2015(10): 28-29. DOI:10.3969/j.issn.1005-8613.2015.10.008.
[3] 刘松珍, 张雁, 张名位, 等. 肠道短链脂肪酸产生机制及生理功能的研究进展[J]. 广东农业科学, 2013, 40(11): 99-103. DOI:10.16768/ j.issn.1004-874x.2013.11.025.
[4] 李婉, 张晓峰, 常爱武, 等. 低聚木糖对小鼠肠道菌群和短链脂肪酸的影响[J]. 河南工业大学学报(自然科学版), 2014, 35(5): 93-96. DOI:10.16433/j.cnki.issn1673-2383.2014.05.018.
[5] PRYDE S E, DUNCAN S H, HOLD G L, et al. The microbiology of butyrate formation in the human colon[J]. FEMS Microbiology Letters, 2002, 217(2): 133-139. DOI:10.1111/j.1574-6968.2002.tb11467.x.
[6] 陈燕, 曹郁生, 刘晓华. 短链脂肪酸与肠道菌群[J]. 江西科学, 2006, 24(1): 38-40. DOI:10.13990/j.issn1001-3679.2006.01.010.
[7] SEGAIN J P, de la BLÉTIÈRE D R, BOURREILLE A, et al. Butyrate inhibits inflammatory responses through NF-kappaB inhibition: implications for Crohn’s disease[J]. Gut, 2000, 47(3): 397-403. DOI:10.1136/gut.47.3.397.
[8] 刘小华, 李舒梅, 熊跃玲. 短链脂肪酸对肠道功效及其机制的研究进展[J]. 肠外与肠内营养, 2012, 19(1): 56-58. DOI:10.3969/ j.issn.1007-810X.2012.01.019.
[9] PAN X D, CHEN F Q, WU T X, et al. Prebiotic oligosaccharides change the concentrations of short-chain fatty acids and the microbial population of mouse bowel[J]. Journal of Zhejiang University: Science B, 2009, 10(4): 258-263.DOI:10.1631/jzus.B0820261.
[10] 余荣, 徐小芳, 王雯熙. 丁酸对动物肠道影响的研究进展[J]. 中国畜牧杂志, 2012, 48(16): 64-68. DOI:10.3969/j.issn.0258-7033.2012.16.015.
[11] LOUIS P, DUNCAN S H, MCCRAE S I, et al. Restricted distribution of the butyrate kinase pathway among butyrate-producing bacteria from the human colon[J]. Journal of Bacteriology, 2004, 186(7): 2099-2106. DOI:10.1128/JB.186.7.2099-2106.2004.
[12] Food and Agriculture Organization of the United Nations, World Health Organization. Health and nutrition properties of probiotics in food including powder milk with live lactic acid bacteria[J]. FAO Food and Nutrition Paper, 2006, 85: 1-33. DOI:10.1201/9781420009613.ch16.
[13] 廖文艳, 周凌华, 王荫榆, 等. 近年来益生菌肠道功能作用机制及研究方法的进展[J]. 中国微生态学杂志, 2011, 23(2): 184-189. DOI:10.13381/j.cnki.cjm.2011.02.010.
[14] SCHNEIDER S M, GIRARD-PIPAU F, FILIPPI J, et al. Effects of Saccharomyces boulardii on fecal short-chain fatty acids and microflora in patients on long-term total enteral nutrition[J]. World Journal of Gastroenterology, 2005, 11(39): 6165-6169. DOI:10.3748/ wjg.v11.i39.6165.
[15] SAKATA T, KOJIMA T, FUJIEDA M, et al. Influences of probiotic bacteria on organic acid production by pig caecal bacteria in vitro[J]. Proceedings of the Nutrition Society, 2003, 62(1): 73-80. DOI:10.1079/PNS2002211.
[16] 张家超, 郭壮, 孙志宏, 等. 益生菌对肠道菌群的影响: 以Lactobacillus casei Zhang研究为例[J]. 中国食品学报, 2011, 11(9): 58-68. DOI:10.3969/j.issn.1009-7848.2011.09.007.
[17] 宋静颐, 张明, 刘松玲, 等. 副干酪乳杆菌L9安全性评价[J]. 中国奶牛, 2015(21): 27-31. DOI:10.3969/j.issn.1004-4264.2015.21.009.
[18] 杨景, 刘松玲, 葛绍阳, 等. 树突状细胞激活介导副干酪乳杆菌L9对CD4+T细胞的分化作用研究[J]. 中国乳业, 2015(9): 65-69. DOI:10.16172/j.cnki.114768.2015.09.039.
[19] 汪昕昕, 任倩然, 付天娇, 等. Lactobacillus casei-14对小鼠溃疡性结肠炎的预防作用[J]. 甘肃农业大学学报, 2013, 48(2): 1-5. DOI:10.3969/j.issn.1003-4315.2013.02.001.
[20] 周晓丹, 刘爱萍, 张明, 等. 副干酪乳杆菌LC-01对便秘小鼠的通便作用[J]. 乳业科学与技术, 2012(5): 7-11. DOI:10.15922/j.cnki. jdst.2012.05.013.
[21] GOOSSENS D, JONKERS D, RUSSEL M, et al. The effect of Lactobacillus plantarum 299v on the bacterial composition and metabolic activity in faeces of healthy volunteers: a placebocontrolled study on the onset and duration of effects[J]. Alimentary Pharmacology & Therapeutics, 2003, 18(5): 495-505. DOI:10.1046/ j.1365-2036.2003.01708.x.
[22] VIA L E, III J O F. Comparison of methods for isolation of Mycobacterium avium complex DNA for use in PCR and RAPD fingerprinting[J]. Journal of Microbiological Methods, 1995, 21(2): 151-161. DOI:10.3748/wjg.v11.i39.6165.
[23] SPRONG R C, SCHONEWILLE A J, van der MEER R. Dietary cheese whey protein protects rats against mild dextran sulfate sodiuminduced colitis: role of mucin and microbiota[J]. Journal of Dairy Science, 2010, 93(4): 1364-1371. DOI:10.3168/jds.2009-2397.
[24] HEILIG H, ZOETENDAL E G, VAUGHAN E E, et al. Molecular diversity of Lactobacillus spp. and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA[J]. Applied and Environmental Microbiology, 2002, 68(1): 114-123. DOI:10.1128/AEM.68.1.114-123.2002.
[25] LOUIS P, FLINT H. Development of a semiquantitative degenerate real-time PCR-based assay for estimation of numbers of butyrylcoenzyme A (CoA) transferase genes in complex bacterial sample[J]. Applied and Environmental Microbiology, 2007, 73(6): 2009-2012. DOI:10.1128/AEM.02561-06.
[26] 易中华, 马秋刚, 王晓霞, 等. 大豆寡糖对肉仔鸡肠道pH值和盲肠短链脂肪酸的影响[J]. 饲料工业, 2010, 31(19): 32-35. DOI:10.3969/ j.issn.1001-991X.2010.19.010.
[27] PIANO M D, MORELLI L, STROZZI G P, et al. Probiotics: from research to consumer[J]. Digestive and Liver Disease, 2006, 38(Suppl 2): 248-255. DOI:10.1016/S1590-8658(07)60004-8.
[28] 于卓腾, 杭苏琴, 姚文, 等. 肠道产丁酸细菌及其丁酸产生机制的研究进展[J]. 世界华人消化杂志, 2006, 14(25): 2531-2534. DOI:10.3969/j.issn.1009-3079.2006.25.012.
[29] KOEBNICK C, WAGNER I, LEITZMANN P, et al. Probiotic beverage containing Lactobacillus casei Shirota improves gastrointestinal symptoms in patients with chronic constipation[J]. Canadian Journal of Gastroenterolog, 2003, 17(11): 655-659. DOI:10.1155/2003/654907.
[30] BENIWAL R S, ARENA V C, THOMAS L, et al. A randomized trial of yogurt for prevention of antibiotic-associated diarrhea[J]. Digestive Diseases and Sciences, 2003, 48(10): 2077-2082. DOI:10.1023/ A:1026155328638.
Effect of Lactobacillus paracasei L9 on the Content of Intestinal Short Chain Fatty Acids in Healthy Mice
WANG Xiaocheng1, ZHANG Ming2, CHEN Shanbin3, SUN Yanan3, REN Fazheng3, TONG Qigen1,*
(1. Food Science and Engineering College, Beijing University of Agriculture, Beijing 102206, China; 2. School of Food and
Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China; 3. Key Laboratory of Functional Dairy, Ministry of Education & Beijing Government, Beijing 100083, China)
Abstract:Objective: To evaluate the effect of Lactobacillus paracasei L9 on the content of intestinal short chain fatty acids (SCFAs) in healthy mice. Methods: Fifty three-week-old BALB/c male mice were randomly divided into 5 groups: high dose, medium dose, low dose, positive control and negative control groups. After continuous administration at a dose of 0.2 mL/day per mouse for 21 days, mouse feces were collected, and the cecal contents were also examined after sacrificing the mice on day 21. The changes in SCFAs concentrations of samples were analyzed by gas chromatography, and RTPCR was used to analyze the changes in the intestinal flora. Results: The concentration of short-chain fatty acids including acetic acid, propionic acid and butyric acid increased significantly (P < 0.05), when compared with those observed before administration. The counts of Bifidobaceterium spp. and Lactobacillus and the expression level of butyryl-CoA:acetate CoA-transferase gene (CoAT) were increased significantly (P < 0.05) in feces of mice on day 21. For the cecal contents, Bifidobaceterium spp. count and the expression level of CoAT in low-dose and high-dose groups showed a significant difference (P < 0.05) those in normal saline group. Conclusion: Lactobacillus paracasei L9 can adjust the intestinal flora and promote the production of short chain fatty acids in the intestine of healthy mice. Compared with commercial strain Lactobacillus casei strain Shirota, L9 has a better effect on promoting the yield of propionic acid and butyric acid and the growth of Bifidobaceterium spp. in the intestine.
Key words:Lactobacillus paracasei L9; short chain fatty acids (SCFAs); intestinal microflora
DOI:10.7506/spkx1002-6630-201713039
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2017)13-0238-06
收稿日期:2016-07-12
作者简介:王晓成(1989—),女,硕士,研究方向为功能性乳品。E-mail:570126226@qq.com
*通信作者:仝其根(1962—),男,教授,硕士,研究方向为蛋品、食品添加剂、农产品加工。E-mail:tongqigen@163.com
引文格式:
王晓成, 张明, 陈善斌, 等. 副干酪乳杆菌L9对小鼠肠道短链脂肪酸含量的影响[J]. 食品科学, 2017, 38(13): 238-243.
DOI:10.7506/spkx1002-6630-201713039. http://www.spkx.net.cn
WANG Xiaocheng, ZHANG Ming, CHEN Shanbin, et al. Effect of Lactobacillus paracasei L9 on the content of intestinal short chain fatty acids in healthy mice[J]. Food Science, 2017, 38(13): 238-243. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713039. http://www.spkx.net.cn