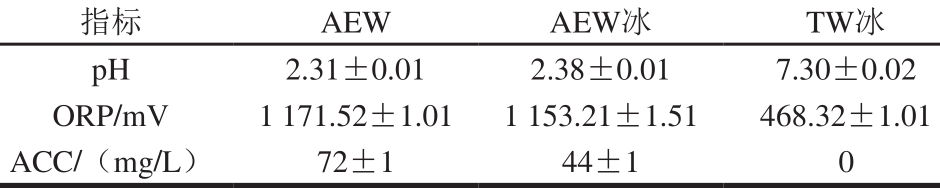
表1 AEW冰和TW冰的理化性质
Table 1 Physical and chemical properties of AEW ice and TW ice
姚 鑫1,赵爱静1,杜苏萍1,孙晓红1,2,3,潘迎捷1,2,3,赵 勇1,2,3,*
(1.上海海洋大学食品学院,上海 201306;2.上海水产品加工及贮藏工程技术研究中心,上海 201306;3.农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306)
摘 要:为探讨酸性电解水(acidic electrolyzed water,AEW)冰对水产品的保鲜效果,以小黄鱼为对象,研究小黄鱼贮藏7 d过程中酶活力及微生物菌落总数的变化。结果表明,AEW冰抑制酸性磷酸酶、组织蛋白酶B活性的效果不明显,但对组织蛋白酶D、脂肪酶活性有显著的抑制效果(P<0.05);传统平板计数以及聚合酶链式反应-变性梯度凝胶电泳结果显示,AEW冰能抑制鱼体上腐败微生物的生长,且最大减少量可达0.34 (lg(CFU/g))。因此,AEW冰技术作为一种新型高效杀菌保鲜技术,具有广阔的应用前景,相比于自来水冰更加有利于水产品的贮藏保鲜。
关键词:酸性电解水冰;小黄鱼;酶活性;聚合酶链式反应-变性梯度凝胶电泳
目前,自来水(tap water,TW)冰是一种常用于保持食品新鲜度的手段,因其可以提供较低的温度和较高的湿度而被广泛应用于水果、蔬菜,尤其是水产品等食品的保鲜[1]。酸性电解水(acidic electrolyzed water,AEW)是一种新型的杀菌技术,已被证实对人体健康几乎没有不良的影响。AEW具有杀菌能力强、杀菌范围广,无污染、无残留,对人体安全,制取方便、价格低廉等特点[2]。基于AEW的这些特点,改良了AEW的形态,制成AEW冰,使得AEW在水产品的保鲜上有进一步的功效。冷冻贮藏过程中,对产业和消费者来说水产品的新鲜度是至关重要的,而新鲜度的变化主要与微生物活动有关。近年来,有关AEW冰的研究主要涉及食品保鲜和微生物杀灭等方面。周然等[3]的研究表明AEW对河豚鱼的质构变化有减缓的作用,能更好地维护鱼肉的品质。Wang Meng等[4]的研究发现AEW冰对虾肉部分酶活的变化具有显著的影响。Phuvasate等[5]研究报道AEW冰在鱼皮贮藏期间,能够使其表面的产组胺微生物失活。Feliciano[1]、Koseki[6]等的研究分别表明AEW冰可有效杀灭和抑制生菜表面的需氧微生物、单增李斯特菌和大肠杆菌及鱼片中的大肠杆菌和假单胞菌。以上研究表明,AEW冰可以有效地杀灭常见食源性致病菌和腐败微生物,并延长食品的货架期。然而AEW冰在水产品保鲜方面的研究还处于萌芽状态,尤其在保鲜基础理论方面亟待深入完善。
小黄鱼是我国渔业主要捕捞对象,随着我国经济的不断发展,旅游餐饮业的繁荣,小黄鱼巨大的市场经济价值越来越凸显,对开放小黄鱼市场的呼声越来越高。小黄鱼肉不易贮藏,在捕捞、运输、加工及贮藏过程中极易受细菌侵袭而腐败变质,导致其货架期缩短,严重影响了产品的销售和流通。根据经验,在生产上常用的冷藏条件下(4 ℃)鱼类产品仅能有4 d左右的货架期[1]。因此,研发一项新型杀菌保鲜技术来提高小黄鱼的保鲜效果十分必要。本实验将小黄鱼作为实验的研究对象,探究了AEW冰与TW冰对小黄鱼酶活及品质变化的影响,这将为AEW冰能更好地保鲜水产品提供重要的理论依据,同时也为今后研究AEW冰对其他水产品的保鲜效果提供参考。
1.1 材料
新鲜的小黄鱼(约(250 ± 10) g),购自上海某农贸市场。
1.2 仪器与设备
FW-200型酸性电解水生成器、RC-3F型高浓度有效氯测定仪(测量范围:0~300 mg/L,分辨率:1 mg/L)日本Amano公司;TA-XTPlus质构分析仪 英国Stable Micro Systems公司;pH/ORP测定仪 梅特勒-托利多仪器上海有限公司;BagMixer 400VW型拍打式均质器法国Interscience公司;酶标仪 美国BioTek公司;离心机、聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 德国Eppendorf公司;变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)电泳仪、凝胶成像仪分析系统 美国Bio-Rad公司。
1.3 方法
1.3.1 AEW冰的制备
AEW的制备方法参照Wang Meng等[4]的方法,运用二槽隔膜(离子交换膜,阴离子如Cl-、OH-,阳离子如Na+、H+等均可通过)式电解水制备仪电解0.15% NaCl溶液15 min,在阳极获得酸性电解水(2Cl-→Cl2+2e-;Cl2+H2O→HCl+HClO;2H2O→4H++O2+4e-),在阴极获得碱性电解水(2H2O+2e-→H2+2OH-)同时测定pH值、氧化还原电位(oxidation-reduction potential,ORP)和有效氯质量浓度(available chlorine concentration,ACC)3 项指标。将制备好的10 L AEW立即装入密封袋中并于-20 ℃条件下冷冻24 h制成冰。实验前测定AEW冰、TW冰融化液的pH值、ORP、ACC三项理化指标,见表1。
表1 AEW冰和TW冰的理化性质
Table 1 Physical and chemical properties of AEW ice and TW ice

1.3.2 小黄鱼处理及贮藏条件
小黄鱼由密闭箱(装有冰袋)运至实验室后立即用自来水冲洗干净备用。AEW冰和TW冰分别铺在一个无菌的不锈钢托盘上(两格72 cm×48 cm×9.5 cm/格)。将鱼随机摆放至AEW冰和TW冰中进行贮藏,在室温(18±2)℃放置7 d,每12 h换冰一次。每2 d随机取样进行各项指标测定,共进行3 次平行实验,如图1所示。
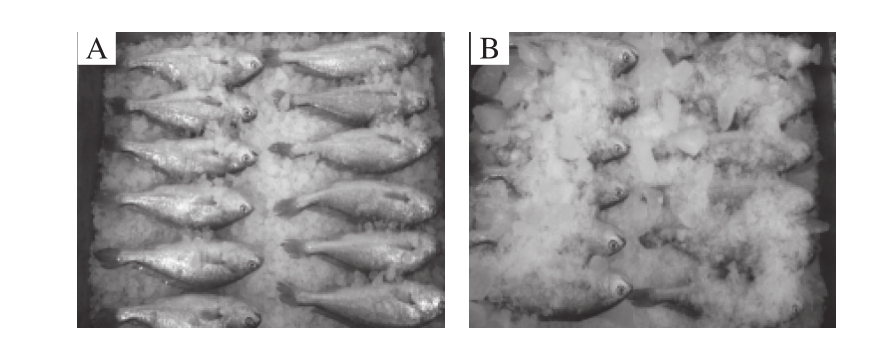
图1 在AEW冰(A)和TW冰(B)中冷藏的小黄鱼保鲜图Fig. 1 Photographs of fish stored in AEW ice (A) and TW ice (B)
1.3.3 小黄鱼贮藏过程中感官品质的变化
每次各随机抽选3条不同处理的小黄鱼,水平铺放在干净的白纸上,拍摄照片,观察其色泽、肉质等感官的变化。
1.3.4 小黄鱼贮藏过程中质构的测定
采用TA-XTPlus质构分析仪测定小黄鱼肉的质构。将小黄鱼水平搁置在桌上,用医用小刀对着小黄鱼鱼体脊背处进行切割,然后横向取得切片,厚度为1.5 cm。采用直径为6 mm 的P6探头,利用TPA模式,测试速率为1 mm/s,压缩程度为30%,0.049 N自动触发力。每种处理测定重复12 次。本研究选硬度、弹性和回复性等与鱼肉品质关系较大的质构结果进行研究。采用的质构参数定义为:硬度是第1次压缩时的最大峰值;弹性为2次压缩过程中,压缩到第2次峰值与压缩到第1次峰值的时间比值;回复性表示样品在第1次压缩过程中回弹的能力,为第1次压缩循环过程中最大峰值两侧的面积比[7]。
1.3.5 小黄鱼贮藏过程中肌肉pH值的测定
利用pH计测定小黄鱼在贮藏过程中pH值的变化情况。随机取10 g鱼样,加90 mL 0.85% 无菌生理盐水均质2 min,然后在室温(18 ± 2) ℃条件下静置30 min,测定pH值。每次测定3 个平行。
1.3.6 小黄鱼贮藏过程中肌肉酶活力测定
1.3.6.1 待测粗酶液的提取
待测粗酶液提取的方法参照Teixeira等[8]的研究方法。10 g鱼样与40 mL冷水(4 ℃)进行混合均质(2 min,8 000 r/m),均质液置于冰上30 min,静置期间振动2~3 次,然后进行离心(14 600×g,4 ℃,20 min),对离心获得的上清液进行过滤,滤液用于酶活力的测定。
1.3.6.2 酸性磷酸酶活力的测定
1 mL上述提取物与反应底物(0.9 mL、4 mmol/L对硝基苯基磷酸酯,pH 5.5。配制溶剂为0.1 mmol/L醋酸钠缓冲液和1 mmol/L乙二胺四乙酸)混合,于37 ℃放置15 min。用4 mL KOH(0.1 mol/L)溶液终止反应,于400 nm波长处测定可见光吸光度。酸性磷酸酶活力表示为每分钟每克肌肉吸光度(AU)的变化[8]。共进行3 次平行实验。
1.3.6.3 组织蛋白酶B活力的测定
根据Barrett等[9]的实验方法来进行组织蛋白酶B活力测定,按照0.1 mL提取物与反应底物(0.1 mL Z-精氨酸-精氨酸-7-酰氨基-4-甲基香豆素盐酸盐,pH 6.5。配制溶剂为100 mmol/L Bis-Tris,20 mmol/L 乙二胺四乙酸,4 mmol/L二硫苏糖醇)进行混合,置于37 ℃条件下5 min,反应通过添加十二烷基硫酸钠进行终止(1 mL,30 mg/mL含50 mmol/L Bis-Tris,pH 7.0)。释放出的7-氨基-4 -甲基香豆素在荧光下(λEx= 360 nm、λEm= 460 nm)进行测量。组织蛋白酶B的活力表示为每分钟每克肌肉荧光度值(FU)的变化[10-12]。共进行3 次平行实验。
1.3.6.4 组织蛋白酶D活力的测定
组织蛋白酶D活力测定实验过程是根据Anson[13]描述的实验方法,0.5 mL提取物与反应底物(1.5 mL,20 mg/mL变性血红蛋白,pH 3.7,配制溶剂为0.2 mol/L柠檬酸缓冲溶液)进行混合,37 ℃条件下培养3 h,添加1.5 mL三氯乙酸(0.1 g/mL)终止反应。剧烈摇荡,离心(18 000×g,15 min)除去沉淀物,可溶肽含量于280 nm波长处分光光度计测量。组织蛋白酶D的活力表示为每小时每克肌肉AU的变化[12-13]。共进行3 次平行实验。
1.3.6.5 脂肪酶活力的测定
脂肪酶活力的测定底物为榄油,测定方法为滴定法[14]。1 mL提取物与底物(1.5 mL橄榄油、1.25 mL去离子水和0.5 mL 200 mmol/L Tris-HCl 缓冲液,pH 7.7)进行混合,37 ℃条件下静置24 h,通过添加乙醇(2 mL,体积分数95%)终止反应。释放的脂肪酸量通过NaOH滴定获得,百里酚酞作为指示剂。酶活力表示为U/g,即一个单位指1 h水解脂肪酸甘油三酯为一个微当量脂肪酸所需酶的量。共进行3 次平行实验。
1.3.7 小黄鱼贮藏过程中微生物指标的测定
1.3.7.1 传统菌落计数
通过传统平板涂布方法获得小黄鱼中总菌落数。无菌操作条件下,取鱼肉(10±1) g加90 mL 0.85%生理盐水,均质2 min,然后将均质液进行10 倍梯度稀释,取0.1 mL稀释液涂布于TSA平板上,平板于37 ℃培养24 h后进行菌落计数。共进行3 次平行实验。
1.3.7.2 PCR-DGGE分析微生物多样性变化
参考Lin等[2]方法提取菌体,菌体于-80 ℃保存用于提取DNA。DNA提取按照天根细菌基因组DNA提取试剂盒说明书进行操作。选取细菌16S rDNA的V3可变区引物V3-2:5’-ATTACCGCGGCTGCTGG-3’和带GC夹板的V3-3:5’-GCCCGCCGCGCGCGGCGGGCGGGCGGGGG CA CGGGGGGCCTACGGGAGGCAGCAG-3’进行扩增[2]。采用20 μL PCR反应体系:ddH2O 8 μL,引物V3-2和V3-3各0.5 μL,Taq酶10 μL,模板DNA 1 μL。PCR扩增程序为:95 ℃预变性3 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸30 s,25 个循环;72 ℃延伸5 min。产物用1%琼脂糖凝胶电泳检测,并用凝胶成像系统拍照,用微量紫外分光光度计检测PCR产物的浓度。将200 bp PCR产物用DGGE分离,凝胶的配制采用8%聚丙烯酰胺凝胶,其中变性剂浓度梯度为40%~60%(100%的变性胶包含7 mol/L尿素和40%甲酰胺)。电泳缓冲液为1 × TAE,在60 ℃条件下60 V电压电泳16 h左右,电泳完毕后用染色液SYBR Green(1×TAE,1∶10000)染色,在紫外灯下用凝胶成像仪拍照。用Image Lab软件分析DGGE凝胶图,计算多样性采用Quantity One软件进行多样性分析。微生物多样性指数(Shannon index)计算表达式[15]如下所示:
式中:H’为多样性指数;Pi为第i条 带的光密度与该泳道所有条带光密度总和的比值;Pt为贮藏时间t的样品光密度与该泳道所有条带光密度总和的比值。
1.4 数据分析
数据结果均以 s表示,采用SPSS 19.0软件对获得的数据进行分析,并用Origin 8.0 软件作图。
s表示,采用SPSS 19.0软件对获得的数据进行分析,并用Origin 8.0 软件作图。

图2 AEW冰和TW冰贮藏7 d条件下小黄鱼感官品质的变化
Fig. 2 Sensory changes of fish treated with AEW ice and TW ice for 7 days
2.1 AEW冰对小黄鱼感官品质的影响理的小黄鱼弹性逐渐下降。除了第4天AEW冰处理的小黄鱼弹性高于TW冰处理外,AEW冰处理的小黄鱼弹性在第2、7天都要低于TW冰处理组,但两者没有显著性差异(P>0.05)。图3C结果显示,AEW冰和TW冰处理组的回复性在初始的2 d内都是上升的,这是由于鱼在冷冻条件下代谢减弱,肌肉组织更好地受到了保护。在贮藏第2天后,AEW冰和TW冰处理小黄鱼的回复性逐渐下降。在这期间AEW冰处理小黄鱼的回复性都要低于TW冰处理组(第7天除外),但两者并无显著性差异(P>0.05)。由此可知,与TW冰相比,AEW冰虽不能展现出延缓小黄鱼纤维组织变化较好的效果,它对小黄鱼质构的变化也没有不利影响。

图3 AEW冰和TW冰贮藏7 d条件下小黄鱼的质构变化
Fig. 3 Changes in texture of fish treated with AEW ice and TW ice for 7 days
2.3 AEW冰处理后小黄鱼pH值的变化
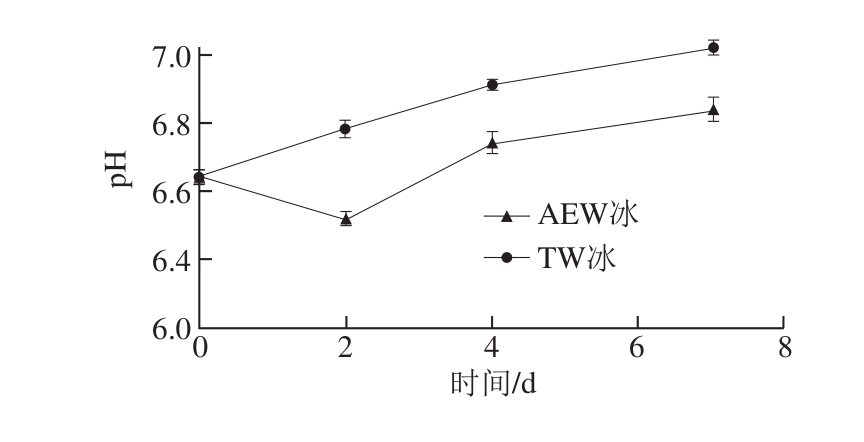
图4 AEW冰和TW冰贮藏7 d条件下小黄鱼pH值的变化
Fig. 4 Change in pH of fish treated with AEW ice and TW ice for 7 days
经AEW冰和TW冰冷藏处理后小黄鱼的感官品质保鲜结果如图2所示。随着贮藏时间的延长,不论是AEW冰和TW冰贮藏的小黄鱼其色泽品质都有所下降,特别是第4天小黄鱼的色泽明显变得灰暗,到第7天时表皮色泽变得更灰暗,鱼肉开始丧失新鲜气味,说明鱼体已经进入了腐败阶段。相较于TW冰,AEW冰保鲜2 d的小黄鱼其色泽品质没有明显差别,4 d后的其色泽要稍亮一些,而7 d后要稍暗一点,但整体来说没有明显差异,表明AEW冰对小黄鱼的感官品质保鲜效果与TW冰的相当。赵爱静等[16]探究了AEW冰对南美白对虾感官品质的影响时,获得了与本研究相似的结果。
2.2 AEW冰对小黄鱼质构的影响
由图3可以发现,随着贮藏时间的延长,小黄鱼的硬度、弹性和回复性在贮藏第2天后都逐渐降低,表明鱼肉逐渐失去新鲜的质构特征,逐渐变软。类似的研究在周然等[3]用AEW对冷藏河豚鱼肉质构变化的影响也有报道。鱼肌肉的质构特征主要与鱼体的肌原纤维、脂肪和胶原蛋白含量有关。鱼死亡后,由于自溶和微生物分解导致的肌原纤维蛋白的变化,是肌肉变软和失去弹性的重要原因。
图3A结果显示,随着贮藏时间的延长,小黄鱼肉的硬度在逐渐降低,除了第2天AEW冰处理的小黄鱼硬度高于TW冰处理外,AEW冰处理的小黄鱼硬度在第4、7天都要低于TW冰处理组,但两者没有显著性差异(P>0.05)。图3B结果显示,在初始的2 d内AEW冰和TW冰处理组的弹性均上升。在贮藏第2天后,AEW冰处
图4显示了AEW冰和TW冰贮藏条件下小黄鱼的pH值变化情况。AEW冰处理组pH值的变化范围为6.63~6.81,TW冰处理组为6.63~7.01。所有处理组的小黄鱼pH值总体上均呈现出了逐渐上升的趋势。小黄鱼贮藏过程中pH值上升主要是由于鱼肉组织内的蛋白质分解为基本的碱性含氮小分子物质(如氨类化合物、三甲胺等),而这些物质主要由水产品(鱼、虾等)中碱化微生物的作用而产生的[17-18]。在贮藏期间,AEW冰处理组小黄鱼pH值要显著低于TW冰对照组(P<0.05)。谢军等[19]研究表明冬季南美白对虾贮藏过程中,pH值在总体上呈逐渐上升趋势。因此本研究表明AEW冰能够抑制小黄鱼中碱性化合物的产生,这种现象的原因可以归结为AEW冰具有较强的杀菌作用。
2.4 AEW冰对小黄鱼酶活力的影响
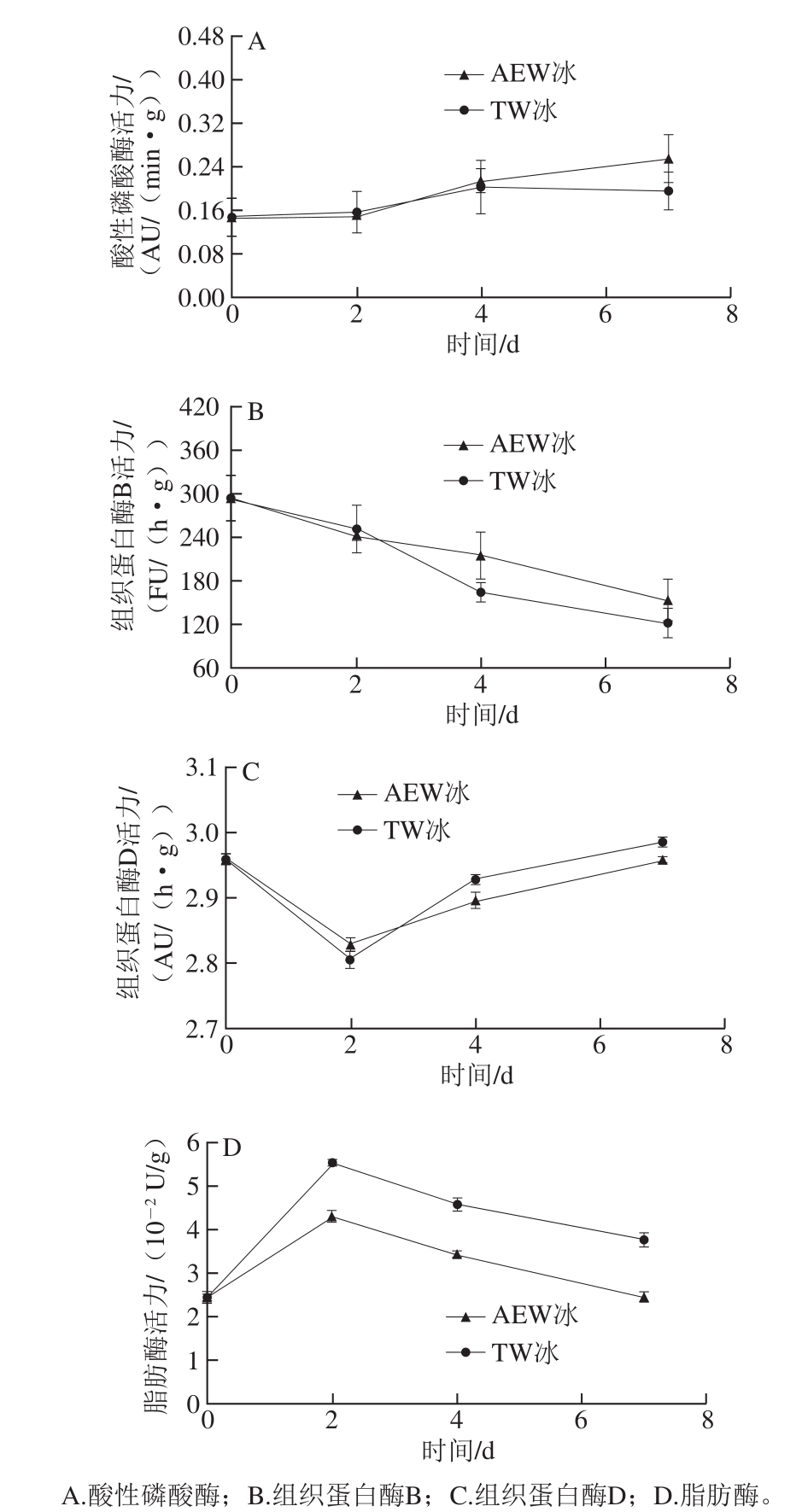
图5 AEW冰和TW冰贮藏7 d条件下小黄鱼的酶活力变化
Fig. 5 Changes in enzyme activities of fish treated with AEW ice and TW ice for 7 days
磷酸酶在脱磷酸化作用方面起着重要的作用,尤其在ATP-、ADP-及IMP-脱磷酸化过程中,同时在肌肉组织中的磷酸酶活力与肉制品的新鲜度指标密切相关[20]。图5A结果显示了经AEW冰和TW冰处理后小黄鱼中的酸性磷酸酶的活力变化情况。用AEW冰和TW冰贮藏的小黄鱼酸性磷酸酶活力具有相同的变化趋势。0 d小黄鱼酸性磷酸酶活力为0.15 AU/(min·g),随后在AEW冰和TW冰贮藏的第4天出现了显著性上升(P<0.05),分别达到了0.21、0.20 AU/(min·g)。在贮藏第4~7天,AEW冰处理的小黄鱼酸性磷酸酶活力一直比TW冰处理组高,但几乎都保持在一个定值不变,这与Ohmori等[21]运用超高压探究其对牛肝脏中酸性磷酸酶活力影响效果的研究是相似的。在相同贮藏时间内AEW冰和TW冰贮藏并没有引起酸性磷酸酶活力变化的显著性差异(P>0.05),这表明AEW冰在抑制酸性磷酸酶活力方面没有展现出较好的抑制效果。
组织蛋白酶B是一类能够软化肌肉组织的活性酶类,这种活性酶经常存在于溶酶体中,并且当溶酶体破裂时其能够被释放到细胞质中,以上这种情况往往发生在动物死后贮存过程中[18]。其中,组织蛋白酶B是一种半胱氨酸蛋白酶,主要被广泛地在脊椎动物(人、老鼠等)中研究,在无脊椎动物(虾、线虫类等)中的研究报道较少。图5B结果显示了经AEW冰和TW冰处理后小黄鱼中组织蛋白酶B的活力变化情况。在小黄鱼贮藏时间内,经AEW冰与TW冰处理小黄鱼的组织蛋白酶B活力都在逐渐下降。且在贮藏的第4~7天内,TW冰处理的小黄鱼组织蛋白酶B的活力都要比AEW冰处理的小黄鱼组织蛋白酶B的活力略低,且两者无显著差异(P>0.05)。
组织蛋白酶D是一种天冬氨酸蛋白酶,存在于溶酶体系统中,其被认为是在肌肉死后蛋白降解过程中,起着重要作用的蛋白降解酶类之一[22]。图5C结果显示,经AEW冰和TW冰处理的小黄鱼中组织蛋白酶D的活力变化情况。AEW冰和TW冰处理组小黄鱼的组织蛋白酶D活力在贮藏第2天后都逐渐升高,但AEW冰处理组组织蛋白酶D的活力显著低于TW冰处理组(P<0.05)。这说明AEW冰对组织蛋白酶D活力的抑制具有更好的效果。
脂肪酶是三酰甘油乙酰水解酶,其能够降解磷脂,催化三酰甘油中的脂肪酸酯键水解,从而将其水解为游离脂肪酸和甘油。游离脂肪酸的积累与食品品质的腐败变质有着密切的关系,主要表现在激发蛋白降解引起的相关组织的变性,脂肪氧化产生的食品风味的变化等[23]。图5D结果显示了经AEW冰和TW冰处理后小黄鱼中脂肪酶的活力变化情况。AEW冰和TW冰处理组小黄鱼的脂肪酶活力在初始的2 d内都是上升的,小黄鱼空白样品中(第0天)脂肪酶活力为2.45×10-2U/g,当贮藏时间达到第2天时分别上升了1.76×10-2(AEW冰)、
04×10-2U/g(TW冰)。在贮藏第2~7天过程中,AEW冰与TW冰处理的小黄鱼中脂肪酶活力逐渐降低,且AEW冰处理组脂肪酶的活力极显著地低于TW冰处理组(P<0.01),这表明AEW冰对脂肪酶活力的抑制具有更好的效果。总的来说,AEW冰贮藏能够在一定时间范围内显著抑制了小黄鱼中组织蛋白酶D、脂肪酶活力(P<0.05),从而延长了小黄鱼贮藏过程中的货架期。2.5 AEW冰对小黄鱼菌落总数的影响
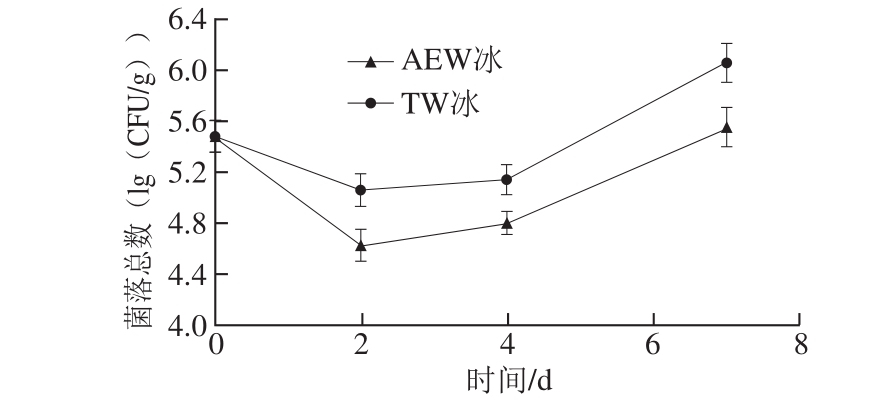
图6 AEW冰和TW冰贮藏7 d条件下小黄鱼的菌落总数变化
Fig. 6 Change in total viable counts of bacteria in fish treated with AEW ice and TW ice for 7 days
对于水产品来说,细菌总数是评价品质和货架期的一个非常有效的参数[3]。图6显示了小黄鱼在AEW冰和TW冰贮藏过程中小黄鱼中菌落总数的变化情况。贮藏的第0天时,小黄鱼的微生物总量为5.32(lg(CFU/g)),在第2天时AEW冰和TW冰处理的小黄鱼中菌落总数分别降低了0.72(lg(CFU/g))和0.30 (lg(CFU/g)),AEW冰显著抑制了小黄鱼中微生物的生长(P<0.05)。从贮藏第2天开始,在后续的整个贮藏过程中菌落总数虽呈现逐渐上升的趋势,但AEW冰处理组菌落总数均显著低于TW冰对照组(P<0.05)。这说明AEW冰对小黄鱼菌落变化有明显的抑制作用,可能因为AEW冰中的含次氯酸(HOCl)可以产生羟基(—OH)和氯基团(—Cl),这些分子可以抑制细胞质酶,并损坏细菌的外层细胞膜[24]。同时,AEW冰具有正的氧化还原电位,可以吸收细菌细胞膜中的电子,导致细胞膜的不稳定,进而使得抗菌物质更容易进入细菌内部而影响细菌的代谢,从而导致细菌死亡[25]。在本研究中,AEW冰处理延缓了小黄鱼中的菌落总数的升高,进而更好地保持了贮藏过程中小黄鱼的品质。
2.6 AEW冰对小黄鱼微生物菌落多样性的影响
AEW冰对小黄鱼贮藏保鲜过程中微生物菌群多样性的影响如图7和表2所示。由图7可知,随着贮藏时间的延长,AEW冰处理组微生物菌群DGGE条带数量整体上要少于TW冰处理组,直观地表明AEW冰能够减少小黄鱼中微生物群落的多样性,与图6所得结论相符。表2中,通过DGGE条带计算获得的微生物菌落多样性指数H’从客观的角度进一步证明上述结论。对于AEW冰处理组,小黄鱼中微生物多样性指数(H’)随着贮藏时间的延长总体上呈现降低的趋势,且最大差值可达到0.34(空白与第7天的差值)。在TW冰贮藏过程中,小黄鱼中微生物群落多样性并没有呈现出明显的变化趋势,且其多样性指数(H’)均在2.30以上,且最大差值为0.10(空白与第7 d差值),低于AEW冰处理组。统计分析结果显示,与TW冰相比,AEW冰(第4天和第7天)可显著减少微生物多样性(P<0.05)。研究表明[6,26-29]随着AEW冰融化后释放出Cl2含量的增加及融化后产生的AEW依然能够显著地(P<0.05)降低微生物的数量。基于以上分析,小黄鱼贮藏过程中微生物数量的减少主要归纳为,AEW冰释放出的Cl2含量以及融化获得的AEW对微生物的共同作用。综上所述,AEW冰显著抑制了小黄鱼贮藏过程中微生物的菌落多样性,进而有效抑制了鱼肉的腐败,延长其货架期。

图7 AEW冰和TW冰贮藏条件下小黄鱼中微生物菌落PCR-DGGE图谱
Fig. 7 PCR-DGGE fingerprints of microbial communities of fish under AEW ice and TW ice treatment
表2 AEW冰和TW冰贮藏7 d条件下小黄鱼中微生物菌落的多样性指数
Table 2 Shannon index of bacterial diversity in fish treated with AEW ice and TW ice for 7 days

注:*.同列数据存在显著性差异(P<0.05)。
本实验以小黄鱼为研究对象,通过比较传统TW冰与AEW冰处理,研究其贮藏过程中其物理、化学及微生物指标的变化情况。结果表明,在7 d的贮藏中,AEW冰对小黄鱼的感官品质及质构变化不会产生不利影响(P>0.05);AEW冰显著降低了小黄鱼pH值的变化(P<0.05);经AEW冰处理的小黄鱼中的脂肪酶、组织蛋白酶D的活力显著低于TW冰对照组(P<0.05),更有利于小黄鱼的贮藏保鲜;AEW冰有效减少了小黄鱼冰藏过程中微生物总数及菌落的多样性,利于新鲜度的保持及食用的安全性。因此,AEW冰对鱼类产品的保鲜效果更佳,今后可考虑替代TW冰应用于小黄鱼的贮藏保鲜。
参考文献:
[1] FELICIANO L, LEE J, LOPES J A, et al. Efficacy of sanitized ice in reducing bacterial load on fish fillet and in the water collected from the melted ice[J]. Journal of Food Science, 2010, 75(4): M231-M238. DOI:10.1111/j.1750-3841.2010.01583.
[2] LIN T, WANG J J, LI J B, et al. Use of acidic electrolyzed water ice for preserving the quality of shrimp[J]. Journal of Agricultural and Food Chemistry, 2013, 61(36): 8695-8702. DOI:10.1016/ j.foodcont.2013.07.005.
[3] 周然, 刘源, 谢晶, 等. 电解水对冷藏河豚鱼肉质构及品质变化的影响[J]. 农业工程学报, 2011, 27(10): 365-369. DOI:10.3969/ j.issn.1002-6819.2011.10.064.
[4] WANG Meng, WANG J J, SUN X H, et al. Preliminary mechanism of acidic electrolyzed water ice on improving the quality and safety of shrimp[J]. Food Chemistry, 2015, 176: 333-341. DOI:10.1016/ j.foodchem.2014.12.089.
[5] PHUVASATE S, SU Y C. Effects of electrolyzed oxidizing water and ice treatments on reducing histamine-producing bacteria on fish skin and food contact surface[J]. Food Control, 2010, 21(3): 286-291. DOI:10.1016/j.foodcont.2009.06.007.
[6] KOSEKI S, ISOBE S, ITOH K. Efficacy of acidic electrolyzed water ice for pathogen control on lettuce[J]. Journal of Food Protection, 2004, 67(11): 2544-2549. DOI:10.6791/j.foodchem.2004.08.025.
[7] 潘秀娟, 屠康. 质构仪质地多面分析(TPA)方法对苹果采后质地变化的检测[J]. 农业工程学报, 2005, 21(3): 166-170. DOI:10.3321/ j.issn:1002-6819.2005.03.038.
[8] TEIXEIRA B, FIDALGO L, MENDES R, et al. Changes of enzymes activity and protein profiles caused by high-pressure processing in sea bass (Dicentrarchus labrax) fillets[J]. Journal of Agricultural and Food Chemistry, 2013, 61: 2851-2860. DOI:10.1016/j.ifset.2013.07.002.
[9] BARRETT A J, KIRSCHKE H, CATHEPSIN B, et al. In methods in enzymology[M]//LORAND L. Proteolytic enzymes. New York: Academic Press, 1981: 535-561. DOI:10.21341/dcss.186964-12613.1981.081231.
[10] STEPHENS A, ROJO L, ARAUJO-BERNAL S, et al. Cathepsin B from the white shrimp Litopenaeus vannamei: cDNA sequence analysis, tissues-specific expression and biological activity[J]. Comparative Biochemistry and Physiology, Part B, 2012, 161: 32-40. DOI:10.1875/j.foodcont.2012.09.004.
[11] AHMED Z, DONKOR O, STREET W A, et al. Proteolytic activities in fillets of selected underutilized Australian fish species[J]. Food Chemistry, 2013, 140: 238-244. DOI:10.1016/ j.foodchem.2013.02.042.
[12] BUCKOW R, TRUONG B Q, VERSTEEG C. Bovine cathepsin D activity under high pressure[J]. Food Chemistry, 2010, 120: 474-481. DOI:10.1016/j.foodchem.2009.10.040.
[13] ANSON M L. The estimation of pepsin, trypsin, papain, and cathepsin with hemoglobin[J]. Journal of General Physiology, 1938, 22: 78-89. DOI:10.5387/j.foodchem.2006.03.013.
[14] Enzymatic assay of lipase (EC 3.1.1.3) (olive oilas substrate) [EB/OL]. (2016-04-26) http://www.sigmaaldrich. DOI:10.7641/ j.foodchem.2009.08.032.
[15] 刘晓飞, 王志中, 王勇, 等. 早期类风湿关节炎患者肠道微生物群落的分析[J]. 第三军医大学学报, 2012, 34(23): 2411-2415. DOI:10.8428/j.khlf.5480-5292.2012.975327.
[16] 赵爱静, 王萌, 赵飞, 等. 酸性电解水冰,对南美白对虾杀菌保鲜效果的研究[J]. 现代食品科技, 2016, 32(3): 67-78. DOI:10.9842/ j.tyna.7628-9852.2016.097637.
[17] KIM W T, LIM Y S, SHIN I S, et al. Use of electrolyzed water ice for preserving freshness of pacific saury (Cololabis saira)[J]. Journal of Food Protection, 2006, 69: 2199-2204. DOI:10.8752/ j.foodchem.2006.09.006.
[18] CAMPOS C A, LOSADA V, RODRÍGUEZ Ó, et al. Evaluation of an ozone-slurry ice combined refrigeration system for the storage of farmed turbot (Psetta maxima)[J]. Food Chemistry, 2006, 97: 223-230. DOI:10.2552/j.foodcont.2006.11.039.
[19] 谢军, 孙晓红, 潘迎捷, 等. 电解水和有机酸对虾的杀菌效果及感官品质影响[J]. 食品与发酵工业, 2010, 36(5): 57-63. DOI:10.3576/ j.piok.6713-9092.2010.103237.
[20] LOPEZ-AMAYA C, MARANGONI A G. Lipases in seafood enzymes[M]// HAARD N F, SIMPSON B K. Utilization and influence on postharvest seafood quality. Switzerland: Marcel Dekker Inc Basel, 2000: 121-146. DOI:10.6513/j.foodchem.2000.08.025.
[21] OHMORI T, SHIGEHISA T, TAGI S, et al. Biochemicaleffects of high hydrostatic pressure on the lysosome and proteasesinvolved in it[J]. Bioscience Biotechnology & Biochemistry, 1992, 56: 1285-1288. DOI:10.2986/j.foodchem.1992.06.027.
[22] CHÉRET R, DELBARRE-LADRAT C, LAMBALLERIE-ANTON M D, et al. High-pressure effects on the proteolytic enzymes of sea bass (Dicentrarchus labrax L.) fillets[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 3969-3973. DOI:10.6098/ j.foodchem.2005.07.128.
[23] HASAN F, SHAH A A, HAMEED A. Methods for detection and characterization of lipases: a comprehensive review[J]. Biotechnology Advances, 2009, 27: 782-798. DOI:10.1016/j.biotechadv.2009.06.001. [24] MBARKI R, SADOK S, BARKALLAH I. Quality changes of the Mediterranean horse mackerel (Trachurus mediterraneus) during chilled storage: the effect of low-dose gamma irradiation[J]. Radiation Physics and Chemistry, 2009, 78(4): 288-292. DOI:10.3568/ j.foodcont.2009.06.125.
[25] MAHMOUD B S M, YAMAZAKI K, MIYASHITA K, et al. Preservative effect of combined treatment with electrolyzed NaCl solutions and essential oil compounds on carp fillets during convectional air-drying[J]. International Journal of Food Microbiology, 2006, 106(3): 331-337. DOI:10.1169/j.ijfoodmicro.2005.09.010.
[26] HAN Y Q, XU X L, JIANG Y, et al. Inactivation of food spoilage bacteria by high pressure processing: evaluation with conventional media and PCR-DGGE analysis[J]. Food Research International, 2010, 43: 1719-1724. DOI:10.1016/j.foodchem.2006.08.011.
[27] LIU C C, DUAN J Y, SU Y C. Effects of electrolyzed oxidizing water on reducing Listeria monocytogenes contamination on seafood processing surfaces[J]. International Journal of Food Microbiology, 2006, 106: 248-253. DOI:10.3218/j.food microbiology.2002.03.016.
[28] XIE J, SUN X H, PAN Y J, et al. Combining basic electrolyzed water pretreatment and mild heat greatly enhanced the efficacy of acidic electrolyzed water against Vibrio parahaemolyticus on shrimp[J]. Food Control, 2012, 23: 320-324. DOI:10.2198/j.food control.2009.09.006. [29] ZHOU R, LI Y, YAN L, et al. Effect of edible coatings on enzymes, cellmembrane integrity, and cell-wall constituents in relation to brittleness and firmness of Huanghua pears (Pyrus pyrifolia Nakai, cv. Huanghua) during storage[J]. Food Chemistry, 2011, 124: 569-575. DOI:10.1128/j.food chem.2003.05.003.
Effect of Acidic Electrolyzed Water Ice on Quality and Enzyme Activities in Muscular Tissue of Small Yellow Croaker (Larimichthys polyactis)
YAO Xin1, ZHAO Aijing1, DU Suping1, SUN Xiaohong1,2,3, PAN Yingjie1,2,3, ZHAO Yong1,2,3,*
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China; 3. Laboratory of Quality & Safety Risk Assessment for Aquatic Product on Storage and Preservation (Shanghai), Ministry of Agriculture, Shanghai 201306, China)
Abstract:Acidic electrolyzed water (AEW) ice has been developed in recent years as a new food preservation technology. To investigate the effect of electrolyzed water ice on preserving the quality of small yellow croaker, changes in enzyme activities and total viable bacterial counts were assayed periodically during seven days of storage. The results showed that compared with traditional tap water (TW) ice, AEW ice displayed inhibitory activity (P < 0.05) toward cathepsin D and lipase, although it did not present positive effects on inhibiting acid phosphatase and cathepsin B. Conventional plate count enumeration and polymerase chain reaction-denatured gradient gel electrophoresis (PCR-DGGE) indicated that AEW ice had the capability of inhibiting the growth of bacteria on raw fish, and the maximum reduction in bacterial population reached 0.34 (lg(CFU/g)) on the 7thday. Therefore, AEW ice has a broad application prospect and can be more useful than TW ice for preserving seafood.
Key words:acidic electrolyzed water (AEW) ice; small yellow croaker; enzyme activity; polymerase chain reactiondenatured gradient gel electrophoresis (PCR-DGGE)
DOI:10.7506/spkx1002-6630-201713040
中图分类号:TS254.4
文献标志码:A
文章编号:1002-6630(2017)13-0244-07
引文格式:
姚鑫, 赵爱静, 杜苏萍, 等. 酸性电解水冰对小黄鱼品质及肌肉组织中酶活力变化的影响[J]. 食品科学, 2017, 38(13): 244-250. DOI:10.7506/spkx1002-6630-201713040. http://www.spkx.net.cn
YAO Xin, ZHAO Aijing, DU Suping, et al. Effect of acidic electrolyzed water ice on quality and enzyme activities in muscular tissue of small yellow croaker (Larimichthys polyactis)[J]. Food Science, 2017, 38(13): 244-250. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713040. http://www.spkx.net.cn
收稿日期:2016-05-11
基金项目:国家自然科学基金面上项目(31271870);上海市科委科研计划项目(14DZ1205100;14320502100);上海市科技兴农重点攻关项目(沪农科攻字2014第3-5号、2015第4-8号);上海水产品加工及贮藏工程技术研究中心项目(11DZ2280300)
作者简介:姚鑫(1990—),男,硕士研究生,研究方向为水产品贮运保鲜与安全风险评估。E-mail:526772041@qq.com
*通信作者:赵勇(1975—),男,教授,博士,研究方向为食品安全风险评估。E-mail:yzhao@shou.edu.cn