图1 茶叶功能成分(如EGCG、茶黄素)对蛋白质聚集作用模式图
Fig. 1 Working models showing the effects of functional components such as EGCG and theaflavins in tea on protein aggregation
张 静,黄建安,刘仲华*
(湖南农业大学 茶学教育部重点实验室,国家植物功能成分利用工程技术研究中心,植物功能成分利用协同创新中心,湖南 长沙 410128)
摘 要:蛋白质错误折叠是引起阿尔茨海默病、帕金森、亨廷顿舞蹈症及2型糖尿病等疾病的发生机制,导致蛋白质聚集产生具有毒性的蛋白质寡聚体及淀粉样变性。本文依据近年来国内外体内、体外实验研究结果,就茶叶中儿茶素、茶黄素等功能成分抑制蛋白质聚集的作用方式及机理,以及对几种典型的蛋白质错误折叠疾病具有的防治作用进行综述。
关键词:茶叶;儿茶素;茶黄素;蛋白质;聚集;错误折叠
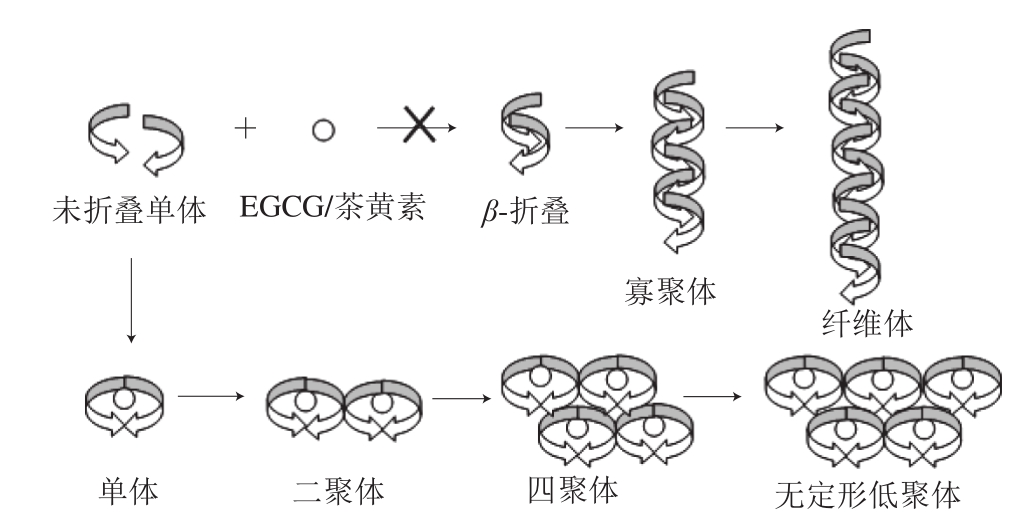
蛋白质是构成生物体的基础物质之一,正常情况下,蛋白质正确折叠是体内蛋白正常代谢及其行使正常生物学功能的基础,其本质是DNA-RNA-多肽链-功能蛋白的生命信息流动,当蛋白质结构发生错误折叠后聚集,则代谢发生紊乱[1]。然而,人体内超过27%蛋白可能发生错误折叠,其概率相对较高。蛋白质错误折叠一般发生在DNA复制、翻译及翻译后等环节,当DNA复制受到内源性或外源性因素引起损伤;翻译过程中氨基酸导入错误;翻译后,分子伴侣无法帮助不能自发折叠的蛋白质进行正确组装或蛋白酶系统无法清除错误折叠蛋白时,蛋白质将发生错误折叠。同时,在非正常、 非稳定条件下,蛋白质先由单体形成低聚体,再缓慢变为纤维核,原纤加速聚集形成大分子的成熟纤维,从而导致淀粉样变性[2]。在此聚集过程中,形成的具有毒性的寡聚体和自行组装的、有序的淀粉样纤维富含极其稳定的β-折叠结构,同一蛋白和不同蛋白β-折叠片之间通过肽键的氨基和羧基形成氢键,从而以这种方式发生交联产生不溶性纤维化聚集体,导致蛋白质以非天然构象存在(图1)。

图1 茶叶功能成分(如EGCG、茶黄素)对蛋白质聚集作用模式图
Fig. 1 Working models showing the effects of functional components such as EGCG and theaflavins in tea on protein aggregation
近年来,研究发现一些疾病伴随着蛋白质错误折叠,同时产生包含β-折叠结构的不溶性淀粉样纤维,并将这类疾病命名为蛋白质错误折叠疾病(protein misfolding diseases,PMDs)[3]。目前,已发现超过20 种淀粉样蛋白可导致PMDs的发生与发展[4],如β-淀粉样蛋白(amyloid β-protein,Aβ)聚集和Tau蛋白磷酸化诱发的阿尔茨海默病(Alzheimer’s disease,AD)、α-突触核蛋白(alpha-synuclein,α-syn)聚集诱发的帕金森症(Parkinson’s disease,PD)、胰岛淀粉样多肽(islet amyloid polypeptide,IAPP)聚集诱发的2型糖尿病(typeⅡ diabetes mellitus,T2DM)、累积的突变蛋白形成不可溶的亨廷顿蛋白(Huntingtin,Htt)聚集体诱发的多聚谷氨酰胺疾病如亨廷顿舞蹈病(Huntington’s disease,HD),甲状腺结合前清蛋白(transthyretin,TTR)聚集诱发的家族性淀粉样多发性神经病(familial amyloidotic polyneuropathy,FAP)、具有传染性朊蛋白导致海绵状脑病(transmissible spongiform eneephalopathy,TSE)、血红蛋白聚集诱发镰刀性贫血症等[5]。如今,PMDs患者的人数日益剧增,预期至2030年全世界患AD的人数达6 570万;患T2DM的人数将达到3.6亿;在欧洲地区超过65 岁的人群中存在1.8%老年人患有PD[6-8];为了缓解此类疾病对人类健康造成的巨大危险,因此,蛋白质错误折叠及聚集机理研究已成为当前研究的热点。蛋白质聚集及错误折叠产生细胞毒性的致病机理主要包括氧化应激、内质网应激、脂质膜通透性增加及线粒体功能障碍等,大多数PMDs与淀粉样蛋白产生活性氧(reactive oxygen species,ROS)导致的氧化应激密切相关[9],现主要通过以上几种致病机理研发防治PMDs的方法和药物。抑制蛋白质聚集的主要方法有物理、化学和生物等方法;现阶段主要处于小分子抑制剂的体外研究阶段,小分子抑制剂的结构特性决定其抑制蛋白质聚集或解聚功能,芳香环上携带3 个以上羟基被认为是能够有效结合淀粉样蛋白从而抑制淀粉样纤维化的关键结构[10-11],也有专家认为含有C6-连-C6结构的成分将可能成为极具潜力的蛋白质聚集抑制剂[12]。因此,探索和开发抑制蛋白质聚集或逆转蛋白质构象异常变化的天然产物作为防治PMDs的药物已成为人们的关注焦点。
近年来,主要研究的小分子抑制剂为多酚类化合物[10,13-15]。茶多酚类化合物是茶叶主体功能成分,其中儿茶素成分可达到绿茶干质量的30%[16],儿茶素中以表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)、表儿茶素没食子酸酯((-)-epicatechin-gallate,ECG)、表没食子儿茶素((-)-epigallocatechin,EGC)、表儿茶素((-)-epicatechin,EC)为主;而红茶中茶黄素类是由儿茶素经多酚氧化酶催化后形成的有色氧化产物。茶多酚类化合物因分子结构具有抑制淀粉样蛋白聚集优势基团和结构,同时具有良好的生物兼容性和抗氧化、抗淀粉样纤维等生理学功能活性[17],因此,许多专家通过体内外实验研究了茶叶功能成分在不引起毒副作用的前提下,对以下几种典型的淀粉样蛋白聚集产生抑制作用,以探讨茶叶功能成分成为防治PMDs潜在药物的可能性。
AD是最常见的老年痴呆病,早在20世纪已被归为神经退行性疾病,AD主要由Aβ聚集及沉积形成老年斑(senile plaques,SP)和Tau蛋白过度磷酸化形成神经纤维缠结(neurofibrillary tangle,NFT)两种致病途径引起。Aβ是引发AD的主要淀粉样蛋白之一,属于含有36~43 个氨基酸残基的无结构的内源性蛋白,Aβ由淀粉样前体蛋白(amyloid precursor protein,APP)先后经β-分泌酶和γ-分泌酶水解产生,然而绝大多数APP在α-分泌酶作用下通过非淀粉源途径代谢释放具有神经保护作用的可溶性α片段sAPPa,从而有效阻止Aβ生成。一般常见的是含有40或42 个氨基酸残基的Aβ1-40和Aβ1-42,两者共同参与了脑内淀粉斑块与寡聚体的形成[10],Aβ寡聚体比纤维体具有更强的神经毒性[18-20],寡聚体可能引起小鼠体内突触损伤[21-22],可溶性Aβ寡聚体可通过扰乱谷氨酸能和γ-氨基丁酸能系统平衡,从而损害海马突触传递的长期增益效应[23]。目前Aβ1-42寡聚体被认为是最直接的神经毒性因子,Aβ1-42寡聚体浓度低至5 μmol/L即可对细胞产生损伤作用[24];而Aβ1-40为脑内和脑脊液中的正常可溶性产物,但其为血液中Aβ的主要形式,为脑血管壁Aβ沉积的主要成分[25],对脑血管亦有一定损伤作用。引发AD的另一种主要淀粉样蛋白即Tau蛋白,它由位于17q21染色体上的微管相关蛋白Tau (microtubule-associated protein Tau,MAPT)基因编码,包含16 个外显子及6 种亚型,促进微管蛋白聚合并保持微管稳定,具有轴突运输以及细胞骨架、信号转导等作用。然而,Tau蛋白过磷酸化作用将抑制微管的组装,降低微管稳定性,从而导致神经元退行性变。一般情况下,磷酸化Tau蛋白在AD患者脑中高出正常人3~4 倍[26]。
体外实验表明,EGCG不仅能直接结合天然无折叠的淀粉样多肽,有效抑制Aβ聚集过程中原纤维以及中间体的产生,从而抑制Aβ致神经毒性[27-28],同时,EGCG还能结合到富含β-折叠结构的成熟Aβ纤维上,通过改变其构象使之转变为分子质量较小的、无定形的、对细胞无毒性的蛋白质聚集物[28],从而表明EGCG可通过调控Aβ聚集对AD具有一定保护作用。有研究通过建立Aβ25-35或Aβ1-42诱导小鼠海马细胞产生细胞毒性的AD模型[29],比较了绿茶和红茶提取物(5~25 µg/mL)对神经细胞的保护作用,同时还比较了EGCG、ECG、EGC、EC(1~20 µmol/L)4 种主要单体成分抑制细胞产生毒性的效果。Aβ不仅能诱导细胞毒性,Aβ42寡聚体还能进入神经元细胞膜并形成钙离子通道或小孔导致脂质膜损伤及细胞凋亡[30-31],然而EGCG及红茶提取物能有效抑制Aβ寡聚体导致的细胞膜通透性增加、线粒体膜损伤及细胞色素C释放增加等[32-33]。Fernandez等[34]研究表明,转染了人SweAPP基因的小鼠神经母细胞瘤细胞(neuro-2a cells,N2a)和来自于SweAPP基因过表达小鼠的原代神经元细胞经EGCG处理后,可显著降低Aβ水平;同时,对SweAPP转基因小鼠(Tg2576)进行腹腔注射或口服EGCG,均能使Aβ生成量及淀粉样斑块减少。此外,还有研究表明EGCG能调控小鼠脑内APP从而缓解脑内淀粉样变性,其作用机制可能是提高了α-分泌酶的切割活性,并增加了sAPP的产生,而β-、γ-分泌酶活性并无显著改变[2]。由此可知,EGCG可促使APP转为sAPP,从而减少Aβ生成量[35-36]。
有研究证实EGCG具有强化蛋白激酶B(Akt)磷酸化,从而抑制GSD3β诱导Tau蛋白磷酸化[25,37],运用绿茶多酚及EGCG单体干预合成的Tau蛋白片段(His-K18DK280),研究发现毒性寡聚体生成量显著下降[38],也有研究者通过动物模型实验表明了EGCG能调控转基因AD小鼠体内Tau蛋白磷酸化以及Aβ聚集,从而抑制小鼠认知功能损伤[36]。总之,通过大量体内外实验研究表明,儿茶素能抑制Aβ聚集及Tau蛋白磷酸化从而减轻细胞毒性,并发挥神经保护作用。
PD是最常见神经退行性疾病之一,PD早期症状可能潜伏于21~40 岁之间的年轻人甚至在20 岁以下的青少年阶段,有报道声称呈常染色体显性遗传的早发性家族性PD与α-syn基因突变有关。PD主要病理变化为黑质致密部的多巴胺能神经元进行性死亡,致使纹状体内多巴胺不足,同时在剩余神经元中出现嗜酸性包涵体即路易小体,其主要成分为α-syn,在病理条件下,α-syn错误折叠导致纤维性聚集体的产生,从而引起锥体外系运动功能障碍。
体外实验研究表明,EGCG不仅能直接结合未折叠的α-syn从而抑制其转变为毒性寡聚体,同时还能将成熟的α-syn转变为毒性较小的无定形聚集体[32-33]。红茶中4 种主要茶黄素单体具有抑制α-syn纤维化及清除淀粉样沉积的作用[39]。通过研究14 种天然多酚类化合物以及红茶提取物对α-syn寡聚体形成的影响,有人提出了含有邻二酚羟基的芳香族化合物可能具备打破α-syn自行聚集状态的能力[40]。有研究运用α-syn的10 种表位特异性抗体检测区分α-syn单体和纤维体,以及检测多酚类与单体或二聚体稳定结合后蛋白质构象变化,结果表明小分子抑制剂如EGCG能结合淀粉样纤维化过程中产生的中间体,从而抑制纤维化形成[41]。Bae[42]和Hwang[43]等研究表明离子液体能促使淀粉样蛋白快速形成淀粉样纤维,进一步研究表明1-丁基-3-甲基咪唑六氟磷酸盐离子液体能促使α-syn快速形成聚集体,然而,经EGCG处理后能有效解聚聚集体[44]。研究人员运用预纤维化野生型α-syn及突变型α-syn(A30P 和A53T)诱导脂质囊泡及SH-SY5Y神经细胞线粒体膜渗透性改变以及细胞色素c释放,经红茶提取物及EGCG处理后均发生一定程度的改善[45]。上述研究为寻找α-syn结构中潜在的治疗靶标提供了理论依据。此外,有研究以6-羟基多巴胺诱导的人神经母细胞瘤SH-SY5Y 细胞系作为PD体外细胞模型,比较了6 种茶提取物如茶多酚、EGCG、茶黄素、L-茶氨酸、咖啡碱、茶色素对PD细胞模型的保护作用差异,综合评价了茶叶提取物防治PD的潜力,并比较出茶黄素、EGCG及茶多酚保护效果较为突出[46];以上茶叶功能成分还可通过调节蛋白激酶C(protein kinase C,PKC)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)等信号通路、调节细胞内Ca2+稳态、抑制氧化应激及细胞凋亡等方面防治PD[47]。
因发病机理不同可将糖尿病分为1型糖尿病和2型糖尿病,其中2型糖尿病占了糖尿病总人数的90%~95%左右,它被认为是世界上第五大死因[7,48]。T2DM的发病机制是由于胰岛素抵抗造成胰岛素靶细胞对胰岛素需求量增加,从而引起内分泌失调及胰岛β-细胞凋亡[49]。可能引起2型糖尿病的一个致病因素是胰岛淀粉样蛋白聚集,IAPP是含有37 个氨基酸残基的多肽类激素,它是由胰岛β-细胞在分泌胰岛素的同时分泌的可以在胰岛内发生淀粉样聚集的一种淀粉样蛋白,它可产生细胞毒性从而引起β-细胞凋亡[50-52]。
在研究2型糖尿病病理过程中,研究人员发现淀粉样蛋白与细胞膜的相互作用和蛋白诱发的β-细胞功能损伤密切相关[53],而EGCG具有抑制IAPP聚集以及IAPP聚集引起的细胞膜通透性变化[54-55]。体外实验研究表明儿茶素能通过干预松散的IAPP 22-27胰岛淀粉样多肽片段并稳定其天然形态,从而显著抑制纤维化早期阶段胰岛淀粉样蛋白形成纤维核,儿茶素在一定程度上可将成熟的胰岛淀粉样纤维逆转成松散单体结构,同时,儿茶素能抑制由IAPP诱导的细胞毒性,从而延缓2型糖尿病的发病[56-58]。小鼠体内研究表明EGCG和其他儿茶素及黄酮类化合物通过增加胰岛素活性以及抑制β-细胞损伤从而预防高血糖症[59]。另外,红茶对小鼠具有一定降血糖功能[60-61],绿茶中EGCG能缓解因果糖所致糖尿病小鼠体内的胰岛抵抗并升高葡萄糖运输容量[62],同时能抑制糖尿病患者肝脏葡萄糖生成[63]以及氧化应激损伤[64]。有研究者给予2型糖尿病小鼠剂量为300 mg/(kg·d)的绿茶提取物,连续30 d后发现绿茶提取物能使小鼠体内血浆葡萄糖和糖基化血红蛋白水平显著下降,同时升高胰岛素及血红蛋白水平,肝脏中有关糖代谢的几种关键酶的活性均能恢复至正常水平[65]。另有研究表明喝茶能有效防治2型糖尿病的发生与发展,经调查65~100 岁年龄段的非肥胖人群,每天饮用1~2 杯红茶或者绿茶的人群患有2型糖尿病的几率降低了88%[66];对日本231 名男性及213 名女性糖尿病患者进行5 年跟踪调查,发现每天喝绿茶不少于6 杯的人群与每周喝茶少于1 杯的参与者相比,患2型糖尿病的概率降低了1/3[67];“新加坡华人健康研究”项目从1999—2004年跟踪调查了36 908 名年龄在45~74 岁之间的参与者,报导了每天喝红茶不少于1 杯的参与者比每天不喝红茶的参与者患2型糖尿病的风险降低了14%[68];患有2型糖尿病的成人坚持每天饮用1.5 L乌龙茶,连续4 周后发现患者空腹血糖值显著下降[69]。对于通过饮茶可防治2型糖尿病的众多研究中,不同的研究结果其有效饮茶量也不相同,有学者通过统计前人研究结果并综合分析,总结出每天饮茶量不少于4 杯可降低患2型糖尿病的风险[70]。
HD是一种常染色体显性遗传的影响运动功能的慢性进行性舞蹈病。该病具有高度的区域选择性,其中一个主要病症为侵害基底节运动通路引发运动过度,即舞蹈样动作;另外,大脑运动皮层锥体细胞以及纹状体投射性γ-氨基丁酸能神经元过早死亡,导致患者认知情感功能障碍及精神异常[71],且晚期亨廷顿舞蹈症多见痴呆。导致该疾病的是位于人第4号染色体上的IT15基因发生突变,该基因第一外显子CAG三核苷酸异常重复扩张,拷贝数超过35 次则引起HD,该基因编码含3 144 个氨基酸、分子质量为350 kD的亨廷顿蛋白Htt,其氨基末端含一段多聚谷氨酰胺序列(PolyQ)[72]。
Ehrnhoefer等[73]通过体外实验比较了几种主要儿茶素成分对亨廷顿exon 1蛋白聚集抑制作用,通过斑点免疫印迹法以及原子力显微镜观察等检测,结果表明EGCG和ECG抑制Htt蛋白错误折叠以及寡聚体生成的效果较为显著,且干预作用产生于聚集过程的早期阶段,然而EGC、GC并无明显效果,因此得出EGCG在多酚与Htt蛋白相互作用中起着至关重要的作用;同时,这一结果首次表明绿茶多酚类化合物能调节Htt蛋白聚集化过程中早期阶段的蛋白质错误折叠。体内实验表明EGCG不仅能显著抑制HD酵母模型中Htt聚集及细胞毒性,还能促使HD转基因果蝇运动功能提升。Kumar等[74]用神经毒素3-硝基丙酸处理Wistar雄性大鼠构建HD动物模型,从而导致大鼠认知功能损伤及谷胱甘肽系统障碍,经EGCG(10、20、40 mg/(kg·d))处理后,大鼠记忆力显著提高,谷胱甘肽系统功能得到一定修复。
TTR是人体内重要的运输甲状腺素和VA的血浆转运蛋白之一,约95%产生于肝脏,在眼睛和脉络膜细胞中也有少量合成[75],主要分布于脑脊髓液和人体血浆之中。正常情况下,TTR在体内以四聚体形式存在,但TTR四聚体在非正常生理状态下无法维持稳定结构,从而聚集形成淀粉样纤维,最终引发FAP,现有100多种TTR突变体已被鉴定。
EGCG能结合TTR从而有效抑制其淀粉样纤维化,Miyata等[76]运用X射线晶体定向仪检测出EGCGV30M TTR复合物中EGCG具有3 个结合位点,首次发现其晶体结构与TTR四聚体不同的结合位点及作用方式;运用11 种TTR突变体与EGCG体外孵育得出EGCG具有抑制TTR四聚体纤维化的作用,且EGCG抑制效果与其剂量存在一定依赖关系;将20 µmol/L EGCG干预经TTR突变体转染的CHO-K1细胞36 h后,通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳和蛋白质免疫印迹法检测细胞内四聚体含量升高。Ferreira等[77]通过体外实验研究将2 mg/mL野生型TTR与0.36 mmol/L EGCG于37 ℃孵育1 h后进行电喷雾质谱检测,结果表明一个EGCG分子能与一个TTR四聚体相结合,并通过等温滴定量热法测定结合常数表明EGCG配体能与蛋白质强力结合;将EGCG与预纤维化的TTR L55P于37 ℃孵育4 d,运用透射电子显微镜以及动态光散射法分析,表明EGCG能有效抑制预纤维化的TTR形成无定形蛋白质聚集物;将EGCG干预经TTR L55P cDNA转染的小鼠许旺氏细胞(rat schwannoma,RN22),斑点免疫印迹法检测结果表明EGCG对TTR聚集抑制效果超过90%。小鼠体内实验以剂量为100 mg/(kg·d)的EGCG喂养TTR V30M转基因小鼠6 周后,通过等电聚焦电泳检测,结果表明EGCG处理能提高TTR四聚体稳定性并降低TTR纤维化沉积[78];生物素标记法检测发现,经EGCG处理后,小鼠肠胃及背根神经节中BiP、Fas和3-NT蛋白表达量及TTR沉积物降低。Ferreira等[79]进一步实验结果表明:等电聚焦电泳法检测结果表明茶叶中主要儿茶素及茶黄素等多酚类化合物能不同程度上结合并稳定TTR四聚体,从而影响TTR淀粉样纤维形成;通过动态光散射和透射电子显微镜表明这些黄酮类化合物不同程度抑制TTR低聚物形成;并通过RN22细胞毒性实验表明,茶叶中儿茶素及茶黄素等黄酮类化合物能有效抑制由TTR低聚物激活的Caspase-3通路和内质网应激,综合实验结果可知没食子酸酯在抑制蛋白质聚集中具有关键性作用。临床实验将每天饮用绿茶的14 名遗传性转甲状腺素蛋白淀粉样变心肌病患者作为研究对象,对患者进行长达一年的血液、超声波心动图、心脏磁共振成像等检测评估,结果表明全程参与本研究的患者左心室心肌衰弱得到一定缓解,二尖瓣环收缩期运动速度降低,总胆固醇及低密度脂蛋白明显降低,由此推测绿茶或绿茶提取物对由TTR基因突变所致淀粉样变心肌病具有一定防治作用[80]。
可传播性海绵状脑病是PMDs中具有传染性的神经退行性疾病,传播源是一种不含RNA和DNA的朊病毒蛋白,它在人和动物体内正常存在时被称为PrPC,其结构包含3 个α-螺旋及一段短的反平行β-折叠结构,当PrPCα-螺旋被β-折叠结构所取代而转变为不能被蛋白酶降解的具有传染性的朊蛋白时则被称为PrPsc,现对此类蛋白研究较多的是酵母朊蛋白Sup35。有报道称EGCG能消除预成型的Sup35朊病毒蛋白以及扰乱分子内和分子间朊病毒接触,同时,EGCG与DAPH-12两者共同作用时将增强对多种Sup35朊病毒菌株的消除作用[81]。
随着社会老龄化现象日趋严重,与衰老直接相关的神经退行性疾病的发病率也日益增高,近年来,在美国、澳大利亚、日本及欧洲地区AD、PD及TM2D等发病人数逐渐增加,这已成为显著的健康与社会发展问题,科研工作者为阐明在体外或组织中蛋白质聚集的分子机理,从简单的细胞实验到动物模型实验乃至人体临床实验进行了大量有关PMDs病理学研究。相对于化学合成药物诸多副作用以及昂贵价格,以天然产物化学成分为主体开发的药物凸显高效性、安全性及稳定性优势,天然成分所具备的生物兼容特性也使其更容易嵌入并结合至生命体系分子结构中,已经被生物学和医药学领域广泛认可和开发[82]。茶叶作为全球性健康型天然饮料,其功能成分的挖掘及保健药用功效深度开发一直吸引着国内外学者的关注。现有研究初步表明,茶叶中儿茶素主成分EGCG以及红茶中茶黄素均能有效抑制或延迟多肽和蛋白质进行错误折叠后形成毒性寡聚态或纤维状高分子聚合物,甚至能将蛋白质聚集体通过逆转途径使其恢复成无毒性的蛋白质单体(图1)。但现阶段将茶叶功能成分应用于PMDs临床研究仍存在一些问题:目前,防治PMDs相关研究更多停留在体外实验,对于动物实验或人类临床实验相对较少;茶叶功能成分对其神经保护作用及神经退行性疾病防治作用靶点或相关通路尚不太明确;因血脑屏障及人类吸收代谢较为复杂,导致茶叶功能成分进入血脑屏障后含量或活性降低[83]。因此,未来可采用纳米技术等方法改进茶叶功能成分吸收效率;同时,需引进更多如生物素标记、分子结构修饰以及蛋白质组学等新型实验方法和技术,从分子、细胞及动物多水平明确儿茶素或茶黄素等茶多酚类化合物缓解PMDs发生和发展的作用机制,为今后临床实验以及将茶叶功能成分开发成为防治神经退行性疾病的功能产品奠定坚实的理论基础。
参考文献:
[1] 王晔, 顾振纶, 秦正红. 蛋白质错误折叠与神经退行性疾病[J].中国临床神经科学, 2005, 13(4): 422-426. DOI:10.3969/ j.issn.1008-0678.2005.04.02.
[2] REZAI-ZADEH K, SHYTLE D, SUN N, et al. Green tea epigallocatechin-3-gallate (EGCG) modulates amyloid precursor protein cleavage and reduces cerebral amyloidosis in Alzheimer transgenic mice[J]. The Journal of Neuroscience, 2005, 25(38): 8807-8814. DOI:10.1523/JNEUROSCI.1521-05.2005.
[3] CAUGHEY B, LANSBURY P T. Protofibrils, pores, fibrils, and neurodegeneration: separating the responsible protein aggregates from the innocent bystanders[J]. Annual Review of Neuroscience, 2003, 26(1): 267-298. DOI:10.1146/annurev.neuro.26.010302.081142.
[4] 王明, 李学周, 符兆英. 蛋白质错误折叠与蛋白质构象病[J]. 延安大学学报(医学科学版), 2009, 7(2): 12-13. DOI:10.3969/ j.issn.1672-2639.2009.02.005.
[5] 陈明辉, 占琦, 霍光华. 错误折叠蛋白质的聚集效应及其对策[J]. 生命的化学, 2005, 25(3): 193-195. DOI:10.3969/j.issn.1000-1336.2005.03.006.
[6] KALARIA R N, MAESTRE G E, ARIZAGA R, et al. Alzheimer’s disease and vascular dementia in developing countries: prevalence, management, and risk factors[J]. The Lancet Neurology, 2008, 7(9): 812-826. DOI:10.1016/S1474-4422(08)70169-8.
[7] WILD S, ROGLIC G, GREEN A, et al. Global prevalence of diabetes estimates for the year 2000 and projections for 2030[J]. Diabetes Care, 2004, 27(5): 1047-1053. DOI:10.2337/diacare.27.5.1047.
[8] de RIJK M, LAUNER L, BERGER K, et al. Prevalence of Parkinson’s disease in Europe: a collaborative study of population-based cohorts. Neurologic Diseases in the Elderly Research Group[J]. Neurology, 1999, 54(Suppl 5): 21-23. DOI:10.1136/jnnp.62.1.10.
[9] CHENG B, GONG H, XIAO H, et al. Inhibiting toxic aggregation of amyloidogenic proteins: a therapeutic strategy for protein misfolding diseases[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2013, 1830(10): 4860-4871. DOI:10.1016/j.bbagen.2013.06.029.
[10] PORAT Y, ABRAMOWITZ A, GAZIT E. Inhibition of amyloid fibril formation by polyphenols: structural similarity and aromatic interactions as a common inhibition mechanism[J]. Chemical Biology & Drug Design, 2006, 67(1): 27-37. DOI:10.1111/j.1747-0285.2005.00318.x.
[11] SINHA S, DU Z, MAITI P, et al. Comparison of three amyloid assembly inhibitors: the sugar scyllo-inositol, the polyphenol epigallocatechin gallate, and the molecular tweezer CLR01[J]. ACS Chemical Neuroscience, 2012, 3(6): 451-458. DOI:10.1021/cn200133x.
[12] RIVIÈRE C, RICHARD T, VITRAC X, et al. New polyphenols active on β-amyloid aggregation[J]. Bioorganic & Medicinal Chemistry Letters, 2008, 18(2): 828-831. DOI:10.1016/j.bmcl.2007.11.028.
[13] PALLAUF K, RIMBACH G. Autophagy, polyphenols and healthy ageing[J]. Ageing Research Reviews, 2013, 12(1): 237-252. DOI:10.1016/j.arr.2012.03.008.
[14] FERREIRA N, SARAIVA M J, ALMEIDA M R. Natural polyphenols inhibit different steps of the process of transthyretin (TTR) amyloid fibril formation[J]. FEBS Letters, 2011, 585(15): 2424-2430. DOI:10.1016/j.febslet.2011.06.030.
[15] ONO K, YOSHIIKE Y, TAKASHIMA A, et al. P4-369 Potent anti-amyloidogenic and fibril-destabilizing effects of polyphenols in vitro: implications for the prevention and therapeutics of Alzheimer’s disease[J]. Neurobiology of Aging, 2004, 25(1): 172-181. DOI:10.1016/S0197-4580(04)81927-4.
[16] TENORE G C, DAGLIA M, CIAMPAGLIA R, et al. Exploring the nutraceutical potential of polyphenols from black, green and white tea infusions: an overview[J]. Current Pharmaceutical Biotechnology, 2015, 16(3): 265-271. DOI:10.2174/1389201016666150118133604.
[17] LU Jike, HAO Limin, TAO Ruyu, et al. Antioxidant activity of green tea polyphenols and theaflavins of varied purities[J]. 食品科学, 2015, 36(17): 17-21. DOI:10.7506/spkx1002-6630-201517004.
[18] MA M F. Amyloid-beta protein dimers isolated directly from Alzheimer’s brains impair synaptic plasticity and memory[J]. Nature Medicine, 2008, 14: 837-842. DOI:10.1038/nm1782.
[19] JAN A, ADOLFSSON O, ALLAMAN I, et al. Aβ42 neurotoxicity is mediated by ongoing nucleated polymerization process rather than by discrete Aβ42 species[J]. Journal of Biological Chemistry, 2011, 286(10): 8585-8596. DOI:10.1074/jbc.M110.172411.
[20] SANDBERG A, LUHESHI L M, SÖLLVANDER S, et al. Stabilization of neurotoxic Alzheimer amyloid-β oligomers by protein engineering[J]. Proceedings of the National Academy of Sciences, 2010, 107(35): 15595-15600. DOI:10.1073/pnas.1001740107.
[21] KLYUBIN I, WALSH D M, LEMERE C A, et al. Amyloid β protein immunotherapy neutralizes Aβ oligomers that disrupt synaptic plasticity in vivo[J]. Nature Medicine, 2005, 11(5): 556-561. DOI:10.1038/nm1234.
[22] TOWNSEND M, SHANKAR G M, MEHTA T, et al. Effects of secreted oligomers of amyloid β-protein on hippocampal synaptic plasticity: a potent role for trimers[J]. The Journal of Physiology, 2006, 572(2): 477-492. DOI:10.1113/jphysiol.2005.103754.
[23] LEI M, XU H, LI Z, et al. Soluble Aβ oligomers impair hippocampal LTP by disrupting glutamatergic/GABAergic balance[J]. Neurobiology of Disease, 2016, 85: 111-121. DOI:10.1016/j.nbd.2015.10.019.
[24] 王建秀, 段淑荣, 王德生, 等. Aβ_(42)与Aβ_(42)寡聚体的生物学性质比较研究[C]//全国神经病学学术会议. 北京: 中华医学会神经病学分会, 2008: 2577-2580.
[25] SCHROETER H, BAHIA P, SPENCER J P, et al. (-)Epicatechin stimulates ERK-dependent cyclic AMP response element activity and up-regulates GluR2 in cortical neurons[J]. Journal of Neurochemistry, 2007, 101(6): 1596-1606. DOI:10.1111/j.1471-4159.2006.04434.x.
[26] 万章, 王春梅. Tau蛋白过度磷酸化在阿尔茨海默病发病机制中的作用[J]. 医学研究生学报, 2010, 23(5): 539-542. DOI:10.3969/ j.issn.1008-8199.2010.05.023.
[27] EHRNHOEFER D E, BIESCHKE J, BOEDDRICH A, et al. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers[J]. Nature Structural & Molecular Biology, 2008, 15(6): 558-566. DOI:10.1038/nsmb.1437.
[28] BIESCHKE J, RUSS J, FRIEDRICH R P, et al. EGCG remodels mature α-synuclein and amyloid-β fibrils and reduces cellular toxicity[J]. Proceedings of the National Academy of Sciences, 2010, 107(17): 7710-7715. DOI:10.1073/pnas.0910723107.
[29] BASTIANETTO S, YAO Z X, PAPADOPOULOS V, et al. Neuroprotective effects of green and black teas and their catechin gallate esters against β-amyloid-induced toxicity[J]. European Journal of Neuroscience, 2006, 23(1): 55-64. DOI:10.1111/j.1460-9568.2005.04532.x.
[30] ARISPE N, POLLARD H B, ROJAS E. The ability of amyloid β-protein [AβP (1–40)] to form Ca2+channels provides a mechanism for neuronal death in Alzheimer’s disease[J]. Annals of the New York Academy of Sciences, 1994, 747(1): 256-266. DOI:10.1111/j.1749-6632.1994.tb44414.x.
[31] LIN H, BHATIA R, LAL R. Amyloid β protein forms ion channels: implications for Alzheimer’s disease pathophysiology[J]. The FASEB Journal, 2001, 15(13): 2433-2444. DOI:10.1096/fj.01-0377com.
[32] GAUCI A J, CARUANA M, GIESE A, et al. Identification of polyphenolic compounds and black tea extract as potent inhibitors of lipid membrane destabilization by Aβ42 aggregates[J]. Journal of Alzheimer’s Disease, 2011, 27(4): 767. DOI:10.3233/JAD-2011-111061.
[33] CAMILLERI A, ZARB C, CARUANA M, et al. Mitochondrial membrane permeabilisation by amyloid aggregates and protection by polyphenols[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2013, 1828(11): 2532-2543. DOI:10.1016/j.bbamem.2013.06.026.
[34] FERNANDEZ J W, REZAI-ZADEH K, OBREGON D, et al. EGCG functions through estrogen receptor-mediated activation of ADAM10 in the promotion of non-amyloidogenic processing of APP[J]. FEBS Letters, 2010, 584(19): 4259-4267. DOI:10.1016/ j.febslet.2010.09.022.
[35] OBREGON D F, REZAI-ZADEH K, BAI Y, et al. ADAM10 activation is required for green tea (-)-epigallocatechin-3-gallateinduced α-secretase cleavage of amyloid precursor protein[J]. Journal of Biological Chemistry, 2006, 281(24): 16419-16427. DOI:10.1074/ jbc.M600617200.
[36] REZAI-ZADEH K, ARENDASH G W, HOU H, et al. Green tea epigallocatechin-3-gallate (EGCG) reduces β-amyloid mediated cognitive impairment and modulates tau pathology in Alzheimer transgenic mice[J]. Brain Research, 2008, 1214: 177-187. DOI:10.1016/j.brainres.2008.02.107.
[37] VAUZOUR D, VAFEIADOU K, RICE-EVANS C, et al. Activation of pro-survival Akt and ERK1/2 signalling pathways underlie the anti-apoptotic effects of flavanones in cortical neurons[J]. Journal of Neurochemistry, 2007, 103(4): 1355-1367. DOI:10.1111/j.1471-4159.2007.04841.x.
[38] WOBST H J, SHARMA A, DIAMOND M I, et al. The green tea polyphenol (-)-epigallocatechin gallate prevents the aggregation of tau protein into toxic oligomers at substoichiometric ratios[J]. FEBS Letters, 2015, 589(1): 77-83. DOI:10.1016/j.febslet.2014.11.026.
[39] GRELLE G, OTTO A, LORENZ M, et al. Black tea theaflavins inhibit formation of toxic amyloid-β and α-synuclein fibrils[J]. Biochemistry, 2011, 50(49): 10624-10636. DOI:10.1021/bi2012383.
[40] CARUANA M, HÖGEN T, LEVIN J, et al. Inhibition and disaggregation of α-synuclein oligomers by natural polyphenolic compounds[J]. FEBS Letters, 2011, 585(8): 1113-1120. DOI:10.1016/j.febslet.2011.03.046.
[41] MASUDA M, HASEGAWA M, NONAKA T, et al. Inhibition of α-synuclein fibril assembly by small molecules: analysis using epitope-specific antibodies[J]. FEBS Letters, 2009, 583(4): 787-791. DOI:10.1016/j.febslet.2009.01.037.
[42] BAE S Y, KIM S, LEE B Y, et al. Amyloid formation using 1-butyl-3-methyl-imidazolium-based ionic liquids[J]. Analytical Biochemistry, 2011, 419(2): 354-356. DOI:10.1016/j.ab.2011.08.007.
[43] HWANG H, CHOI H, KIM H K, et al. Ionic liquids promote amyloid formation from α-synuclein[J]. Analytical Biochemistry, 2009, 386(2): 293-295. DOI:10.1016/j.ab.2008.12.019.
[44] BAE SY, KIM S, HWANG H, et al. Amyloid formation and disaggregation of α-synuclein and its tandem repeat (α-TR)[J]. Biochemical and Biophysical Research Communications, 2010, 400(4): 531-536. DOI:10.1016/j.bbrc.2010.08.088.
[45] CARUANA M, NEUNER J, HÖGEN T, et al. Polyphenolic compounds are novel protective agents against lipid membrane damage by α-synuclein aggregates in vitro[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2012, 1818(11): 2502-2510. DOI:10.1016/ j.bbamem.2012.05.019.
[46] 闫敬娜, 罗理勇, 胡雅琼, 等. 茶提取物和纳米表没食子儿茶素没食子酸酯对6-羟基多巴胺诱导的SH-SY5Y细胞保护作[J]. 食品科学, 2016, 37(1): 163-170. DOI:10.7506/spkx1002-6630-201601029.
[47] 胡雅琼, 罗理勇, 曾亮. 茶叶提取物对帕金森病的防治作用研究进展[J]. 中草药, 2014, 45(9): 1342-1348. DOI:10.7501/ j.issn.0253-2670.2014.09.027.
[48] ZIMMET P. The burden of type 2 diabetes: are we doing enough?[J]. Diabetes & Metabolism, 2003, 29(4): 6S9-6S18. DOI:10.1016/S1262-3636(03)72783-9.
[49] STUMVOLL M, GOLDSTEIN B J, van HAEFTEN T W. Type 2 diabetes: principles of pathogenesis and therapy[J]. The Lancet, 2005, 365: 1333-1346. DOI:10.1016/S0140-6736(05)61032-X.
[50] KHEMTEMOURIAN L, GAZIT E, MIRANKER A. Recent insight in islet amyloid polypeptide morphology, structure, membrane interaction, and toxicity in Type 2 diabetes[J]. Journal of Diabetes Research, 2016, 2016: 1-2. DOI:10.1155/2016/2535878.
[51] LUCIE C, HOFFMANN A R F, ALEXANDRA B, et al. Molecular structure, membrane interactions, and toxicity of the islet amyloid polypeptide in Type 2 diabetes mellitus[J]. Journal of Diabetes Research, 2016, 2016(6): 1-13. DOI:10.1155/2016/5639875.
[52] SPIJKER H S, SONG H, ELLENBROEK J H, et al. Loss of β-cell identity occurs in Type 2 diabetes and is associated with islet amyloid deposits[J]. Diabetes, 2015, 64(8): 2928. DOI:10.2337/db14-1752.
[53] BRENDER J R, DÜRR U H, HEYL D, et al. Membrane fragmentation by an amyloidogenic fragment of human islet amyloid polypeptide detected by solid-state NMR spectroscopy of membrane nanotubes[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes, 2007, 1768(9): 2026-2029. DOI:10.1016/j.bbamem.2007.07.001.
[54] BRISSE M. The inhibitive effects of 5 dietary compounds on IAPP fibril formation[D]. Ann Arbor: University of Michigan, 2013: 16-17.
[55] ENGEL M F, VANDENAKKER C C, SCHLEEGER M, et al. The polyphenol EGCG inhibits amyloid formation less efficiently at phospholipid interfaces than in bulk solution[J]. Journal of the American Chemical Society, 2012, 134(36): 14781-14788. DOI:10.1021/ja3031664.
[56] CAO P, RALEIGH D P. Analysis of the inhibition and remodeling of islet amyloid polypeptide amyloid fibers by flavanols[J]. Biochemistry, 2012, 51(13): 2670-2683. DOI:10.1021/bi2015162.
[57] KAMIHIRA-ISHIJIMA M, NAKAZAWA H, KIRA A, et al. Inhibitory mechanism of pancreatic amyloid fibril formation: Formation of the complex between tea catechins and the fragment of residues 22-27[J]. Biochemistry, 2012, 51(51): 10167-10174. DOI:10.1021/bi3012274.
[58] MENG F, ABEDINI A, PLESNER A, et al. The flavanol (-)-epigallocatechin 3-gallate inhibits amyloid formation by islet amyloid polypeptide, disaggregates amyloid fibrils, and protects cultured cells against IAPP-induced toxicity[J]. Biochemistry, 2010, 49(37): 8127-8133. DOI:10.1021/bi100939a.
[59] ANDERSON R A, POLANSKY M M. Tea enhances insulin activity[J]. Journal of Agricultural and Food Chemistry, 2002, 50(24): 7182-7186. DOI:10.1021/jf020514c
[60] GOMES A, VEDASIROMONI J, DAS M, et al. Anti-hyperglycemic effect of black tea (Camellia sinensis) in rat[J]. Journal of Ethnopharmacology, 1995, 45(3): 223-226. DOI:10.1016/0378-8741(95)01223-Z.
[61] BROADHURST C L, POLANSKY M M, ANDERSON R A. Insulinlike biological activity of culinary and medicinal plant aqueous extracts in vitro[J]. Journal of Agricultural and Food Chemistry, 2000, 48(3): 849-852. DOI:10.1021/jf9904517.
[62] WU L Y, JUAN C C, HWANG L S, et al. Green tea supplementation ameliorates insulin resistance and increases glucose transporter IV content in a fructose-fed rat model[J]. European Journal of Nutrition, 2004, 43(2): 116-124. DOI:10.1007/s00394-004-0450-x.
[63] WALTNER-LAW M E, WANG X L, LAW B K, et al. Epigallocatechin gallate, a constituent of green tea, represses hepatic glucose production[J]. Journal of Biological Chemistry, 2002, 277(38): 34933-34940. DOI:10.1074/jbc.M204672200.
[64] SABU M, SMITHA K, KUTTAN R. Anti-diabetic activity of green tea polyphenols and their role in reducing oxidative stress in experimental diabetes[J]. Journal of Ethnopharmacology, 2002, 83(1): 109-116. DOI:10.1016/S0378-8741(02)00217-9.
[65] SUNDARAM R, NARESH R, SHANTHI P, et al. Modulatory effect of green tea extract on hepatic key enzymes of glucose metabolism in streptozotocin and high fat diet induced diabetic rats[J]. Phytomedicine, 2013, 20(7): 577-584. DOI:10.1016/j.phymed.2013.01.006.
[66] POLYCHRONOPOULOS E, ZEIMBEKIS A, KASTORINI C M, et al. Effects of black and green tea consumption on blood glucose levels in non-obese elderly men and women from Mediterranean Islands (MEDIS epidemiological study)[J]. European Journal of Nutrition, 2008, 47(1): 10-16. DOI:10.1007/s00394-007-0690-7.
[67] ISO H, DATE C, WAKAI K, et al. The relationship between green tea and total caffeine intake and risk for self-reported type 2 diabetes among Japanese adults[J]. Annals of Internal Medicine, 2006, 144(8): 554-562. DOI:10.7326/0003-4819-144-8-200604180-00005.
[68] ODEGAARD A O, PEREIRA M A, KOH W P, et al. Coffee, tea, and incident type 2 diabetes: the Singapore Chinese Health Study[J]. The American Journal of Clinical Nutrition, 2008, 88(4): 979-985.
[69] HOSODA K, WANG M F, LIAO M L, et al. Antihyperglycemic effect of oolong tea in type 2 diabetes[J]. Diabetes Care, 2003, 26(6): 1714-1718. DOI:10.2337/diacare.26.6.1714.
[70] JING Y, HAN G, HU Y, et al. Tea consumption and risk of type 2 diabetes: a meta-analysis of cohort studies[J]. Journal of General Internal Medicine, 2009, 24(5): 557-562. DOI:10.1007/s11606-009-0929-5.
[71] FERRANTE R, KOWALL N, BEAL M, et al. Selective sparing of a class of striatal neurons in Huntington’s disease[J]. Science, 1985, 230: 561-563. DOI:10.1126/science.2931802.
[72] MacDONALD M E, AMBROSE C M, DUYAO M P, et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington’s disease chromosomes[J]. Cell, 1993, 72(6): 971-983.
[73] EHRNHOEFER D E, DUENNWALD M, MARKOVIC P, et al. Green tea (-)-epigallocatechin-gallate modulates early events in huntingtin misfolding and reduces toxicity in Huntington’s disease models[J]. Human Molecular Genetics, 2006, 15(18): 2743-2751. DOI:10.1093/ hmg/ddl210.
[74] KUMAR P, KUMAR A. Effect of lycopene and epigallocatechin-3-gallate against 3-nitropropionic acid induced cognitive dysfunction and glutathione depletion in rat: a novel nitric oxide mechanism[J]. Food and Chemical Toxicology, 2009, 47(10): 2522-2530. DOI:10.1016/ j.fct.2009.07.011.
[75] SARAIVA M J, CARDOSO I S. Transthyretin aggregation and toxicity[M]// RAHIMI F, BITAN G. Non-fibrillar amyloidogenic protein assemblies-common cytotoxins underlying degenerative diseases. Berlin: Springer, 2012: 407-432. DOI:10.1007/978-94-007-2774-8_13.
[76] MIYATA M, SATO T, KUGIMIYA M, et al. The Crystal structure of the green tea polyphenol (-)-epigallocatechin gallate-transthyretin complex reveals a novel binding site distinct from the thyroxine binding site[J]. Biochemistry, 2010, 49(29): 6104-6114. DOI:10.1021/ bi1004409.
[77] FERREIRA N, CARDOSO I, DOMINGUES M R, et al. Binding of epigallocatechin-3-gallate to transthyretin modulates its amyloidogenicity[J]. FEBS Letters, 2009, 583(22): 3569-3576. DOI:10.1016/j.febslet.2009.10.062.
[78] FERREIRA N, SARAIVA M J, ALMEIDA M R. Epigallocatechin-3-gallate as a potential therapeutic drug for TTR-related amyloidosis:“in vivo” evidence from FAP mice models[J]. PLoS ONE, 2012, 7(1): e29933. DOI:10.1371/journal.pone.0029933.
[79] FERREIRA N, PEREIRA-HENRIQUES A, ALMEIDA M R. Transthyretin chemical chaperoning by flavonoids: structure-activity insights towards the design of potent amyloidosis inhibitors[J]. Biochemistry and Biophysics Reports, 2015, 3: 123-133. DOI:10.1016/ j.bbrep.2015.07.019.
[80] KRISTEN A V, LEHRKE S, BUSS S, et al. Green tea halts progression of cardiac transthyretin amyloidosis: an observational report[J]. Clinical Research in Cardiology, 2012, 101(10): 805-813. DOI:10.1007/s00392-012-0463-z.
[81] ROBERTS B E, DUENNWALD M L, WANG H, et al. A synergistic small-molecule combination directly eradicates diverse prion strain structures[J]. Nature Chemical Biology, 2009, 5(12): 936-946. DOI:10.1038/nchembio.246.
[82] CLARDY J, WALSH C. Lessons from natural molecules[J]. Nature, 2004, 432: 829-837. DOI:10.1038/nature03194.
[83] 魏然, 徐平, 应乐, 等. 茶多酚对阿尔茨海默病的防治功能与机理研究进展[J]. 茶叶科学, 2016(1): 1-10. DOI:10.13305/j.cnki. jts.2016.01.001.
Progress in Understanding Inhibitory Effects of Tea Functional Components on Protein Aggregation and Misfolding Diseases
ZHANG Jing, HUANG Jianan, LIU Zhonghua*
(National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Collaborative Innovation Center of Utilization of Functional Ingredients from Botanicals, Key Laboratory of Tea Science, Ministry of Education, Hunan Agricultural University, Changsha 410128, China)
Abstract:Protein misfolding and aggregation can cause a series of diseases such as Alzheimer’s, Parkinson’s, Huntington’s diseases and type 2 diabetes by inducing the formation of toxic oligomer and amyloid fiber. In this article, recent in vivo and in vitro studies in this regard are summarized. We also review the literature on the inhibitory effects and mechanisms of functional components such as catechins and theaflavins in tea on protein aggregation as well as their effects in preventing and treating several typical protein misfolding diseases.
Keywords:tea; catechin; theaflavins; protein; aggregation; misfolding
DOI:10.7506/spkx1002-6630-201713045
中图分类号:R742;R285
文献标志码:A
文章编号:1002-6630(2017)13-0277-08
引文格式:
张静, 黄建安, 刘仲华. 茶叶功能成分抑制蛋白质聚集及错误折叠疾病的研究进展[J]. 食品科学, 2017, 38(13): 277-284. DOI:10.7506/spkx1002-6630-201713045. http://www.spkx.net.cn
ZHANG Jing, HUANG Jianan, LIU Zhonghua. Progress in understanding inhibitory effects of tea functional components on protein aggregation and misfolding diseases[J]. Food Science, 2017, 38(13): 277-284. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201713045. http://www.spkx.net.cn
收稿日期:2016-05-16
基金项目:国家现代农业(茶叶)产业技术体系建设专项(CARS-23-11B);湖南省植物功能成分利用协同创新项目(HNCR-2014003)
作者简介:张静(1989—),女,博士研究生,主要从事茶叶功能成分药理研究。E-mail:zhangjingjing8509@163.com
*通信作者:刘仲华(1965—),男,教授,博士,主要从事茶叶深加工及功能成分利用研究。E-mail:larkin-liu@163.com