表1 类胡萝卜素回归方程
Table 1 Regression equations for quantitation of carotenoids

刘 亚,刘建花,张惠玲*,齐晓琴,李金鹏,付丽霞,王晓昌
(宁夏大学农学院,宁夏 银川 750021)
摘 要:以鲜果枸杞为原料接种酵母菌发酵枸杞酒,采用高效液相色谱、气相色谱测定分析代谢产物中含量较多的醇类、酯类、羧酸类、醛酮类物质,以及枸杞酒发酵前后类胡萝卜素的含量变化,以测定的以上代谢产物含量为参数,建立模拟实验,对照分析各类代谢产物含量对类胡萝卜素含量的影响,确定在枸杞酒中影响类胡萝卜素降解的最主要因素。结果表明:羧酸类化合物是影响类胡萝卜素降解的主要因素,其次为醛酮类物质,影响最小的是酯类及醇类物质。
关键词:枸杞酒;发酵;类胡萝卜素;降解
枸杞是中国传统的药食两用性植物,含有多种活性物质,如黄酮、类胡萝卜素、多糖等[1-2],其中所含类胡萝卜素既是重要的营养物质,又是枸杞的主要呈色色素[3-5]。枸杞鲜果中类胡萝卜素含量为干果的0.03%~0.5%[6],种类繁多,除少量玉米黄素和β-胡萝卜素外,97%以上的类胡萝卜素都以酯化形式存在[7],其中含量最多的是玉米黄素双棕榈酸酯,约占类胡萝卜素总量的80%以上[8]。一般完整植物组织中的类胡萝卜素很稳定,可作为色素或抗氧化剂添加在食品中[9],但在果蔬加工过程中由于受高温等因素的影响,使其细胞组织遭到破坏,而其中的类胡萝卜素则会从组织中游离出来,失去保护机制的类胡萝卜素极易受热、光、氧的影响而发生降解[10-11]。同样,在枸杞酒发酵过程中由于受到光、热、氧等多种因素的影响,导致枸杞中类胡萝卜素发生降解[12]。有文献[13]表明,类胡萝卜素降解产生的异戊二烯类化合物对枸杞酒的品质有一定的贡献,却对色泽产生不利影响,已有学者对枸杞中类胡萝卜素的含量变化进行分析研究,张志宁等[14]采用分光光度法测定了不同产地宁夏枸杞类胡萝卜素百分含量,结果表明不同产地枸杞中类胡萝卜素含量有一定差异。罗青等[15]对枸杞及其他果蔬中类胡萝卜素含量的测定表明,鲜果枸杞中类胡萝卜素含量明显高于干果枸杞。康迎春等[16]采用高效液相色谱(high performance liquid chromatography,HPLC)法测定枸杞鲜果中主要类胡萝卜素组成,结果表明HPLC法准确度和精确度都很高,且可用于鲜果枸杞中类胡萝卜素的定量分析。曲云卿等[17]通过不同产地枸杞中主要类胡萝卜素的聚类分析得出,利用HPLC法能够快速有效地对枸杞中类胡萝卜素进行定量分析。王晓璇[18]通过对枸杞皮渣中类胡萝卜的提取及稳定性研究找到提取类胡萝卜素的最佳工艺。周广志[19]通过枸杞酒发酵发现枸杞汁中类胡萝卜素在不同果胶酶、SO2、pH值及高压灭菌条件下含量的变化情况,并对发酵体系中类胡萝卜素含量变化进行建模研究,但还鲜有人对整个发酵体系进行模拟研究。
本实验对枸杞酒发酵前后类胡萝卜素含量的变化进行测定,并测定分析主要代谢产物醇类、酯类等化合物的含量,同时以枸杞酒发酵中含量较多的醇类、酯类等化合物含量为单因素,模拟研究其对类胡萝卜素降解的影响程度,辅助分析枸杞类胡萝卜素在发酵体系中主要的影响因素及影响程度。
1.1 材料与试剂
枸杞鲜果 宁夏百瑞源枸杞产业发展有限公司。
酿酒干酵母 湖北安琪酵母股份有限公司;偏重亚硫酸钾(食品级) 宁夏为民生物有限公司;果胶酶(1×105U/g) 江苏省锐阳生物公司;β-胡萝卜素标准品(HPLC级,纯度≥98%) 南京泽朗生物科技有限公司;玉米黄素标准品(HPLC级,纯度≥97%)、玉米黄素双棕榈酸酯标准品(HPLC级,纯度≥98%)美国Sigma-Aldrich公司;pH计 上海精密科学仪器有限公司;正己烷(色谱纯) 德国Meker公司。
1.2 仪器与设备
1100 HPLC仪(配有自动进样器ZORBAX Edipse XDB-C18反相色谱柱(4.6 nm×250 nm,5 μm))美国安捷伦公司;LRH-150B恒温培养箱 广东省医疗器械厂;电子分析天平 梅特勒-托利多仪器有限公司;旋转蒸发仪 上海亚荣生化仪器厂;DF-Ⅱ数显集热式磁力搅拌器 常州爱华仪器制造有限公司;GCMS-QP2010气相色谱-质谱联用仪 日本岛津公司。
1.3 方法
1.3.1 枸杞酒发酵工艺
1.3.1.1 工艺流程
鲜枸杞→清洗→榨汁、打浆→添加偏重亚硫酸钾→加入果胶酶、酶解→调节酸度、糖度→接种酵母→主发酵→后发酵→过滤→灌装→成品酒
1.3.1.2 操作要点[20-21]
枸杞汁预处理:挑选色泽明亮、颗粒大小适中的枸杞洗净、热烫后,以料液比1∶3加水,放入榨汁机中榨汁,立即加入60 mg/L的偏重亚硫酸钾,随后加入40 mg/L的果胶酶,40 ℃酶解2 h,再添加蔗糖调整枸杞汁糖度到25%,pH 3.0~3.3。
接种酵母:在枸杞汁中按接种量为0.1~0.2 g/100 mL接种已活化的酿酒酵母,置于22 ℃培养箱恒温发酵。每天定时取样测定发酵液的酒精度、还原糖含量。
过滤陈酿:发酵结束后,用灭菌过的干净纱布过滤澄清,装于密闭的棕色玻璃瓶中,低温贮存6 个月左右,酒体澄清透明,枸杞香与酒香融为一体。
1.3.2 模拟发酵体系中主要单因素对类胡萝卜素的影响
本实验通过测定枸杞酒发酵产物中各种物质的含量,选择含量较高的代谢物质进行单因素试验,目的在于获得对类胡萝卜素影响最大的代谢产物。实验表明,枸杞酒中主要成分有醇类、酯类、羧酸类、醛酮类等,其中醇类相对峰面积为55%,占总成分的12.23%,主要为乙醇和异戊醇;酯类物质相对峰面积为14.1%,占总成分的14.08%,主要为辛酸乙酯;羧酸类占总成分的0.27%,主要为辛酸;醛酮类占总成分的9.78%,主要为乙缩醛。故实验此部分以枸杞酒中含有的主要物质为单因素进行发酵体系环境的模拟研究,以下操作均在避光条件下进行。
1.3.2.1 醇类对类胡萝卜素的影响
配制醇类体积分数为12.23%的发酵模拟溶液:精确吸取0.930 mL乙醇、0.293 mL异戊醇,再分别加入1.0 mL玉米黄素双棕榈酸酯、β-胡萝卜素、玉米黄素储备液,用蒸馏水稀释至10 mL比色管中。20 ℃放置3.5 h后取样并测定类胡萝卜素含量。
1.3.2.2 酯类对类胡萝卜素的影响
配制酯类体积分数为14.08%的发酵模拟溶液:准确量取辛酸乙酯1.408 mL,以下步骤同上。
1.3.2.3 羧酸类对类胡萝卜素的影响
配制羧酸类体积分数为0.27%的发酵模拟溶液:准确量取辛酸0.027 mL,以下步骤同上。
1.3.2.4 醛酮类对类胡萝卜素的影响
配制醛酮类体积分数为9.78%的发酵模拟溶液:准确量取乙缩醛0.978 mL,以下步骤同上。
1.3.3 酒精度的测定
采用气相色谱法[22]。
样品前处理:取枸杞发酵液2.5 mL于10 mL容量瓶中,用色谱级甲醇稀释至刻度;样品上机前必须用0.22 μm针孔滤膜过滤。
检测条件:岛津GC-2010气相色谱仪,DBWax (30 m×0.25 mm,0.25μm),流量24 mL/min;升温程序34~210 ℃;程序升温,34 ℃保持5 min,以30 ℃/min升至210 ℃,保持5 min;进样口温度200 ℃;氢火焰离子检测器温度 210 ℃;柱压力72.3 kPa;总流量24.0 mL/min;线速率25.3 cm/s;Purge Flow 3.0 mL/min;分流进样,分流比20∶1;柱流量1.00 mL/min;进样量0.1 μL。
取5个10 mL容量瓶,分别吸取0.01、0.05、0.1、0.25、0.5、1 mL乙醇,再分别用甲醇定容至10mL,配制成体积分数0.1%、0.5%、1.0%、2.5%、5.0%、10%的乙醇标准溶液。用0.22 μm针孔滤膜过滤乙醇标准溶液,按以上检测条件分别上机测定乙醇标准溶液,得各标准乙醇溶液所对应的峰面积。以标准溶液乙醇体积分数为横坐标,峰面积为纵坐标绘制标准曲线,得标准曲线:y=117 216.31x+5 035.90,R2=0.999 0。
1.3.4 类胡萝卜素的测定
采用高效液相色谱法[23]测定。色谱条件:等度洗脱;流动相:V(甲醇)∶V(乙腈)∶V(正己烷)∶V(二氯甲烷)=15∶40∶20∶20;柱温25 ℃;流速1 mL/min;紫外-可见光检测器,检测波长450 nm。
类胡萝卜素含量测定:分别避光准确称取β-胡萝卜素标准品、玉米黄素标准品、玉米黄素双棕榈酸酯标准品各0.005 g,用流动相定容于10 mL容量瓶,作为母液备用。进样测定前根据需要将此溶液稀释成不同质量浓度梯度。以质量浓度为横坐标x,峰面积为纵坐标y绘制标准曲线,其回归方程如表1所示,由此测定各类胡萝卜素含量。
类胡萝卜素总量的测定[24]:避光准确称取β-胡萝卜素标准品4.000 mg,用石油醚定容至10 mL,配制成质量浓度为0.4 mg/mL的母液备用。开始进样前将其稀释10、5、4、2、1 倍,于454 nm波长处测定吸光度,以溶液质量浓度为横坐标,吸光度为纵坐标绘制标准曲线(表1),测定类胡萝卜素总量。
表1 类胡萝卜素回归方程
Table 1 Regression equations for quantitation of carotenoids

1.3.5 指标测定
还原糖含量用直接滴定法[25]。醇类、酯类、羧酸类及醛酮类物质含量均由气相色谱-质谱法测得[26]。
色谱条件:色谱柱DB-5MS(30 m×0.25 mm,0.25 μm),程序升温:40 ℃保持3 min,以5 ℃/min的速率升至120 ℃,再以8 ℃/min的速率升至230 ℃,保持10 min;载气为He,体积流量为1 mL/min,进样口温度为250 ℃。
质谱条件:电子电离源,电子能量70 eV,灯丝流量0.20 mA;检测器电压350 V。扫描范围20~450 u,离子源温度200 ℃。
1.4 数据处理
采用Office Excel进行数据整理与归纳,采用Origin 8.5作图,SPSS 17.0进行统计与分析。
2.1 发酵过程中主要物质含量的变化
2.1.1 还原糖含量和酒精度的变化
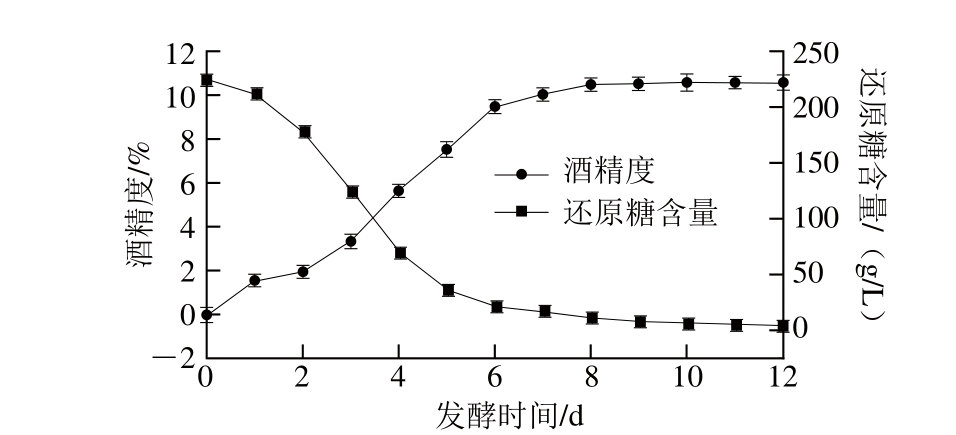
图1 发酵过程中还原糖含量和酒精度的变化
Fig. 1 Changes in sugar and alcohol during fermentation process
由图1可知,接种酵母菌后,第1天是其环境适应期,菌体生长快,耗糖较迟缓。第2~4天进入主发酵期,酵母菌耗糖量迅速增加,酒精含量快速升高,产生大量的热量和气泡。第8天发酵停止,不产生气泡,酒泥沉于瓶底,最终残糖量为4.2 g/L,酒精度达最大,为11.8%。
2.1.2 发酵前后醇类、酯类、羧酸类、醛酮类物质的变化
枸杞果酒中的醇类、酯类、羧酸类、醛酮类化合物都是其重要的风味物质组成成分,对枸杞酒的香气具有重要的作用。
表2 枸杞酒发酵前后醇类、酯类、羧酸类、醛酮类化合物的变化
Table 2 Changes in the contents of alcohol, esters, carboxylic acids and sugars before and after fermentation of Chinese wolfberry wine
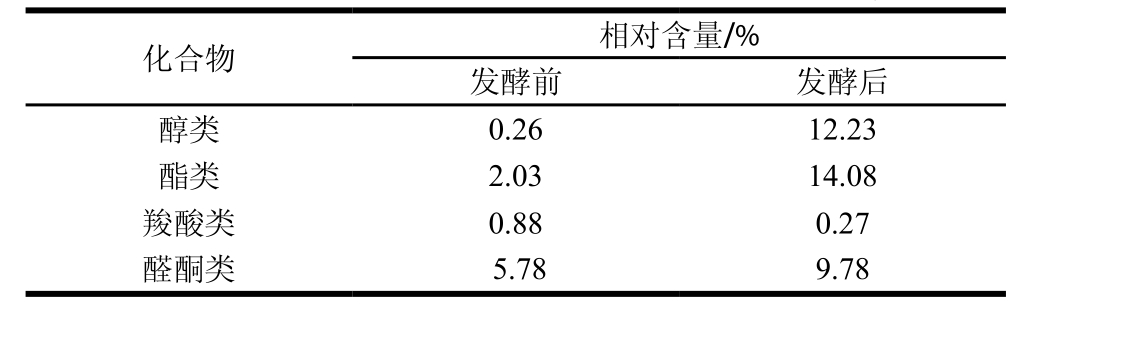
由表2可以看出,枸杞酒在发酵前后醇类、酯类、羧酸类、醛酮类化合物相对含量都发生了不同程度的变化,其中醇类相对含量增加最明显,其次为酯类物质,含量由2.03%增加到14.08%,醛酮类化合物由5.78%增加至9.78%,而羧酸类物质相对含量有所降低。这是因为在酵母发酵产生乙醇的同时,还生成了不同种类的醇类、酯类和醛酮类化合物,同时发酵液中类胡萝卜素的降解也会产生不同的酯类、醛酮类物质。羧酸类化合物不会在发酵过程中被代谢,但是某些羧酸,如酒石酸,会因酒石酸氢钾的沉淀作用而减少[27]。
2.2 发酵体系环境的模拟实验结果
2.2.1 醇类对类胡萝卜素含量的影响由表3可以看出,类胡萝卜素在醇溶液中呈整体下降趋势,降低率最大的是β-胡萝卜素,为16.29%。醇类对玉米黄素的影响次之,降低率为11.16%,对玉米黄素双棕榈酸酯的影响最小,降低率为4.26%。这可能是因为β-胡萝卜素分子结构中含有多个共轭双键,有较多的甲基,可将醇类的羟基取代,发生甲基化反应,或由于羟基的存在使得类胡萝卜素发生氢键结合,或者相互转化,导致其含量降低[28]。
表3 醇类对类胡萝卜素含量的影响
Table 3 Impact of alcohols on carotenoids contents

2.2.2 酯类对类胡萝卜素含量的影响
表4 酯类对类胡萝卜素含量的影响
Table 4 Impact of esters on carotenoids contents
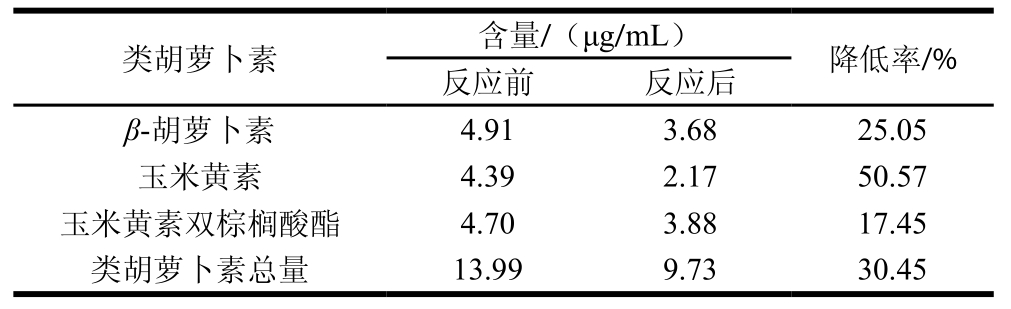
由表4可以看出,酯类对类胡萝卜素的影响趋势一致,但程度有所差异,其中对玉米黄素的影响最大,降低率为50.57%,β-胡萝卜素次之,降低率为25.05%,对玉米黄素双棕榈酸酯的影响最小,降低率为17.45%。这是因为常温条件下,类胡萝卜素在辛酸乙酯中的溶解性较弱。酯类化合物结构中含有—COO—官能团,一般为中性物质,有些能溶于水形成醇类和羧酸类[29],其中—OH和—COOH都能与类胡萝卜素分子发生化学反应,而且弱酸性环境下β-胡萝卜素性质不稳定,易发生自身分解反应,所以酯类溶液中类胡萝卜素的降低率较大。
2.2.3 羧酸类对类胡萝卜素含量的影响
表5 羧酸类对类胡萝卜素含量的影响
Table 5 Impact of carboxylic acid on carotenoids contents

由表5可以看出,羧酸类物质对类胡萝卜素的影响比较大,总体呈明显下降趋势。β-胡萝卜素的降低率最高,达91.85%。玉米黄素相对而言降解最少,降低率为49.66%,这可能是因为有部分的玉米黄素双棕榈酸酯在酸性环境下转变为玉米黄素,使得玉米黄素含量降低不是最严重。酸性条件下玉米黄素双棕榈酸酯比β-胡萝卜素稳定。类胡萝卜素总量由13.99 μg/mL降为3.90 μg/mL,降低率达72.12%,说明类胡萝卜素在酸性条件下性质不稳定,同时酸会增加溶液中的氢离子浓度,使枸杞中主要的类胡萝卜素玉米黄素双棕榈酸酯有可能发生分解,或类胡萝卜素的 5,6-环氧化合物发生重排,形成 2,5-二氢呋喃,致使类胡萝卜素含量发生变化。这与王孝荣[30]研究结果一致。
2.2.4 醛酮类对类胡萝卜素含量的影响
表6 醛酮类对类胡萝卜素含量的影响
Table 6 Impacts of aldehyde and ketone compounds on carotenoid content
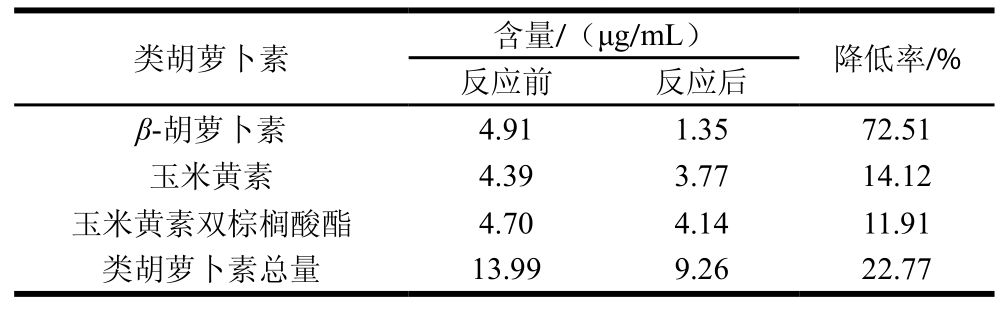
由表6可以看出,醛酮类物质对类胡萝卜素的影响程度有差异,其中对β-胡萝卜素的影响最大,由4.91 μg/mL降为1.35 μg/mL,降低率达72.51%,对玉米黄素及其酯的影响程度相近,且都较低,分别为14.12%和11.91%,类胡萝卜素总量由13.99 μg/mL降为9.26 μg/mL,降低率22.77%。醛酮类物质含有的C=O是一个极性官能团,易发生加成反应,同时它又是吸电子基团,对其α位的C—H具有诱导作用,容易表现出酸性,易发生卤仿、羟醛缩合等反应[31],由类胡萝卜素的结构可知,玉米黄素含有羟基,易与醛酮发生缩合反应,产物中含有二氢猕猴桃内酯、2,2,6-三甲基-环己烷-1-酮、异佛尔酮、α-环状柠檬醛,β-环状柠檬醛等重要致香物质。β-胡萝卜素可通过羟基化转变为二羟基衍生物玉米黄素,故其含量降低率较大。
2.2.5 不同模拟条件对类胡萝卜素降解的显著性分析
表7 各处理条件下类胡萝卜素含量差异显著性分析
Table 7 Significance analysis of the effects of different treatments on carotenoids contents
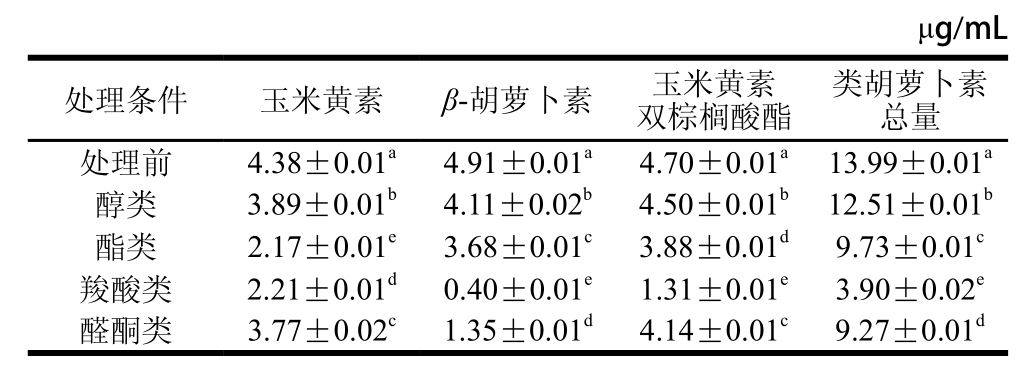
注:同列字母不同表示差异显著(P<0.05)。
枸杞发酵液模拟体系中经不同条件处理后,各类胡萝卜素含量差异显著。由表7可知,羧酸类物质对β-胡萝卜素、玉米黄素双棕榈酸酯及类胡萝卜素总量的影响最大,其次是醛酮类物质,对类胡萝卜素含量变化影响最小的是醇类物质。其中,对玉米黄素影响最大的是酯类物质,此时玉米黄素含量由原来的4.38 μg/mL降为2.17 μg/mL,其次是羧酸类的影响,玉米黄素含量由4.38 μg/mL降为2.21 μg/mL,对其影响最小的是醇类,此时玉米黄素的含量由4.38 μg/mL降为3.89 μg/mL。对β-胡萝卜素含量影响最大的是羧酸类,含量由4.91 μg/mL降为0.40 μg/mL,其含量显著低于其他处理条件,醇类对其降解影响最小,含量由原来的4.91 μg/mL降为4.11 μg/mL。玉米黄素双棕榈酸酯以羧酸类的影响最为严重,其含量由4.70 μg/mL降为1.31 μg/mL,影响最不显著的是醇类,其含量由4.70 μg/mL降为4.50 μg/mL。对类胡萝卜素总量影响最为显著的因素是羧酸类,此时类胡萝卜素总量由13.99 μg/mL降为3.90 μg/mL,其次是醛酮类的影响,含量由13.99 μg/mL降为9.27 μg/mL,醇类对其降解影响最小,其含量由原来的13.99 μg/mL降至12.51 μg/mL。
通过对发酵过程中代谢产物的测定,以及类胡萝卜素的变化,得知发酵过程中的主要产物是醇类、羧酸类、醛酮类、酯类。为分析环境中多个代谢产物中单个因素对类胡萝卜素影响程度,实验进行模拟研究,得出羧酸类对其含量的影响最大,这可能是由于在酸性环境下类胡萝卜素的共轭双键结构遭到了破坏,使类胡萝卜素分子结构发生了重排,生成其他物质。其次是醛酮类的影响,这主要是因为醛酮类物质含有的C=O官能团,使其溶液不仅显酸性,还易与类胡萝卜素基团结合发生羟醛缩合,导致类胡萝卜素含量降低。对类胡萝卜素变化率影响最小的是醇溶液,总类胡萝卜素降低率为10.65%,这可能是因为β-胡萝卜素分子结构中含有多个共轭双键及甲基,可将醇类的羟基取代,发生甲基化反应,或由于羟基的存在使得类胡萝卜素发生氢键结合,或者相互转化,导致其含量降低,其次为脂类物质的影响,这可能是因为酯结构中含有的官能团使得其性质比较稳定,对类胡萝素分子的破坏较小,从而使得类胡萝卜素的保留量比较多。
参考文献:
[1] ZHANG Q Y, CHEN W W, ZHAO J H, et al. Functional constituents and antioxidant activities of eight Chinese native goji genotypes[J]. Food Chemistry, 2016, 200: 230-236. DOI:10.1016/ j.foodchem.2016.01.046.
[2] SHING C L, LUO Z, WU D T, et al. Comparison and characterization of compounds with antioxidant activity in Lycium barbarum using high-performance thin layer chromatography coupled with DPPH bioautography and tandem mass spectrometry[J]. Journal of Food Science, 2016, 81(6): 1378-1384. DOI:10.1111/1750-3841.13327.
[3] 彭光华, 李忠. 薄层色谱法分离鉴定枸杞子中的类胡萝卜素[J].营养学报, 1998(1): 76-78. DOI:10.13325/j.cnki.acta.nutr. sin.1998.01.016.
[4] INBARAJ B S, LU H, HUNG C F, et al. Determination of carotenoids and their esters in fruits of Lycium barbarum Linnaeus by HPLCDAD-APCI-MS[J]. Journal of Pharmaceutical & Biomedical Analysis, 2008, 47(4/5): 812-818. DOI:10.1016/j.jpba.2008.04.001.
[5] MELLADO-ORTEGA E, HORNERO-MÉNDEZ D. Carotenoid profiling of Hordeum chilense, grains: the parental proof for the origin of the high carotenoid content and esterification pattern of tritordeum[J]. Journal of Cereal Science, 2015, 62(4): 15-21. DOI:10.1016/j.jcs.2014.12.005.
[6] HARUNOBU A, NORMAN R F. A review of botanical characteristics, phytochemistry, clinical relevance in efficacy and safety of Lycium barbarum fruit (Goji)[J]. Food Research International, 2011, 44: 1702-1717. DOI:10.1016/j.foodres.2011.03.027.
[7] 李赫, 陈敏, 马文平, 等. 不同成熟期枸杞中类胡萝卜素含量的变化规律[J]. 中国农业科学, 2006, 39(3): 599-605. DOI:10.3321/ j.issn:0578-1752.2006.03.024.
[8] INBARAJ B S, LU H, HUNG C F, et al. Determination of carotenoids and their esters in fruits of Lycium barbarum Linnaeus by HPLCDAD-APCI-MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 47(4/5): 812-818. DOI:10.1016/j.jpba.2008.04.001.
[9] PEETHAMBARAN D, BIJESH P, BHAGYALAKSHMI N. Carotenoid content, its stability during drying and the antioxidant activity of commercial coriander (Coriandrum sativum L.) varieties[J]. Food Research International, 2012, 45(1): 342-350. DOI:10.1016/ j.foodres.2011.09.021.
[10] RAMESH M N, WOLF W, TEVINI D, et al. Influence of processing parameters on the drying of spice paprika[J]. Journal of Food Engineering, 2001, 49(1): 63-72. DOI:10.1016/S0260-8774(00)00185-0.
[11] ESCUDERO A, GOGORZA B, MELUS M A, et al. Characterization of the aroma of a wine from maccabeo, key role played by compounds with low odor activity values[J]. Journal of Agriculture and Food Chemistry, 2004, 52: 3516-3524. DOI:10.1021/jf035341l.
[12] 董彩英. 辣椒果实类胡萝卜素的积累特点及其与果色的关系研究[D].扬州: 扬州大学, 2009.
[13] 王树林. 沙棘酒香味前体物β-胡萝卜素降解产香规律及机理研究[D].杨凌: 西北农林科技大学, 2011.
[14] 张志宁, 张玮. 宁夏枸杞类胡萝卜素含量测定[J]. 内蒙古中医药, 2013, 32(34): 134. DOI:10.16040/j.cnki.cn15-1101.2013.34.058.
[15] 罗青. 枸杞及不同果蔬中类胡萝卜素含量及抗氧化活性研究[J]. 食品研究与开发, 2015, 36(24): 39-42. DOI:10.3969/ j.issn.1005-6521.2015.24.010.
[16] 康迎春, 尹跃, 赵建华, 等. HPLC法测定枸杞鲜果中主要类胡萝卜素组成[J]. 食品工业, 2014, 35(12): 270-273.
[17] 曲云卿, 张同刚, 刘敦华. 不同产地枸杞中主要类胡萝卜素的聚类分析[J]. 食品与机械, 2015, 31(2): 76-79. DOI:10.13652/ j.issn.1003-5788.2015.02.015.
[18] 王晓璇. 枸杞皮渣中类胡萝卜素的提取及稳定性研究[D]. 兰州:甘肃农业大学, 2013.
[19] 周广志. 枸杞酒发酵对类胡萝卜素的变化影响研究[D]. 银川: 宁夏大学, 2015.
[20] 张惠玲. 低温留糖发酵半甜型枸杞酒的研究[J]. 中国酿造, 2008, 27(4): 53-55. DOI:10.3969/j.issn.0254-5071.2008.04.017.
[21] 杨天英. 枸杞酒生产工艺初探[J]. 中国酿造, 2005, 24(12): 51-53. DOI:10.3969/j.issn.0254-5071.2005.12.016.
[22] 陈英. 酒产品中低含量总糖和还原糖的快速检测方法[J]. 广州化工, 2015, 43(24): 147-148. DOI:10.3969/j.issn.1001-9677.2015.24.055.
[23] VIRÁG D, KISS A, FORGÓ P, et al. Study on Maillard-reaction driven transformation and increase of antioxidant activity in lysine fortified biscuits[J]. Microchemical Journal, 2013, 107: 172-177. DOI:10.1016/j.microc.2012.06.018.
[24] 周广志, 王琦, 张惠玲. 枸杞汁发酵预处理条件对枸杞类胡萝卜素的影响[J]. 北方园艺, 2015(13): 149-152. DOI:10.11937/ bfyy.201513043.
[25] 王欢, 金哲雄, 温美佳, 等. 不同产地宁夏枸杞活性成分比较研究[J].现代中药研究与实践, 2014(6): 21-25. DOI:10.13728/j.1673-6427.2014.06.006.
[26] 王琦, 张惠玲, 周广志. 采用HS-GC-MS法对枸杞汁发酵前后香气成分的比较分析[J]. 酿酒科技, 2015(8): 101-104. DOI:10.13746/ j.njkj.2014535.
[27] 吴桂君. 发酵型枸杞酒中挥发酸稳定性研究[J]. 安徽农业科学, 2012, 40(36): 17718-17719. DOI:10.3969/j.issn.0517-6611.2012.36.104.
[28] 杨虹琦. 不同产区烤烟中质体色素及降解产物的研究[J]. 西南农业大学学报, 2004, 26(5): 640-644. DOI:10.3969/j.issn.1673-9868.2004.05.033.
[29] 韦广鑫, 杨笑天, 周永文, 等. 葡萄酒中酯类化合物研究进展[J]. 食品工业科技, 2015, 36(14): 394-399. DOI:10.13386/j.issn1002-0306.2015.14.073.
[30] 王孝荣. 响应面优化枸杞色素提取工艺及稳定性研究[J]. 西南师范大学学报(自然科学版), 2013, 38(8): 108-113. DOI:10.3969/ j.issn.1000-5471.2013.08.023.
[31] GIOVANNUCCI E, ASCHERIO A, RIMM E B, et al. Intake of carotenoids and retinol in relation to risk of prostate cancer[J]. Journal of the National Cancer Institute, 1995, 87: 1767-1776. DOI:10.1093/ jnci/87.23.1767.
Effect of Main Metabolites on Carotenoids Degradation during the Fermentation of Chinese Wolfberry Wine
LIU Ya, LIU Jianhua, ZHANG Huiling*, QI Xiaoqin, LI Jinpeng, FU Lixia, WANG Xiaochang
(School of Agriculture, Ningxia University, Yinchuan 750021, China)
Abstract:In this paper, Chinese wolfberries were inoculated with yeast and fermented to produce a wine. High performance liquid chromatography (HPLC) and gas chromatography (GC) were used to analyze the contents of the main metabolites alcohols, esters, carboxylic acids, aldehydes and ketones as well as changes in carotenoid content before and after fermentation. On the basis of the obtained data, we established a model wine system to elucidate the effects of various metabolites on carotenoid content and further to determine the most important factor affecting carotenoid degradation. The results showed that carboxylic acids were the main factors affecting the degradation of carotenoids, followed by aldehydes and ketone. Esters and alcohols had a minimal impact.
Key words:Chinese wolfberry wine; fermentation; carotenoids; degradation
DOI:10.7506/spkx1002-6630-201714006
中图分类号:TS26
文献标志码:A
文章编号:1002-6630(2017)14-0036-06
引文格式:刘亚, 刘建花, 张惠玲, 等. 枸杞酒发酵主要代谢产物对类胡萝卜素降解的影响[J]. 食品科学, 2017, 38(14): 36-41.
DOI:10.7506/spkx1002-6630-201714006. http://www.spkx.net.cn
LIU Ya, LIU Jianhua, ZHANG Huiling, et al. Effect of main metabolites on carotenoids degradation during the fermentation of Chinese wolfberry wine[J]. Food Science, 2017, 38(14): 36-41. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201714006. http://www.spkx.net.cn
收稿日期:2016-08-02
基金项目:国家自然科学基金地区科学基金项目(31360402)
作者简介:刘亚(1991—),女,硕士,研究方向为微生物发酵。E-mail:ly2542704345@163.com
*通信作者:张惠玲(1963—),女,教授,学士,研究方向为生物工程、微生物发酵。E-mail:zhl5792@163.com