表1 米酒感官评价标准
Table 1 Criteria for sensory evaluation of rice wine
赵婷婷1,卢倩文1,宋菲菲1,徐顾榕1,蔡 婷1,向文良1,*,朱建清2
(1.西华大学食品与生物工程学院,四川省食品生物技术重点实验室,古法发酵(酿造)生物技术研究所,四川 成都 610039;2.四川农业大学水稻研究所,四川 成都 611130)
摘 要:从传统米酒曲中筛选到1 株具有潜在应用价值的产香真菌ZT018,经形态学和18S rRNA鉴定为印度毛霉(Mucor indicus)。协同米根霉发酵米酒(记为MIX)时,ZT018能够迅速成为MIX中的优势菌,其形态也随发酵进行逐渐由菌丝态转向更利于各种香气成分生成的酵母态。顶空固相微萃取和气相色谱-质谱联用法对MIX的检测揭示:在整个发酵过程中,米酒主体香气中的乙酸苯乙酯、棕榈酸乙酯、异戊醇和2-苯乙醇在MIX中的含量均比纯种米根霉发酵米酒(记为SIM)有显著提高;另外,MIX中还发现了异丁醇、丙酸和柠檬烯等能够改善酒体香气融合和协调的其他香气成分。感官分析表明:印度毛霉ZT018协同米根霉发酵5~7 d的米酒品质最佳。此时,MIX中乙酸苯乙酯、棕榈酸乙酯、异戊醇和2-苯乙醇的含量分别为5.270~5.750、2.270~4.877、4.375~8.419、39.983~63.046 mg/L,较SIM分别提高了30.03%~38.06%、46.83%~15.68%、28.45%~23.81%和55.60%~22.91%。综合比较理化指标和感官分析结果,印度毛霉ZT018协同米根霉发酵的米酒品质更优,对提高米酒的香气质量有重要意义。
关键词:米酒;印度毛霉;挥发性香气物质;顶空固相微萃取;气相色谱-质谱联用法
米酒是以糯米为原料,经微生物发酵而成的酒精型饮料,不仅香气怡人、风味独特,而且还含有丰富的营养物质[1]。众所周知,米酒品质直接决定了消费者对产品的接受性和喜爱程度,其中微生物主导的代谢活动是决定米酒品质的关键因素[2]。在发酵过程中,米酒中的微生物与其代谢产物的相互作用导致发酵体系中各种物质形态不断产生和消失,进而形成了米酒的风格特征[3]。因此,米酒发酵微生物对米酒品质形成起着决定性作用。
传统米酒曲生产主要以自然接种为主,尽管发酵的米酒风味柔和,但其制曲过程易受杂菌的侵害,因而导致产品质量稳定性差、安全性低[4];商业酒曲发酵的米酒质量稳定、食用安全,但单一的发酵微生物导致了米酒风味欠佳[5]。因此,利用功能性微生物弥补商业酒曲的不足成为改善商品米酒风味、确保产品品质的最佳途径之一[6-8]。印度毛霉(Mucor indicus)是一种双晶态、安全性高的非致病性真菌,广泛存在于各种淀粉类传统发酵食品中。除高产酒精和耐受酒精之外[9-10],印度毛霉还较好地展现了米酒中某些特征性风味物质的生成能力,如:2-苯乙醇、异戊醇、柠檬烯等[11]。然而,目前该菌株在米酒中的应用研究较少[12]。
因此,本研究拟从传统酒曲中筛选产香真菌,并将其作为功能性微生物协同米根霉发酵米酒,通过发酵过程中的微生物动力学、米酒中理化因子、挥发性香气物质与感官品质等分析,评估其对米根霉发酵米酒的影响,以期为产香真菌协同米根霉在米酒生产中的应用提供一定的理论基础。
1.1 材料、试剂与培养基
糯米、传统米酒曲 市售;安琪纯种米根霉酒曲湖北安琪生物集团有限公司。
3,5-二硝基水杨酸、苯酚 山东西亚公司;正丙醇、甲醇、2-辛醇(均为色谱纯)、18909 Calcofluor White Stain(CFW) 美国Sigma公司。
制曲培养基:糯米粉碎后过60 目筛,称取300 g用纱布包好,于蒸笼蒸30 min,冷却后加水20%~25%,搅拌均匀后过20 目筛,分装于100 g/500 mL的三角瓶中,121 ℃灭菌20 min;马铃薯葡萄糖液体培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、孟加拉红培养基按文献[13]配制。
1.2 仪器与设备
Biometra聚合酶链式反应(polymerase chain reaction,PCR)仪 德国耶拿分析仪器有限公司;ECLIPSE Ti倒置显微镜 日本Nikon公司;GC-2010气相色谱(配氢火焰离子检测器和Rtx-Wax毛细管柱(30 m×0.25 mm,0.25 μm))、QP2010 Plus气相色谱-质谱联用仪 日本岛津公司;固相微萃取针头75 μm CAR/PDMS、SPME手动进样手柄 美国Supelco公司;色谱柱DB-5MS(30 m×0.25 mm,0.25 μm) 安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 产香真菌的筛选
取10 g粉碎的传统酒曲于90 mL无菌生理盐水中,振荡摇匀,10 倍梯度稀释至适当浓度后均匀涂布于PDA培养基,30 ℃培养2 d,划线纯化单菌落。
纯化后的菌种接种至PDA斜面,于30 ℃培养至孢子大量形成,用无菌水冲洗后收集于锥形瓶中,制成5×105CFU/mL的孢子悬液。以2%的接种量接种至马铃薯葡萄糖液体培养基中,30 ℃、180 r/min培养2 d,然后组织有品评经验的品评员(男10 名,女10 名)对各菌株发酵液的气味效果进行评价,选取发酵液呈明显香气的菌株进行后续分析。
1.3.2 菌株的鉴定
参照《真菌鉴定手册》对产香菌株进行形态学鉴定[14],同时根据李可等[15]的方法提取菌株DNA,PCR扩增18S rRNA。扩增引物为18S-F(5’-AACCTGGTTGATCCTGCCAGT-3’)和18S-R(5’-TGATCCTTCTGCAGGTTCACCTAC-3’)。扩增条件:95 ℃预变性5 min,95 ℃变性1 min、55 ℃退火1 min、72 ℃延伸2 min,35 个循环后72 ℃保持10 min。扩增产物连接到pGM-T载体后克隆入感受态细胞E. coli DH5α中,提取重组质粒对18S rRNA测序。所得序列提交至NCBI进行序列比对,利用MEGA 5.0软件构建系统发育树。
1.3.3 米酒的酿造
复合酒曲的制备:接种产香真菌孢子悬液至制曲培养基并搅拌均匀,30 ℃恒温培养2~3 d至米粉结饼。将产香真菌曲饼(约2.52×107CFU/g)与安琪纯种米根霉酒曲(约1.24×105CFU/g)按质量比1∶1混合,粉碎制备复合酒曲。
米酒酿造工艺流程:糯米→分选、清洗→浸泡→蒸煮糊化→冷却→拌曲(质量分数0.4%)→糖化发酵(28 ℃、3 d)→后发酵(15 ℃、12 d)→成品。
1.3.4 发酵过程分析
分别对发酵1、3、5、7、10、15 d的米酒样品进行微生物、理化因子、挥发性香气物质和感官分析。
1.3.4.1 微生物分析
参照GB 478915—2010《食品微生物学检验 霉菌和酵母计数》对米酒中的产香真菌和米根霉进行计数。同时取适当浓度的样液于洁净载玻片上,添加1 滴CFW和 1 滴10% KOH溶液,盖上盖玻片静置1 min后,于荧光显微镜下观察产香真菌的形态[16]。
1.3.4.2 理化因子分析
总酸含量测定参照GB/T 12456—2008《食品中总酸的测定》进行;米酒中还原糖含量采用3,5-二硝基水杨酸比色法测定[17];乙醇含量测定采用气相色谱法[18],以正丙醇为内标物,待测样品经色谱级甲醇稀释2 倍后注入色谱柱[19],色谱条件:色谱柱为Rtx-Wax毛细管柱(30 m×0.25 mm,0.25 μm);载气为He,流速1.0 mL/min;初始温度45 ℃保持5 min,以3 ℃/min升温至60 ℃并保持3 min,最后以20 ℃/min升温至200 ℃,保持5 min;进样口温度200 ℃;分流比1∶20。
1.3.4.3 挥发性香气物质分析
香气物质富集:在15 mL顶空瓶中加5 mL样品、2 g氯化钠和2-辛醇(终质量浓度为15.2 mg/L)内标,加盖密封,50 ℃水浴平衡10 min后,将老化好的固相微萃取头插入顶空瓶吸附30 min。萃取完成后,于气相色谱进样口250 ℃解吸4 min[20]。
气相色谱-质谱条件:色谱柱为DB-5MS(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;程序升温40 ℃保持3 min,以6 ℃/min升温至230 ℃并保持10 min;以He为载气,流速1.0 mL/min,不分流。电子电离源;电子能量70 eV;离子源温度230 ℃,接口温度250 ℃;扫描范围m/z 40~400[21]。
数据分析:由气相色谱-质谱分析得到的质谱数据经计算机在NIST、Wiley检索比对,要求匹配度大于800
(
最大值为1 000)。同时以2-辛醇为内标,采用半定量的方法计算各挥发性物质含量[20]。
1.3.4.4 感官评定
组织有品评经验的品评员(男10 名,女10 名)对米酒色泽、香气及口感进行感官评定[22],评定标准按表1进行评分,评定分数为所有品评员的评分均值。
表1 米酒感官评价标准
Table 1 Criteria for sensory evaluation of rice wine

2.1 菌株筛选与形态特征
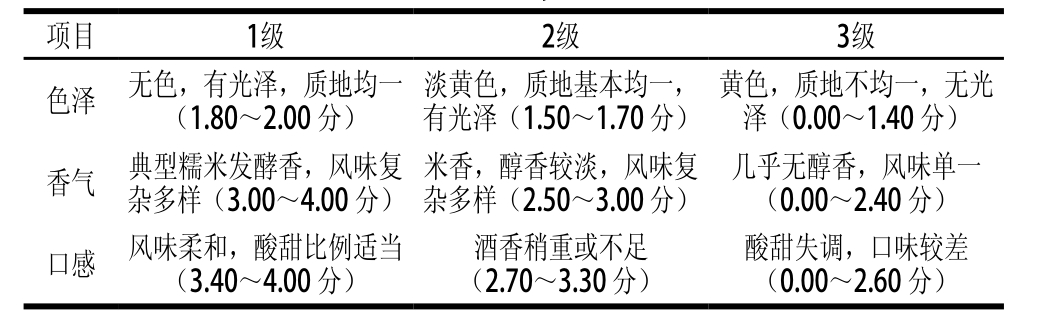
从传统米酒曲中筛选到1 株产香明显的霉菌,命名为ZT018。在PDA培养基上,该菌菌丝扩散生长,随着培养时间延长菌丝逐渐由初期的白色变成淡黄色(图1A),并有部分黑色孢子出现。在显微镜下,营养菌丝无隔(图1B),菌丝顶端有球形孢子囊,表面光滑,无囊托,孢囊孢子椭球形(图1C)。依据《真菌鉴定手册》[14]将其初步鉴定为毛霉菌。
图1 菌株ZT018的菌落形态(A)及菌丝(B)、孢子囊(C)显微特征(×400)
Fig. 1 Microscopic characteristics and colony morphology of strain ZT018 (× 400)
2.2 分子鉴定与系统发育树构建
真菌在自然界种类繁多,个体多态性明显。按照传统形态学、生理生化特点等特征对真菌鉴定常会出现假阳性或假阴性的结果。随着分子生物学技术的不断发展,真菌的鉴定逐渐转向分子生物学技术,其中18S rRNA是真菌种、属系统分类最常见的技术之一[23]。为了明确ZT018的分类学地位和系统发育关系,对其进行18S rRNA序列分析,并利用MEGA 5.0软件构建系统发育树。结果表明:ZT018的18S rRNA与印度毛霉DSM2185和FJ-M-5的18S rRNA相似性达到100%。Schaechter等[23]认为当18S rRNA的序列同源性不小于97%时可以认为是一个属,序列同源性不小于98%时则可以认为是一个种。菌株ZT018及其相近种的18S rRNA的系统发育树进一步表明:ZT018在18S rRNA系统发育上属于毛霉属,与印度毛霉DSM2185和FJ-M-5具有较大的亲缘关系(图2)。结合ZT018的形态特征,将其鉴定为印度毛霉。

图2 菌株ZT018基于18S rRNA 基因序列的系统发育树
Fig. 2 Phylogenetic tree of strain ZT018 based on 18S rRNA gene sequence
2.3 发酵动力学分析
表2 米酒发酵中微生物的数量变化
Table 2 Changes in the quantity of microorganisms in rice wine during fermentation
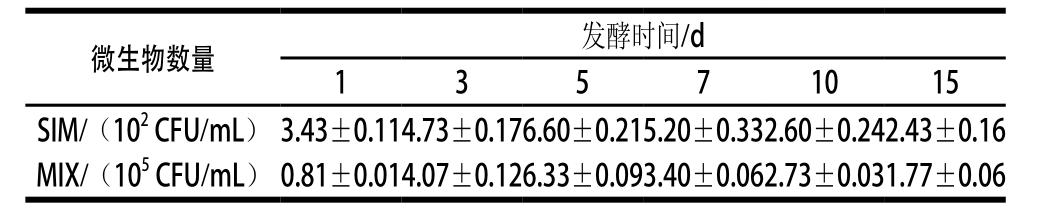
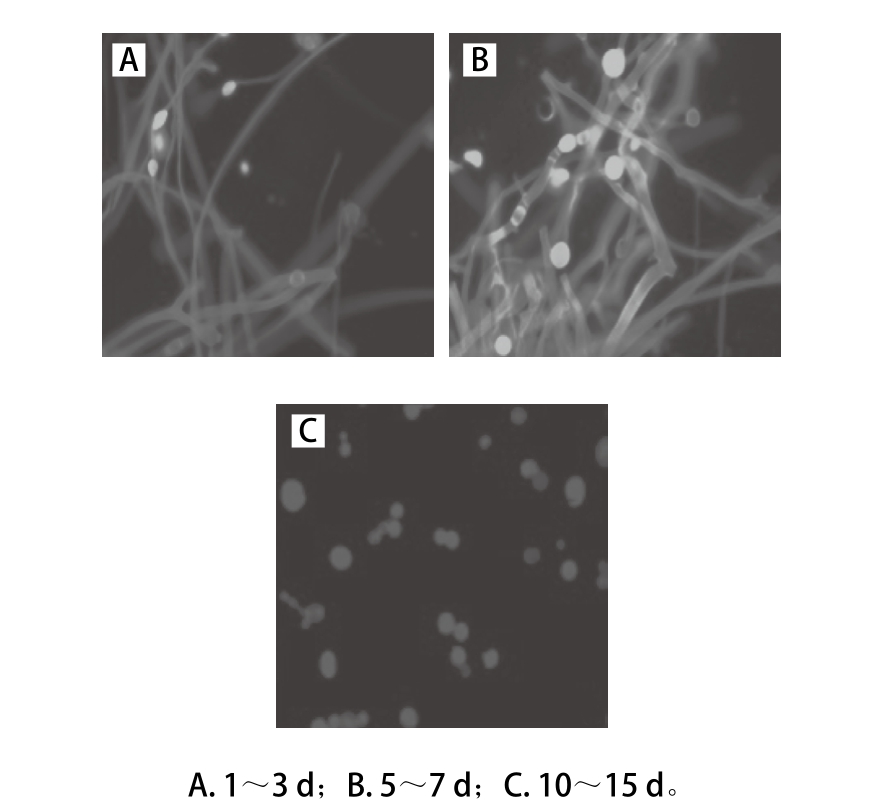
图3 MIX米酒发酵过程中印度毛霉荧光显微镜下的细胞形态(×400)
Fig. 3 Morphology of M. indicus under fluorescence microscope during MIX fermentation (×400)
米酒发酵中,微生物对米酒的品质形成具有重要的作用[1]。微生物计数发现:复合酒曲发酵米酒(记为MIX)与纯种米根霉酒曲发酵米酒(记为SIM)中的微生物在动力学上表现出相似趋势,即二者在数量上均在第5天达到最大值,随后降低,最后趋于稳定(表2)。但在相同发酵时间,二者中微生物数量差异巨大,MIX中菌落数为(0.81~6.33)×105CFU/mL,而SIM中菌落数为(2.43~6.60)×102CFU/mL。同时,进一步的研究表明:印度毛霉是MIX中的优势种,在1~3 d样品中它主要以菌丝态存在,5~7 d酵母态增多,而10~15 d几乎全部是酵母态(图3A~C)。Song Feifei等[11]对双晶态印度毛霉的代谢研究发现:不同形态的印度毛霉细胞其代谢不同,其中酵母态的印度毛霉细胞更利于发酵酒中香气物质如2-苯乙醇、异戊醇、柠檬烯等的形成。
米酒发酵是一个边糖化边发酵的过程,一方面霉菌分泌的糖化酶对淀粉进行糖化,另一方面糖化产生的糖供酒精发酵[24]。在淀粉质原料的发酵过程中,郑国斌[25]、Karimi[12]等分别对米根霉和印度毛霉的研究表明:米根霉表现出了较强的糖化能力,印度毛霉具有较强的乙醇转化能力。同时,由于印度毛霉是MIX中的优势菌,因此在整个发酵过程中MIX体系中残留的还原糖较SIM低,而乙醇含量较SIM高(图4A、B)。发酵第3天,两种米酒中残留还原糖的含量达最大值,其中MIX为28.47 g/L,SIM为32.44 g/L。发酵结束时,MIX中还原糖残留降为7.03 g/L,较SIM低11.8%,而乙醇含量达12.75 mL/100 mL,比SIM高8.1%。此外,米酒发酵过程中还产生有机酸,如乳酸、丁二酸等。与乙醇的变化趋势类似,随发酵进行米酒中的总酸不断增加,在发酵10 d后逐渐趋于稳定(图4C)。
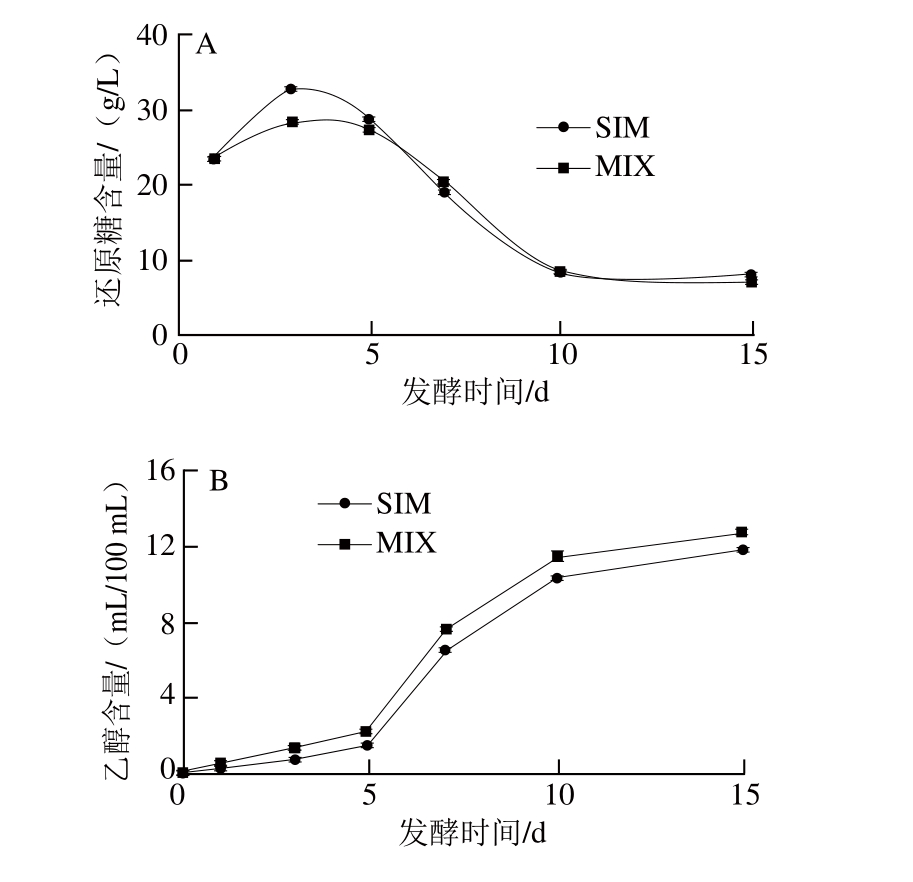
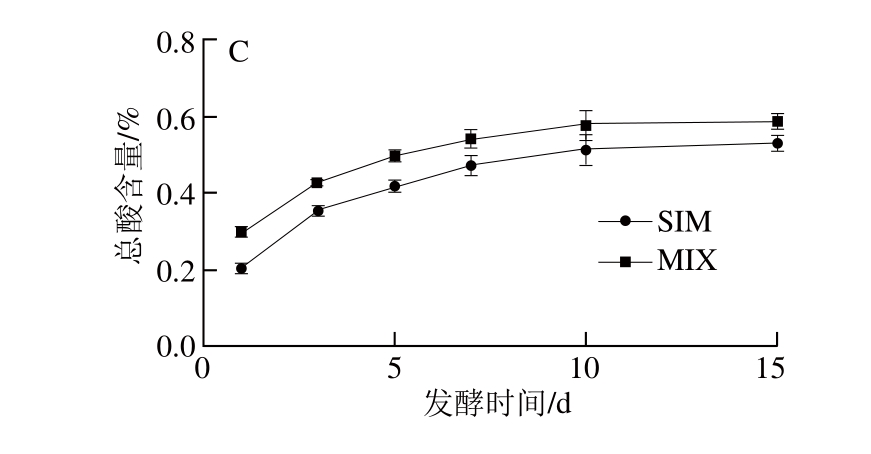
图4 米酒发酵过程中还原糖(A)、乙醇(B)和总酸(C)含量的变化
Fig. 4 Fermentation kinetic profiles of reducing sugar, ethanol and total acids of rice wine
2.4 挥发性香气物质分析
采用顶空固相微萃取和气相色谱-质谱联用法在SIM和MIX两种米酒中共检测到31 种香气物质,其中酯类16 种、醇类7 种、酸类2 种、醛类4 种及萜烯类2 种(图5)。发酵第1天时,两种米酒的主体香气基本形成,主要为乙酸苯乙酯、辛酸乙酯、癸酸乙酯、棕榈酸乙酯、异戊醇和2-苯乙醇;随着发酵进行,SIM和MIX中的香气物质种类和含量呈现不同程度的变化,与SIM相比,MIX香气物质种类和含量更丰富(图5)。
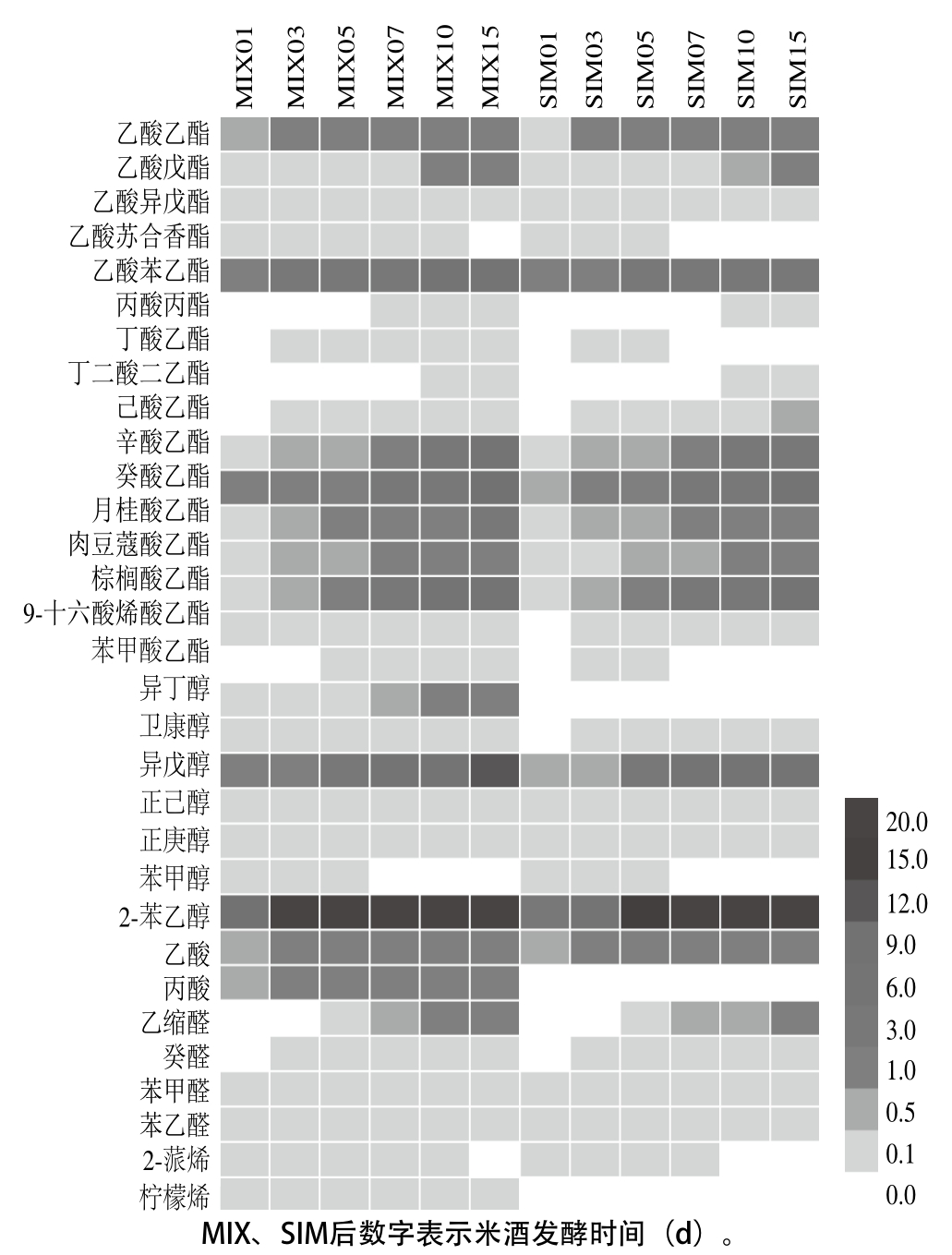
图5 米酒发酵过程中挥发性香气物质谱
Fig. 5 Volatile aroma compound profiles in rice wine during fermentation
挥发性香气物质是影响米酒品质的重要原因,进一步对SIM和MIX的分析发现:挥发性香气物质总含量在发酵过程变化较大,MIX从19.131 mg/L增加到了180.071 mg/L,SIM从9.635 mg/L增加到了137.113 mg/L(表3)。与SIM相比较,发酵结束时MIX中香气物质总含量增加了31.33%,其中总酯、总醇和总酸分别增加了19.70%、34.88%和84.14%。
酯类是米酒中种类最多的香气物质,也是其呈现特殊花香和果香味的重要物质基础[26]。其中,米酒中的主要酯类物质是乙酸苯乙酯(蜜甜玫瑰香)、辛酸乙酯(白兰地香)、癸酸乙酯(椰子香)和棕榈酸乙酯(奶油香)等[20]。发酵结束时,在MIX中这些酯类的含量分别达6.921、6.438、9.804、7.955 mg/L,较SIM分别提高了36.59%、14.68%、10.78%和22.76%。在SIM和MIX中辛酸乙酯在前7 d含量增加缓慢,之后含量增加较快;癸酸乙酯和棕榈酸乙酯则在5 d后呈明显增加趋势,而其他酯类物质整体较平稳(表3)。
醇类物质是米酒中含量相对较高的另一类香气物质,主要来源于微生物发酵和氨基酸代谢[26]。异戊醇和2-苯乙醇是米酒中的主要醇类,对米酒风味和口感的形成有不可忽视的作用[20]。其中,异戊醇呈香蕉味,可以柔和米酒中苦味氨基酸的苦味[20]。2-苯乙醇是米酒中的特征性香气物质,具有清甜的玫瑰香味,落口有绵甜清爽之感[27]。发酵结束时,在MIX中它们的含量分别达12.341 mg/L和119.671 mg/L,较SIM分别提高了3.742 mg/L和29.601 mg/L(表3)。在MIX中,其他醇类,如异丁醇、正己醇、正庚醇等也有所提高。
相对酯类和醇类,酸类、醛类、萜烯类等香气物质的含量明显较少,但它们对酒体风味的形成仍具有重要的作用[28-29]。相比SIM,MIX中还检出了丙酸(果香奶香)。乙缩醛(芳香)、癸醛(甜香)、苯甲醛(苦杏仁)和苯乙醛(风信子)等醛类对酒体香气的融合和协调也有重要作用[29],其中乙缩醛在发酵第5天检出,且在发酵过程其含量变化较明显,而其他醛类则无明显差异。萜烯类物质能赋予米酒特殊的香气,在MIX中还检出了SIM中未检出的柠檬烯(清香柠檬)[30]。
表3 发酵米酒中挥发性香气物质及其含量
Table 3 The contents of volatile aroma compounds in rice wine during fermentation

续表3 mg/L
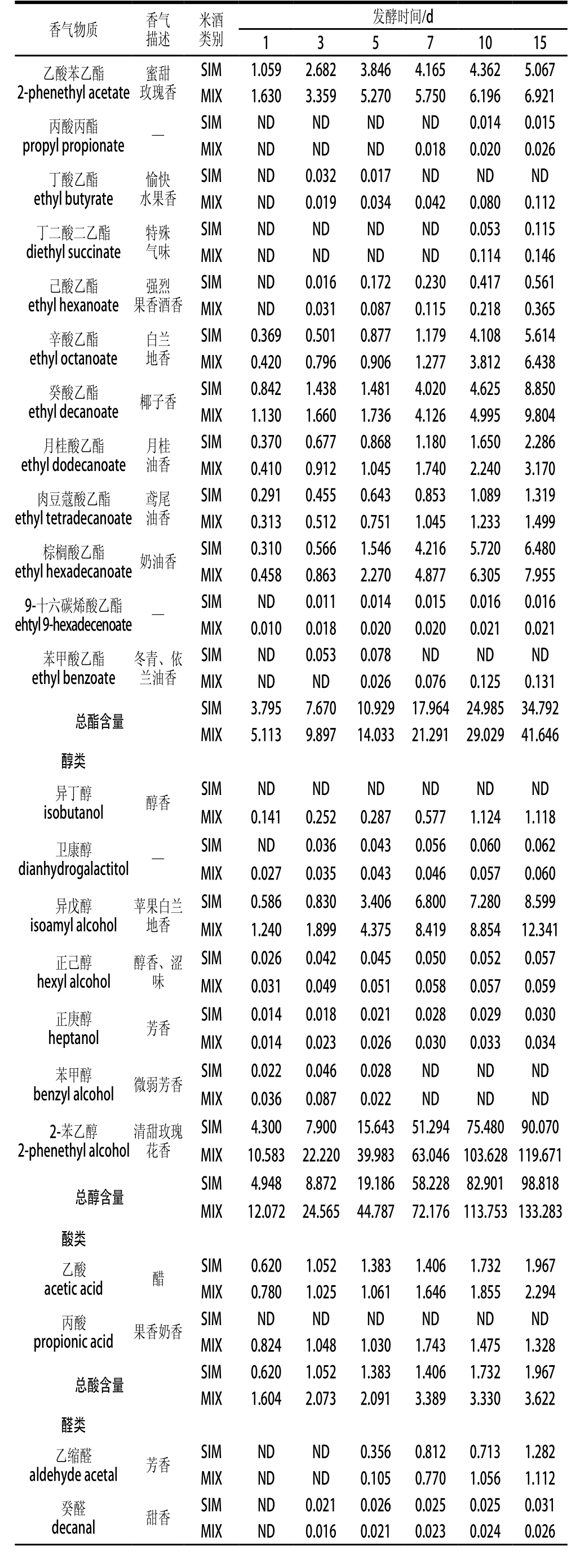
续表3 mg/L
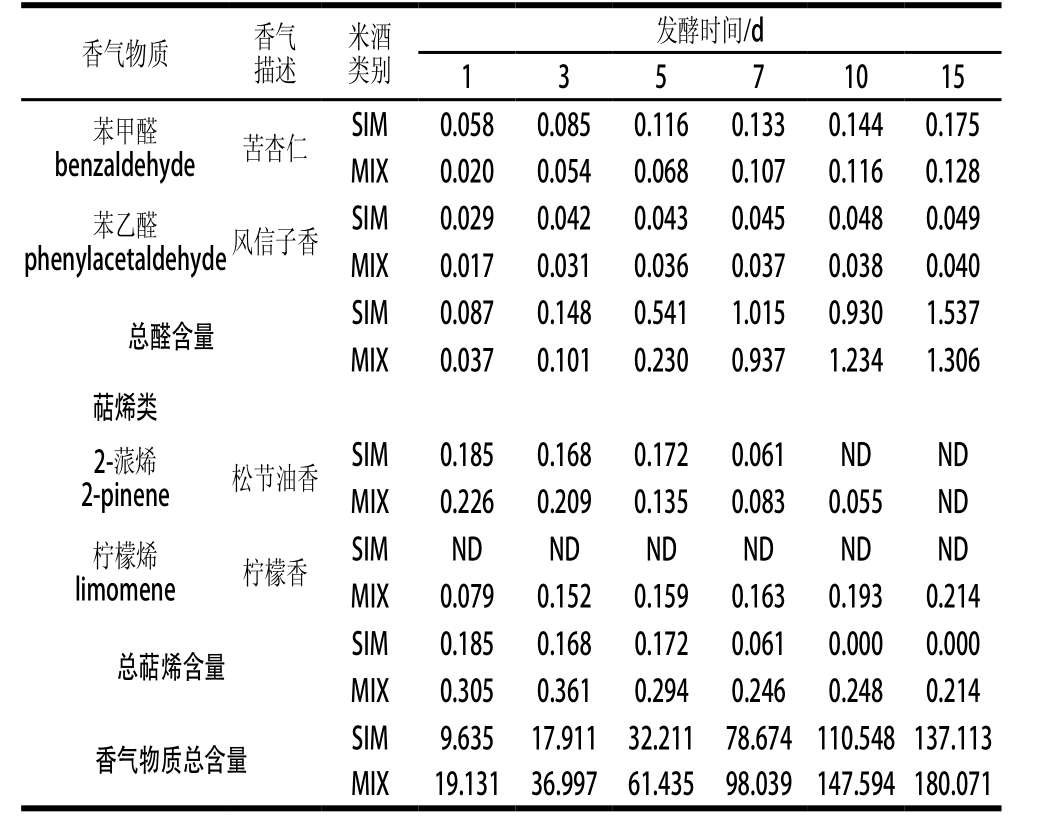
注:ND.未检测出;—.未显示香气。
2.5 米酒的感官评价
4 米酒感官评分结果
Table 4 Sensory evaluation of rice wine during fermentation
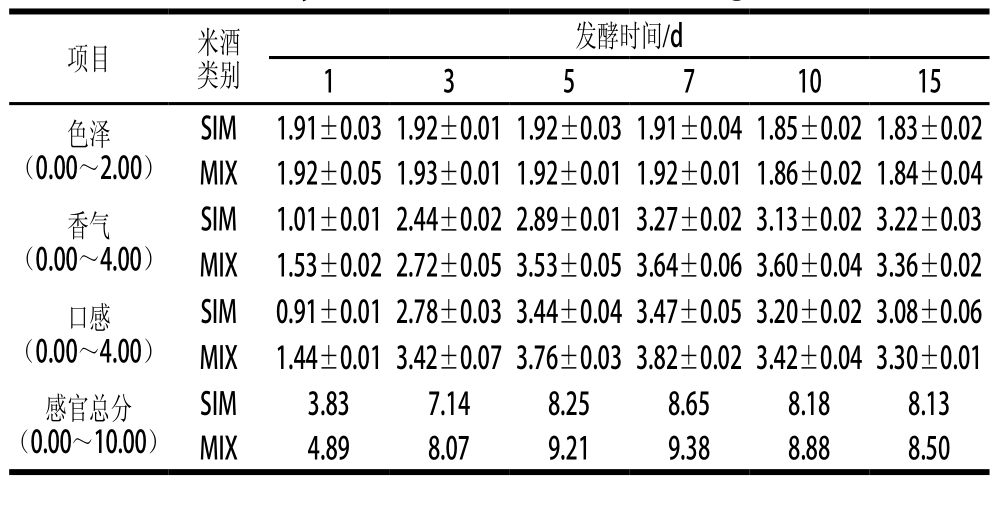
在整个发酵过程中,米酒的感官品质不断变化。在起始阶段,由于微生物代谢较弱,米酒中的各种风味物质积累较少,米酒的食用品质较差[5]。随着发酵进行,米酒中微生物增殖和代谢增强,醇类、酸类和其他香气物质的含量和种类逐渐增加(表3),米酒的食用品质逐渐提高。依据宁洁等[22]推荐的米酒感官评定标准发现:SIM和MIX在28 ℃发酵3 d后有明显的米香、醇香,基本具备了米酒的风味特征。进一步15 ℃低温发酵12 d,SIM和MIX中的风味物质种类和含量进一步积累(表3),发酵5~7 d的米酒香气更浓郁,口感更协调(表4)。此时,MIX中还原糖含量为27.20~20.12 g/L,乙醇含量为2.22~7.56 mL/100 mL,总酸含量为0.50%~0.54%;主体香气成分中的乙酸苯乙酯、棕榈酸乙酯、异戊醇和2-苯乙醇的含量分别为5.270~5.750、2.270~4.877、4.375~8.419 、39.983~63.046 mg/L,较SIM分别提高了30.03%~38.06%、46.83%~15.68%、28.45%~23.81%和55.60%~22.91%。但随着低温发酵时间延长,米酒中的还原糖含量降低、乙醇和总酸含量升高(图2)以及某些呈味物质的增加(图5和表3),米酒中呈香物质的平衡被破坏,因而米酒的感官品质降低(表4)。但相较于SIM,MIX是混菌发酵,酶系与代谢更复杂,因此各阶段的MIX感官评分优于SIM,表明:印度毛霉作为发酵辅助剂能够很好地协同纯种米根霉发酵米酒,改善米酒品质。
从传统酒曲中筛选到1 株双晶态产香真菌印度毛霉ZT018,将其作为功能性微生物协同米根霉发酵米酒,能够明显改善纯种米根霉发酵米酒的品质。运用顶空固相微萃取和气相色谱-质谱联用法发现:印度毛霉ZT018协同米根霉发酵的米酒中,除主体香气成分如:癸酸乙酯、棕榈酸乙酯、辛酸乙酯、乙酸苯乙酯、异戊醇和2-苯乙醇等的含量高于纯种米根霉发酵米酒外,还发现有异丁醇、丙酸、柠檬烯等能够明显改善酒体香气融合和协调的一些风味物质。因此,印度毛霉ZT018有望成为高品质米酒发酵的增香辅助菌,同时也为生产中应用印度毛霉ZT018协同米根霉发酵米酒、提高产品品质提供了前期基础和理论依据。
参考文献:
[1] 王玉荣, 张俊英, 胡欣洁, 等. 湖北孝感和四川成都地区来源的酒曲对米酒滋味品质影响的评价[J]. 食品科学, 2015, 36(16): 207-210. DOI:10.7506/spkx1002-6630-201516038.
[2] 胡欣洁, 刘云. 苦荞米酒发酵工艺条件的优化[J]. 食品研究与开发, 2013, 34(3): 43-47. DOI:10.3969/j.issn.1005-6521.2013.03.012.
[3] PARK K H, LIU Z B, PARK C S, et al. Microbiota associated with the starter cultures and brewing process of traditional Hong Qu glutinous rice wine[J]. Food Science and Biotechnology, 2016, 25(3): 649-658. DOI:10.1007/s10068-016-0115-6.
[4] L☒ Xucong, HUANG Ruolan, CHEN Fang, et al. Bacterial community dynamics during the traditional brewing of Wuyi Hong Qu glutinous rice wine as determined by culture-independent methods[J]. Food Control, 2013, 34(2): 300-306. DOI:10.1016/j.foodcont.2013.05.003.
[5] 况启生, 李安明, 戴余军, 等. 孝感民间传统米酒菌株的分离、鉴定与筛选、培养[J]. 食品科学, 2003, 24(9): 94-96. DOI:10.3321/ j.issn:1002-6630.2003.09.022.
[6] DUARTE W F, AMORIM J C, SCHWAN R F. The effects of coculturing non-Saccharomyces yeasts with S. cerevisiae on the sugar cane spirit (cacha☒a) fermentation process[J]. Antonie van Leeuwenhoek, 2013, 103(1): 175-194. DOI:10.1007/s10482-012-9798-8.
[7] GARAVAGLIA J, SCHNEIDER R C, MENDES S D, et al. Evaluation of Zygosaccharomyces bailii BCV 08 as a co-starter in wine fermentation for the improvement of ethyl esters production[J]. Microbiological Research, 2015, 173: 59-65. DOI:10.1016/ j.micres.2015.02.002.
[8] VIANA F, GIL J V, VALLES S, et al. Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture of Hanseniaspora osmophila and Saccharomyces cerevisiae[J]. International Journal of Food Microbiology, 2009, 135(1): 68-74. DOI:10.1016/j.ijfoodmicro.2009.07.025.
[9] MILLATI R, EDEBO L, TAHERZADEH M J. Performance of Rhizopus, Rhizomucor, and Mucor in ethanol production from glucose, xylose, and wood hydrolyzates[J]. Enzyme and Microbial Technology, 2005, 36(2): 294-300. DOI:10.1016/j.enzmictec.2004.09.007.
[10] KARIMI K, EMTIAZI G, TAHERZADEH M J. Production of ethanol and mycelial biomass from rice straw hemicellulose hydrolyzate by Mucor indicus[J]. Process Biochemistry, 2006, 41(3): 653-658. DOI:10.1016/j.procbio.2005.08.014.
[11] SONG Feifei, XIANG Wengliang. Mucor indicus: the novel bioconversion producer of L-phenylalanine into 2-phenylethanol[J]. Research Journal of Biotechnology, 2015, 10(9): 69-72.
[12] KARIMI K, ZAMANI A. Mucor indicus: biology and industrial application perspectives: a review[J]. Biotechnology Advances, 2013, 31(4): 466-481. DOI:10.1016/j.biotechadv.2013.01.009.
[13] 杜连祥, 路福平. 微生物学实验技术[M]. 北京: 中国轻工业出版社, 2014: 349-354.
[14] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 405-642.
[15] 李可, 范志刚, 王俊芳, 等. 浓香型白酒发酵黄水中微生物群落结构解析[J]. 食品与生物技术学报, 2015, 34(11): 1155-1161. DOI:10.3969/j.issn.1673-1689.2015.11.006.
[16] HARRINGTON B J, HAGEAGE G J. Calcofluor white: a review of its uses and applications in clinical mycology and parasitology[J]. Laboratory Medicine, 2003, 34(5): 361-367. DOI:10.1309/ eph2tdt8335gh0r3.
[17] 赵凯, 许鹏举, 谷广烨. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008, 29(8): 534-536. DOI:10.1021/ac60147a030.
[18] JUNG H, LEE S J, LIM J H, et al. Chemical and sensory profiles of makgeolli, Korean commercial rice wine, from descriptive, chemical, and volatile compound analyses[J]. Food Chemistry, 2014, 152: 624-632. DOI:10.1016/j.foodchem.2013.11.127.
[19] 张红雨, 宋曙辉, 周家华, 等. 紫山药低醇发酵饮料中乙醇含量的气相色谱法测定[J]. 食品工业科技, 2014, 35(1): 307-314. DOI:10.13386/j.issn1002-0306.2014.01.023.
[20] WANG Peixuan, MAO Jian, MENG Xiangyong, et al. Changes in flavour characteristics and bacterial diversity during the traditional fermentation of Chinese rice wines from Shaoxing region[J]. Food Control, 2014, 44: 58-63. DOI:10.1016/j.foodcont.2014.03.018.
[21] CAO Yu, XIE Guangfa, WU Chun, et al. A study on characteristic flavor compounds in traditional Chinese rice wine-Guyue Longshan rice wine[J]. Journal of the Institute of Brewing, 2010, 116(2): 182-189. DOI:10.1002/j.2050-0416.2010.tb00416.x.
[22] 宁洁, 赵新淮. 发酵米酒中一些霉菌和酵母的性质与应用研究[J].食品科技, 2008, 33(10): 5-9. DOI:10.13684/j.cnki.spkj.2008.10.015.
[23] SCHAECHTER M. 真核微生物[M]. 北京: 科学出版社, 2012: 363-365.
[24] YANG D, LUO X, WANG X. Characteristics of traditional Chinese shanlan wine fermentation[J]. Journal of Bioscience & Bioengineering, 2014, 117(2): 203-207. DOI:10.1016/j.jbiosc.2013.07.010.
[25] 郑国斌, 俞学锋, 李知洪, 等. 一种根霉菌及其应用以及米酒曲: 201210040937.8[P]. 2012-07-25.
[26] YU Haiyan, DAI Xin, YAO Guiyao, et al. Application of gas chromatographybased electronic nose for classification of Chinese rice wine by wine age[J]. Food Analytical Methods, 2014, 7(7): 1489-1497. DOI:10.1007/s12161-013-9778-2.
[27] 张彭湃, 杨生玉. 产酯酵母在黄酒生产中的应用及增香降度研究[J]. 食品科技, 2005, 30(7): 66-68. DOI:10.3969/ j.issn.1005-9989.2005.07.020.
[28] BERENGUER M, VEGARA S, BARRAJON E, et al. Physicochemical characterization of pomegranate wines fermented with three different Saccharomyces cerevisiae yeast strains[J]. Food Chemistry, 2016, 190: 848-855. DOI:10.1016/j.foodchem.2015.06.027.
[29] 江伟, 兰玉倩, 黄毅, 等. 固相微萃取与气相色谱-质谱联用法对不同酒龄黄酒的微量风味分析与应用[J]. 食品发酵与工业, 2011, 37(2): 144-149.
[30] WANG Jiaming, DIMITRA L C, KERRY L W, et al. Rosé wine volatile composition and the preferences of Chinese wine professionals[J]. Food Chemistry, 2016, 202: 507-517. DOI:10.1016/ j.foodchem.2016.02.042.
Screening of an Aroma-Producing Fungal Strain and Its Synergistic Effect with Rhizopus oryzae on Rice Wine Fermentation
ZHAO Tingting1, LU Qianwen1, SONG Feifei1, XU Gurong1, CAI Ting1, XIANG Wenliang1,*, ZHU Jianqing2
(1. Provincial Key Laboratory of Food Biotechnology of Sichuan, Institute of Ancient Brewing Technology, College of Food and Bioengineering, Xihua University, Chengdu 610039, China; 2. Rice Research Institute, Sichuan Agricultural University, Chengdu 611130, China)
Abstract:A fungal strain, ZT018, isolated from a traditional rice wine starter culture for its potential to produce aroma compounds was identified as Mucor indicus based on its 18S rRNA sequence and morphology. When cooperated with Rhizopus oryzae to ferment rice wine, the fungal isolate soon became the dominant genus, and its cellular morphology was also gradually transformed from a filamentous form to a yeast-like one which benefited the production of aroma compounds. In the rice wine fermented by a mixture of ZT018 and R. oryzae (MIX), the volatile aroma components were analyzed by headspace solid-phase micro-extraction coupled with gas chromatography-mass spectrometry (HS-SPME-GCMS). The results showed that among the primary volatile aroma compounds of MIX, the amounts of 2-phenethyl acetate, ethyl hexadecanoate, isoamyl alcohol and 2-phenethyl alcohol were significantly improved when compared with the one fermented by R. oryzae alone (SIM). Moreover, other volatile aroma compounds that could coordinate well with each other to improve the aroma, such as isobutanol, propionic acid and limomene, were also found in the MIX. The MIX fermented for 5–7 days exhibited the best sensory quality, and it had 2-phenethyl acetate, ethyl hexadecanoate, isoamyl alcohol and 2-phenethyl alcohol contents of 5.270–5.750, 2.270–4.877, 4.375–8.419 and 39.983–63.046 mg/L, respectively, which were increased by 30.03%–38.06%, 46.83%–15.68%, 28.45%–23.81% and 55.60%–22.91%, respectively, as compared with those in the SIM. Thus, the MIX had better quality than SIM, which will be of great significance to improve rice wine aroma.
DOI:10.7506/spkx1002-6630-201714007
中图分类号:TS261.1
文献标志码:A
文章编号:1002-6630(2017)14-0042-07
引文格式:赵婷婷, 卢倩文, 宋菲菲, 等. 1 株产香真菌的筛选及其协同米根霉对米酒发酵的影响[J]. 食品科学, 2017, 38(14): 42-48.
DOI:10.7506/spkx1002-6630-201714007. http://www.spkx.net.cn
ZHAO Tingting, LU Qianwen, SONG Feifei, et al. Screening of an aroma-producing fungal strain and its synergistic effect with Rhizopus oryzae on rice wine fermentation[J]. Food Science, 2017, 38(14): 42-48. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714007. http://www.spkx.net.cn
收稿日期:2016-07-30
基金项目:国家自然科学基金面上项目(31571935);四川省科技支撑计划项目(2016FZ0023);四川省教育厅重点项目(14ZA0110)
作者简介:赵婷婷(1992—),女,硕士研究生,研究方向为食品微生物过程学。E-mail:zttmoyu@sina.com
*通信作者:向文良(1973—),男,教授,博士,研究方向为中国西南地区特色发酵食品微生物过程学。
E-mail:biounicom@mail.xhu.edu.cn
Key words:rice wine; Mucor indicus; volatile aroma compounds; headspace solid-phase micro-extraction; gas chromatography-mass spectrometry