张佩佩1,牛会敏2,李苗云1,*,赵改名1,崔文明1,孙灵霞1
(1.河南省肉制品加工与质量安全控制重点实验室,河南农业大学食品科学技术学院,河南 郑州 450002;2.河南省产品质量监督检验院,河南 郑州 450004)
摘 要:研究甲型副伤寒沙门氏菌在不同介质中热失活规律,对接种108CFU/g甲型副伤寒沙门氏菌的不同介质进行55、63、72 ℃热处理,测定处理后样品中甲型副伤寒沙门氏菌的菌体浓度。应用DoseResp模型拟合在3 种温度下志贺氏菌的动力学模型,用D值(decimal reduction time)表示甲型副伤寒沙门氏菌在不同介质中的耐热情况。结果表明:甲型副伤寒沙门氏菌的热失活曲线运用DoseResp模型拟合较好,相关系数均在0.97以上。甲型副伤寒沙门氏菌在不同介质中的D值不同,在蛋白质和脂肪含量较高的灌肠肥瘦肉1∶1(m/m)中D值较大,相对耐热。55 ℃条件下热处理25.0 min,63 ℃热处理2.03 min,72 ℃热处理0.31 min后,一般肉制品中甲型副伤寒沙门氏菌均能被杀死。
关键词:甲型副伤寒沙门氏菌;热失活;动力学模型;D值
http://www.spkx.net.cn
甲型副伤寒沙门氏菌(Salmonella paratyphi A)是一种不产生芽孢,无荚膜的革兰氏阴性杆菌,能够引起急性消化道传染病。主要经过污染的水源和食物而暴发流行,甲型副伤寒分布中国各地,常年散发,以夏秋季最多,发病以儿童、青壮年较多。据统计,1997年以来,甲型副伤寒病例逐年升高,截止2000年,伤寒、甲型副伤寒的暴发疫情中甲型副伤寒占了约50%[1]。食品中杀菌的方法很多,包括物理方法、化学方法和生物方法等。热处理是商业应用的标准灭活方式,是食品工业最经济有效、最简便和使用最广泛的杀菌方法[2]。微生物杀菌研究中,预测微生物学结合微生物学、化学、统计学、数学以及计算机技术研究和建立不同环境因素影响下的失活参数模型,是能够缩减或取代为确保食品安全而进行的实验,已获得了广泛的应用[3-4]。
细菌菌株之间存在耐热性差异,其热失活曲线并不完全遵循对数线性关系,在拟合细菌热失活规律时,经常出现细菌对数图凸形、凹形以及S形曲线等非线性的现象[5]。DoseResp模型已被广泛用于生物学、医学、卫生学等诸多领域[6-8],王虎虎等[9]将此模型应用于拟合酸化亚氯酸钠对沙门氏菌和单增李斯特菌的热致死规律,发现可以很好的拟合pH 2.5条件下2 种致病菌的失活曲线。目前,有关单增李斯特菌、金黄色葡萄球菌、沙门氏菌等食源性致病菌的热失活的研究已有报道[10-12],而有关甲型副伤寒沙门氏菌在不同介质中热失活方面的研究较少。为了达到消毒且不损害食品品质的目的,工业上常用的灭菌方法是巴氏杀菌(一般在60~82 ℃),但是巴氏杀菌热处理程度比较低,杀菌后容易造成微生物的残存。结合其他致病菌的热失活特性的研究,研究了55、63、 72 ℃ 3 种温度热处理对不同介质中甲型副伤寒沙门氏菌的致死效果,用DoseResp模型拟合了甲型副伤寒沙门氏菌非线性失活曲线,建立了甲型副伤寒沙门氏菌的热失活模型,用D值比较了甲型副伤寒沙门氏菌在不同介质中的耐热性情况,为甲型副伤寒沙门氏菌的控制提供理论参考。
1.1 材料与试剂
本实验所用肉均购自河南漯河双汇集团。
甲型副伤寒沙门氏菌为本研究室从肉中分离,经过国标法生化鉴定、Vitek测定以及分子测序鉴定,鉴定结果是甲型副伤寒沙门氏菌ATCC9150,-80 ℃甘油管保存。
营养肉汤(nutrient broth,NB)、营养琼脂(nutrient agar,NA)、木糖赖氨酸脱氧胆盐琼脂(xylose lysine deoxycholate salt agar,XLD) 青岛高科园海博生物技术有限公司;氯化钠(分析纯) 天津市瑞金特化学品有限公司。
1.2 仪器与设备
HVE-50高压蒸汽灭菌锅 日本Hirayama公司;AESAP1068拍打式均质器 法国AES Chemunex公司;SW-CJ-2F超净工作台 苏州安泰空气技术有限公司;真空包装机 温州市大江真空包装机械有限公司;JA2003N电子天平 上海菁海仪器有限公司;DHP-9272型电热恒温培养箱、精密鼓风干燥箱 上海一恒科技有限公司;HH-501数显超级恒温水浴 金坛市杰瑞尔电器有限公司;THZ-C台式恒温振荡器 太仓市华美生化仪器厂。
1.3 方法
1.3.1 样品准备
取同一生产日期的熏煮火腿,紫外线照射30 min后去除外皮,无菌条件下将其绞碎,以每份(25.0±0.5) g进行真空封装。保存于-25 ℃,使用前置于4 ℃条件下解冻。
纯瘦肉和肥瘦肉按1∶1(m/m)灌肠是选择卫生检验合格的冷却猪瘦肉、肥膘,剔除可见脂肪和结缔组织,切成小块,用18.5 mm的孔板绞碎,将纯瘦肉和肥瘦肉1∶1分别称质量。低温腌制后斩拌,立即用灌肠机后肉糊充填到6路猪肠衣内,每15 cm左右打一个结,肠应该松紧适度,两指捏住相碰为宜,清洗后用钢针排气,65 ℃烘箱里烘烤60 min左右,然后在水温80~85 ℃之间,煮制时间40 min左右,自然冷却后,无菌条件下将其绞碎,以每份(25.0±0.5)g进行真空封装。保存于-25 ℃,使用前置于4 ℃条件下解冻。
1.3.2 菌悬液的制备
无菌操作条件下,将储存于-80 ℃条件下的志贺氏菌接种到NA平板上,37 ℃条件下培养24 h,挑取典型菌落至无菌的NB培养液中,37 ℃、150 r/min摇床上培养至稳定期(约109CFU/mL),得到的稳定期菌液稀释至108CFU/mL备用。
1.3.3 人工污染不同介质
参考文献:[13]的方法,无菌操作取2.5 mL稳定期稀释至108CFU/mL的菌液置于无菌真空袋样品中压成均匀片状,用真空包装机0.1 MPa抽真空,并封口并使其袋子厚度小于1 mm,以确保传热的统一。放在(37±1)℃的恒温培养箱培养18 h后备用。每一组温度时间的组合重复3 次。
1.3.4 营养肉汤中甲型副伤寒沙门氏菌热处理
甲型副伤寒沙门氏菌用营养肉汤为培养介质,取1 mL NB增菌液梯度稀释使菌液浓度为108CFU/mL,分装于无菌的1.5 mL离心管中。水浴锅55 ℃热处理24 min,时间间隔为3 min;63 ℃热处理12 min,时间间隔为3 min;72 ℃热处理1 min,时间间隔为10 s。加热时,将样品完全浸没热水中,按照预先设定的时间间隔,定时取出样品进行测定。热处理后的样品应立即放入预先准备好的冰水中以阻止其继续进行热失活过程。从设定的温度冷却至室温的时间小于10 s。
1.3.5 熏煮火腿中甲型副伤寒沙门氏菌热处理
用熏煮火腿作为介质,采用注射法进行人工污染,人工污染的菌液浓度为108CFU/g,注射剂量为每25 g样品注射2.5 mL菌液[15]。注射后37 ℃培养16 h。水浴锅55 ℃热处理80 min,时间间隔为5 min;63 ℃热处理12 min,时间间隔为3 min;72 ℃热处理70 s,时间间隔为10 s。其他同1.3.4节。
1.3.6 纯瘦肉灌肠中甲型副伤寒沙门氏菌热处理
用纯瘦肉灌肠作为介质,采用注射法进行人工污染,人工污染的菌液浓度为108CFU/g,样品搅碎称取25 g注射2.5 mL菌液[15],放入真空袋中压成片状,用真空包装机抽真空,并封口,37 ℃培养16 h。水浴锅55 ℃热处理90 min,时间间隔为5 min;63 ℃热处理12 min,时间间隔为2 min; 72 ℃热处理90 s,时间间隔为10s。其他同1.3.4节。
1.3.7 肥瘦肉1∶1灌肠中甲型副伤寒沙门氏菌热处理
用肥瘦肉1∶1灌肠作为介质,采用注射法进行人工污染,人工污染的菌液浓度为108CFU/g,样品搅碎称取25 g注射2.5 mL菌液[15],放入真空袋中压成片状,用真空包装机抽真空,并封口,37 ℃培养16 h。水浴锅55 ℃热处理150 min,时间间隔为5 min;63 ℃热处理18 min,时间间隔为3 min;72 ℃热处理150 s,时间间隔为10 s。其他同1.3.4节。
1.3.8 活菌计数
采用稀释涂布法进行活菌计数,37 ℃条件下培养18~24 h。
1.3.9 热失活模型建立及模型验证
热失活模型利用Origin 8.0软件建立DoseResp模型拟合,得出甲型副伤寒沙门氏菌在不同介质中热失活曲线,并得到相应的模型参数。DoseResp模型如式(1)。
式中:y为甲型副伤寒沙门氏菌的残存菌体浓度/(CFU/g);x为热处理时间/min;A1、A2、x0、p为模型参数。
应用建立的甲型副伤寒沙门氏菌的热失活动力学模型求得72 ℃下的预测值,与在72 ℃热失活实验中实际检测的甲型副伤寒沙门氏菌进行比较,采用准确度(accuracy factor,Af)和偏差度(bias factor,Bf)来评价所建模型的可靠性[16]。准确度和偏差度分别按公式(2)、(3)计算。

式中:N实测为实验实际测得的甲型副伤寒沙门氏菌菌体浓度/(CFU/g);N预测为应用热失活模型预测得到的同一时间点的甲型副伤寒沙门氏菌菌体浓度/(CFU/g);n为实验次数。
1.3.10 细菌耐热性及热致死曲线
D值是指在某一温度下,活菌数死亡90%所需要的时间,即细菌残存曲线经一个对数周期所需的时间。D值是细菌死亡率的倒数,D值越大死亡速率越慢,该菌的耐热性越强。用Linear模型拟合热致死曲线方程中,t为热处理时间,x为加热时间,y为细菌活细胞的对数值,可得出该函数的斜率的负倒数为所求的D值,即D=-1/k。
1.4 数据处理
采用SPSS 17.0进行数据处理与统计分析,所有数据均为3 个平行样品分别测定3 次的平均数,结果用±s表示。
2.1 甲型副伤寒沙门氏菌不同介质中的热抗性比较
表1 热处理甲型副伤寒沙门氏菌不同介质的D值
Table 1Dvalues of Salmonella paratyphi A in different media
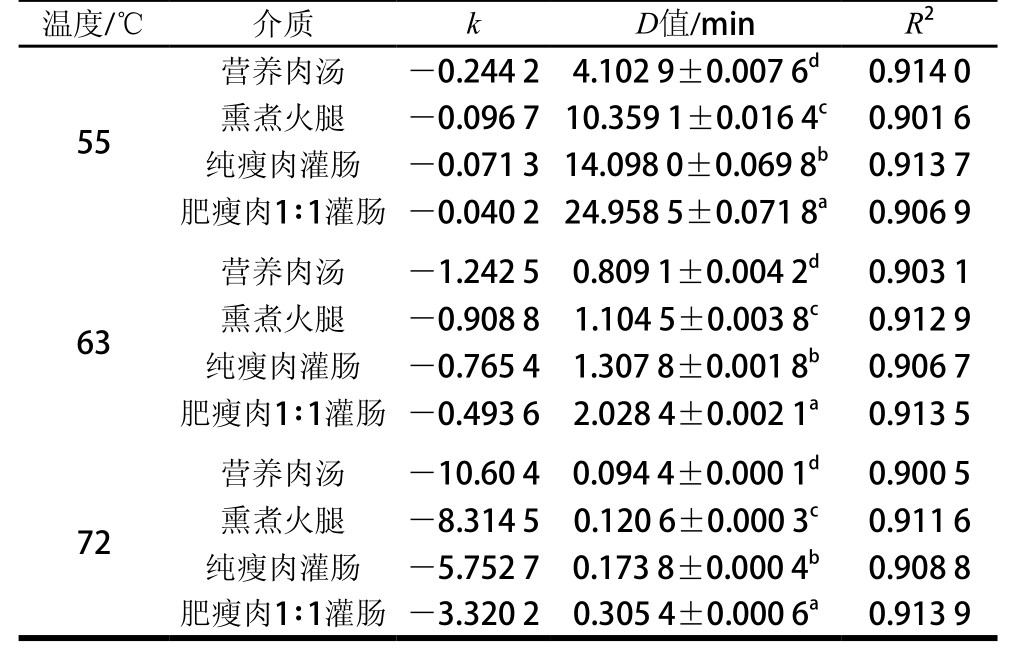
注:同列小写字母不同表示显著差异(P<0.01)。
残存菌落数量的对数值随着加热时间的延长而降低。如表1所示,利用Linear方程求得的55 ℃热处理下甲型副伤寒沙门氏菌在不同介质中的热失活模型的判定系数(R2)分别为0.914 0、0.901 6、0.913 7和0.906 9; 63 ℃热处理R2分别为0.903 1、0.912 9、0.906 7和0.913 5;72 ℃热处理R2分别为0.900 5、0.911 6、0.908 8和0.913 9。根据线性回归方程得到3 种温度下甲型副伤寒沙门氏菌的D值之间有显著性差异(P<0.01)。甲型副伤寒沙门氏菌在脂肪含量最高的介质肥瘦肉1∶1中D值最大,显著高于其他菌株,在介质肥瘦肉1∶1中的热抗性最强;其次在灌肠纯瘦,在营养肉汤中D值显著低于其他菌株,热抗性最小。
2.2 不同温度下甲型副伤寒沙门氏菌的热失活规律
由图1~4可知,随着加热时间的延长,失活速率升高。随着加热温度的升高,失活的时间缩短。根据甲型副伤寒沙门氏菌恒定温度条件下的残存菌落计数结果,利用Origin 8.0软件中的DoseResp模型拟合,绘制出以营养肉汤、熏烤火腿、纯瘦肉灌肠、肥瘦肉1∶1灌肠4 个不同介质,热处理温度分别为55、63、72 ℃的时间-甲型副伤寒沙门氏菌菌体浓度曲线,得到甲型副伤寒沙门氏菌在不同温度条件下处理时的失活曲线。

图1 甲型副伤寒沙门氏菌在营养肉汤中55(A)、63(B)、72 ℃(C)热处理时拟合的失活曲线
Fig. 1 Inactivation curves fitted with DoseResp model of Salmonella paratyphi A in broth at 55 (A), 63 (B) and 72 ℃ (C)
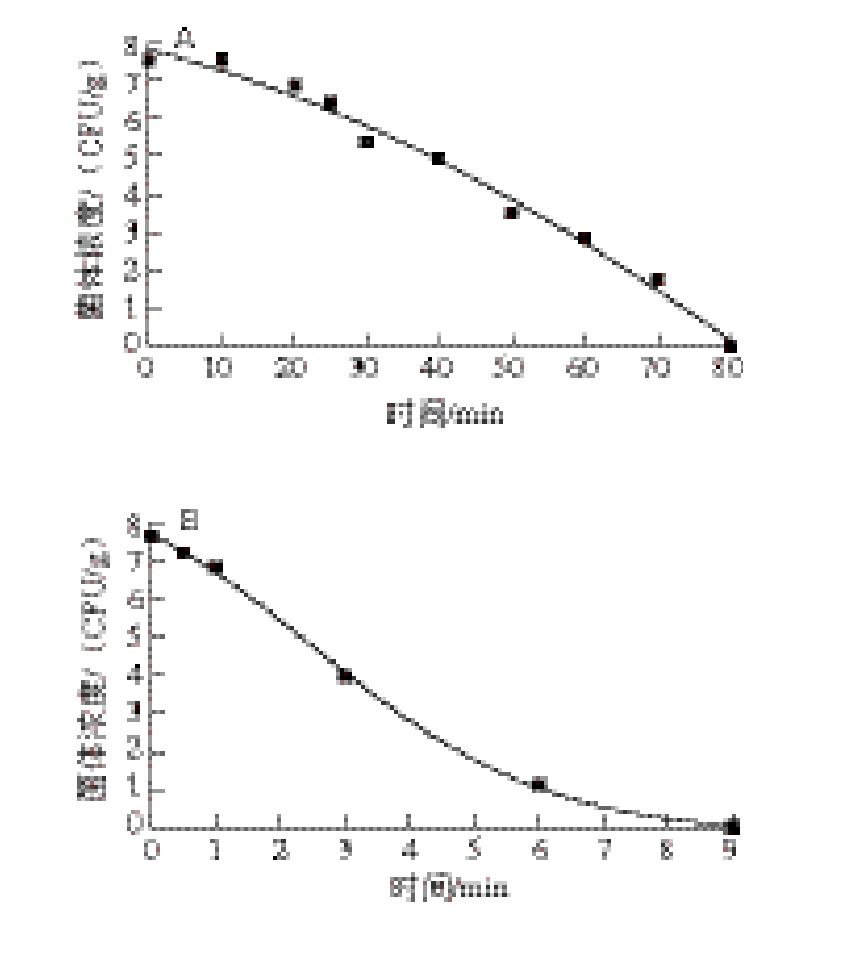

图2 甲型副伤寒沙门氏菌在熏烤火腿中55(A)、63(B)、72 ℃(C)热处理时拟合的失活曲线
Fig. 2 Inactivation curves fitted with DoseResp model of Salmonella paratyphi A in smoked pork ham at 55 (A), 63 (B) and 72 ℃ (C)
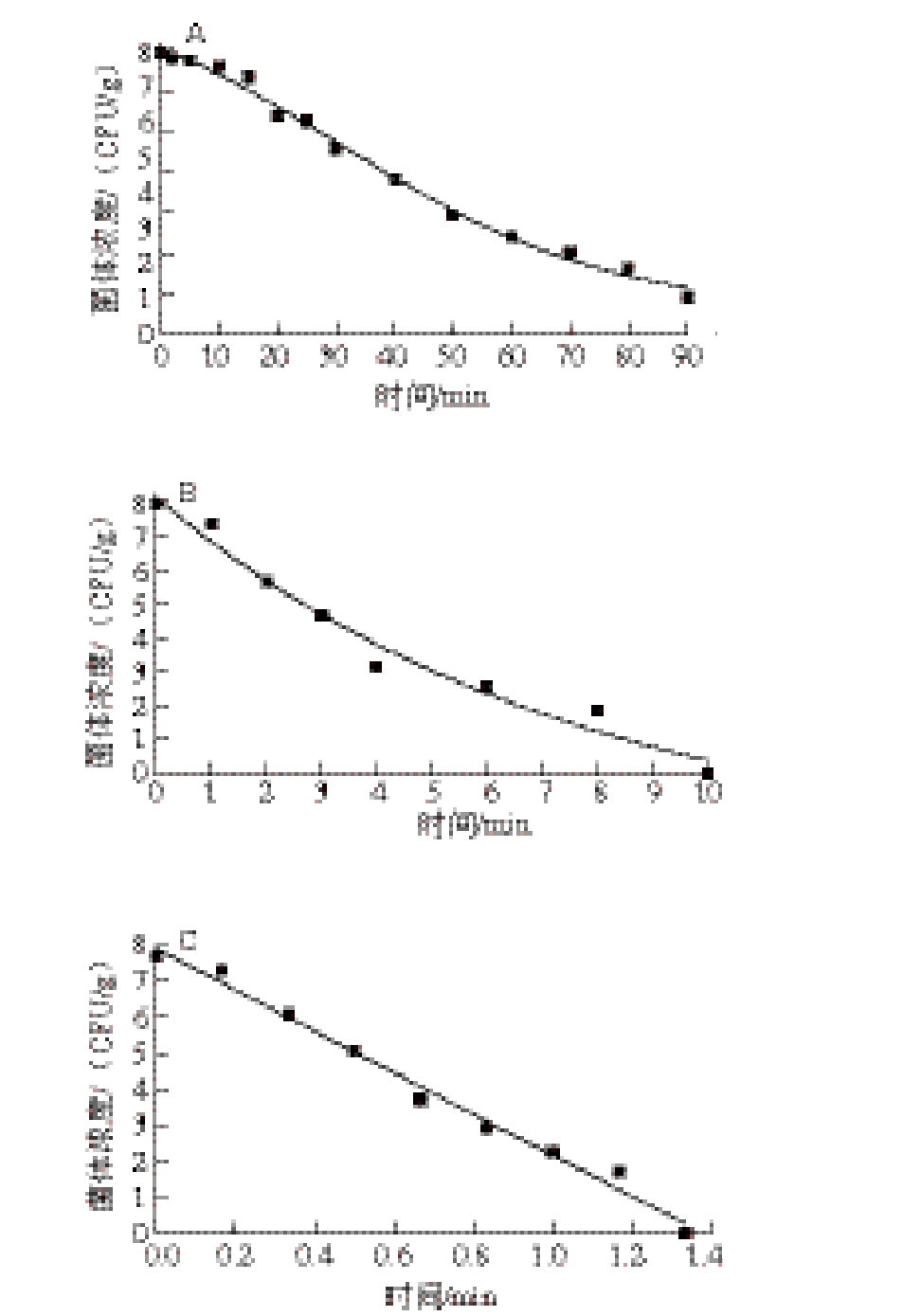
图3 甲型副伤寒沙门氏菌在纯瘦肉灌肠中55(A)、63(B)、72 ℃(C)热处理时拟合的失活曲线
Fig. 3 Inactivation curves fitted with DoseResp model of Salmonella paratyphi A in pure lean meat sausage at 55 (A), 63 (B) and 72 ℃ (C)
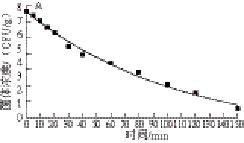
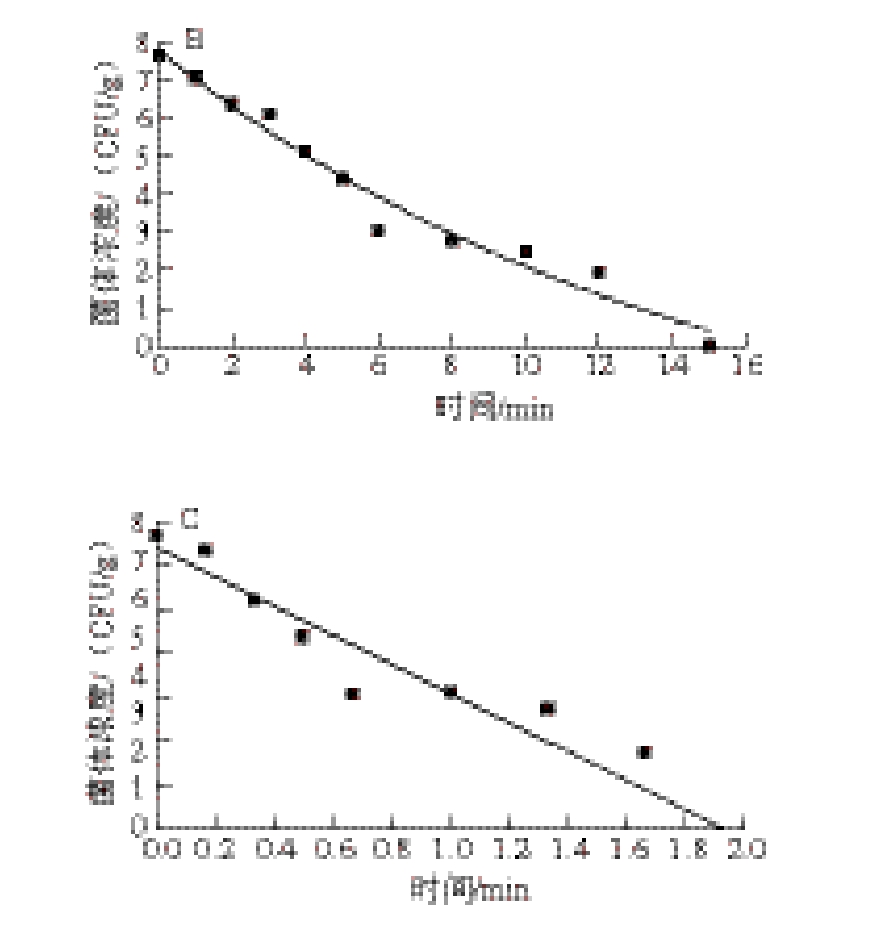
图4 甲型副伤寒沙门氏菌在肥瘦肉1:1灌肠中55(A)、63(B)、72 ℃(C)热处理时拟合的失活曲线
Fig. 4 Inactivation curves fitted with DoseResp model of Salmonella paratyphi A in sausage with fat-to-lean meat ratio of 1:1 at 55 (A), 63 (B) and 72 ℃ (C)
表2 甲型副伤寒沙门氏菌不同温度的模型拟合参数
Table 2 Parameter values and statistic criteria of inactivation curve models at different temperatures for Salmonella paratyphi A
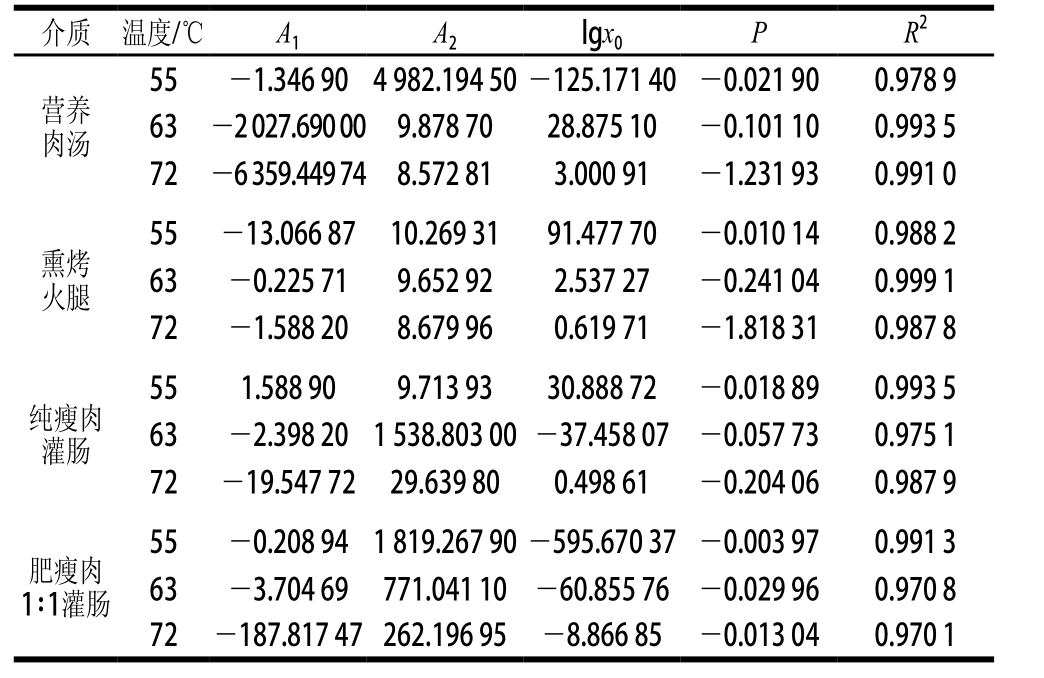
甲型副伤寒沙门氏菌的热失活曲线用DoseResp模型拟合的参数如表2所示,在营养肉汤中R2分别为0.978 9、0.993 5和0.991 0,熏烤火腿中R2分别为0.988 2、0.999 1和0.987 8,纯瘦肉灌肠中R2分别为0.993 5、0.975 1和0.987 9,肥瘦肉1∶1灌肠中R2分别为0.991 3、0.970 8和0.970 1,即所有模型的R2均大于0.970 0,拟合能力较好。
2.3 甲型副伤寒沙门氏菌失活模型的验证
为了定量评价建立的DoseResp模型的可靠性,本实验采用了Ross[17]提出的并且已经被许多学者所接受的准确度(Af)和偏差度(Bf)。Af是用来衡量预测值和实测值之间的差异,Bf是用来检查预测值上下波动的幅度。在68 ℃条件下随机选择甲型副伤寒沙门氏菌在纯瘦肉灌肠和熏煮火腿中存活的真实值与应用预测模型计算得到的甲型副伤寒沙门氏菌存活的预测值来计算准确度和偏差度,以比较、评价和验证模型的可靠性(表3)。
表3 68 ℃条件下纯瘦肉灌肠和熏煮火腿中甲型副伤寒沙门氏菌失活预测值的准确度和偏差度
Table 3 Accuracy and bias factor of predicted values of Salmonella paratyphi A in pure lean meat sausage and smoked pork ham at 68 ℃

由表3可知,本研究中预测值和实测值之间的差异(Af)介于10%左右,预测值上下波动的幅度(Bf)为10%左右。验证结果表明,本研究中建立的甲型副伤寒沙门氏菌的热失活模型能很好的预测不同温度处理对甲型副伤寒沙门氏菌的影响。
加热杀菌是食品工业最常采用的方法之一,因此对于细菌热抗性的研究具有重要意义。国外对于不同沙门氏菌耐热性的研究有不少报道,其中对于鼠伤寒沙门氏菌和山夫登堡沙门氏菌的报道居多,鼠伤寒沙门氏菌的稳定期细胞以胰蛋白胨大豆肉汤培养基为培养介质,在55 ℃热处理条件下的D值为14 min,58 ℃的D值为5.0 min,60 ℃的D值为0.3 min[18];山夫登堡沙门氏菌的稳定期细胞以磷酸盐缓冲液为培养介质,在57.2 ℃热处理时的D值为6.23 min,60 ℃时的D值为2.69 min, 65 ℃时的D值为0.29 min[19-20]。本实验所得的稳定期的甲型副伤寒沙门氏菌稳定期细胞以NB为培养介质,D55值(55 ℃条件下的D值,下同)为4.10 min,D63值为0.81 min,D72值为0.09 min;以熏烤火腿为培养介质,D55值为10.36 min,D63值为1.10 min,D72值为0.12 min;以纯瘦肉灌肠SS为培养介质,D55值为14.10 min,D63值为1.31 min,D72值为0.17 min;以肥瘦肉1∶1灌肠为培养介质,D55值为24.96 min,D63值为2.03 min,D72值为0.31 min。这与其他研究者报道的结果不完全一致,这是因为沙门氏菌菌属、营养介质的不同会导致其耐热性产生差异。
不同血清同一菌属的细菌内部结构有所差异,从而导致他们对刺激环境的适应能力不同。Osaili等[21]报道的甲型副伤寒沙门氏菌在鸡肉制品中的60 ℃的D值是0.46 min,Bucher等[22]报道的肠炎沙门氏菌在鸡肉制品中的60℃的D值是0.39 min,而Juneja等[23]报道的汤普森氏沙门氏菌在鸡胸肉中的60 ℃的D值是5.20 min。这些都说明了细菌菌属的不同会体现其耐热性不同。细菌存在的介质也影响细菌的耐热性,熏煮火腿中营养物质丰富,蛋白质对微生物具有缓冲保护功能,丰富的营养会加速微生物的繁殖和自我修复[24]。脂肪同样有缓冲保护作用,由于脂肪的导热性差,水分活度低,高脂肪含量会导致微生物更高的热抗性[23,25-26]。营养肉汤、熏烤火腿、纯瘦肉灌肠、肥瘦肉1∶1灌肠的蛋白含量和脂肪含量都是增加趋势,所以耐热性也越来越强,体现在同一温度条件下D值越来越大。
微生物动力学研究中,经常会出现细菌的非线性失活现象,即凹形、凸形甚至S形曲线,其主要原因是细菌菌群含有亚菌群,而细菌残存曲线是亚菌群各自动力学模式的综合体现[27-29]。虽然在建立高温失活模型时假设温度与D值是呈线性相关性的,但事实上两者之间是非线性关系[30]。本实验结果表明,DoseResp模型(非线性)能够成功拟合营养肉汤、熏烤火腿、纯瘦肉灌肠、肥瘦肉1∶1灌肠甲型副伤寒沙门氏菌的热失活曲线。这和王虎虎等[9]研究的在pH 2.5的条件下DoseResp曲线能准确地模拟酸化亚氯酸钠对沙门氏菌和单增李斯特菌的致死效果一致。
本研究应用DoseResp模型拟合了甲型副伤寒沙门氏菌不同菌株在熏煮火腿中的热失活曲线,R2均在0.970~0.999之间,并用68 ℃条件下实际的甲型副伤寒沙门氏菌存活数对模型进行验证,得到Af在10%左右,Bf为10%左右,表明DoseResp模型能很好的预测不同温度处理对甲型副伤寒沙门氏菌的热失活动态。采用D值比较了甲型副伤寒沙门氏菌在不同介质中的耐热性情况,结果表明甲型副伤寒沙门氏菌在不同介质中的热抗性存在显著性差异。55 ℃条件下热处理25.0 min,63 ℃条件下热处理2.03 min,72 ℃热处理0.31 min后,甲型副伤寒沙门氏菌一般肉制品中均能被杀死。甲型副伤寒沙门氏菌在蛋白质和脂肪含量高的介质中更耐热。本研究结果为热处理杀灭肉制品中甲型副伤寒沙门氏菌提供理论参考,同时为进一步研究甲型副伤寒沙门氏菌的热失活机制提供了一定的参考依据。
参考文献:
[1] 游旅, 张玉琼. 贵州省伤寒和甲型副伤寒沙门氏菌流行株的耐药性变迁及意义[J]. 贵州医药, 2004, 28(4): 371-372. DOI:10.3969/ j.issn.1000-744X.2004.04.048.
[2] CHOTYAKUL N, VELAZQUEZ G, TORRES J A. Assessment of the uncertainty in thermal food processing decisions based on microbial safety objectives[J]. Journal of Food Engineering, 2011, 102(3): 247-256. DOI:10.1016/j.jfoodeng.2010.08.027.
[3] 王军, 董庆利, 丁甜. 预测微生物模型的评价方法[J]. 食品科学, 2011, 32(21): 268-272.
[4] 冯可, 胡文忠, 姜爱丽, 等. 预测微生物学在鲜切果蔬产品质量安全控制中的应用[J]. 食品工业科技, 2014, 35(10): 49-52.
[5] FUJIKAWA H, USHIODA H, KUDO Y. Kinetics of Escherichia coli destruction by microwave irradiation[J]. Applied and Environmental Microbiology, 1992, 58(3): 920-924.
[6] 李侠, 彭丹, 张春晖, 等. 红枣酒发酵动力学研究[J]. 中国酿造, 2012, 31(1): 190-193.
[7] 鲍亦璐, 杨鹏波, 王倩, 等. 螺旋藻培养过程中的营养盐监测与消耗[J].食品科技, 2011, 36(3): 98-102.
[8] 杭锋, 陈卫, 陈帅, 等. 食品微波加热杀菌动力学描述模型的选择[J].农业工程学报, 2008, 24(6): 49-52.
[9] 王虎虎, 董洋, 徐幸莲, 等. 酸化亚氯酸钠对鸡肉致病菌的致死模型研究[J]. 中国食品学报, 2013, 13(9): 33-38.
[10] 冯晓慧, 王庆国, 王仁欢, 等. 牛肉中单增李斯特菌的热失活模型[J].微生物学报, 2011, 51(5): 684-691.
[11] 黄潇, 蔡颖慧. 鱼糕中金黄色葡萄球菌生长预测模型的构建[J].食品科技, 2014, 39(7): 324-328.
[12] 汪月霞, 侯鹏飞, 索标. 热胁迫下沙门氏菌亚致死规律及机制[J].食品科学, 2013, 34(13): 140-143. DOI:10.7506/spkx1002-6630-201313031.
[13] 胡家应, 赵改名, 田玮, 等. 不同木薯变性淀粉对熏煮香肠品质的影响[J]. 食品工业科技, 2015, 36(18): 305-309.
[14] 刘永安, 赵改名, 黄现青, 等. 脂肪添加量对熏煮香肠质构的影响[J].食品与发酵工业, 2012, 38(6): 203-208.
[15] HEIN I, FLEKNA G, KRASSNIG M, et al. Real-time PCR for the detection of Salmonella spp. in food: an alternative approach to a conventional PCR system suggested by the FOOD-PCR project[J]. Journal of Microbiological Methods, 2006, 66(3): 538-547. DOI:10.1016/j.mimet.2006.02.008.
[16] NEUMEyER K, ROSS T, MCMEEKIN T. Development of a predictive model to describe the effects of temperature and water activity on the growth of spoilage pseudomonads[J]. International Journal of Food Microbiology, 1997, 38(1): 45-54. DOI:10.1016/ S0168-1605(97)00089-5.
[17] ROSS T. Indices for performance evaluation of predictive models in food microbiology[J]. Journal of Applied Bacteriology, 1996, 81(5): 501-508. DOI:10.1111/j.1365-2672.1996.tb03539.x.
[18] WOLFSON L M, SUMNER S S, FRONING G W. Inhibition of Salmonella typhimurium on poultry by the lactoperoxidase system[J]. Journal of Food Safety, 1994, 14(1): 53-62. DOI:10.1111/j.1745-4565.1994.tb00583.x.
[19] CORRY J E. The effect of sugars and polyols on the heat resistance of Salmonellae[J]. Journal of Applied Bacteriology, 1974, 37(1): 31-43. DOI:10.1111/j.1365-2672.1974.tb00412.x.
[20] CORRy J E, ROBERTS T. A note on the development of resistance to heat and gamma radiation in Salmonella[J]. Journal of Applied Bacteriology, 1970, 33(4): 733-737. DOI:10.1111/j.1365-2672.1970. tb02256.x.
[21] OSAILI T M, AL-NABULSI A A, SHAKER R R, et al. Thermal inactivation of Salmonella typhimurium in chicken shawirma (gyro)[J]. International Journal of Food Microbiology, 2013, 166(1): 15-20. DOI:10.1016/j.ijfoodmicro.2013.06.009.
[22] BUCHER O, D’AOUST J Y, HOLLEY R A. Thermal resistance of Salmonella serovars isolated from raw, frozen chicken nuggets/ strips, nugget meat and pelleted broiler feed[J]. International Journal of Food Microbiology, 2008, 124(2): 195-198. DOI:10.1016/ j.ijfoodmicro.2008.03.002.
[23] JUNEJA V, EBLEN B, MARKS H. Modeling non-linear survival curves to calculate thermal inactivation of Salmonella in poultry of different fat levels[J]. International Journal of Food Microbiology, 2001, 70(1): 37-51. DOI:10.1016/S0168-1605(01)00518-9.
[24] 钟业俊, 刘成梅, 刘伟, 等. 食品基质成分对瞬时高压杀灭枯草芽孢杆菌效果的影响[J]. 现代食品科技, 2006, 22(3): 17-20.
[25] AHMED N M, CONNER D E, HUFFMAN D L. Heat-resistance of Escherichia coli O157:H7 in meat and poultry as affected by product composition[J]. Journal of Food Science, 1995, 60(3): 606-610. DOI:10.1111/j.1365-2621.1995.tb09838.x.
[26] VEERAMUTHU G J, PRICE J F, DAVIS C E, et al. Thermal inactivation of Escherichia coli O157:H7, Salmonella senftenberg, and enzymes with potential as time-temperature indicators in ground turkey thigh meat[J]. Journal of Food Protection, 1998, 61(2): 171-175.
[27] DOYLE M E, MAZZOTTA A S, WANG T, et al. Heat resistance of Listeria monocytogenes[J]. Journal of Food Protection, 2001, 64(3): 410-429.
[28] SILVA F M, GIBBS P, VIEIRA M C, et al. Thermal inactivation of Alicyclobacillus acidoterrestris spores under different temperature, soluble solids and pH conditions for the design of fruit processes[J]. International Journal of Food Microbiology, 1999, 51(2): 95-103. DOI:10.1016/S0168-1605(99)00103-8.
[29] van BOEKEL M A. On the use of the Weibull model to describe thermal inactivation of microbial vegetative cells[J]. International Journal of Food Microbiology, 2002, 74(1): 139-159. DOI:10.1016/ S0168-1605(01)00742-5.
[30] JUNEJA V K, HWANG C A, FRIEDMAN M. Thermal inactivation and postthermal treatment growth during storage of multiple Salmonella serotypes in ground beef as affected by sodium lactate and oregano oil[J]. Journal of Food Science, 2010, 75(1): M1-M6. DOI:10.1111/j.1750-3841.2009.01395.x.
Thermal Inactivation Properties of Salmonella paratyphi A in Different Media
ZHANG Peipei1, NIU Huimin2, LI Miaoyun1,*, ZHAO Gaiming1, CUI Wenming1, SUN Lingxia1
(1. Henan Key Laboratory of Meat Processing and Quality Safety Control, College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, China; 2. Henan Provice Product Quality Supervision and Inspection Center, Zhengzhou 450004, China)
Abstract:This study aimed to study the thermal inactivation profile of Salmonella paratyphi A in different media. Salmonella paratyphi A was inoculated at a concentration of 108CFU/g into different media, and then subjected to thermal treatments at different temperatures. The surviving cells were counted on selective media. DoseResp model was used to fit the thermal inactivation curve by Origin 8.0 software. The decimal reduction time (D) values were calculated, which represented the heat resistance of Salmonella paratyphi A. The results showed that thermal inactivation curves were well fitted to the DoseResp with a correlation coefficient (R2) > 0.97. The D values of Salmonella paratyphi A in different media were different. The D value in sausage high in fat and protein with a lean meat-to-fat ratio of 1:1 (m/m) was greater, indicating that that it was relatively heat resistant. Salmonella paratyphi A could be killed by thermal treated at 55 ℃ for 25.0 min, 63 ℃ for 2.03 min, or 72 ℃ for 0.31 min in common meat products.
Key words:Salmonella paratyphi A; thermal inactivation; kinetic model; D value
DOI:10.7506/spkx1002-6630-201714009
中图分类号:TS251.5
文献标志码:A
文章编号:1002-6630(2017)14-0058-06
引文格式:张佩佩, 牛会敏, 李苗云, 等. 不同介质中甲型副伤寒沙门氏菌的热失活特性[J]. 食品科学, 2017, 38(14): 58-63.
DOI:10.7506/spkx1002-6630-201714009. http://www.spkx.net.cn
ZHANG Peipei, NIU Huimin, LI Miaoyun, et al. Thermal inactivation properties of Salmonella paratyphi A in different media[J]. Food Science, 2017, 38(14): 58-63. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714009.
收稿日期:2016-09-27
基金项目:国家自然科学基金青年科学基金项目(31401511)
作者简介:张佩佩(1991—),女,硕士研究生,研究方向为肉品安全与质量控制。E-mail:phioself@163.com
*通信作者:李苗云(1976—),女,教授,博士,研究方向为肉品安全与质量控制。E-mail:limy7476@126.com