谢友坪1,赵旭蕊1,阳需求1,卢英华2,郑向南1,陈剑锋1,*
(1.福州大学生物科学与工程学院,福建 福州 350108;2.厦门大学化学化工学院,福建 厦门 361005)
摘 要:考察脉冲式添加氮源培养对耐温微藻Desmodesmus sp. F51细胞生长和细胞组成的影响。结果表明,在脉冲式添加氮源培养过程中,藻株F51的蛋白质含量由(560±16)mg/g降低至(456±17)mg/g,而碳水化合物和油脂含量则分别由(209±13)mg/g和(98±3) mg/g提高至(310±12)mg/g和(120±4)mg/g。另外,对色素和油脂的具体组成变化进行分析,发现脉冲式添加氮源培养可增强β-胡萝卜素的生物合成,以及促进α-胡萝卜素生物转化为叶黄素,同时还可发现叶黄素积累与多不饱和脂肪酸含量变化呈正相关性。而在碳水化合物的具体组成分析中,发现碳水化合物为藻株F51主要的储能物质,当脉冲式添加氮源培养时间为3 d时,其葡萄糖占总碳水化合物的质量分数可明显提高至(75.7±1.4)%。采用脉冲式添加氮源培养策略可明显同时促进藻株F51叶黄素和碳水化合物的生产。
关键词:微藻;流加培养;细胞组成;叶黄素;碳水化合物
微藻具有光合作用效率高、生长速率快等特点,在某些特定培养条件下,微藻还可改变其细胞组成成分,从而高效积累某一细胞产物,如蛋白质、碳水化合物、油脂或色素等[1-7]。其中,较高的蛋白质含量以及合适的氨基酸组成使得微藻可被用作健康食品和饲料添加剂[6]。微藻碳水化合物组成在细胞壁外层主要为多糖,而在细胞壁内层主要为淀粉和纤维素,因此容易被水解为可发酵糖,进而被用作生物酒精发酵的原料[1]。特别地,一些微藻油脂还含有较高含量的长链不饱和脂肪酸,如二十碳五烯酸(eicosapntemacnioc acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),可被开发用作保健和医药产品[4]。而在营养匮乏条件下,大多数微藻油脂组成主要为十六碳脂肪酸和十八碳脂肪酸,因此较适合用于生物柴油的生产[2-3]。此外,微藻来源的多种天然色素,如类胡萝卜素和藻胆色素等,还可被应用于保健品和化妆品等[5]。截至目前,已有较多研究集中于微藻细胞单一成分(如蛋白质、油脂、碳水化合物或色素等)的开发利用,并将其应用于不同的下游领域。然而,在微藻生物燃料应用方面,其生产成本还相对较高,目前还难以实现大规模的商业化开发利用[8]。为降低微藻生物燃料的开发利用成本,对微藻细胞进行多组分综合利用,以及耦合生产高附加值产品,已是其发展趋势[8]。
叶黄素是一种含氧的类胡萝卜素,由于具有较强的抗氧化和抗炎作用,被广泛应用于食品、饲料添加剂、医药和保健品等行业,而微藻则被认为是商业叶黄素的新兴来源[5,9]。由于叶黄素较高的应用价值,目前在微藻叶黄素方面已有较多研究报道,如考察藻种种类、光照强度、培养温度、培养策略等条件对微藻叶黄素合成的影响[5,9-10]。此外,为降低微藻生物燃料的开发利用成本,一些研究表明在使用微藻粗油进行生物柴油制备过程中,还可同步进行高附加值叶黄素的偶合生产[11-12]。此外,也有研究者致力于将提完粗油后的藻渣(富含碳水化合物)用作生物乙醇发酵的原料[13]。然而,目前微藻培养可同时积累叶黄素、油脂和碳水化合物的研究还鲜有报道。Araya等[14]考察了小球藻同时生产叶黄素和油脂的情况,发现其中Chlorella vulgaris 1803的叶黄素产率和油脂产率可分别达0.51、11.12 mg/(L·d),而Chlorella zofingiensis B 32的叶黄素产率和油脂产率分别为0.53、10.95 mg/(L·d)。Dineshkumar等[12]通过人工神经网络建模优化小球藻Chlorella minutissima同时生产叶黄素和油脂的培养条件,最终其最高叶黄素产率和油脂产率可分别达4.32、142.2 mg/(L·d)。
前期研究结果表明,微藻Desmodesmus sp. F51是较佳的叶黄素生产藻株,同时该藻株具有一定的耐高温特性,十分适于热带和亚热带地区的户外培养[2,15-17]。Xie Youping等[15]研究发现耐温微藻Desmodesmus sp. F51需在氮源非限制条件下才会积累叶黄素,并比较了5 种不同的脉冲式添加氮源培养策略对叶黄素生产的影响,发现当脉冲流加控制氮源浓度为2.2 mmol/L时,可明显提高其叶黄素含量和产率,分别达(5.05±0.20) mg/g和(3.56±0.10) mg/(L·d)。然而,对于耐温微藻Desmodesmus sp. F51的细胞组成在氮源流加过程中的变化还未有深入研究。鉴于此,本实验在前期研究基础上,进一步深入考察Desmodesmus sp. F51细胞组成的变化,同时探讨此策略是否也适用于微藻油脂和碳水化合物的生产,为开发低成本的微藻生物精炼技术提供理论参考和实验依据。
1.1 材料与试剂
耐温微藻Desmodesmus sp. F51由台湾中山大学陈庆能副教授提供。
种子培养基为Modified Bold Basal 3N培养基[15],实验培养基为Modified Bristol培养基[15]。
无水乙醚、丙酮、乙酸铵、丁基羟基甲苯、三乙胺、甲醇、乙醇、乙腈、甲基叔丁基醚、正己烷、二十烷酸甲酯、类胡萝卜素标准品 美国Sigma公司;其他试剂均为国产分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
1 L光生物反应器玻璃瓶 德国Schott Duran公司;AB104N电子天平 德国Sartorius公司;U-2001紫外-可见分光光度计 日本Hitachi公司;TDL-40B低速台式大容量离心机 上海安亭科学仪器厂;Li-190SA日射强度计 美国Li-COR公司;Minibeadbeater-16破碎仪美国Biospec公司;FD-1000型冷冻干燥机 上海爱郎仪器有限公司;RCT B S25型磁力搅拌器 德国IKA公司;MOT500-CO2-IR型二氧化碳检测器 美国德康公司;1200高效液相色谱仪、GC7890气相色谱仪美国安捷伦公司;Vario EL Ⅲ型元素分析仪 德国Elementar公司。
1.3 方法
1.3.1 种子培养
种子培养按Xie Youping等[15]的方法。从平板上刮取1~2 球藻体,接种于250 mL玻璃瓶中,35 ℃培养,300 r/min磁力搅拌,2.5% CO2-空气混合气,通气量0.05 L/min,光照强度60 μmol/(m2·s),培养至OD685nm为3.5。
1.3.2 脉冲式添加氮源培养
脉冲式添加氮源培养按Xie Youping等[15]的方法。将种子接种于1 L玻璃瓶中,接种量9%,400 r/min磁力搅拌,通气量0.2 L/min,光照强度600 μmol/(m2·s),其余条件同上。当初始氮源浓度耗尽时,开始脉冲流加浓度为880 mmol/L的硝酸钠溶液,使得培养液中氮源浓度达到2.2 mmol/L。待氮源耗尽时,再次开始脉冲流加氮源。
1.3.3 生物量的测定
待测藻液适当稀释后测定OD685nm。用已称质量的醋酸纤维素膜(孔径0.45 μm,直径47 mm)过滤50 mL待测藻液,滤膜置于105 ℃烘箱中烘干至恒质量,根据过滤前后滤膜的干质量得藻体细胞干质量。在氮源充足的条件下,藻体生物质浓度X(g/L)与其在特定波长下的光密度呈线性关系[8],可得回归方程X=0.315OD685nm-0.024(R2=0.988)。根据公式(1)计算藻体的生物量产率。
式中:Pbiomass为藻体生物量产率/(g/(L·d));ΔX为Δt时间内藻体的生物量浓度差/(g/L);Δt为藻体培养时间差/d。
1.3.4 硝酸钠浓度的测定
硝酸钠浓度测定按Chiu等[18]的方法。NO3-在220 nm波长处有最大吸收值,因此用紫外分光光度法测定培养基中硝酸钠浓度。
1.3.5 细胞元素组成和蛋白含量的测定
准确称取5 mg干藻体,使用Vario EL Ⅲ型元素分析仪测定藻体中的C、N、S和H元素含量,并根据公式(2)计算藻体蛋白质含量[19]。
式中:P为藻体蛋白质含量/%;Nnitrogen为藻体N元素含量/%。
1.3.6 类胡萝卜素含量及组成的测定
类胡萝卜素含量及组成测定按Xie Youping等[15]的方法。待测藻液6 000 r/min离心2 min,倒去上清液,用等量去离子水清洗2 次后,藻体冷冻干燥。准确称取10 mg干藻体,置于2 mL离心管中,加入1 mL 60% KOH溶液和0.5 g研磨珠,用破碎仪破碎7 min,于40 ℃水浴40 min,加入2 mL无水乙醚萃取类胡萝卜素,重复萃取直至乙醚层无色。用氮气将乙醚萃取液吹干,加入3 mL丙酮重悬,用高效液相色谱仪测定重悬液中类胡萝卜素含量及组成。
1.3.7 叶绿素质量浓度的测定
采用Hansmann等[20]报道的方法测定藻体叶绿素含量。准确称取5 mg干藻体,置于15 mL离心管中,加入8 mL 90%丙酮和0.5 g研磨珠,使用破碎仪破碎7 min。将处理后的样品6 000 r/min离心2 min,所得上清液经90%丙酮适当稀释后,使用紫外分光光度计分别测定OD665nm、OD645nm和OD630nm值。藻体中叶绿素a、b、c的质量浓度(ρ)分别按公式(3)~(5)计算。

1.3.8 油脂含量及脂肪酸组成的测定
油脂含量及脂肪酸组成测定按Ho等[3]的方法。准确称取40 mg干藻体置于15 mL离心管中,加入8 mL 0.5 mol/L 的氢氧化钾/乙醇溶液,混匀,使用破碎仪破碎7 min。将破碎处理后的样品置于100 ℃水浴条件下皂化15 min,冷却至室温。然后,加入8 mL 0.7 mol/L的盐酸-甲醇溶液和10 mL 14%三氟化硼的甲醇溶液,混匀,于100 ℃水浴条件下酯化反应15 min,冷却后加入5 mL正己烷和50 μL 40 g/L的二十烷酸甲酯,混匀振荡,接着加入2 mL饱和氯化钠溶液防止乳化,静置分层后取上层正己烷相并加入无水硫酸钠脱水,最后使用0.22 μm有机滤膜过滤后进行气相色谱分析。
1.3.9 碳水化合物含量及其组成的测定
碳水化合物含量及其组成测定按Ho等[3]的方法。准确称取15.0 mg干藻体,置于2 mL离心管中,加入1 mL 72% H2SO4溶液和0.5 g研磨珠,使用破碎仪破碎7 min后,在30 ℃条件下水浴1 h。将混合液转移至50 mL离心管中,再加入17 mL蒸馏水稀释至4% H2SO4,在121 ℃条件下灭菌20 min。混合液在6 000 r/min离心2 min,采用苯酚-硫酸法测定上清液中碳水化合物含量。取5 mL上清液,加入0.5 g碳酸钙中和溶液中的硫酸,之后8 000 r/min离心5 min,最后使用0.22 μm醋酸纤维滤膜过滤后,用高效液相色谱测定碳水化合物组成。
2.1 Desmodesmus sp. F51细胞组成随流加培养时间的变化趋势

图 1Desmodesmus sp. F51细胞生长、氮源消耗及细胞组成随脉冲式添加氮源培养时间的变化趋势
Fig. 1 Time-course profiles of biomass concentration, nitrate concentration and biomolecule composition of Desmodesmus sp. F51 under nitrate pulse-feeding cultivation
前期研究通过脉冲流加控制不同的氮源浓度(1.1、2.2、4.4、8.8、17.6 mmol/L),考察了脉冲式添加氮源培养对藻株F51叶黄素生产的影响,结果表明当脉冲流加控制氮源浓度为2.2 mmol/L时,藻株F51具有最佳的叶黄素生产能力[15]。在此基础上,本研究进一步分析了其细胞组成变化。
表1 脉冲式添加氮源培养对Desmodesmus sp. F51细胞元素含量的影响
Table 1 Effect of nitrate pulse feeding on cellular elemental composition of Desmodesmus sp. F51
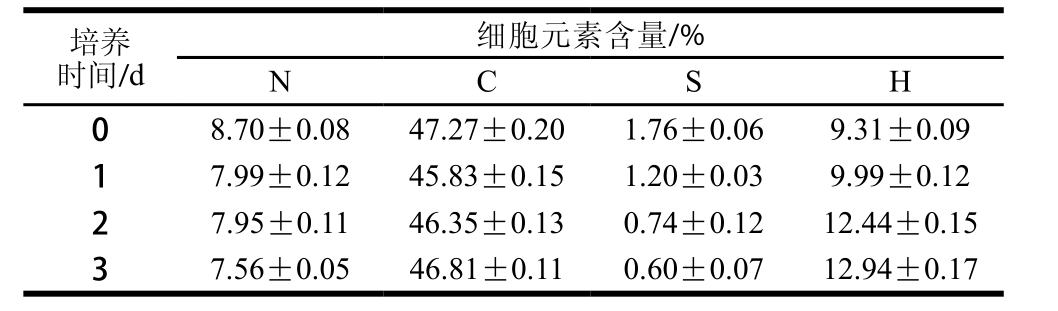
由图1可知,对于不同流加培养时间所获得的藻体,其细胞组成主要为蛋白质、碳水化合物、油脂和色素,而前三者可占到总细胞组成的80%~90%。随流加培养时间的延长,藻株F51的蛋白质含量呈现缓慢降低的趋势,由(560±16) mg/g降低至(456±17) mg/g。同时还可发现,在脉冲式添加氮源培养2 d后,藻株F51的细胞生长速率和氮源消耗速率逐渐下降,这可能是由于培养基中其他营养源被耗尽导致。由表1可知,藻株F51细胞的硫元素含量随流加培养时间延长由1.76%降低至0.60%,该结果表明培养基中的硫元素可能已逐渐处于缺乏或低浓度状态。相关研究表明,当某些必须营养源的浓度低于其临界值时,藻细胞将会感应并表达一系列特定基因来改变其生理机能,以适应营养缺乏的环境[7]。而在硫缺乏条件下,藻体将会降解其细胞内的谷胱甘肽和蛋白质以保证其对硫的需求[21]。
如图1所示,通过氮源脉冲流加培养策略,藻株F51的碳水化合物和油脂含量可分别由(209±13)、(98±3)mg/g提高至(310±12)、(120±4)mg/g。而Ho等[2]发现藻株F51在氮源限制条件下其碳水化合物和油脂含量可分别达到440 mg/g和425 mg/g左右。分析原因可能是由于微藻只有在氮源限制条件下才会明显引起其代谢变化,从蛋白质合成转向非含氮储能物质的合成,如三酰甘油酯和淀粉[6]。而其他营养源的限制(如硫限制),在一定程度上也会促进藻体油脂和碳水化合物的积累,但其效果要明显低于氮源限制的情况[7]。
2.2 脉冲式添加氮源培养对Desmodesmus sp. F51细胞色素组成的影响
如图2所示,藻株F51的类胡萝卜素组成主要为紫黄素、新黄素、叶黄素、α-胡萝卜素和β-胡萝卜素。其中,叶黄素为藻株F51最主要的类胡萝卜素,可占总类胡萝卜素组成的50%~60%。相关研究表明,对于大多数绿藻来说,其叶黄素可占到总类胡萝卜素组成的60%左右,主要是由于叶黄素在组成和稳定捕光复合物(LHC-Ⅱ三聚体)过程中起到重要作用[22]。同时,还可发现随脉冲式添加氮源培养时间的延长,藻株F51的总类胡萝卜和叶绿素含量均呈现先上升而后下降的趋势。分析原因可能是由于在流加培养初期,由于藻体生物量的逐渐提高,使得单位藻体所获得的光照强度逐渐降低,这时藻细胞就需要表达更多色素来捕获光能[23]。而在之后,由于培养基中其他营养源(如硫元素)的缺乏,使得藻体色素含量开始下降。Giordano等[24]研究表明硫元素缺乏会对藻体光合机构的电子传递产生影响,从而降低其光合作用效率。
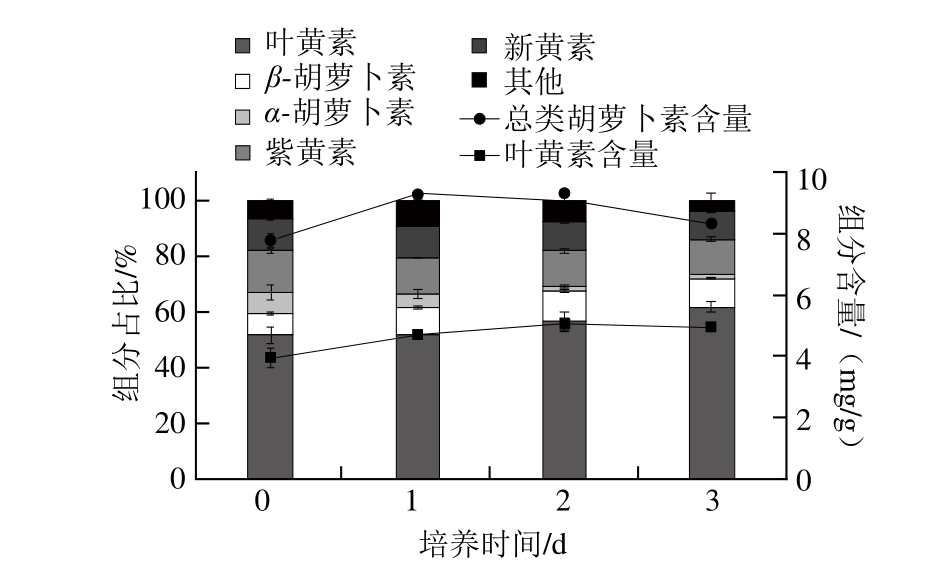
图2 脉冲式添加氮源培养对Desmodesmus sp. F51类胡萝卜素含量及其组成的影响
Fig. 2 Effect of nitrate pulse feeding on carotenoids content and composition of Desmodesmus sp. F51
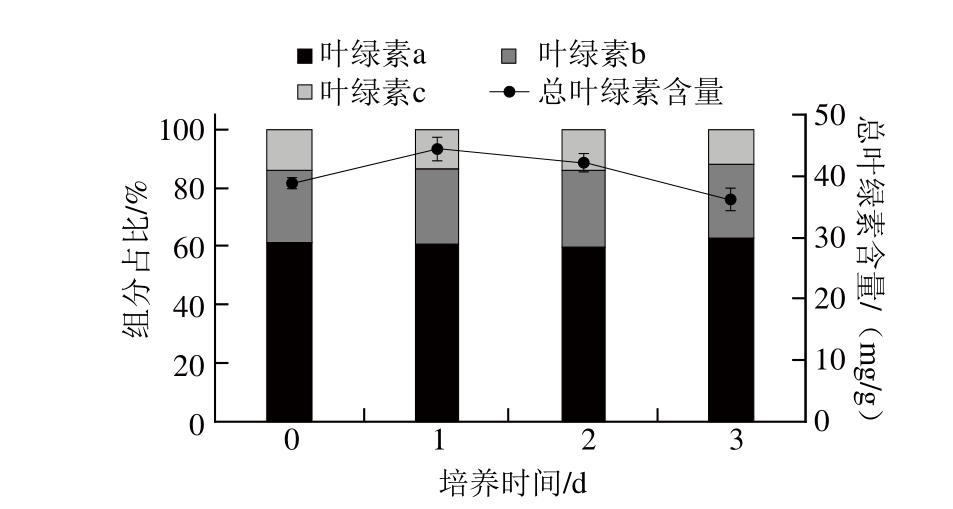
图3 脉冲式添加氮源培养对Desmodesmus sp. F51叶绿素含量及其
组成的影响
Fig. 3 Effect of nitrate pulse feeding on chlorophylls content and composition of Desmodesmus sp. F51
如图2和图3所示,随脉冲式添加氮源培养时间的延长,藻株F51的叶绿素组成无明显变化,但其叶黄素和β-胡萝卜素占总类胡萝卜素的百分含量可分别由51.6%和7.9%提高至61.6%和10.4%,而α-胡萝卜素质量分数由7.5%降低至1.3%。该结果表明,使用脉冲式添加氮源培养策略有利于促进叶黄素和β-胡萝卜素的生物合成。分析原因可能是由于当一些营养源处于缺乏或低浓度状态时,藻体细胞内将容易产生活性氧,而叶黄素和β-胡萝卜素在防止光合机构氧化损伤中起到重要作用,但当这一环境压力超过藻体自身的适应能力时就会导致藻细胞活力下降而死亡[25-26]。有研究发现,当培养基中的S处于缺乏或低浓度状态时,藻体的类胡萝卜素/叶绿素比例会明显提高[7]。而这也与本研究所获得的结果一致,发现在脉冲式添加氮源培养条件下,藻株F51的类胡萝卜素与叶绿素比例可由0.20逐渐提高至0.23。
2.3 脉冲式添加氮源培养对Desmodesmus sp. F51细胞脂肪酸组成的影响

图4 脉冲式添加氮源培养对Desmodesmus sp. F51细胞脂肪酸组成的影响
Fig. 4 Effect of nitrate pulse feeding on fatty acid composition of Desmodesmus sp. F51
如图4所示,在藻株F51的脂肪酸组成中,棕榈酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)和亚麻酸(C18:3)为含量最多的5种脂肪酸,可占到总脂肪酸含量的55%~60%。其中,藻株F51的棕榈酸(C16:0)、硬脂酸(C18:0)和油酸(C18:1)含量在脉冲式添加氮源培养初期逐渐降低,但在脉冲式添加氮源培养2 d后(即氮源消耗速率明显减缓时)呈上升趋势。相反地,对于大部分多不饱和脂肪酸,如亚油酸(C18:2)和亚麻酸(C18:3),却呈现先上升而后下降的趋势。一些研究表明,中性脂质三酰基甘油为藻体主要的贮存脂质,并且其酰基大多为饱和脂肪酸和单不饱和脂肪酸,如棕榈酸(C16:0)和硬脂酸(C18:0)等,而极性脂质的酰基大多为长链多不饱和脂肪酸[27-28]。极性脂质大多位于微藻细胞膜,其含量的提高可增加细胞膜的流动性,从而改善电子传递效率,最终提高藻体的光合作用效率[4,28]。而当营养源缺乏时,微藻细胞膜开始逐渐恶化,其极性脂质含量逐渐降低,藻细胞开始积累贮存脂质(三酰基甘油)[27]。因此可知,在脉冲式添加氮源培养初期,由于单位藻体所获得的光照强度逐渐降低,这时藻体更趋于合成多不饱和脂肪酸来改善光合作用效率,而当培养基中一些营养源(如硫元素)缺乏或处于低浓度时,藻体才开始积累饱和脂肪酸和单不饱和脂肪酸。
另外,有研究表明,藻体类胡萝卜素主要是以类胡萝卜素酯的形式存在于细胞中,其中次级类胡萝卜(如虾青素等)的积累与棕榈酸(C16:0)和油酸(C18:1)含量变化呈正相关[29-30]。而藻株F51在脉冲式添加氮源培养条件下,其类胡萝卜素组成主要为初级类胡萝卜素(叶黄素),因此可发现其含量变化与棕榈酸(C16:0)和油酸(C18:1)含量变化呈负相关,而与多不饱和脂肪酸(亚油酸和亚麻酸)含量变化呈正相关(图2、4)。一些研究也表明,叶黄素和玉米黄素在防止类囊体膜油脂的过氧化过程中起重要作用[31]。因此,藻株F51的叶黄素合成和多不饱和脂肪酸合成可能存在一定联系,但具体的作用机制还有待进一步研究。
2.4 脉冲式添加氮源培养对Desmodesmus sp. F51细胞碳水化合物组成的影响

图5 脉冲式添加氮源培养对Desmodesmus sp. F51细胞碳水化合物含量及其组成的影响
Fig. 5 Effect of nitrate pulse feeding on carbohydrate content and composition of Desmodesmus sp. F51
如图5所示,藻株F51的碳水化合物组成主要为葡萄糖,可占总碳水化合物组成的50%以上。较多研究也表明,微藻细胞在其细胞壁和叶绿体中含有大量的碳水化合物,主要为纤维素、可溶性多糖和淀粉,因此其组成大部分为葡萄糖[1,3]。而Ho等[3]研究还发现微藻Scenedesmus obliquus CNW-N的碳水化合物组成除葡萄糖外,还含有少量的木糖和半乳糖。
在脉冲式添加氮源培养的第0天和第1天,藻株F51的碳水化合物含量及其葡萄糖质量分数变化不明显,但之后随流加培养时间的延长,可分别由(209±13)mg/g和(51.4±1.2)%明显提高至(310±12)mg/g和(75.7±1.4)%。这主要是由于在流加培养2 d后,培养基中其他营养源(如硫元素)处于缺乏或低浓度状态,使得藻细胞的生长速率和氮源消耗速率开始呈现下降趋势(图1),这时藻细胞更倾向于积累合成储能物质来适应外界环境压力[7]。相关研究表明,淀粉为大多数微藻主要的储能碳水化合物,并且其合成与油脂合成共用相同的前体物质[3]。对于大多数微藻来说(特别是绿藻),在营养缺乏的初始阶段,主要是合成淀粉来作为储能物质,而只有当营养源(特别是氮源)缺乏较长时间时,藻细胞才会由淀粉合成转变为更高储能物质油脂的合成[3,7]。因此,可发现在脉冲式添加氮源培养过程中,藻株F51的碳水化合物增加量要明显高于油脂,并且其葡萄糖(淀粉)质量分数也呈明显上升趋势。
2.5 脉冲式添加氮源培养对Desmodesmus sp. F51生物量产率、叶黄素产率、油脂产率和碳水化物产率的影响
表2 脉冲式添加氮源培养对Desmodesmus sp. F51的生物量产率、叶黄素产率、油脂产率和碳水化合物产率的影响
Table 2 Effect of nitrate pulse feeding on biomass, lutein, carbohydrate and lipid productivity of Desmodesmus sp. F51
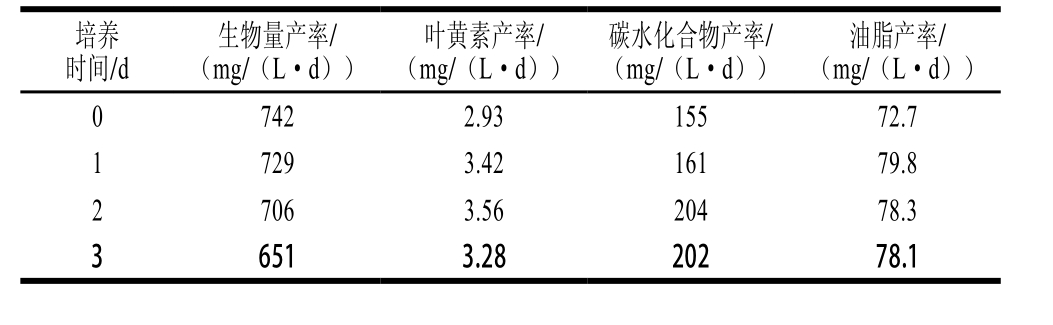
对于微藻培养来说,其产物含量和生物量产率是重要指标。而本研究主要是综合考虑产物含量和生物量产率这两个因素,以产物产率作为指标来考察藻株的生产能力。如表2所示,随流加培养时间的延长,Desmodesmus sp. F51的生物量产率逐渐下降,这可能是由于藻体生物量的提高导致光遮蔽效应逐渐增强,从而降低藻细胞生长速率。在脉冲式添加氮源培养过程中,Desmodesmus sp. F51的叶黄素产率、碳水化合物产率和油脂产率均呈现先上升后下降趋势,在脉冲式添加氮源培养时间为2 d时,其叶黄素产率和碳水化物产率达最大值,分别为3.56 mg/(L·d)和204 mg/(L·d)。
表3 光自养条件下Desmodesmus sp. F51的生物量产率、叶黄素产率、油脂产率和碳水化合物产率与文献结果的比较
Table 3 Comparison of biomass, lutein, carbohydrate and lipid productivity of Desmodesmus sp. F51 with those of other microalgal species reported in the literature under phototrophic cultivation mg/(L·d)
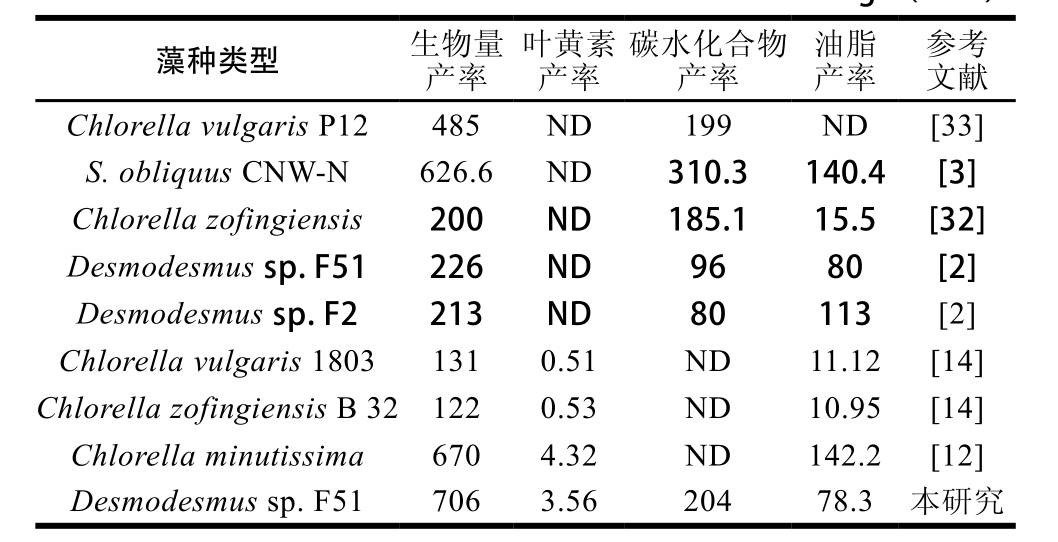
注:ND.未注明。
如表3所示,通过脉冲式添加氮源培养,Desmodesmus sp. F51的生物量产率要高于大部分文献报道的结果,但其油脂产率却明显低于文献报道值。这主要是由于大多数文献是采用氮源匮乏培养策略来促进微藻油脂含量的积累[2-3,32],但同时该策略也会导致微藻生物量产率和叶黄素含量的降低[15]。因此,可发现微藻生物量产率及叶黄素含量与油脂含量之间往往存在相反的变化趋势。类似地,Araya等[14]也发现当以叶黄素为主要目标产物时,其微藻油脂产率要明显低于氮源匮乏培养策略所得结果。而在脉冲式添加氮源培养策略下,培养液中的氮源浓度一直保持较充足状态,但随培养时间的延长,其他营养源(如硫元素)将逐渐处于缺乏或低浓度状态,使得微藻Desmodesmus sp. F51主要以积累碳水化合物作为初级储能物质(图5)。因此,可发现通过该策略不仅可明显提高微藻Desmodesmus sp. F51的叶黄素含量及产率[15],同时还可促进碳水化合物的积累,其碳水化合物产率可达204 mg/(L·d),且高于大多数文献报道结果(表3)。虽然目前已有较多研究致力于微藻细胞单一产物的积累表达,但微藻可同时积累表达叶黄素和碳水化合物的研究还鲜有报道。特别地,已有报道研究表明可同步实现微藻生物柴油和叶黄素产品的偶合生产[11-12],同时也可将提完粗油后的藻渣(富含碳水化合物)用作生物乙醇发酵的原料[13]。鉴于此,对于通过脉冲式添加氮源培养所得藻体,在进行完叶黄素和油脂萃取后,萃余物还可进一步用于微生物酒精发酵,这可为后续开发低成本的微藻生物精炼技术提供一定技术支持。
本实验结果表明:在脉冲式添加氮源培养策略下,藻株F51叶黄素含量变化与多不饱和脂肪酸(亚油酸和亚麻酸)含量变化呈正相关趋势,同时培养基中的其他营养源(如硫元素)逐渐处于缺乏或低浓度状态,使得藻株F51主要以合成碳水化合物来作为储能物质,而其葡萄糖占总碳水化合物的质量分数也可由51.4%明显提高至75.7%。采用脉冲式添加氮源培养策略,可明显同时促进藻株F51叶黄素和碳水化合物的积累表达,其生物量产率、叶黄素产率和碳水化合物产率可分别达706、3.56 mg/(L·d)和204 mg/(L·d),且高于大多数文献报道结果。因此,对于通过脉冲式添加氮源培养所得藻体,在进行完叶黄素和油脂萃取后,萃余物(富含碳水化合物)还可进一步用作微生物酒精发酵的原料。本实验结果可为后续开发低成本的微藻生物精炼技术提供一定技术支持。
参考文献:
[1] CHEN C Y, ZHAO X Q, YEN H W, et al. Microalgae-based carbohydrates for biofuel production[J]. Biochemical Engineering Journal, 2013, 78: 1-10. DOI:10.1016/j.bej.2013.03.006.
[2] HO S H, LAI Y Y, CHIANG C Y, et al. Selection of elite microalgae for biodiesel production in tropical conditions using a standardized platform[J]. Bioresource Technology, 2013, 147: 135-142. DOI:10.1016/j.biortech.2013.08.028.
[3] HO S H, CHEN C Y, CHANG J S. Effect of light intensity and nitrogen starvation on CO2fixation and lipid/carbohydrate production of an indigenous microalga Scenedesmus obliquus CNW-N[J]. Bioresource Technology, 2012, 113: 244-252. DOI:10.1016/ j.biortech.2011.11.133.
[4] CHEN C Y, CHEN Y C, HUANG H C, et al. Engineering strategies for enhancing the production of eicosapentaenoic acid (EPA) from an isolated microalga Nannochloropsis oceanica CY2[J]. Bioresource Technology, 2013, 147: 160-167. DOI:10.1016/ j.biortech.2013.08.051.
[5] del CAMPO J A, GARCIA-GONZALEZ M, GUERRERO M G. Outdoor cultivation of microalgae for carotenoid production: current state and perspectives[J]. Applied Microbiology and Biotechnology, 2007, 74(6): 1163-1174. DOI:10.1007/s00253-007-0844-9.
[6] WANG L, LI Y, SOMMERFELD M, et al. A flexible culture process for production of the green microalga Scenedesmus dimorphus rich in protein, carbohydrate or lipid[J]. Bioresource Technology, 2013, 129: 289-295. DOI:10.1016/j.biortech.2012.10.062.
[7] PROCHAZKOVA G, BRANYIKOVA I, ZACHLEDER V, et al. Effect of nutrient supply status on biomass composition of eukaryotic green microalgae[J]. Journal of Applied Phycology, 2014, 26(3): 1359-1377. DOI:10.1007/s10811-013-0154-9.
[8] MARKOU G, NERANTZIS E. Microalgae for high-value compounds and biofuels production: a review with focus on cultivation under stress conditions[J]. Biotechnology Advances, 2013, 31(8): 1532-1542. DOI:10.1016/j.biotechadv.2013.07.011.
[9] 吴正云, 史贤明, 曾娟. 微藻生物合成叶黄素的研究进展[J]. 食品科学, 2010, 31(1): 268-273.
[10] FERNANDEZ-SEVILLA J M, FERNANDEZ F G A, GRIMA E M. Biotechnological production of lutein and its applications[J]. Applied Microbiology and Biotechnology, 2010, 86(1): 27-40. DOI:10.1007/ s00253-009-2420-y.
[11] PROMMUAK C, PAVASANT P, QUITAIN A T, et al. Simultaneous production of biodiesel and free lutein from Chlorella vulgaris[J]. Chemical Engineering & Technology, 2013, 36(5): 733-739. DOI:10.1002/ceat.201200668.
[12] DINESHKUMAR R, DASH S K, SEN R. Process integration for microalgal lutein and biodiesel production with concomitant flue gas CO2sequestration: a biorefinery model for healthcare, energy and environment[J]. RSC Advances, 2015, 5(90): 73381-73394. DOI:10.1039/c5ra09306f.
[13] LEE O K, OH Y K, LEE E Y. Bioethanol production from carbogydrate-enriched residual biomass obtained after lipid extraction of Chlorella sp. KR-1[J]. Bioresource Technology, 2015, 196: 22-27. DOI:10.1016/j.biortech.2015.07.040.
[14] ARAYA B, GOUVEIA L, NOBRE B, et al. Evaluation of the simultaneous production of lutein and lipids using a vertical alveolar panel bioreactor for three Chlorella species[J]. Algal Research, 2014, 6: 218-222. DOI:10.1016/j.algal.2014.06.003.
[15] XIE Y P, HO S H, CHEN C N N, et al. Phototrophic cultivation of a thermo-tolerant Desmodesmus sp. for lutein production: effects of nitrate concentration, light intensity and fed-batch operation[J]. Bioresource Technology, 2013, 144: 435-444. DOI:10.1016/ j.biortech.2013.06.064.
[16] XIE Y, HO S H, CHEN C Y, et al. Simultaneous enhancement of CO2fixation and lutein production with thermo-tolerant Desmodesmus sp. F51 using a repeated fed-batch cultivation strategy[J]. Biochemical Engineering Journal, 2014, 86: 33-40. DOI:10.1016/j.bej.2014.02.015.
[17] 谢友坪, 阳需求, 陈剑锋, 等. 室内外培养对耐温微藻Desmodesmus sp. F51细胞生长和叶黄素积累的影响[J]. 过程工程学报, 2016, 16(4): 86-92.
[18] CHIU S Y, KAO C Y, TSAI M T, et al. Lipid accumulation and CO2utilization of Nannochloropsis oculata in response to CO2aeration[J]. Bioresource Technology, 2009, 100(2): 833-838. DOI:10.1016/ j.biortech.2008.06.061.
[19] BECKER E W. Microalgae: biotechnology and microbiology[M]. Cambridge: Cambridge University Press, 1994.
[20] HANSMANN E. Handbook of phycological methods: culture methods and growth measurements[M]. Cambridge: Cambridge University Press, 1973.
[21] CARFAGNA S, SALBITANI G, VONA V, et al. Changes in cysteine and O-acetyl-L-serine levels in the microalga Chlorella sorokiniana in response to the S-nutritional status[J]. Journal of Plant Physiology, 2011, 168(18): 2188-2195. DOI:10.1016/j.jplph.2011.07.012.
[22] BISHOP N I. The β,ε-carotenoid, lutein, is specifically required for the formation of the oligomeric forms of the light harvesting complex in the green alga, Scenedesmus obliquus[J]. Journal of Photochemistry and Photobiology B: Biology, 1996, 36(3): 279-283. DOI:10.1016/ S1011-1344(96)07381-2.
[23] MARKOU G, CHATZIPAVLIDIS I, GEORGAKAKIS D. Effects of phosphorus concentration and light intensity on the biomass composition of Arthrospira (Spirulina) platensis[J]. World Journal of Microbiology and Biotechnology, 2012, 28(8): 2661-2670. DOI:10.1007/s11274-012-1076-4.
[24] GIORDANO M, PEZZONI V, HELL R. Strategies for the allocation of resources under sulfur limitation in the green alga Dunaliella salina[J]. Plant Physiology, 2000, 124(2): 857-864. DOI:10.1104/ pp.124.2.857.
[25] JAHNS P, HOLZWARTH A R. The role of the xanthophyll cycle and of lutein in photoprotection of photosystem Ⅱ[J]. Biochimica et Biophysica Acta-Bioenergetics, 2012, 1817(1): 182-193. DOI:10.1016/j.bbabio.2011.04.012.
[26] TELFER A. What is beta-carotene doing in the photosystem Ⅱreaction centre?[J]. Philosophical Transactions of the Royal Society of London, Series B, 2002, 357: 1431-1440.
[27] HU Q, SOMMERFELD M, JARVIS E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances[J]. Plant Journal, 2008, 54(4): 621-639. DOI:10.1111/j.1365-313X.2008.03492.x.
[28] DUNSTAN G A, VOLKMAN J K, BARRETT S M, et al. Changes in the lipid composition and maximisation of the polyunsaturated fatty acid content of three microalgae grown in mass culture[J]. Journal of Applied Phycology, 1993, 5: 71-83. DOI:10.1007/BF02182424.
[29] LAMERS P P, van DE LAAK C C, KAASENBROOD P S, et al. Carotenoid and fatty acid metabolism in light-stressed Dunaliella salina[J]. Biotechnology and Bioengineering, 2010, 106(4): 638-648. DOI:10.1002/bit.22725.
[30] ZHEKISHEVA M, BOUSSIBA S, KHOZIN-GOLDBERG I, et al. Accumulation of oleic acid in Haematococcus pluvialis (Chlorophyceae) under nitrogen starvation or high light is correlated with that of astaxanthin esters[J]. Journal of Phycology, 2002, 38(2): 325-331. DOI:10.1046/j.1529-8817.2002.01107.x.
[31] JOYARD J, TEYSSIER E, MI☒GE C, et al. The biochemical machinery of plastid envelope membranes[J]. Plant Physiology, 1998, 118(3): 715-723. DOI:10.1104/pp.118.3.715.
[32] ZHU S, HUANG W, XU J, et al. Metabolic changes of starch and lipid triggered by nitrogen starvation in the microalga Chlorella zofingiensis[J]. Bioresource Technology, 2014, 152: 292-298. DOI:10.1016/j.biortech.2013.10.092.
[33] DRAGONE G, FERNANDES B D, ABREU A P, et al. Nutrient limitation as a strategy for increasing starch accumulation in microalgae[J]. Applied Energy, 2011, 88(10): 3331-3335. DOI:10.1016/j.apenergy.2011.03.012.
Effect of Nitrate Pulse-Feeding Cultivation on Cell Growth and Cell Composition of Thermo-Tolerant Desmodesmus sp. F51
XIE Youping1, ZHAO Xurui1, YANG Xuqiu1, LU Yinghua2, ZHENG Xiangnan1, CHEN Jianfeng1,*
(1. College of Biological Science and Engineering, Fuzhou University, Fuzhou 350108, China; 2. College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005, China)
Abstract:The aim of the present study was to investigate the effect of nitrate pulse feeding on the cell growth and cell composition of Desmodesmus sp. F51. Under nitrate pulse-feeding cultivation, the protein content of cells of Desmodesmus sp. F51 decreased from (560 ± 16) mg/g to (456 ± 17) mg/g, while the contents of carbohydrate and lipid increased from (209 ± 13) mg/g to (310 ± 12) mg/g and (98 ± 3) mg/g to (120 ± 4) mg/g, respectively. By investigating the changes in carotenoid, lipid and carbohydrate compositions, it appeared that nitrate pulse feeding could promote β-carotene biosynthesis and enhance the bioconversion of α-carotene to lutein. Lutein accumulation was positively associated with polyunsaturated fatty acid formation. Desmodesmus sp. F51 tended to accumulate carbohydrate as an energy storage product after 3 days of cultivation under nitrate pulse-feeding conditions, and the major accumulated monosaccharide was glucose (75.7 ± 1.4)%. Therefore, the nitrate-pulse feeding strategy is a highly promising approach to simultaneously produce lutein and carbohydrate in Desmodesmus sp. F51.
Key words:microalgae; fed-batch culture; cell composition; lutein; carbohydrate
DOI:10.7506/spkx1002-6630-201714010
中图分类号:Q939.97
文献标志码:A
文章编号:1002-6630(2017)14-0064-07
引文格式:谢友坪, 赵旭蕊, 阳需求, 等. 脉冲式添加氮源对耐温微藻Desmodesmus sp. F51细胞生长和细胞组成的影响[J]. 食品科学, 2017, 38(14): 64-70.
DOI:10.7506/spkx1002-6630-201714010. http://www.spkx.net.cn
XIE Youping, ZHAO Xurui, YANG Xuqiu, et al. Effect of nitrate pulse-feeding cultivation on cell growth and cell composition of thermo-tolerant Desmodesmus sp. F51[J]. Food Science, 2017, 38(14): 64-70. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714010. http://www.spkx.net.cn
收稿日期:2016-09-07
基金项目:国家自然科学基金应急管理项目(41641050);福建省青年科技人才创新基金资助项目(2016J05077);福建省海洋高新产业发展专项(闽海洋高新[2016]15号);福州市市校(院所)科技合作项目(2015-G-69)
作者简介:谢友坪(1986—),男,助理研究员,博士,研究方向为生物化工。E-mail:ypxie@fzu.edu.cn
*通信作者:陈剑锋(1968—),男,教授,博士,研究方向为生物化工。E-mail:jfchen@fzu.edu.cn