杨龙平,严文静*,黄明明,乔维维,章建浩*
(南京农业大学食品科技学院,江苏省肉类生产与加工质量安全控制协同创新中心,国家肉品质量与安全控制工程技术研究中心,江苏 南京 210095)
摘 要:为了提高溶菌酶的稳定性及对革兰氏阴性菌的抑菌性能,以金纳米颗粒为核,通过表面定向修饰溶菌酶,制备了绿色、高效的溶菌酶功能化金纳米颗粒抑菌材料,研究溶菌酶与金纳米的比例、纳米颗粒质量浓度等对抑菌效果的影响,研究溶菌酶功能化纳米材料对大肠杆菌的抑菌机理及对人神经母细胞瘤(SH-SY5Y)的细胞毒性。结果表明:与未修饰的金纳米及单纯的溶菌酶相比,溶菌酶功能化金纳米颗粒对大肠杆菌和金黄色葡萄球菌的抑菌效果均显著增强,表现出协同抑菌作用,在最优条件下,0.1 g/L溶菌酶功能化金纳米颗粒可以完全杀死2 种细菌,并且该溶菌酶功能化金纳米颗粒具有持久抑菌性及良好的生物相容性,对哺乳细胞没有毒性。透射电子显微镜和活菌/死菌荧光染色结果表明:溶菌酶功能化金纳米颗粒主要通过破坏菌体细胞壁和细胞膜结构,从而杀死细菌。
关键词:溶菌酶;金纳米颗粒;抑菌活性;细胞毒性;细胞膜通透性
蛋清溶菌酶是一种糖苷水解酶,等电点为10.8,酸性条件下十分稳定,具有催化、抑菌等作用[1]。溶菌酶能够通过水解细胞壁中肽聚糖主链上N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键,最终导致细菌溶解死亡,主要作用于革兰氏阳性菌。由于革兰氏阴性菌细胞壁中的肽聚糖含量很少,且存在于细胞膜的中间层,因此,溶菌酶对革兰氏阴性菌几乎没有抑制效果[2]。另外,有研究表明,溶菌酶的抑菌活性受盐浓度、碱性条件、氧化剂等因素影响,因而极大限制了溶菌酶作为天然防腐剂在食品保鲜中的实际应用和推广[3]。
随着细菌对抗生素的耐药性日益增强,纳米材料在抗菌杀菌领域的研究和应用受到了广泛的关注。纳米材料具有量子尺寸效应、小尺寸效应和极大的比表面积等特性,因而具有传统抗菌剂无法比拟的抗菌性能[4]。其中,银纳米颗粒由于在杀菌方面具有强效、快速和渗透力强等特点,且具有广谱抗菌性,被广泛用于医疗、生物等领域[5],但研究发现纳米银对哺乳动物细胞有较大的毒性[6]。金纳米颗粒具有生物相容性好、化学性能稳定、形貌可控、表面易于修饰等特性,目前已在生物成像、癌症治疗、生物传感等方面有着广泛的应用[7]。研究表明,金纳米颗粒能够破坏细胞膜通透性,导致内容物泄漏而使菌体死亡,对革兰氏阳性菌和革兰氏阴性菌均有一定的抑菌作用[8],但是单纯使用金纳米颗粒往往达不到实际杀菌的要求,其原因可能与金纳米良好的生物相容性有关[9]。目前,关于金纳米颗粒在抑菌方面的研究较少。
与常规大尺寸材料不同,纳米材料的性质很大程度上受材料本身的尺寸、形貌、表面性质、聚集状态、剂量等因素影响,这一特点赋予了纳米材料更大的应用潜力。金纳米颗粒能够通过表面静电吸附作用或形成Au—S键与生物分子定向结合,从而制备得到具有不同功能基团和表面性能的金纳米颗粒[10]。另外,通过对金纳米颗粒表面进行定向修饰能够有效降低其细胞毒性和免疫原性,基于此性质,功能化金纳米颗粒已被广泛用于药物释放、光学成像和光热治疗等方面,是目前纳米材料领域研究的热点[11]。但是,功能化金纳米颗粒在抑菌方面的研究却仍处于初级阶段[12]。
本实验为了解决溶菌酶和单纯金纳米颗粒在抑菌方面的局限性,开发绿色、高效、广谱的非抗生素、非银系纳米抑菌材料,通过制备溶菌酶功能化金纳米颗粒抑菌材料,研究该功能化纳米材料对大肠杆菌(革兰氏阴性菌)和金黄色葡萄球菌(革兰氏阳性菌)的抑菌性能、抑菌持久性及其细胞毒性,并且通过活菌/死菌荧光染色及透射电子显微镜(transmission electron microscopy,TEM)初步揭示溶菌酶功能化金纳米颗粒的抑菌机理。
1.1 菌种与试剂
金黄色葡萄球菌(Staphylococcus aureus CMCC(B)26003)、大肠杆菌(Escherichia coli ATCC25922) 广东环凯微生物科技有限公司。
普通肉汤培养基、伊红美兰固体培养基、贝尔德-帕克固体培养基 青岛海博生物科技有限公司;HAuCI4北京化学试剂公司;柠檬酸三钠 美国Sigma公司;单宁酸 上海瑞永生物科技有限公司;碳酸钾 西陇化工股份有限公司;蛋清溶菌酶 北京Solarbio公司。实验用水均为去离子水,所用玻璃仪器均预先采用王水浸泡进行清洗,干燥后备用。
1.2 仪器与设备
JEM-2100 TEM 日本电子株式会社;UV-2600紫外-可见光分光光度计 日本岛津有限公司;Allegra-64R台式冷冻离心机 美国Beckman公司;Nano ZS90纳米粒度仪、Zeta电位仪 英国马尔文仪器有限公司;SW-CJ-IFD型单人单面净化工作台 苏州净化设备有限公司;Bruker-M90电感耦合等离子体质谱(inductively coupled plasma-mass spectrometry,ICP-MS)仪 布鲁克科技有限公司;TCS-SP2激光共聚焦显微镜(confocal laser scanning microscope,CLSM) 德国Leica公司。
1.3 方法
1.3.1 溶菌酶功能化金纳米颗粒的制备与表征
金纳米颗粒合成[13]:取一洁净的锥形瓶A依次加入79 mL超纯水和1 mL 1%的HAuCI4溶液。另取一锥形瓶B依次加入15.8 mL超纯水、4 mL 1%的柠檬酸三钠溶液、0.1 mL 1%的单宁酸溶液、0.1 mL 25 mmol/L的K2CO3溶液。将A、B溶液放置于60 ℃水浴加热30 min,然后将B液迅速加入到A液中,并于60 ℃水浴搅拌加热,直至溶液颜色由无色变成酒红色并保持不变,停止加热,冷却至室温。将制备的金纳米溶液于13 000 r/min离心10 min,去上清液,加12.5 mL超纯水重悬,得到8 倍浓缩的金纳米溶液。由ICP-MS分析得到,浓缩后的金纳米溶液中金纳米颗粒的质量浓度为0.8g/L。
溶菌酶功能化金纳米颗粒制备:分别取上述制备的1 mL 0.05 g/L金纳米溶液于5 个离心管中,向5 个管中依次加入0.001、0.005、0.05、0.1、0.2 mL 100 g/L溶菌酶,使金纳米-溶菌酶的质量比分别为1∶2、1∶10、1∶100、1∶200、1∶400。混合液室温振荡反应过夜,10 000 r/min离心10 min,去上清液,加1 mL超纯水重悬,得到溶菌酶功能化金纳米颗粒溶液。
溶菌酶功能化金纳米颗粒表征:对制备的金纳米颗粒采用TEM进行表征,对溶菌酶修饰的金纳米颗粒采用纳米粒度仪及Zeta电位仪、紫外-可见分光光度计进行表征。
1.3.2 溶菌酶功能化金纳米颗粒抑菌活性测定
分别取冷冻保藏的大肠杆菌、金黄色葡萄球菌菌种,接种于普通肉汤培养基中,于37 ℃条件下振荡培养16 h,在转速6 000 r/min下离心10 min,弃上清液,菌体沉淀重悬并稀释至菌落总数106CFU/mL作为测试菌液,备用。
金纳米颗粒、溶菌酶和溶菌酶功能化金纳米颗粒的抑菌活性采用平板计数法测定。取1 mL不同质量浓度的抑菌剂分别加入到1 mL的菌液中,37 ℃振荡培养24 h,以加生理盐水组作空白对照。取1 mL培养后的菌液加入9 mL无菌生理盐水(1号),振荡均匀后,取管1中1 mL菌液加入9 mL无菌生理盐水(2号),依次类推至6号,即稀释106倍,分别取稀释后的菌悬液100 μL均匀涂布于固体培养基上,将培养平皿在37 ℃条件下恒温培养箱中培养24 h,对菌落计数。实验重复3 次,结果取平均值。抑菌率(R)按公式(1)进行计算。
式中:A、B分别为空白组、处理组平均菌落数。
1.3.3 溶菌酶功能化金纳米颗粒最小抑菌浓度(minimum inhibitory concentration,MIC)测定
将1 mL金纳米、溶菌酶和溶菌酶功能化金纳米颗粒溶液,分别加入到1 mL灭菌的普通肉汤培养基中,进行2 倍逐级稀释后,分别向每个梯度的样品溶液中加入1 mL的菌悬液,37 ℃条件下振荡培养24 h。以加生理盐水替代溶菌酶和金纳米颗粒为空白对照。观察细菌生长情况,空白对照组中细菌呈混浊状生长;然后观察含有抑菌剂溶液的混浊度,溶液开始出现澄清的最低浓度确定为样品的MIC。实验重复3 次,结果取平均值。并通过计算部分抑菌浓度(fractional inhibitory concentration,FIC)来判断2 种抑菌剂联合抑菌效果,FIC指数按公式(2)计算[14]。若FIC≤0.5,则其抑菌效果为协同作用;若0.5<FIC≤1.0,则其抑菌效果为相加作用;若1.0<FIC<4.0,则其抑菌效果无相关作用;若FIC≥4.0,则其抑菌效果为拮抗作用。
式中:MIC甲药联用、MIC乙药联用分别为甲、乙药物联合使用时的MIC值对应的甲、乙药物的浓度;MIC甲药单用、MIC乙药单用分别为甲、乙药物单独使用时的MIC值。
1.3.4 溶菌酶功能化金纳米颗粒生长抑制曲线测定
用肉汤培养基将培养至对数增长期的金黄色葡萄球菌和大肠杆菌菌液稀释成106CFU/mL,分别加入0.5×MIC、1.0×MIC、2.0×MIC的溶菌酶功能化金纳米颗粒。以加生理盐水组为空白对照,37 ℃条件下振荡培养,定时取样,利用紫外-可见分光光度计测定菌液OD600nm。
1.3.5 活菌/死菌荧光染色分析
用生理盐水将培养至对数增长期的大肠杆菌菌液稀释成106CFU/mL,分别加入金纳米(0.05 g/L)、溶菌酶(5.00 g/L)和溶菌酶功能化金纳米颗粒溶液(0.05 g/L)。以加生理盐水组为空白对照,37 ℃条件下振荡反应24 h。按照LIVE/DEAD®BaclightTMBacterial Vibility Kit试剂盒说明书,对处理后的细菌进行染色。在CLSM下死菌被碘化丙啶(propidium iodide,PI)染色呈红色,活菌被SYTO 9染色呈绿色。
1.3.6 TEM观察
培养至对数增长期的大肠杆菌菌液,分别加入金纳米(0.05 g/L)、溶菌酶(5.00 g/L)和溶菌酶功能化金纳米颗粒溶液(0.05 g/L),反应24 h,6 000 r/min离心10 min收集细胞,按照文献[15]进行超薄切片,用TEM观察细菌形态变化。
1.3.7 溶菌酶功能化金纳米颗粒细胞毒性测定
细胞毒性分析采用常用的四甲基偶氮唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)比色法[16],收集对数期SH-SY5Y细胞,制成细胞悬液,以每孔5×104个的密度接种于96 孔板中,每孔100 μL,再置于细胞培养箱中培养12 h。细胞贴壁后向其中分别加入不同质量浓度的金纳米和溶菌酶功能化金纳米颗粒,使其金纳米颗粒的终质量浓度为0、0.012、0.025、0.050、0.100、0.200 g/L,每个梯度做6 孔平行实验。2.5% CO2、37 ℃条件下孵育24 h后,每孔加入10 μL 5 g/L MTT染色液,继续培养4 h后,取出倾倒孔内液体,每个孔中加入100 μL二甲基亚砜(dimethyl sulfoxide,DMSO),室温下避光振荡反应15 min,于酶联免疫检测仪上测定570 nm波长处的吸光度。
2.1 溶菌酶功能化金纳米颗粒制备与表征
由图1A可知,合成的金纳米颗粒分散性好、形貌均一,平均粒径为(11.5±2.5) nm。图1A内嵌图为溶菌酶功能化金纳米颗粒TEM图,可以看出,溶菌酶修饰后的金纳米颗粒呈单分散状态,粒径均一,体系中没有明显的颗粒聚集。由图1B可知,金纳米颗粒的最大吸收峰在520 nm左右,溶菌酶的最大吸收峰在280 nm左右,而制备的溶菌酶功能化金纳米颗粒同时在280 nm和520 nm附近出现吸收峰,分别对应溶菌酶和金纳米的等离子共振峰,说明金纳米表面成功修饰溶菌酶。并且发现,当金纳米表面修饰溶菌酶后,金纳米的最大吸收峰发生红移,但是随着金纳米表面溶菌酶含量逐渐增加,金纳米最大吸收峰的偏移波长逐渐减小。由于反应体系的pH值(8.5)小于溶菌酶的等电点(10.8),此时溶菌酶带正电荷,当与表面带负电荷的金纳米接触时,会引起金纳米聚集,表现为金纳米的最大吸收峰发生红移[17]。但是随着金纳米表面溶菌酶含量的增加,金纳米颗粒被溶菌酶完全包围,有效阻止了金纳米颗粒之间的聚集,因此,金纳米的紫外吸收峰偏移减小。这一结果与溶菌酶功能化金纳米颗粒的粒径和Zeta电位的变化一致。
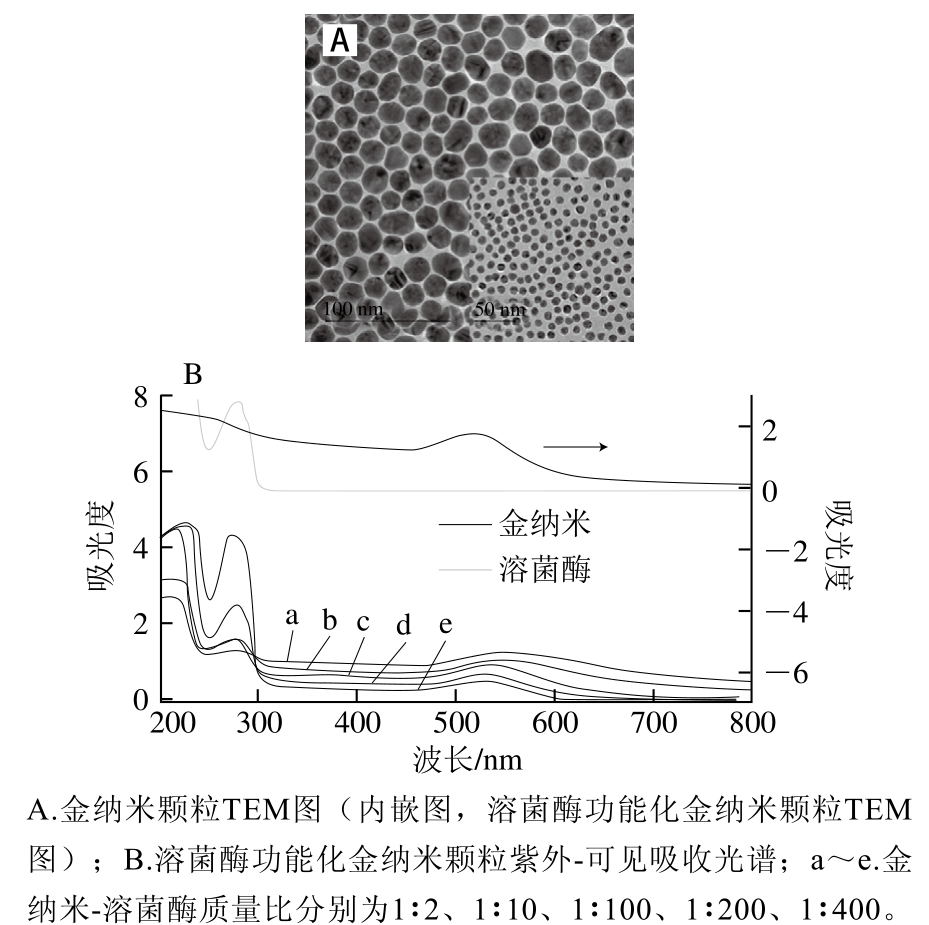
图1 溶菌酶功能化金纳米颗粒表征
Fig. 1 Characterization of lysozyme-functionalized Au NPs
表1 溶菌酶功能化金纳米颗粒粒径和电位
Table 1 Size and Zeta charge of lysozyme-functionalized Au NPs

如表1所示,与未修饰的金纳米相比,金纳米颗粒表面修饰溶菌酶后,其粒径和电位均增大。随着金纳米表面溶菌酶含量的增加,其粒径表现为先增大后减小然后保持不变的趋势,当溶菌酶-金纳米的质量比小于100时,其粒径由原来的11.5 nm增至66.7 nm,表明金纳米颗粒发生明显聚集,当溶菌酶-金纳米的质量比大于等于100时,其粒径减小至40 nm左右并保持不变,说明金纳米颗粒聚集程度减小,并且当溶菌酶的质量比为100时,金纳米表面的溶菌酶已经达到饱和。整个修饰过程中,Zeta电位由原来的-14.7 mV变为49.3 mV,说明金纳米表面成功修饰溶菌酶。
2.2 溶菌酶功能化金纳米颗粒抑菌活性测定

图2 不同材料对大肠杆菌和金黄色葡萄球菌的抑菌活性
Fig. 2 Antibacterial activities of different materials against E. coli and S. aureus
由图2A可知,单纯的金纳米颗粒对金黄色葡萄球菌和大肠杆菌均没有明显的抑制作用,即使在0.8 g/L时对2 种菌株的抑菌率仍小于50%,而此质量浓度的金纳米颗粒对哺乳细胞具有较大的毒性[18]。综合考虑不同质量浓度金纳米的细胞毒性及抑菌效率,选用0.05 g/L的金纳米颗粒作为基底材料,对其表面修饰溶菌酶。
由图2B可知,溶菌酶对2 种菌株都有一定的抑菌效果,并且对革兰氏阳性菌金黄色葡萄球菌的抑菌效果明显高于对革兰氏阴性菌大肠杆菌的抑菌效果。5 g/L溶菌酶能抑制80%的金黄色葡萄球菌,而对大肠杆菌的抑菌率只有53%。其原因在于,溶菌酶是一种作用于细菌细胞壁的胞壁质酶,能够水解细菌细胞壁中的肽聚糖层。由于革兰氏阳性菌的肽聚糖层位于细胞壁外层,因此溶菌酶对大多数革兰氏阳性菌都有较好的抑菌效果;而革兰氏阴性菌的肽聚糖层位于细胞壁的中间层,溶菌酶难以越过脂多糖作用于中间的肽聚糖层,因此溶菌酶对大多数革兰氏阴性菌的抑菌效果并不理想[19]。
由图2C可知,当金纳米颗粒表面修饰溶菌酶后,其抑菌效果大大提高,并且随着金纳米表面溶菌酶含量的增加,其对金黄色葡萄球菌和大肠杆菌的抑菌效果均逐渐提高。当金纳米-溶菌酶的质量比为1∶100时(其中金纳米质量浓度为0.05 g/L,溶菌酶的质量浓度为5 g/L),功能化金纳米颗粒对金黄色葡萄球菌的抑菌率达到99.5%,对大肠杆菌的抑菌率达到83%,明显高于同样质量浓度未修饰的金纳米颗粒和溶菌酶。并且发现,当溶菌酶-金纳米的质量比大于100后,其抑菌率增加幅度减小,可能是与金纳米颗粒的尺寸、表面电位和结合位点有关,根据粒径和Zeta电位的测量结果,当溶菌酶-金纳米质量比超过100时,金纳米表面的溶菌酶已经达到饱和,过多的溶菌酶不能结合到金纳米表面,导致其抑菌率不再增加,故选择金纳米-溶菌酶质量比为1∶100为宜。
2.3 溶菌酶功能化金纳米颗粒MIC实验中分别对金纳米、溶菌酶及溶菌酶功能化金纳米颗粒的MIC进行了测定,由表2可知,溶菌酶对大肠杆菌和金黄色葡萄球菌的MIC分别为20 g/L和13 g/L,单纯的金纳米颗粒对2 种菌株的MIC均大于2 g/L,此结果与平板计数法测得抑菌率的变化趋势一致。而溶菌酶功能化金纳米颗粒(金纳米-溶菌酶质量比为1∶100)对大肠杆菌和金黄色葡萄球菌的MIC分别为0.08 g/L和0.05 g/L,而该复合材料中含的溶菌酶的MIC降至单用时的0.4 倍。通过计算联合抑菌效果指标FIC值进一步考察并验证金纳米颗粒和溶菌酶的联合抑菌效果[20]。由表2可知,溶菌酶与金纳米颗粒对2 种供试菌的抑菌效果指数FIC小于0.5,表现为协同作用。联合抑菌效果的明显性表现为:对金黄色葡萄球菌的抑制能力大于大肠杆菌,且相对于溶菌酶或金纳米颗粒单独抑菌效果来说尤为明显。
表2 溶菌酶功能化金纳米颗粒MIC及联合抑菌效果评价
Table 2 MIC and synergistic antibacterial effect of lysozymefunctionalized Au NPs

2.4 溶菌酶功能化金纳米颗粒生长抑制曲线
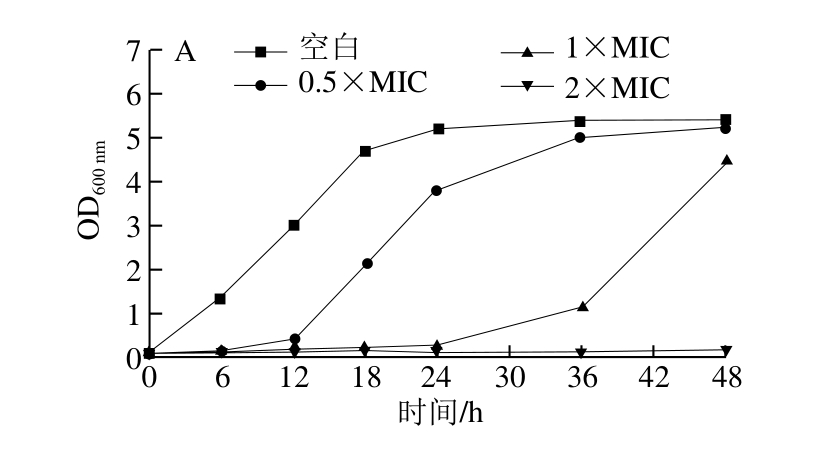
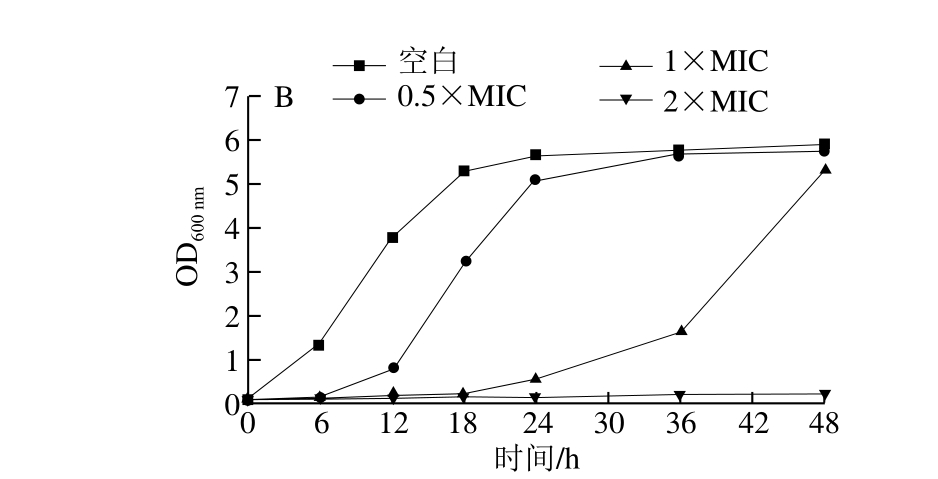
图3 不同质量浓度溶菌酶功能化金纳米颗粒作用下金黄色葡萄球菌(A)、大肠杆菌(B)的生长曲线
Fig. 3 Growth curves of S. aureus and E. coli in the presence of different concentrations of lysozyme-functionalized Au NPs
由图3可知,在0~48 h内,添加生理盐水(空白)的金黄色葡萄球菌和大肠杆菌快速生长,呈现典型的生长曲线。与空白组相比,添加溶菌酶功能化金纳米颗粒的实验组,能有效延长大肠杆菌和金黄色葡萄球菌的延滞期,且随着纳米颗粒质量浓度的提高延滞期变长。当溶菌酶功能化金纳米颗粒的质量浓度达到2 倍MIC时,能完全抑制两菌株的生长,菌液培养至48 h时其OD600nm值仍小于0.2。说明该方法制备的溶菌酶功能化金纳米颗粒具有较持久的抑菌性能。
2.5 活菌/死菌荧光染色分析

图4 活菌/死菌荧光染色CLSM图
Fig. 4 CLSM images of E. coli stained with LIVE/DEAD dye
图4 为SYTO 9/PI染色大肠杆菌的荧光照片。SYTO 9可以穿透所有的细胞膜,而PI只能穿透死亡细菌破损的细胞膜,从而使活菌被绿色荧光标记(图4A),死菌被红色荧光标记(图4B)[21]。通过此方法可以证明,细菌死亡是否与细胞膜破坏有关[22]。由图4可知,单纯金纳米颗粒处理的细菌约90%具有完整的细胞膜结构,仅有10%的细菌被红色标记;溶菌酶处理后,约40%细菌被红色荧光标记,说明少数细菌细胞膜结构受损;而溶菌酶功能化金纳米颗粒处理后,约80%的细菌失去完整的细胞膜结构、菌体死亡,被红色荧光标记的细菌数明显增加,此结果与抑菌活性实验结果基本一致(图2)。由此说明,溶菌酶功能化金纳米颗粒,通过溶菌酶与金纳米颗粒的协同作用破坏细菌细胞膜,增加细胞膜的通透性,从而达到高效杀菌的目的。
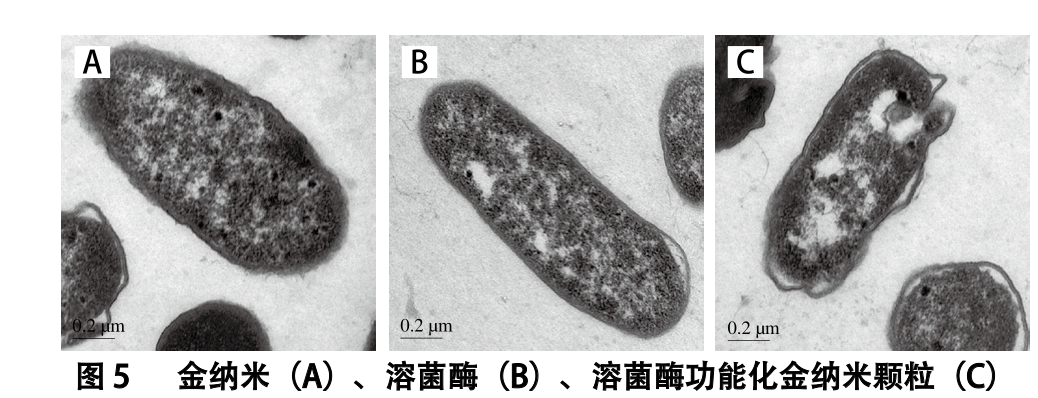
处理后的大肠杆菌TEM图
Fig. 5 TEM images of E. coli treated with different materials
2.6 TEM观察为了进一步说明溶菌酶功能化金纳米颗粒对大肠杆菌细胞形态的影响,通过TEM观察抑菌剂处理后的大肠杆菌,如图5所示。金纳米处理后的大肠杆菌细胞壁模糊、外膜表面出现破损,质壁略有分离,金纳米颗粒进入到细胞质内部,但细胞形状保持不变,仍然存活
(图5A)。在溶菌酶作用下,大肠杆菌质壁略有分离,细胞壁结构、层次不清,有空泡状物及斑片状低电子密度区形成,但菌体仍然保持细胞形状(图5B)[23]。而溶菌酶功能化金纳米颗粒处理后,纳米颗粒进入细胞质,大肠杆菌细胞整体皱缩变形、质壁严重分离,细胞壁及细胞膜断裂、出现孔洞,导致细胞内容物外流,细胞呈现为无定型的空壳形态(图5C)。大肠杆菌属于革兰氏阴性菌,其细胞壁由肽聚糖层和外膜构成,因此不易被溶菌酶水解[24]。而金纳米颗粒受表面官能团、电荷、粒径等的影响,极易吸附到菌体表面,通过在膜上形成孔洞进入到菌体内部,从而破坏微生物的细胞膜结构[25]。因此,通过将溶菌酶修饰于金纳米颗粒表面,一方面,能够增加细菌表面溶菌酶的局部浓度,增加其稳定性,提高溶菌酶的抑菌效果;另一方面,金纳米颗粒能够通过吞噬作用进入细胞内,使得修饰在金纳米表面的溶菌酶能够越过外膜,并作用于肽聚糖层,通过破坏细胞壁和细胞膜的结构和功能,最终导致细胞死亡[26]。
2.7 溶菌酶功能化金纳米颗粒细胞毒性

图6 溶菌酶功能化金纳米颗粒细胞毒性
Fig. 6 Cytotoxicity of lysozyme-functionalized Au NPs
功能化金纳米颗粒对SH-SY5Y的细胞毒性如图6所示。随着金纳米颗粒质量浓度的增加,金纳米处理的SH-SY5Y细胞存活率明显降低,说明金纳米对细胞的毒性增强,且当质量浓度大于0.025 g/L时,细胞存活率低于80%,通常认为此质量浓度的金纳米颗粒有毒性[27],此结果与Boyoglu等[18]的报道一致。相比于单纯的金纳米颗粒,溶菌酶功能化金纳米颗粒的细胞存活率显著(P<0.05)提高,即使在0.1 g/L高质量浓度金纳米颗粒的作用下,细胞存活率仍大于80%,说明通过表面修饰溶菌酶能有效降低金纳米颗粒的细胞毒性。纳米颗粒的毒性与纳米材料的剂量、尺寸、表面官能团、聚集状态等有密切关系[28-29],而溶菌酶是天然来源的防腐剂,具有良好的生物相容性,通过在金纳米表面修饰溶菌酶,能够有效提高金纳米颗粒的稳定性,通过阻止金纳米颗粒在细胞内的聚集,从而减弱金纳米颗粒对细胞的毒理作用[30]。因此,该研究制备的溶菌酶功能化金纳米颗粒具有良好的生物相容性。
通过纳米材料表面定向修饰制备的溶菌酶功能化金纳米颗粒,是一种绿色、高效的纳米抑菌材料,利用溶菌酶和金纳米颗粒的协同杀菌作用,0.1 g/L的溶菌酶功能化金纳米颗粒可以100%杀死大肠杆菌和金黄色葡萄球菌,并且具有持久的抑菌性能(48 h)和良好的生物相容性,与单纯的金纳米和溶菌酶相比,其对革兰氏阴性菌阳性菌的抑菌效果均显著提高。生物TEM和细胞染色结果显示,金纳米颗粒与溶菌酶的协同效果显著,两者共同作用导致细菌的细胞膜和细胞壁结构破坏,从而加速细菌的死亡,然而其具体作用机理和作用途径还不清楚,有待进一步研究。
参考文献:
[1] 卢小菊, 孟鸳. 溶菌酶与壳聚糖复配液抑菌作用的研究[J]. 中国食品添加剂, 2016(2): 51-56. DOI:10.3969/ j.issn.1006-2513.2016.02.002.
[2] AMINLARI L, HASHEMI M M, AMINLARI M. Modified lysozymes as novel broad spectrum natural antimicrobial agents in foods[J]. Journal of Food Science, 2014, 79(6): R1077- R1090. DOI:10.1111/1750-3841.12460.
[3] 任西营, 胡亚芹, 胡庆兰, 等. 溶菌酶在水产品防腐保鲜中的应用[J].食品工业科技, 2013, 34(8): 390-399.
[4] EBY D M, SCHAEUBLIN N M, FARRINGTON K E, et al. Lysozyme catalyzes the formation of antimicrobial silver nanoparticles[J]. ACS Nano, 2009, 3(4): 984-994. DOI:10.1021/nn900079e.
[5] SHARMA V K, yNGARD R A, LIN y. Silver nanoparticles: green synthesis and their antimicrobial activities[J]. Advances in Colloid and Interface Science, 2009, 145(1/2): 83-96. DOI:10.1016/ j.cis.2008.09.002.
[6] SOTIRIOU G A, PRATSINIS S E. Antibacterial activity of nanosilver ions and particles[J]. Environmental Science & Technology, 2010, 44(14): 5649-5654. DOI:10.1021/es101072s.
[7] DAS M, SGIM K H, AN S S A, et al. Review on gold nanoparticles and their applications[J]. Toxicology and Environmental Health Sciences, 2012, 3(4): 193-205. DOI:10.1007/s13530-011-0109-y.
[8] RAI A, PINTO S, VELHO T R, et al. One-step synthesis of highdensity peptide-conjugated gold nanoparticles with antimicrobial efficacy in a systemic infection model[J]. Biomaterials, 2016, 85: 99-110. DOI:10.1016/j.biomaterials.2016.01.051.
[9] LEE Y, GECKELER K E. Cytotoxicity and cellular uptake of lysozyme-stabilized gold nanoparticles[J]. Journal of Biomedical Materials Research Part A, 2012, 100(4): 848-855. DOI:10.1002/jbm. a.34020.
[10] 刘肇彧, 丁娅, 吴迪, 等. 生物医学新材料金纳米粒子的细胞毒性研究进展[J]. 药学进展, 2011, 33(4): 153-161. DOI:10.3969/ j.issn.1001-5094.2011.04.002.
[11] JIANG X M, WANG L M, WANG J, et al. Gold nanomaterials: preparation, chemical modification, biomedical applications and potential risk assessment[J]. Applied Biochemistry and Biotechnology, 2012, 166(6): 1533-1551. DOI:10.1007/s12010-012-9548-4.
[12] LAI H Z, CHEN W Y, WU C Y, et al. Potent antibacterial nanoparticles for pathogenic bacteria[J]. ACS Applied Materials & Interfaces, 2015, 7(3): 2046-2054. DOI:10.1021/am507919m.
[13] YAN W, XU L, XU C, et al. Self-assembly of chiral nanoparticle pyramids with strong R/S optical activity[J]. Journal of the American Chemical Society, 2012, 134(36): 15114-15121. DOI:10.1021/ja3066336.
[14] 张新娟, 左国营, 涛王, 等. 木犀草素与抗菌药体外联用抗耐甲氧西林金葡菌的作用研究[J]. 药学进展, 2012, 36(4): 173-179. DOI:10.3969/j.issn.1001-5094.2012.04.005.
[15] 李仲兴, 王秀华, 时东彦, 等. 五倍子提取物对表皮葡萄球菌的抗菌作用及其扫描和透射电镜观察[J]. 中国中医药信息杂志, 2004, 11(10): 867-869. DOI:10.3969/j.issn.1005-5304.2004.10.010.
[16] MAHMOUDI M, SERPOOSHAN V. Silver-coated engineered magnetic nanoparticles are promising for the success in the fight against antibacterial resistance threat[J]. ACS Nano, 2012, 6(3): 2656-2664. DOI:10.1021/nn300042m.
[17] DAS R, JAGNNATHAN R, SHARAN C, et al. Mechanistic study of surface functionalization of enzyme lysozyme synthesized Ag and Au nanoparticles using surface enhanced raman spectroscopy[J]. Journal of Physical Chemistry C, 2009, 113(52): 21493-21500. DOI:10.1021/ jp905806t.
[18] BOYOGLU C, HE Q W, WILLING G, et al. Microscopic studies of various sizes of gold nanoparticles and their cellular localizations[J]. ISRN Nanotechnology, 2013, 2013: 123838. DOI:10.1155/2013/123838.
[19] TINA F, YUE T, LI Y, et al. Computer simulation studies on the interactions between nanoparticles and cell membrane[J]. Science China Chemistry, 2014, 57(12): 1662-1671. DOI:10.1007/s11426-014-5231-7.
[20] 豆丽丽. 蛋清溶菌酶与茶多酚联合抑菌作用研究[J]. 包装学报, 2012, 4(4): 26-30. DOI:10.3969/j.issn.1674-7100.2012.04.006.
[21] SOTIRIOU G A, STARICH F, DASARGYRI A, et al. Photothermal killing of cancer cells by the controlled plasmonic coupling of silicacoated Au/Fe2O3nanoaggregates[J]. Advanced Functional Materials, 2014, 24(19): 2818-2827. DOI:10.1002/adfm.201303416.
[22] LI Y, YU H, QIAN Y, et al. Amphiphilic star copolymer-based bimodal fluorogenic/magnetic resonance probes for concomitant bacteria detection and inhibition[J]. Advanced Materials, 2014, 26(39): 6734-6741. DOI:10.1002/adma.201402797.
[23] 杨向科, 邹艳丽, 孙谧, 等. 海洋微生物溶菌酶的抑菌作用及抑菌机理初步研究[J]. 渔业科学进展, 2005, 26(5): 62-68. DOI:10.3969/ j.issn.1000-7075.2005.05.011.
[24] 卢亚萍, 潘宏涛. Aegis溶菌酶的抑菌作用及抑菌机理初步研究[J]. 饲料与畜牧, 2007(12): 15-17. DOI:10.3969/j.issn.1006-6314-B.2007.12.008.
[25] ADHIKARI M D, GOSWAMI S, PANDA B R, et al. Membranedirected high bactericidal activity of (gold nanoparticle)-polythiophene composite for niche applications against pathogenic bacteria[J]. Advanced Healthcare Materials, 2013, 2(4): 599-606. DOI:10.1002/ adhm.201200278.
[26] REGIELFUTYRA A, KUSLISKIEWICZ M, SEBASTIAN V, et al. Development of noncytotoxic chitosan-gold nanocomposites as efficient antibacterial materials[J]. ACS Applied Materials & Interfaces, 2014, 7(2): 1087-1099. DOI:10.1021/am508094e.
[27] 宋文植, 尹万忠, 杨欢, 等. MTT法检测纳米金粒子体外细胞毒性的研究[J]. 中国实验诊断学, 2011, 15(8): 1242-1245. DOI:10.3969/ j.issn.1007-4287.2011.08.004.
[28] 张富强, 佘文珺, 傅远飞. 六种纳米载银无机抗菌剂的体外细胞毒性比较[J]. 中华口腔医学杂志, 2005, 40(6): 504-506. DOI:10.3760/ j.issn:1002-0098.2005.06.018.
[29] SOENEN S J, MANSHIAN B, MONTENEGRO J M, et al. Cytotoxic effects of gold nanoparticles: a multiparametric study[J]. ACS Nano, 2012, 6(7): 5767-5783. DOI:10.1021/nn301714n.
[30] UBOLDI C, BONACCHI D, LORENZI G, et al. Gold nanoparticles induce cytotoxicity in the alveolar type-Ⅱ cell lines A549 and NCIH441[J]. Particle and Fibre Toxicology, 2009, 6: 18. DOI:10.1186/1743-8977-6-18.
Antimicrobial Activity of Lysozyme-Functionalized Gold Nanoparticles
YANG Longping, YAN Wenjing*, HUANG Mingming, QIAO Weiwei, ZHANG Jianhao*
(Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control, National Central of Meat Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:In order to improve the stability of lysozyme and its antibacterial activity against Gram-negative bacteria, as a green and highly efficient antibacterial agent, lysozyme-functionalized gold nanoparticles were prepared for the first time by surface modification of gold nanoparticles with lysozyme. The influences of the mass ratio of lysozyme to gold nanoparticles and the concentration of functionalized nanoparticles on the antibacterial activity against Gram-negative and Gram-positive bacteria were examined. The antibacterial mechanism of the prepared materials against Escherichia coli and the cytotoxicity on SH-SY5Y cells were also investigated. The results showed that compared with pure gold nanoparticles and lysozyme, the antibacterial activity of lysozyme-functionalized gold nanoparticles against E. coli and Staphylococcus aureus were obviously enhanced, which indicated the synergistic antibacterial effect of lysozyme and gold nanoparticles. Under optimized conditions, 0.1 g/L lysozyme-functionalized gold nanoparticles were able to completely kill the two types of bacteria. Besides, lysozymefunctionalized gold nanoparticles exhibited durable antibacterial properties and good biocompatibility, which were not toxic to mammalian cells. Transmission electron microscopy (TEM) images and live/dead bacterial assay showed that lysozymefunctionalized gold nanoparticles could kill bacteria by disrupting the cell membrane and cell wall.
Key words:lysozyme; gold nanoparticles; antibacterial activity; cytotoxicity; membrane permeability
DOI:10.7506/spkx1002-6630-201714013
中图分类号:TS206.4
文献标志码:A
文章编号:1002-6630(2017)14-0084-07
引文格式:杨龙平, 严文静, 黄明明, 等. 溶菌酶功能化金纳米颗粒抑菌性能研究[J]. 食品科学, 2017, 38(14): 84-90.
DOI:10.7506/ spkx1002-6630-201714013. http://www.spkx.net.cn
YANG Longping, YAN Wenjing, HUANG Mingming, et al. Antimicrobial activity of lysozyme-functionalized gold nanoparticles[J]. Food Science, 2017, 38(14): 84-90. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714013. http://www.spkx.net.cn
收稿日期:2016-06-16
基金项目:“十二五”国家科技支撑计划项目(2015BAD16B05);中央高校基本科研业务费自主创新重点项目(KYZ2015);江苏省农业科技自主创新项目(CX(15)1049)
作者简介:杨龙平(1991—),女,硕士研究生,研究方向为纳米抑菌材料开发。E-mail:2014108075@njau.edu.cn
*通信作者:严文静(1986—),女,讲师,博士,研究方向为纳米材料抑菌保鲜。E-mail:ywj1103@njau.edu.cn
章建浩(1961—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:nau_zjh@njau.edu.cn