表1 响应面试验因素与水平
Table 1 Variables and levels used in the three-factor, three-level response surface design

张丽丽1,范琳琳2,聂启兴2,黄延盛1,张全才1,殷军艺2,张 爽1,聂少平2,*
(1.无限极(营口)有限公司,辽宁 营口 115000;2.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
摘 要:采用响应面法优化蝙蝠蛾拟青霉菌丝体多糖的提取工艺,并对提取所得多糖的结构进行初步分析。结果表明:发酵虫草菌丝体多糖提取最佳工艺条件为提取温度98.0 ℃、提取时间4.5 h、液固比25∶1(mL/g),该条件下多糖得率为9.69%。菌丝体多糖主要由中性糖(84.7%)和糖醛酸(9.5%)组成。采用高效体积排阻色谱、红外光谱扫描和离子色谱对多糖结构进行光谱分析和单糖组成分析,结果表明该多糖主要为分子质量61.6 kD的单一色谱峰且可能呈吡喃环结构。另外,菌丝体多糖由阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和半乳糖醛酸组成,其物质的量比为2.5∶31∶36∶1∶15∶4。研究成果可为日后发酵虫草菌丝体多糖精细结构与活性研究以及产品开发提供一定理论依据。
关键词:发酵虫草菌丝体多糖;提取工艺优化;响应面;结构分析
冬虫夏草是指包括冬虫夏草在内广义的虫草属真菌的总称,为麦角菌科虫草属的药用真菌。近代研究表明冬虫夏草具有抗肿瘤、降血压、增强免疫力、调节内分泌等诸多药用价值[1-4],素与人参、鹿茸齐名,享有“东方传奇式珍宝”的美称,它也是中国中草药在世界范围内最具影响力的神奇中药之一[5-7]。
由于冬虫夏草极高的药用价值以及对生长环境的苛求,天然虫草的产量已远远不能满足人们的需求,而发酵虫草菌丝体的研究与开发则成为解决此问题的有效途径。蝙蝠蛾拟青霉是虫草中的一种常见内寄生真菌,通过深层发酵,可获得蝙蝠蛾拟青霉菌丝体。研究表明,蝙蝠蛾拟青霉菌丝体具有相当天然虫草的活性功能[8-10]。与天然虫草相比,人工发酵虫草菌粉的主要活性物质(如氨基酸、核苷类、虫草素、多糖等)与天然虫草在种类上基本一致,但含量和总量上有差异[11-12]。虫草多糖作为冬虫夏草中最主要的活性成分之一,具有抗氧化、抗炎、免疫调节、抗肿瘤以及降血糖等功效[2,12-13],然而,由于来源和发酵批次不同,菌丝体多糖的结构也有很大差异,因此相应的结构分析也是多糖活性研究过程中重要的理论基础[14-15]。
本研究在单因素试验的基础上,以发酵虫草菌丝体多糖得率为响应值,运用响应面分析法对发酵虫草菌丝体多糖的提取工艺条件进行优化,为发酵虫草菌丝体多糖的工业化生产提供理论参考。同时进一步对多糖进行分子质量、单糖组成和红外光谱等理化性质和组成成分分析,为发酵虫草菌丝体多糖的进一步开发利用提供理论支持。
1.1 材料与试剂
蝙蝠蛾拟青霉菌丝体粉由无限极中国有限公司提供。
单糖标准岩藻糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、果糖、半乳糖醛酸、葡萄糖醛酸(均为分析纯)、溴化钾(光谱纯) 美国Sigma公司;氢氧化钠、醋酸钠 阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
1260高效液相色谱(high performance liquid chromatography,HPLC)仪(配备紫外检测器、示差检测器) 美国Agilent科技有限公司;Dionex ICS-5000离子交换色谱仪(配备积分脉冲安培检测器) 美国Dionex公司;高效体积排阻色谱(high performance size exclusion chromatography,HPSEC)仪(配备示差检测器、黏度监测器、多角度激光光散射检测器) 美国Wyatt技术公司;XS-105电子分析天平 瑞士梅特勒-托利多集团;Nicolet 5700红外光谱仪 美国Thermo公司。
1.3 方法
1.3.1 虫草菌丝体多糖提取工艺流程
称取1 g干燥的虫草菌丝体粉,按一定液固比加入蒸馏水,按设计的工艺参数进行热水浴加热浸提,4 800 r/min离心10 min得上清液,真空浓缩后按80%比例加入无水乙醇,搅拌均匀,4 ℃静置过夜,4 800 r/min离心,收集醇沉物,干燥后测定其质量[16]。多糖得率计算如下式所示:
1.3.2 单因素及响应面试验优化设计
分别选取提取时间、液固比、提取温度3 个因素进行菌丝体多糖提取单因素试验。在单因素试验结果基础上,选取合适的水平,再利用Design-Expert 8.05软件进行试验设计,根据中心组合试验设计原理设计三因素三水平响应面试验,因素及水平设计见表1。
表1 响应面试验因素与水平
Table 1 Variables and levels used in the three-factor, three-level response surface design

1.3.3 虫草精制多糖制备及其结构初步分析
精密称取发酵虫草菌丝体干燥粉末300 g,提取多糖。醇沉之后4 800 r/min离心15 min,收集沉淀,沉淀加入蒸馏水复溶,再用Sevag法脱蛋白,反复进行3 次至无蛋白层。然后用蒸馏水透析48 h,冷冻干燥得虫草菌丝体精制多糖,用于理化性质及结构分析。
1.3.3.1 虫草多糖的基本化学组成
中性糖含量测定采用苯酚-硫酸法,酸性糖含量测定采用咔唑-乙醇法,蛋白含量测定采用考马斯亮蓝染色法,水分测定采用直接干燥法。
1.3.3.2 HPSEC分析
分别采用HPSEC广谱校正和HPSEC串联多角度激光光散射的标准方法对虫草菌丝体多糖的Mw及其分布进行分析[17]。HPSEC串联多角度激光光散射检测器、黏度检测器和示差检测器。Model 1500 HPLC泵连接两个分析柱:SB-806 HQ和SB-804 HQ,柱温35 ℃。流动相为0.2 mol/L NaNO3(含0.02% NaN3),流速为0.6 mL/min,ASTRA 6.1 software采集和分析数据。
1.3.3.3 单糖组成分析
采用高效阴离子交换色谱串联脉冲安培积分检测器分析虫草菌丝体多糖单糖组成。分析条件:CarboPacTMPA 20保护柱和CarboPacTMPA 20分析柱(4 mm×250 nm),流动相A为超纯水,B为250 mmol/L NaOH溶液,C为1 mol/L NaOAc溶液,梯度洗脱,洗脱程序见表2,流速为0.25 mL/min。
表2 Dionex色谱系统单糖和糖醛酸的洗脱程序
Table 2 Gradient elution procedure for separation of monosaccharides
a
nd uronic acid using Dionex chromatographic system

取多糖样品5 mg于具塞试管中,冰浴条件下加入0.5 mL 12 mol/L的浓硫酸,冰浴搅拌30 min,然后加水稀释至3 mL,转移至100 ℃油浴中水解4 h。水解完成后取出,迅速用冷水冷却,稀释后用0.22 μm针孔过滤器过滤后直接进样分析。单糖标准品配成不同浓度的单标和混标后直接进样分析,用于判断和计算样品中单糖的含量和种类。
1.3.3.4 红外光谱分析
称取充分干燥的多糖样品2 mg与KBr混匀研磨后压片,上机扫描分析,扫描范围400~4 000 cm-1[18]。
2.1 单因素试验结果
2.1.1 液固比对多糖得率的影响
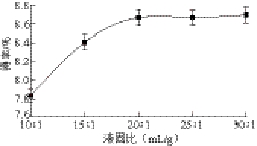
图1 液固比对多糖得率的影响
Fig. 1 Effect of solvent-to-solid ratio on the yield of polysaccharides
在固定提取温度90 ℃、提取时间2 h、提取1 次的条件下,考察液固比对多糖得率的影响,结果如图1所示。多糖等大分子物质在水中的溶解度与液固比密切相关,随着液固比的增加,多糖的得率呈现上升趋势,当液固比小于20∶1时,得率增长较快。当液固比大于25∶1时,上升已趋于平缓。虽然随着液固比的增加得率有轻微增长,但综合考虑浓缩以及醇沉的能耗,最佳液固比选择22∶1为宜。
2.1.2 提取温度对多糖得率的影响
在固定液固比20∶1、提取时间2 h、提取1 次的条件下,考察提取温度对多糖得率的影响,结果如图2所示。温度直接影响物质在水中的溶解度,因此对多糖的得率会有比较明显的影响。随着温度的升高,多糖的得率呈现上升趋势,当温度小于95 ℃时,得率增长较快。当温度大于95 ℃时,得率已趋于平缓。因此,最佳提取温度选择95 ℃。

图2 提取温度对多糖得率的影响
Fig. 2 Effect of extraction temperature on the yield of polysaccharides
2.1.3 提取时间对多糖得率的影响
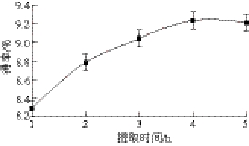
图3 提取时间对多糖得率的影响
Fig. 3 Effect of extraction time on the yield of polysaccharides
在固定液固比20∶1、提取温度95 ℃、提取1 次的条件下,考察提取时间对多糖得率的影响,结果如图3所示。随着时间的延长,多糖得率呈现上升趋势,当时间大于4 h时,得率已趋于平缓。因此,最佳提取时间选择4 h。
2.2 发酵虫草菌丝体多糖提取工艺优化
表3 响应面试验设计与结果
Table 3 Experimental design and results for response surface methodology
依据Design-Expert 8.05软件中的中心组合设计选项,得到发酵虫草菌丝体多糖提取的三因素三水平试验设计及结果,见表3。按照表3数据进行多元回归方程拟合,可建立以发酵虫草菌丝体得率(Y)对液固比(X1)、提取时间(X2)、提取温度(X3)的拟合方程为:Y=9.59+0.14X1+0.14X2+0.19X3+0.15X1X3+ 0.07X2X3-0.2X12-0.19X2
2-0.28X3
2。对回归方程进行显著性检验及方差分析结果(表4)表明,模型F值为17.08,极显著(P<0.01),且失拟项不显著(P=0.1103),因此可用该回归方程代替试验真实点对结果进行分析。相关系数R2为0.9564,表明用上述回归方程描述各因素与响应值之间的关系时,其因变量和全体自变量之间的线性关系显著,该模型与实际拟合较好。
表4 发酵虫草菌丝体多糖提取工艺条件的回归模型方差分析
Table 4 Analysis of variance of regression model for polysaccharides from Paecilomyces hepiali Chen & Dai

注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。
从表4可以看出,多糖提取模型建立中一次项和二次项均对多糖得率表现出极显著影响,交互项X1X3对多糖得率的影响表现为显著水平,而X1X2和X2X3不具有显著水平影响。因此,各因素对多糖得率的影响主次顺序为:X3(提取温度)>X1(液固比)>X2(提取时间)。
通过软件求解回归方程,得出提取工艺最优条件为液固比24.85∶1、提取时间4.48 h、提取温度97.75 ℃,预测得率为9.71%。考虑到实际的可操作性,选择液固比25∶1、提取时间4.5 h、提取温度98.0 ℃,在此条件下进行3次平行实验,验证实验结果显示发酵虫草菌丝体多糖得率为(9.69±0.04)%,相对标准偏差为1.5%,提取工艺稳定、可行。
2.3 基本组成分析
表5 发酵虫草菌丝体多糖组成成分
Table 5 Chemical composition of the extracted polysaccharide
表5显示,发酵虫草菌丝体多糖中中性糖含量较高,并含有部分糖醛酸(9.5%),离子色谱(图5)显示为半乳糖醛酸。除此之外,还含有少量水分和蛋白质。HPSEC(图4)结果显示出菌丝体多糖分子质量分布较为集中,有1个较大主峰(峰2),因此,可进一步对多糖进行纯化获得纯度更高、均一性更好的多糖纯品。
2.4 HPSEC分析
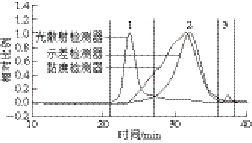
HPSEC串联多检测器(多角度激光光散射检测器、黏度检测器和示差检测器)技术已经被广泛应用于聚合物分子质量和大小的分析。图4为发酵虫草菌丝体多糖在不同检测器下的洗脱曲线,通过ASTRA 6.1 software计算,得到多糖的分子参数,结果如表6所示。色谱峰1处只存在单独的激光信号,可能是因为发酵虫草菌丝体多糖中存在极少量的高分子质量多糖组分或聚集体[19],这些组分的含量很低,在示差等浓度型检测器中几乎检测不出,但是由于分子尺寸大,光散射能力强,在光散射检测器(尤其是小角度)中可观察到这些极少量物质的信息。
表6 发酵虫草菌丝体多糖的分子参数
Table 6 Molecular parameter of the polysaccharide

如表6所示,色谱峰2的数均分子质量Mn和重均分子质量Mw分别34.7、61.6 kD,色谱峰3的Mn和Mw分别26.6 kD和35.8 kD,由此可知色谱峰2和色谱峰3的多分散系数(Mw/Mn)分别为1.77和1.35,表明菌丝体多糖的分子尺寸是一种宽分布且峰2的分子质量分布区间比峰3要更宽。ASTRA软件分析多糖样品的构象,即由分子旋转半径与分子摩尔数之间的关系曲线可得,该关系曲线用α表示[20-22]。一般认为α在0.5~0.8之间,表明多糖分子呈柔性无规则线团;当α增大,多糖的刚性随之增强。当α超过1时,表明多糖链呈棒状结构,低于0.3时则呈球形结构[23-24]。发酵虫草菌丝体多糖的主要成分(峰2)的α值为0.61,因此其结构可能呈柔性无规则线团结构。
2.5 单糖组成分析

图5 发酵虫草菌丝体多糖的单糖组成色谱图
Fig. 5 HPAEC chromatogram for the monosaccharide composition of
the polysaccharide
a.多糖样品色谱图;b.单糖标准色谱图。1.岩藻糖;2.鼠李糖;3.阿拉伯糖;4.半乳糖;5.葡萄糖;6.木糖;7.甘露糖;8.果糖;9.半乳糖醛酸;10.葡萄糖醛酸。
发酵虫草菌丝体多糖经酸水解后进离子色谱分析,结果如图5所示。根据不同单糖标准曲线计算得到,发酵虫草菌丝体多糖主要由阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖和半乳糖醛酸组成,其物质的量比为2.5∶31∶36∶1∶15∶4,另外还有极少量的岩藻糖和鼠李糖。单糖种类结果与Wu Zhongwei等[25]报道的类似,但是他们所提取的拟青霉多糖中甘露糖含量最高,这种差异可能因为菌种、发酵条件等的不同而导致的。其他有关发酵虫草菌粉多糖的报道中也有相似的单糖组成[26-27],表明发酵虫草菌丝体多糖属于杂多糖。
2.6 红外光谱分析

图6 发酵虫草菌丝体多糖的红外图谱
Fig. 6 FI-IR spectrum of the polysaccharide
发酵虫草菌丝体多糖红外光谱分析见图6,菌丝体多糖具有糖类化合物的特征吸收峰3 600~3 200 cm-1, 3 000~2 800 cm-1和1 400~1 200 cm-1。3 448 cm-1处是多糖分子中O—H的伸缩振动,说明存在分子内和分子间氢键[28-29]。2 931 cm-1波长处的峰是多糖类C—H伸缩振动,1 417 cm-1之间的吸收峰是多糖类C—H的变角振动[27]。1 652 cm-1为羰基伸缩振动,1 234 cm-1为—COOH中O—H键伸缩振动,1 040 cm-1的中等强度的信号峰是C—O—H和吡喃糖环C—O—C中C—O键伸缩振动引起的,877 cm-1处的吸收峰说明该多糖以β-糖苷键连接[30]。
本研究采用响应面法对发酵虫草菌丝体多糖的提取工艺条件进行优化,得出菌丝体多糖最佳提取工艺条件分别为提取温度98.0 ℃、提取时间4.5 h、液固比25∶1,该条件下多糖得率为9.69%。发酵虫草菌丝体多糖主要为分子质量61.6 kD的单一色谱峰,并且可能呈柔性无规则线团结构。单糖组成结果表明菌丝体多糖主要由半乳糖、葡萄糖和甘露糖组成,红外光谱表明多糖可能为吡喃环结构。本研究为进一步探讨发酵虫草菌丝体多糖活性与结构的关系提供数据支持,同时也为发酵虫草菌丝体多糖产品的开发及扩大应用提供初步理论依据。
参考文献:
[1] 申玲玲, 杜光. 冬虫夏草的药理作用[J]. 中国医院药学杂志, 2010, 30(2): 158-159. DOI:10.3969/j.issn.1008-049X.2003.06.027.
[2] LEE S, LEE H H, KIM J, et al. Anti-tumor effect of Cordyceps militaris, in HCV-infected human hepatocarcinoma 7.5 cells[J]. Journal of Microbiology, 2015, 53(7): 468-474. DOI:10.1007/s12275-015-5198-x.
[3] 王林萍, 余意, 冯成强. 冬虫夏草活性成分及药理作用研究进展[J]. 中国中医药信息杂志, 2014(7): 132-136. DOI:10.3969/ j.issn.1005-5304.2014.07.043.
[4] 刘高强, 王晓玲, 杨青, 等. 冬虫夏草化学成分及其药理活性的研究[J]. 食品科技, 2007, 32(1): 202-205. DOI:10.3969/ j.issn.1005-9989.2007.01.061.
[5] 张姝, 张永杰, SHRESTHA B, 等. 冬虫夏草菌和蛹虫草菌的研究现状、问题及展望[J]. 菌物学报, 2013, 32(4): 577-597.
[6] 丘雪红, 曹莉, 韩日畴. 冬虫夏草的研究进展、现存问题与研究展望[J]. 环境昆虫学报, 2016, 38(1): 1-23. DOI:10.3969/ j.issn.1674-0858.2016.01.1.
[7] 詹小涛, 赖桂萍, 朱德霞. 冬虫夏草及其发酵菌丝体药理作用研究进展[J]. 医学综述, 2012, 18(10): 1566-1569.
[8] 曾世明. 蝙蝠蛾拟青霉多糖的结构及活性研究[D]. 长春: 东北师范大学, 2011.
[9] WANG J, LI L Z, LIU Y G, et al. Investigations on the antifatigue and antihypoxic effects of Paecilomyces hepiali extract[J]. Molecular Medicine Reports, 2016, 13(2): 1861-1868. DOI:10.3892/mmr.2015.4734.
[10] WU Z, YANG Z, DAN G, et al. Influences of carbon sources on the biomass, production and compositions of exopolysaccharides from Paecilomyces hepiali, HN1[J]. Biomass & Bioenergy, 2014, 67: 260-269. DOI:10.1016/j.biombioe.2014.05.008.
[11] 钟石, 李有贵, 陈诗, 等. 人工培养蛹虫草与冬虫夏草的主要活性成分比较[J]. 蚕业科学, 2009, 35(4): 831-836. DOI:10.3969/ j.issn.0257-4799.2009.04.020.
[12] WANG J, KAN L, NIE S, et al. A comparison of chemical composition, bioactive components and antioxidant activity of natural and cultured Cordyceps sinensis[J]. Lebensmittel-Wissenschaft und-Technologie, 2015, 63(1): 2-7. DOI:10.1016/j.lwt.2015.03.109.
[13] DENG B, WANG Z P, TAO W J, et al. Effects of polysaccharides from mycelia of Cordyceps sinensis, on growth performance, immunity and antioxidant indicators of the white shrimp Litopenaeus vannamei[J]. Aquaculture Nutrition, 2014, 21(2): 173-179. DOI:10.1111/anu.12147.
[14] WANG Y, WANG M, LING Y, et al. Structural determination and antioxidant activity of a polysaccharide from the fruiting bodies of cultured Cordyceps sinensis[J]. American Journal of Chinese Medicine, 2009, 37(5): 977-989.
[15] ZHANG J, YU Y, ZHANG Z, et al. Effect of polysaccharide from cultured Cordyceps sinensis on immune function and antioxidation activity of mice exposed to60Co[J]. International Immunopharmacology, 2011, 11(12): 2251-2257. DOI:10.1016/ j.intimp.2011.09.019.
[16] 李景恩, 聂少平, 杨超, 等. 响应曲面法优化香薷多糖的提取工艺[J]. 食品科学, 2009, 30(18): 131-134. DOI:10.3321/ j.issn:1002-6630.2009.18.026.
[17] ZHANG H, NIE S P, YIN J Y, et al. Structural characterization of a heterogalactan purified from fruiting bodies of Ganoderma atrum[J]. Food Hydrocolloids, 2014, 36(5): 339-347. DOI:10.1016/ j.foodhyd.2013.08.029.
[18] 陈雪峰, 贾士儒, 王岳, 等. 发菜多糖的红外光谱分析与抗氧化活性的研究[J]. 食品与发酵工业, 2009(7): 133-137.
[19] LI W, WANG Q, CUI S W, et al. Elimination of aggregates of (1→3) (1→4)-β-D-glucan in dilute solutions for light scattering and size exclusion chromatography study[J]. Food Hydrocolloids, 2006, 20(2): 361-368. DOI:10.1016/j.foodhyd.2005.03.018.
[20] 王海燕, 戴军, 陈尚卫. 灵芝菌丝体多糖的分离纯化及其单糖组成分析与分子质量测定[J]. 食品与机械, 2015(5): 201-205.
[21] PU X, MA X, LU L, et al. Structural characterization and antioxidant activity in vitro of polysaccharides from angelica, and astragalus[J]. Carbohydrate Polymers, 2016, 137: 154-164. DOI:10.1016/ j.carbpol.2015.10.053.
[22] 张攀峰, 陈玲, 李晓玺, 等. 不同直链/支链比的玉米淀粉分子质量及其构象[J]. 食品科学, 2010, 31(19): 157-160.
[23] 康继. 天然高性能乳化剂—印度树胶的精细分子结构和构象特性研究[D]. 无锡: 江南大学, 2011.
[24] 杨涛, 郭龙, 李灿, 等. 红芪多糖HPS1-D的化学结构和抗补体活性研究[J]. 中国中药杂志, 2014, 39(1): 89-93. DOI:10.4268/ cjcmm20140118.
[25] WU Zhongwei, ZHANG Mingxia, XIE Minhao, et al. Extraction, characterization and antioxidant activity of mycelial polysaccharides from Paecilomyces hepiali HN1[J]. Carbohydrate Polymers, 2015, 137(3): 263-298. DOI:10.1016/j.carbpol.2015.11.010.
[26] 刘金花, 李富奎, 贾得儒, 等. 中国被毛孢发酵虫草菌丝体多糖的提取、纯化及其理化性质[J]. 食品与发酵工业, 2014, 40(3): 222-226.
[27] 许峰, 吴玲芳, 林善, 等. 发酵冬虫夏草菌丝体中虫草多糖含量的检测及结构鉴定[J]. 基因组学与应用生物学, 2014(6): 1294-1302.
[28] 黄静涵, 艾斯卡尔·艾拉提, 毛健. 灵芝多糖的分离纯化及结构鉴定[J].食品科学, 2011, 32(12): 301-304.
[29] ZHOU X, XU L, FENG S, et al. Characteristics and bioactivities of different molecular weight polysaccharides from camellia seed cake[J]. International Journal of Biological Macromolecules, 2016, 91: 1025-1032. DOI:10.1016/j.ijbiomac.2016.06.067.
[30] WU F, YAN H, MA X, et al. Comparison of the structural characterization and biological activity of acidic polysaccharides from Cordyceps militaris, cultured with different media[J]. World Journal of Microbiology & Biotechnology, 2012, 28(5): 2029-2038. DOI:10.1007/s11274-012-1005-6.
Optimization of Extraction and Structural Analysis of Polysaccharide from Paecilomyces hepiali Chen & Dai
ZHANG Lili1, FAN Linlin2, NIE Qixing2, HUANG Yansheng1, ZHANG Quancai1, YIN Junyi2, ZHANG Shuang1, NIE Shaoping2,*
(1. Infintus (Yingkou) Co. Ltd., Yingkou 115000, China; 2. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Abstract:Response surface methodology was applied to optimize polysaccharide extraction from Paecilomyces hepiali Chen & Dai. The extracted polysaccharide was structurally elucidated. The optimal extraction conditions were found to be 4.5 h extraction with hot water at 98.0 ℃ at water/material ratio of 25:1 (mL/g). Under these conditions, the maximum polysaccharide yield of 9.69% was obtained and the polysaccharide mainly composed of neutral polysaccharide (84.7%) and uronic acid (9.5%). High performance size exclusion chromatography (HPESC), high performance anion exchange chromatography and FT-IR spectroscopy were used to analyze the structural characteristics of the polysaccharide. Results showed that the molecular weight of the polysaccharide was 61.6 kD, displaying a single chromatographic peak, and its structure contained a pyran ring. In addition, the polysaccharide was composed of arabinose, galactose, glucose, xylose, mannose and galacturonic acid, with a molar ratio of 2.5:31:36:1:15:4. The findings may be useful for future studies on the structure-activity relationship of polysaccharides from Paecilomyces hepiali Chen & Dai and for the development of new polysaccharide-based products.
Key words:polysaccharide from Paecilomyces hepiali Chen & Dai; extraction optimization; response surface methodology; structural analysis
DOI:10.7506/spkx1002-6630-201714014
中图分类号:TS201.1
文献标志码:A
文章编号:1002-6630(2017)14-0091-06
引文格式:张丽丽, 范琳琳, 聂启兴, 等. 发酵虫草菌丝体多糖提取条件优化及其结构分析[J]. 食品科学, 2017, 38(14): 91-96.
DOI:10.7506/spkx1002-6630-201714014. http://www.spkx.net.cn
ZHANG Lili, FAN Linlin, NIE Qixing, et al. Optimization of extraction and structural analysis of polysaccharide from Paecilomyces hepiali Chen & Dai[J]. Food Science, 2017, 38(14): 91-96. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201714014. http://www.spkx.net.cn
收稿日期:2016-09-05
基金项目:“十二五”国家科技支撑计划项目(2012BAD33B06)
作者简介:张丽丽(1986—),女,工程师,硕士,研究方向为保健食品。E-mail:lili.zhang@infinitus-int.com
*通信作者:聂少平(1978—),男,教授,博士,研究方向为食品化学与分析、食品营养与安全、食品复杂碳水化合物。E-mail:spnie@ncu.edu.cn