表1 响应面试验因素与水平
Table 1 Factors and levels used in response surface design

姚国强,张雪梅,高志敏,赵燕霞,孙天松,张和平*
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室,农业部奶制品加工重点实验室,内蒙古 呼和浩特 010018)
摘 要:Lactobacillus reuteri IMAU10240(L. reuteri IMAU10240)是一株具有潜在益生特性的乳酸菌,为实现产业化应用,对其培养工艺进行优化以提高其活菌数。本研究以MRS培养基为基础,通过单因素筛选试验、正交试验和响应面优化试验对该菌株的培养基以及培养条件进行优化。通过实验确定L. reuteri IMAU10240最适培养基:蔗糖100.00 g/L,大豆蛋白胨13.25 g/L,酵母粉8.84 g/L,酵母蛋白胨13.25 g/L,Na2HPO419.85 g/L,柠檬酸2.58 g/L,MnSO4·5H2O 0.12 g/L,MgSO4·7H2O 0.40 g/L,甘油2.76 g/L,吐温-80 1.00 g/L,L-半胱氨酸盐酸盐0.50 g/L。初始pH 6.5,通入氮气37 ℃恒pH 5.5培养7~8 h。利用优化好的配方工艺进行5 L/50 L/200 L发酵罐的小试及中试试验,验证L. reuteri IMAU10240的发酵工艺,活菌数为7.57×109CFU/mL,冻干菌粉活菌数为2.59×1011CFU/g,可以进行生产验证。
关键词:罗伊氏乳杆菌;增殖培养基;高密度培养
罗伊氏乳杆菌(Lactobacillus reuteri)广泛存在于酸面团、肉和奶等发酵食品中以及人与动物的胃肠道中[1-4]。L. reuteri具有降胆固醇、改善和调节肠道菌群、提升机体免疫力、抑制致病菌和腐败菌(罗伊氏菌素)等功能[5-6],可广泛应用于奶酪和酸奶等奶制品、肉制品及功能性食品中。美国食品和药品管理协会在1989年已将其列为安全的微生物菌种。我国卫生部也于2010年将其纳入了《可用于食品的菌种名单》,2014年批准L. reuteri DSM17938用于婴幼儿食品。
乳杆菌属作为益生菌被广泛用来预防和治疗断奶幼畜的腹泻症状,并且是替代抗生素促进家畜生长的一种有效手段[7-8]。研究发现L. reuteri能够有效促进断奶仔猪生长、降低死亡率,促进仔猪肠绒毛发育,有助于完善新生仔猪的肠黏膜屏障功能;缓减低温对禽类的生长抑制,增加体重且降低死亡率;2015年我国学者完成了可用于仔猪健康养殖的L. reuteri 15007全基因组序列分析[9-13]。1989年美国食品药物管理局和美国饲料公定协会公布了L. reuteri可用于饲料生产,2013年我国农业部也将其列入《饲料添加剂品种目录(2013)》,允许在各种动物养殖中使用。
L. reuteri IMAU10240分离自内蒙古锡林郭勒盟镶黄旗大山羊粪便,L. reuteri IMAU10240对胃液和胆盐有较好的耐受力[14]。随着L. reuteri在食品和微生态制剂领域研究的逐渐深入,其应用前景光明。本研究主要目的是对L. reuteri IMAU10240培养基及培养工艺进行优化,以实现其富集培养,为该菌的后续工业化生产奠定基础。
1.1 材料与试剂
L. reuteri IMAU10240由内蒙古农业大学乳品生物技术与工程教育部重点实验室乳酸菌菌种库保藏和提供。
蔗糖 中粮屯河股份有限公司;大豆蛋白胨北京奥博星生物技术有限公司;酵母粉、酵母蛋白胨安琪酵母股份有限公司;Na2HPO4、MnSO4江苏科伦多食品配料有限公司;柠檬酸 潍坊英轩实业有限公司;MgSO4莱州市莱玉化工有限公司;吐温-80广东润华化工有限公司;L-半胱氨酸盐酸盐 宁波海硕生物科技有限公司。
1.2 仪器与设备
ZHJH-C1112C洁净工作台 上海智城分析仪器制造有限公司;UV-1700型分光光度计 日本岛津株式会社分析仪器部;FE20型实验室pH计 梅特勒-托利多仪器(上海)有限公司;SX-500型高压蒸汽灭菌锅 日本Tomy Digital Biology公司;GUJS-5L×3/GUJS-50L-50L-200L-200L全自动机械搅拌发酵罐 镇江东方生物工程设备技术有限责任公司;Lyo-5(CIP)真空冷冻干燥机东富龙科技股份有限公司。
1.3 方法
1.3.1 菌种活化
MRS培养基配方:植物蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖20 g,吐温-80 1 g,K2HPO42 g,醋酸钠5 g,柠檬酸钠水合物2 g,MgSO4·7H2O 200 mg,MnSO4·5H2O 54 mg,蒸馏水1 000 mL。调节pH 6.5, 121 ℃灭菌15 min。
将于-80 ℃保存的L. reuteri IMAU10240按照2%(V/V)的比例接入MRS液体培养基中,37 ℃厌氧培养24 h活化1 代;将第1代活化液按照2%的比例接入MRS液体培养基中,37 ℃厌氧培养24 h。
1.3.2 培养基成分筛选
以L. reuteri IMAU10240为研究对象,在MRS培养基的基础上,使用多种碳源和氮源替代MRS培养基中原有的碳、氮源,配制新的培养基进行筛选并确定碳氮总量和比例。在上述优化培养基的基础上,分别加入不同含量及种类的常用缓冲盐体系、微量元素、生长因子物质等,通过测定菌体密度确定不同物质对L. reuteri IMAU10240生长促进作用。培养基成分筛选时,三角瓶装液量为60%,接种完成后置于厌氧罐中静止培养,创造厌氧环境。
1.3.3 培养基成分比例优化
确定后的碳源、氮源和缓冲盐各组成分,通过Design-Expert 7.0软件,根据Box-Behnken设计原理,设计三因素三水平共计17 个点的响应面分析试验,其中12 个是析因点,用来估计误差的零点试验重复5 次,以菌体密度为响应值,碳源含量(X1)、氮源含量(X2)、缓冲盐含量(X3)为自变量,试验因素及水平设计见表1。
表1 响应面试验因素与水平
Table 1 Factors and levels used in response surface design

1.3.4 静态培养条件优化
研究不同温度、pH值和接种量对L. reuteri IMAU10240生长情况的影响,通过测定菌体密度和活菌数确定L. reuteri IMAU10240的最佳静态培养条件。用优化培养基在最适培养条件下培养L. reuteri IMAU10240,绘制L. reuteri IMAU10240生长曲线。以L. reuteri IMAU10240在MRS培养基中的生长情况为对照。
1.3.5 高密度发酵条件优化
确定最优静态培养条件的基础上,采用5 L液体发酵罐对L. reuteri IMAU10240的高密度发酵工艺条件进行单因素优化。其中,选取对高密度发酵条件影响显著的因素,如发酵恒pH值和气体环境等进行优化,以最终收获的发酵液中活菌数作为高密度发酵工艺的优化指标。发酵罐装液量为罐容积的60%(3 L培养基/5 L发酵罐),搅拌速率80 r/min,流加25%的氨水控制恒pH值,罐压0.03~0.05 MPa。
1.3.6 中试生产
在200 L×2液体发酵罐中进行高密度发酵,对优化后的高密度发酵工艺进行验证,同时为其大规模工业化生产提供基础数据。在进行200 L放大中试时,对生产中的发酵液活菌数、菌泥量、发酵时间、耗碱量及冻干粉活菌数等生产特性进行对比研究。
1.3.7 菌体生长情况及生产特性检测
菌体密度的测定:使用分光光度计,以蒸馏水为空白对照组,以接菌后发酵液为实验组,测定在600 nm波长处的吸光度并记录结果。
活菌数的测定:将待测发酵液和冻干菌粉等样品用灭菌的磷酸盐缓冲溶液将样品按10 倍梯度稀释至一定倍数,取1 mL稀释液用MRS琼脂培养基倾注平板,37 ℃厌氧48 h后计菌落总数,每个梯度4 个平行值,结果以CFU/mL或CFU/g表示。
pH值测定:取3 份平行样品在室温条件下,用FE20型精密pH计直接测量。
1.4 数据处理
响应面设计采用Design-Expert软件进行设计与分析,其他数据采用DPS和Origin进行数据分析和图表处理。
2.1 培养基营养成分的筛选
2.1.1 碳源和氮源的筛选
表 2L. reuteri IMAU10240在不同碳氮源培养基中的菌体密度(A600nm)
Table 2 Absorbances of L. reuteri IMAU10240 grown with different carbon and nitrogen sources
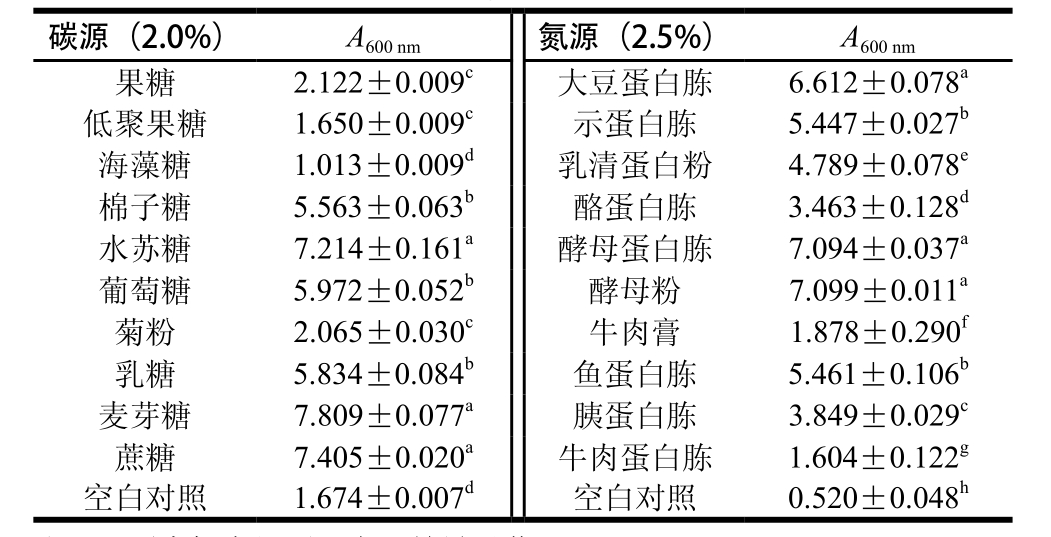
注:同列肩标字母不同表示差异显著(P<0.05)。
表2显示,L. reuteri IMAU10240对麦芽糖、蔗糖和水苏糖的利用能力最强,这与刘金玲等[15]对罗伊乳杆菌增殖培养基中碳源优化的结论相一致;其次为乳糖、葡萄糖和棉籽糖;果糖、菊粉和低聚果糖利用能力较弱;添加麦芽糖、蔗糖和水苏糖的实验组吸光度与以葡萄糖为碳源的MRS培养基、空白对照相比有显著差异(P<0.05)。故采用单因素试验筛选出的碳源物质为麦芽糖、水苏糖和蔗糖,但三者之间无显著性差异,因考虑到成本因素,故在相同情况下选择蔗糖为最佳碳源。L. reuteri IMAU10240对10 种不同氮源物质的利用情况表明,L. reuteri IMAU10240对酵母粉、酵母蛋白胨和大豆蛋白胨的利用能力最强;其次为鱼蛋白胨、示蛋白胨、乳清蛋白粉、酪蛋白胨和胰蛋白胨;牛肉蛋白胨、牛肉膏和脱盐乳清粉利用能力较弱。以酵母粉、酵母蛋白胨和大豆蛋白胨为单一氮源的实验组吸光度与以大豆蛋白胨、酵母粉和牛肉膏为复合氮源的MRS培养基相比无显著差异(P>0.05),与空白对照组相比有显著差异(P<0.05)。采用单因素试验筛选出的氮源物质为酵母粉、酵母蛋白胨和大豆蛋白胨,但三者之间无显著性差异,故需进行复配实验,正交试验设计结果见表3。
表3 氮源L(349)正交试验设计与结果
Table 3 Orthogonal array design L49(3) with experimental values of L. reuteri growth for optimization of combinations of three nitrogen sources

由表3可知,3 种氮源物质对罗伊氏乳杆菌生长影响大小依次为大豆蛋白胨、酵母粉和酵母蛋白胨,根据每因素的k值排序可知该3 种氮源的最优复配组合为A3B3D3,即大豆蛋白胨1.5%、酵母粉1.0%、酵母蛋白胨1.5%。
2.1.2 培养基碳氮源总量及比例优化
碳源与氮源是微生物所需营养和能量的主要物质来源,两者的添加总量与比列对微生物的生长有重要影响。前期实验优化的基础上,对碳氮总量及比例进一步优化,选取的碳氮总量范围为4%~8%,碳氮比例依次为1∶3、1∶2、1∶1、2∶1和3∶1,结果如图1所示。

图1 不同碳氮总量及比例对L. reuteriIMAU10240菌体密度的影响
Fig. 1 Effects of total concentration of nitrogen and carbon and carbon/nitrogen ratio on on the absorbance of L. reuteri IMAU10240
由图1可知,L. reuteri IMAU10240在随着碳氮总量逐渐递增的过程中,菌体密度在相应的增加,且差异显著(P<0.05)。L. reuteri IMAU10240在碳氮比为2∶1的培养基中生长较好,这种现象在不同碳氮总量的情况下均出现。故确定最佳碳氮比2∶1、碳氮总量8%。
2.1.3 培养基缓冲盐优化
乳酸菌在培养过程中会产酸导致坏境中pH值下降,进而抑制菌体生长,添加适当的缓冲盐对生长环境的pH值能起到一定的调节作用,同时还可以调节细胞的渗透压平衡。
表 4L. reuteri IMAU10240在不同缓冲盐体系下的菌体密度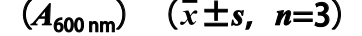
Table 4 Absorbance of L. reiteri IMAU10240 in different buffered salt
注:肩标字母不同表示差异显著(P<0.05)。
由表4可知,当培养基中添加某些特定种类和浓度的缓冲体系时,对菌体生长才有显著的促进作用。实验过程发现当添加0.02 mol/L与0.08 mol/L的Na2HPO4/一水柠檬酸和0.08 mol/L Na2HPO4/KH2PO4作为缓冲盐时与空白组相比有显著差异,但三者之间并无显著性差异(P>0.05)。故根据数据大小选取浓度为0.08 mol/L的Na2HPO4/一水柠檬酸为L. reuteri IMAU10240培养基的缓冲盐体系。
2.1.4 微量元素优化
微量元素是一类对微生物生长有促进作用,但需要量极其微小的元素。通常是作为某些活性物质的组成成分或者酶的激活剂发挥作用。本实验在培养基中加入了不同质量浓度的MnSO4·5H2O、ZnSO4·7H2O、MgSO4·7H2O、FeSO4·7H2O、CuSO4·5H2O。其对菌体密度的影响如图2所示。
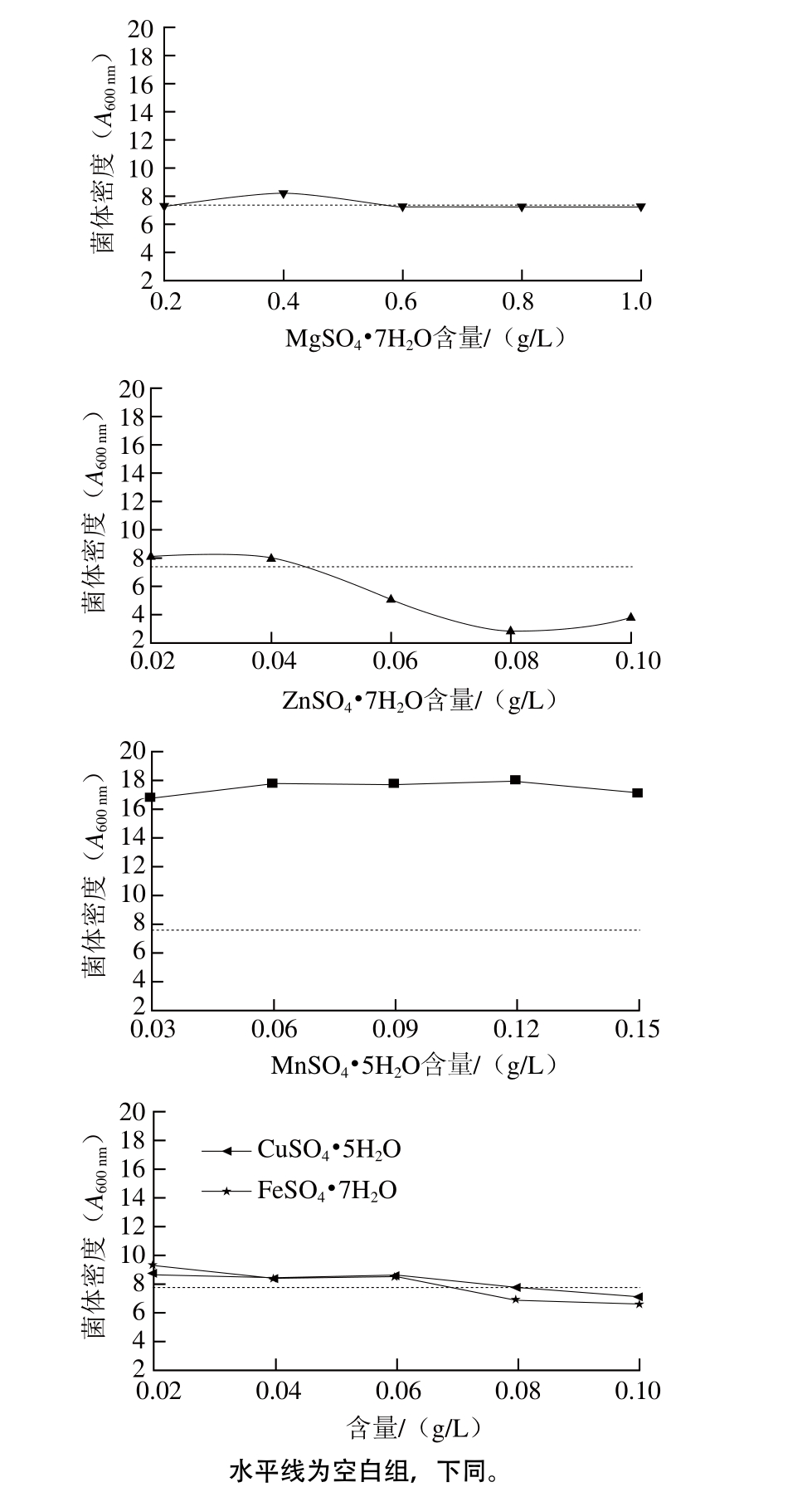
图2 微量元素对L. reuteriIMAU10240菌体密度的影响
Fig. 2 Effects of different types and concentrations of trace elements on absorbance of L. reuteri IMAU10240
Ibrahim[16]和Hayek[17]等研究发现添加Mg2+和Mn2+能够促进L. reuteri MM2-3的α-葡萄糖苷酶活性分别提高113.6%和100.6%,此外,Mg2+和Mn2+能够分别增加L. reuteri CF2-7F酸性磷酸酶94.7%和70.1%。由图2可知,添加MnSO4·5H2O组菌体密度与空白组相比有极显著差异(P<0.01),这与陈国等[18]对罗伊氏乳杆菌的研究结果相一致,选择的最佳质量浓度为0.12 g/L;FeSO4·7H2O、CuSO4·5H2O和ZnSO4·7H2O的添加与空白组相比无显著差异(P>0.05),故不在培养基中添加;考虑到糖酵解的大部分过程中都必须有Mg2+作为辅助因子,所以选择添加0.40 g/L的MgSO4·7H2O。因此L. reuteri IMAU10240微量元素优化结果为:添加0.12 g/L MnSO4·5H2O和0.40 g/L MgSO4·7H2O。
2.1.5 促生长物质优化
为促进微生物的生长,通常在培养基中添加一些微生物自身难以合成却是调节自身生长或代谢不可缺少的物质。以不添加任何生长因子的培养基作为空白对照,研究添加不同维生素、氨基酸和甘油对L. reuteri IMAU10240菌体密度的影响,结果如图3所示。
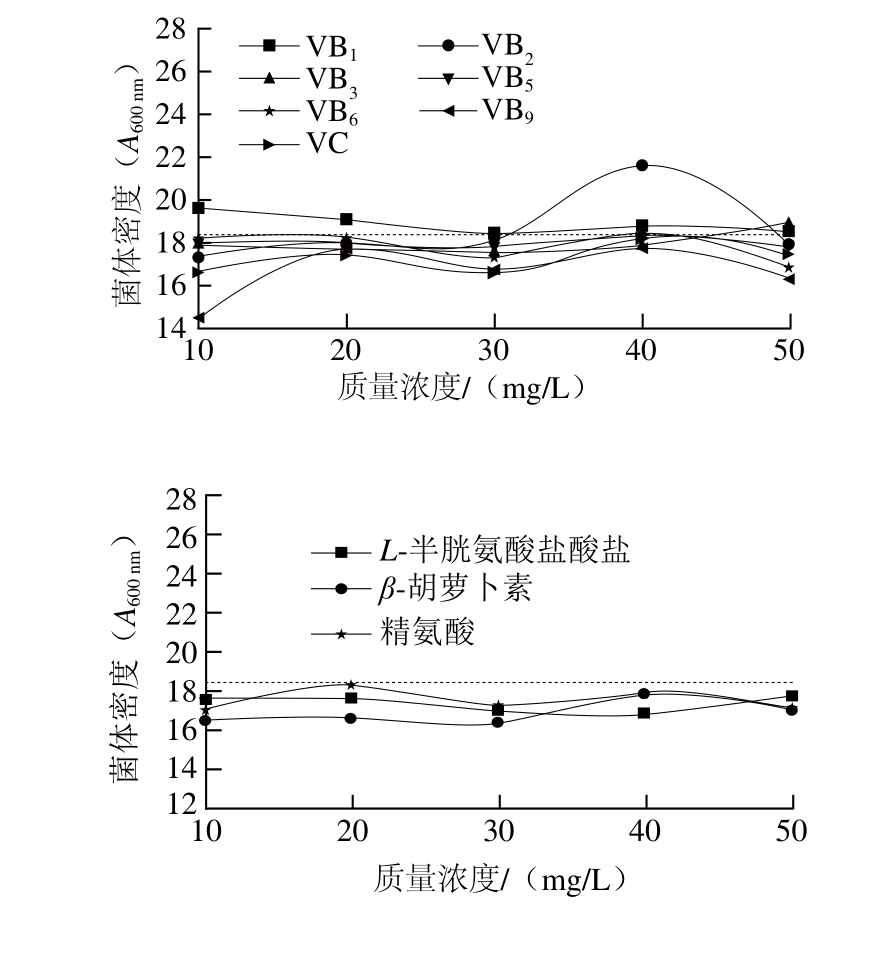
图3 不同生长因子对L. reuteriIMAU10240菌体密度的影响
Fig. 3 Effect of different growth factors on the absorbance of L. reuteri IMAU10240
图3 显示,当培养基中添加不同种类和含量的维生素时,VB1的促进效果高于其他维生素但与空白组相比无显著变化(P>0.05)。Santos等[19]研究发现L. reuteri CRL1098携带的基因簇(cbi、cob和hem)在厌氧环境下能够调控VB12的生物合成,表明L. reuteri能够自身合成维生素,这可能跟实验中菌株添加维生素后菌体无显著增值有关。添加精氨酸、β-胡萝卜素、L-半胱氨酸盐酸盐作用效果不显著,但考虑到L-半胱氨酸盐酸盐具有缓解氧胁迫的作用所以在优化培养基中添加0.50 g/L的L-半胱氨酸盐酸盐。
Talarico等[20]指出L. reuteri在代谢碳水化合物的过程中能够将甘油作为氢受体促进糖代谢,使菌体生长加快,最终获得较高的菌体细胞产量。在本实验中当添加浓度为30 mmol/L的甘油时,吸光度发生极显著提升。为验证结果的准确性,以吸光度与活菌数同时作为指标进行实验,结果如图4所示。
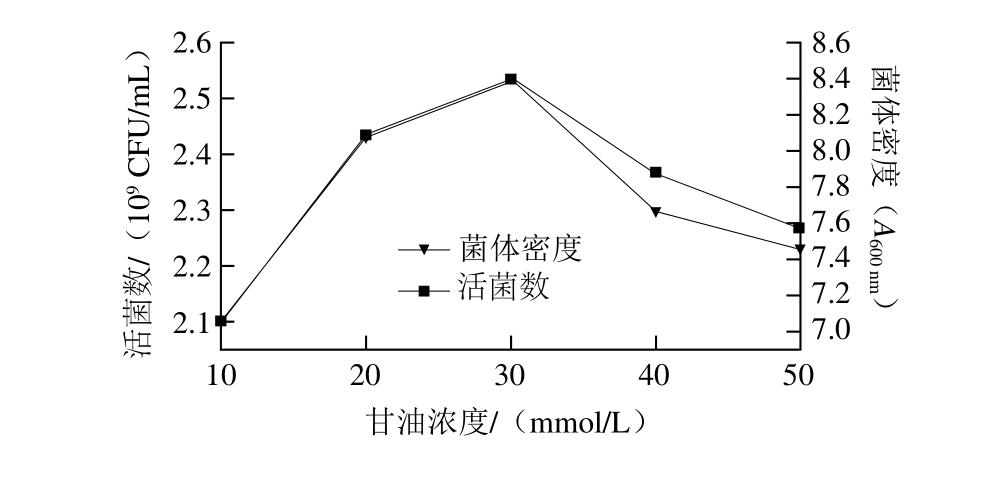
图4 甘油对L. reuteri IMAU10240的影响
Fig. 4 Effect of glycerol concentration on the absorbance of L. reuteri IMAU10240
菌体密度与活菌数都在添加30 mmol/L甘油时达到最高,之后随着甘油浓度的增加菌体密度与活菌数均出现下降趋势。综上所知,优化的培养中添加的促生长物质为0.50 g/L的L-半胱氨酸盐酸盐与30 mmol/L的甘油。
2.2 培养基成分响应面试验结果
2.2.1 响应面试验设计与结果
采用Design-Expert软件中的Box-Behnken试验设计对已确定的培养基主要成分的含量进行优化,以吸光度为评价指标,设计三因素三水平共17 个点的响应面分析。用来估计误差的零点试验重复5 次。具体设计及结果见表5。
表5 Box-Behnken试验设计及结果
Table 5 Box-Behnken experimental design with experimental results

用Design-Expert软件对上表中的数据进行处理,得到L. reuteri IMAU10240菌体密度与培养基主要的3种成分之间的方程模型为:Y=10.21+0.10X1+1.62X2-![]()
![]()
利用软件对17 个响应值进行显著性回归分析,结果显示二次项
 和
和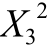 对L. reuteri IMAU10240菌体密度有显著影响(P<0.05),交叉项对L. reuteri IMAU10240菌体密度也有一定影响。整体模型显著(P<0.05),失拟项不显著(P>0.05)。该模型的系数R2为0.929 7,R2Adj为0.839 4,说明此方程与试验的拟合度良好[21]。
对L. reuteri IMAU10240菌体密度有显著影响(P<0.05),交叉项对L. reuteri IMAU10240菌体密度也有一定影响。整体模型显著(P<0.05),失拟项不显著(P>0.05)。该模型的系数R2为0.929 7,R2Adj为0.839 4,说明此方程与试验的拟合度良好[21]。
2.2.2 响应面分析
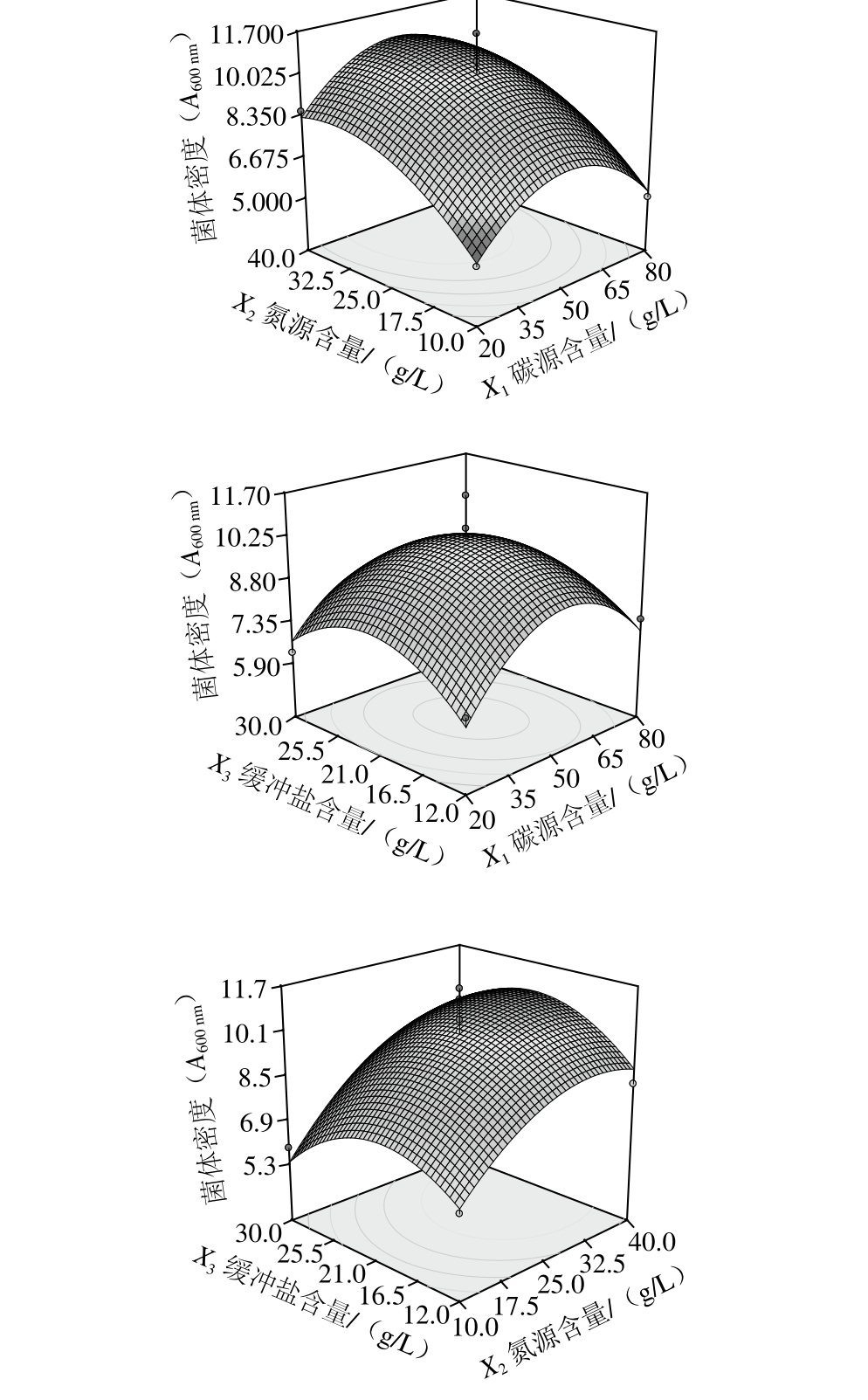
由图5可知,随着碳源、缓冲盐含量的增加,菌体密度随着增大,但当碳源、缓冲盐含量增大到一定程度后,菌体密度呈现下降趋势。最大的菌体密度值出现在曲面上,与沿着缓冲盐、碳源两者的坐标轴所出现的各自的最大值并不重合,可知缓冲盐与碳源之间有显著的交互作用(P<0.05)。随着氮源含量的增加,菌体密度先增大,后保持平衡。回归分析与响应面图都显示碳源与氮源、缓冲盐与氮源之间交互作用不显著(P>0.05)。
对采用响应面法得到的最终培养基中碳源50.86 g/L、氮源35.34 g/L、缓冲盐22.43 g/L,菌体密度预测值为10.77,为验证该法所得结果的可靠性,采用优化好的培养基配方按2%的接种量接种活化二代的L. reuteri IMAU10240,37 ℃厌氧培养,测定A600nm为11.25。与理论预测值相比无显著差异(P>0.05)。因此响应面优化得到的数据准确。最终优化好的静态培养基配方为:蔗糖50.86 g/L,大豆蛋白胨13.25 g/L,酵母粉8.84 g/L,酵母蛋白胨13.25 g/L,Na2HPO419.85 g/L,柠檬酸2.58 g/L,MgSO4·7H2O 0.40 g/L,MnSO4·5H2O 0.12 g/L,甘油2.76 g/L,吐温-80 1.00 g/L,L-半胱氨酸盐酸盐0.50 g/L。
2.3 静态培养条件优化
培养基成分优化完成的基础上,采用单因素试验确定L. reuteri IMAU10240的静态培养条件。包括培养温度、初始pH值和接种量,结果如表6所示。
表6 不同静态培养条件对L. reuteri IMAU10240菌体密度的影响
Table 6 Effect of different static culture conditions on the absorbance of L. reuteri IMAU10240

注:同列肩标字母不同表示差异显著(P<0.05)。
从表6可以看出,培养条件不同,L. reuteri IMAU10240的菌体密度之间差异显著(P<0.05)。最适合的初始pH值为6.5;在所选的温度范围内随着温度的升高,菌体密度呈现先升后降的趋势。最适温度为37 ℃。在初始pH 6.5、培养温度37 ℃的基础上对接种量进行优化,结果显示最佳接种量为2%。综合可知:L. reuteri IMAU10240的最佳静态培养条件为初始pH 6.5,接种量2%,37 ℃培养。
2.4 生长曲线绘制
最佳培养基及培养条件确定的基础上进行发酵,不同时间点取样测定吸光度,绘制生长曲线,如图6所示。

图6 不同培养基中L. reuteri IMAU10240的生长曲线
Fig. 6 Growth curve of L. reuteri IMAU10240 in different culture media
从图6可以看出,L. reuteri IMAU10240在两种培养基中,都是在接种4 h后开始进入对数生长期;两者相比,L. reuteri IMAU10240在优化培养基里菌体密度更高,对数生长期持续时间更长。菌株L. reuteri IMAU10240与陈国等[18]优化的菌株L. reuteri CG001和李文静等[22]对3株罗伊氏乳杆菌测定的生长曲线相一致。
2.5 高密度培养工艺优化
利用5 L×3联装全自动机械搅拌发酵罐在静态优化的基础上对上罐培养基及培养条件进行进一步的优化。
2.5.1 培养基碳源含量优化
L. reuteri IMAU10240为异型乳酸发酵,除生产乳酸外,还产生乙醇、乙酸和CO2等多种产物,产生的ATP也仅为同型乳酸菌产生ATP的一半。相比较而言,异型发酵乳酸菌需要更多的营养物质提供能量供给,为了使发酵液具有较高活菌数,增加碳源物质含量,具体结果见图7。
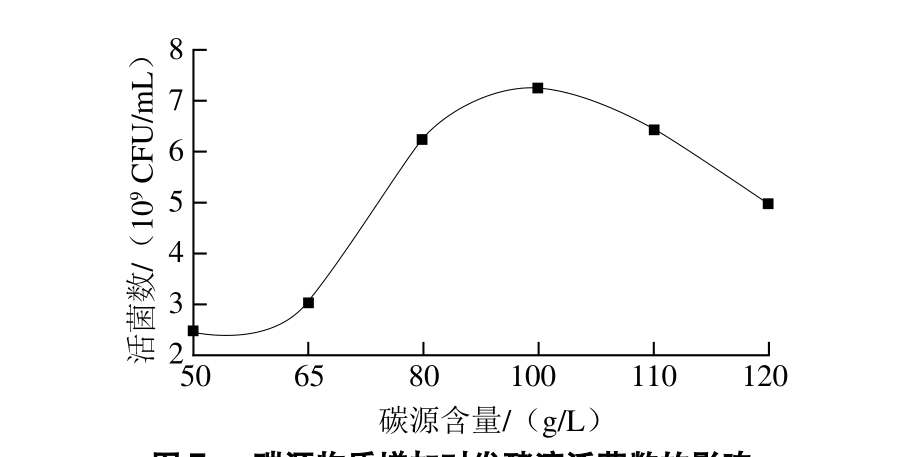
图7 碳源物质增加对发酵液活菌数的影响
Fig. 7 Effect of carbon source on the count of viable cells
从图7可以看出,当碳源含量从50.86 g/L逐渐增加到100.00 g/L时,发酵液活菌数不断升高;之后随着碳源含量的持续增加,发酵液活菌数不再升高。Tango等[23]研究发现,当L. helveticus恒pH值培养时,对碳源的利用速度和需求量明显增加。由于培养环境的变化,菌株的生长状况也发生着变化,适当提高碳源含量对于L. reuteri IMAU10240恒pH值培养是重要的,故选择碳源含量为100.00 g/L。
2.5.2 高密度培养恒pH值优化
乳酸菌高密度培养过程中培养液的恒pH值的高低对于最终发酵液的活菌数、菌泥得率以及发酵的时间均有显著影响。因此,利用5 L发酵罐对发酵液的恒pH值进行了优化,如图8所示。
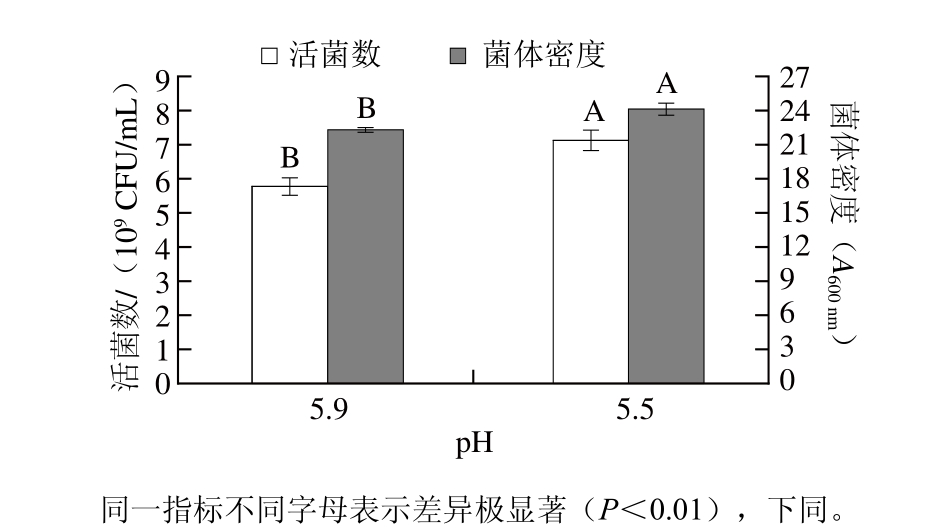
IMAU10240活菌数及菌体密度的影响
Fig. 8 Effect of culture pH on the count of viable cells and absorbance of L. reuteri IMAU10240
图8 发酵pH值对L. reuteri
培养基初始pH值为6.5,搅拌速度为100 r/min左右,25%的氨水作为中和剂,发酵温度37 ℃,停止加碱后采用倾注法计发酵液中L. reuteri IMAU10240的活菌数并测定吸光度,结果如图8所示。同一指标不同恒pH值发酵时,差异极显著(P<0.01),所以最佳发酵恒pH值应为5.5。这与王志林等[24]对L. reuteri LR2最适培养pH 5.5的结果相吻合。此外,Marcia等[25]研究发现L. reuteri 100-23能够将谷氨酸盐转化为γ-氨基丁酸,从而提高其酸性环境下的耐受性及发酵优势。
2.5.3 气体环境优化
一般认为,乳酸杆菌是一类兼性厌氧菌。研究发现,CO2、H2和N2构成的气体环境适合L. reuteri菌株的生长[26],因此,本实验结合具体的实验条件,选择混合气体(V(N2)∶V(H2)∶V(CO2)=80∶10∶10)、N2及空气3种气体环境以选择最优气体环境,其结果如图9所示。

图 9L. reuteri IMAU10240在不同气体环境下培养时的活菌数
Fig. 9 Changes in viable cell counts L. reuteri IMAU10240 cultured under different gas environments
如图9所示,在发酵罐中通入混合气体和氮气,L. reuteri IMAU10240发酵液活菌数较空气显著增高,差异极显著(P<0.01),但氮气和混合气体之间差异不显著。由于混合气体的成本远高于氮气,故本实验最后选择的气体环境是氮气。
2.6 小试发酵结果
利用已优化好的培养基和培养条件进行发酵实验,验证及比较高密度发酵工艺,结果对比如表7所示。
表 7L. reuteri IMAU10240静态培养与发酵罐试验结果
Table 7 Results obtained in static and small-scale fermentor culture of L. reuteri IMAU1024

表7显示,接种后2 h内菌体处于停滞期,此后氨水消耗速率加快并开始大量产气,菌体生长进入对数期。7 h后菌体生长处于稳定期。与静态培养相比,在5 L发酵罐中菌体生长速度快、生长周期明显缩短(时间缩短41.67%),活菌数为7.25×109CFU/mL,是静态培养的2.80 倍。
2.7 中试发酵结果
为了实现L. reuteri IMAU10240的工业化生产,经过实验室规模的高密度培养研究后,在2 个200 L液体发酵罐中进行L. reuteri IMAU10240的中试研究,并对工业生产影响较大的指标进行监测,结果见表8。
表8 L. reuteri IMAU10240中试试验结果
Table 8 Results obtained in pilot-scale high cell density fermentation of L. reuteri IMAU10240

注:耗碱量为1 L发酵液在恒pH值过程中所消耗的25%氨水的质量;菌体湿质量为100 mL发酵液高速离心后的菌体质量。
表8显示,中试发酵主要指标(发酵液活菌数、时间、耗碱量、菌体湿质量和菌粉活菌数)和小试发酵无明显差异,中试发酵液的菌体湿质量低于小试发酵,这跟L. reuteri IMAU10240发酵过程中产生较多的胞外多糖,离心得率低有关。Sims等[27]研究发现L. reuteri 100-23携带的果糖基转移酶基因(tft)能够将培养基质中的蔗糖转化为表多糖(β-2,6-果聚糖);而Bai等[28]研究发现蔗糖-6-葡萄糖基转移酶能够将蔗糖转化为表多糖(α-葡聚糖)。此外,相比较于其他的乳酸杆菌,L. reuteri IMAU10240产酸量(耗碱量)较低,且在培养的过程中有大量的CO2产生,原因是罗伊氏乳杆菌属于专性异型乳酸菌,其代谢产物中乳酸产量要比专性和兼性同型乳酸菌低。
本研究中试发酵液活菌数为7.57×109CFU/mL,制备的冻干菌粉活菌数为2.59×1011CFU/g。国外学者Doleyres等[29]采用分批培养的方式,罗伊氏菌活菌数为1.70×109CFU/mL,王志林等[24]采用改良MRS 培养基培养罗伊氏乳杆菌,活菌数为3.10×109CFU/mL。朱战波等[30]利用二次正交旋转组合法优化罗伊乳杆菌发酵培养基主成分为大豆蛋白胨5.0%、葡萄糖1.0%、酵母浸粉1.7%和低聚糖0.3%,该培养基氮源含量为6.7%,而培养基成分中氮源的价格最高,也是影响生产成本的主要因素。秦鹏等[31]优化的罗伊氏乳杆菌发酵培养基中葡萄糖3.09%、酵母粉4.19%和果蔬汁10.03%。本研究获得的配方和工艺中氮源含量为3.53%,碳源含量为10.00%且为蔗糖,培养基的成本显著降低;此外无需分批培养,简化生产工艺、缩短生产周期。综合上述结论,L. reuteri IMAU10240的增殖培养基及其高密度发酵工艺适合工业化生产,可以进行工业化生产验证。
本研究以工业化生产为出发点,降低培养基成本和简化生产工艺为目的,对菌株L. reuteri IMAU10240高密度培养配方和工艺进行了优化,并进行了中试研究验证,为工厂化生产该菌株微生态制剂提供基础数据。
通过单因素、正交和响应面优化试验确定L. reuteri IMAU10240最适培养基配方:蔗糖100.00 g/L,大豆蛋白胨13.25 g/L,酵母粉8.84 g/L,酵母蛋白胨13.25 g/L,Na2HPO419.85 g/L,柠檬酸2.58 g/L,MnSO4·5H2O 0.12 g/L,MgSO4·7H2O 0.40 g/L,甘油2.76 g/L,吐温-80 1.00 g/L,L-半胱氨酸盐酸盐0.50 g/L。
最优发酵工艺为:初始pH 6.5,37 ℃恒温培养,通入氮气,流加氨水控制恒pH 5.5。利用优化好的培养基进行5 L/50 L/200 L发酵罐的小试及中试试验,验证了L. reuteri IMAU10240的发酵工艺,中试发酵液活菌数为7.57×109CFU/mL,冻干菌粉活菌数为2.59×1011CFU/g,发酵过程主要监控指标稳定,可以进行工业化生产验证。
参考文献:
[1] VOGEL R F, BOCKER G, STOLZ P, et al. Identification of lactobacillus from sourdough and description of Lactobacillus pontis sp. nov[J]. International Journal of Systematic Bacteriology, 1994, 44(2): 223-229.
[2] STEVENS M J, VOLLENWEIDER S, MEILE L, et al. 1,3-Propanediol dehydrogenases in Lactobacillus reuteri impact on central metabolism and 3-hydroxypropionaldehyde production[J]. Microbial Cell Factories, 2011, 10(1): 8529-8532. DOI:10.1186/1475-2859-10-61.
[3] LINDGREN S E, DOBROGOSZ W J. Antagonistic activities of lactic acid bacteria in food and feed fermentations[J]. Fems Microbiology Reviews, 1990, 7(1/2): 149-163. DOI:10.1111/j.1574-6968.1990. tb04885.x.
[4] OH P L, BENSON A K, PETERSON D A, et al. Diversification of the gut symbiont Lactobacillus reuteri as a result of host-driven evolution[J]. ISME Journal, 2010, 4(3): 377-387. DOI:10.1038/ ismej.2009.123.
[5] 庞洁, 周娜, 刘鹏, 等. 罗伊氏乳杆菌的益生功能[J]. 中国生物工程杂志, 2011, 31(5): 131-137. DOI:10.13523/j.cb.20110522.
[6] 刘春娟, 边鑫, 赵士举. 具有抑制腐败菌能力的罗伊氏乳杆菌筛选及在酸乳生产中的应用[J]. 食品科学, 2016, 37(7): 157-162. DOI:10.7506/spkx1002-6630-201607029.
[7] PASCUAL M, HUGAS M, BADIOLA J, et al. Lactobacillus salivarius ctc2197 prevents Salmonella enteritidis colonization in chickens[J]. Applied and Environmental Microbiology, 1999, 65(11): 4981-4986.
[8] HUANG C H, QIAO S Y, LI D F, et al. Effects of Lactobacillus on the performance, diarrhea incidence, VFA concentration and gastrointestinal microbial flora of weaning pigs[J]. Asian-Australasian Journal of Animal Sciences, 2004, 17(3): 401-409. DOI:10.5713/ ajas.2004.401.
[9] MORITA H, TOH H, FUKUDA S, et al. Comparative genome analysis of Lactobacillus reuteri and Lactobacillus fermentum reveal a genomic island for reuterin and cobalamin production[J]. DNA Research, 2008, 15(3): 151-161. DOI:10.1093/dnares/dsn009.
[10] 杨凤娟, 曾祥芳, 谯仕彦. 罗伊氏乳杆菌I5007对新生仔猪肠道形态、二糖酶活性和紧密连接蛋白表达的影响[J]. 中国农业科学, 2014, 47(22): 4506-4515. DOI:10.3864/j.issn.0578-1752.2014.22.016.
[11] HOU C L, ZENG X F, YANG F J, et al. Study and use of the probiotic Lactobacillus reuteri in pigs: a review[J]. Journal of Animal Science and Biotechnology, 2015, 6(1): 1-8. DOI:10.1186/s40104-015-0014-3.
[12] CASAS I A, EDENS F W, PARKHURST C R, et al. Probiotic administrations of Lactobacillus reuteri moderate avian growth depression in Turkeys[J]. Bioscience of Microbiota Food & Health, 1998, 17(2): 125-131. DOI:10.12938/bifidus1996.17.125.
[13] 侯成立. 罗伊氏乳杆菌全基因组序列分析及其调节仔猪肠黏膜免疫功能的研究[D]. 北京: 中国农业大学, 2015: 1-27.
[14] 乔健敏, 席晓霞, 霍冬雪, 等. 内蒙古锡林郭勒牧区自然放养家畜肠道中乳酸菌的分离鉴定与潜在益生特性的筛选[J]. 中国奶牛, 2014(17): 6-13.
[15] 刘金玲, 李嘉文, 张含雪, 等. 罗伊乳杆菌增殖培养基中碳源氮源的优化[J]. 中国微生态学杂志, 2016, 28(5): 533-537. DOI:10.13381/ j.cnki.cjm.201605009.
[16] IBRAHIM S A, ALAZZEH A Y, AWAISHEH S S, et al. Enhancement of α-and β-galactosidase activity in Lactobacillus reuteri by different metal ions[J]. Biological Trace Element Research, 2010, 136(1): 106-116. DOI:10.1007/s12011-009-8519-2.
[17] HAyEK S A, SHAHBAZI A, WORKU M, et al. Enzymatic activity of Lactobacillus reuteri grown in a sweet potato based medium with the addition of metal ions[J]. SpringerPlus, 2013, 2: 465. DOI:10.1186/2193-1801-2-465.
[18] 陈国, 肖雅琴, 陈宏文. 罗伊氏乳杆菌培养基优化及其生长代谢研究[J]. 食品科学, 2010, 31(13): 174-179.
[19] SANTOS F, VERA J L, HEIJDEN R, et al. The complete coenzyme B12biosynthesis gene cluster of Lactobacillus reuteri CRL1098[J]. Microbiology, 2008, 154(1): 81-93. DOI:10.1099/mic.0.2007/011569-0.
[20] TALARICO T L, AXELSSON L T, NOVOTNY J, et al. Utilization of glycerol as a hydrogen acceptor by Lactobacillus reuteri: purification of 1,3-propanediol: NAD oxidoreductase[J]. Applied & Environmental Microbiology, 1990, 56(4): 943-948.
[21] RAO K J, KIM C H, RHEE S K. Statistical optimization of medium for the production of recombinant hirudin from Saccharomyces cerevisiae using response surface methodology[J]. Process Biochemistry, 2000, 35(7): 639-647. DOI:10.1016/S0032-9592(99)00129-6.
[22] 李文静, 梁运祥, 赵述淼. 3 株罗伊氏乳杆菌生物学特性的分析比较[J]. 微生物学通报, 2016, 43(5): 1035-1041. DOI:10.13344/ j.microbiol.china.150800.
[23] TANGO M S A, GHALY A E. Effect of temperature on lactic acid production from cheese whey using Lactobacillus helveticus under batch conditions[J]. Biomass and Bioenergy, 1999, 16(1): 61-78. DOI:10.1016/S0961-9534(98)00062-2.
[24] 王志林, 陈庄, 廖玲, 等. 猪源罗伊氏乳酸杆菌培养条件优化及其冻干保护剂筛选[J]. 广东农业科学, 2012, 39(19): 151-153. DOI:10.16768/j.issn.1004-874x.2012.19.064.
[25] MARCIA S S, SCHLICHT S, GÄNZLE M G. Contribution of glutamate decarboxylase in Lactobacillus reuteri to acid resistance and persistence in sourdough fermentation[J]. Microbial Cell Factories, 2011, 10(Suppl 1): S8. DOI:10.1186/1475-2859-10-S1-S8.
[26] SANTOS F, TEUSINK B, MOLENAAR D, et al. Effect of amino acid availability on vitamin B12production in Lactobacillus reuteri[J]. Applied and Environmental Microbiology, 2009, 75(12): 3930-3936. DOI:10.1128/AEM.02487-08.
[27] SIMS I M, FRESE S A, WALTER J, et al. Structure and functions of exopolysaccharide produced by gut commensal Lactobacillus reuteri 100-23[J]. ISME Journal, 2011, 5: 1115-1124. DOI:10.1038/ ismej.2010.201.
[28] BAI Y X, DOBRUCHOWSKA J M, Van Der KAAIJ R M. Structural basis for the roles of starch and sucrose inhomo-exopolysaccharide formation by Lactobacillus reuteri 35-5[J]. Carbohydrate Polymers, 2016, 151: 29-39. DOI:10.1016/j.carbpol.2016.05.048.
[29] DOLEYRES Y, BECK P, VOLLENWEIDER S, et al. Production of 3-hydroxypropionaldehyde using a two-step process with Lactobacillus reuteri[J]. Applied Microbiology and Biotechnology, 2005, 68(4): 467-474. DOI:10.1007/s00253-005-1895-4.
[30] 朱战波, 刘宇, 贾永全, 等. 二次正交旋转组合设计优化罗伊乳杆菌发酵培养基[J]. 中国生物制品学杂志, 2008, 21(6): 527-530. DOI:10.13200/j.cjb.2008.06.84.zhuzhb.013.
[31] 秦鹏, 谢鹏, 刘广宇, 等. 响应曲面法优化罗伊氏乳杆菌发酵培养基[J]. 安徽农业科学, 2016, 44(6): 91-93. DOI:10.13989/ j.cnki.0517-6611.2016.06.031.
Optimization of Enrichment Medium and High Cell Density Cultivation of Lactobacillus reuteri IMAU10240
YAO Guoqiang, ZHANG Xuemei, GAO Zhimin, ZHAO Yanxia, SUN Tiansong, ZHANG Heping*
(Key Laboratory of Dairy Biotechnology and Engineering, Ministry of Education, Key Laboratory of Dairy Products Processing, Ministry of Agriculture, Inner Mongolia Agricultural University, Hohhot 010018, China)
Abstract:Lactobacillus reuteri IMAU10240 is a potential probiotic lactic acid bacterium (LAB). This study aimed to achieve high viable counts of L. reuteri IMAU10240 by optimization of the composition of deMan Rogosa Sharpe (MRS) medium and culture conditions for industrialization application of this strain. The optimization was done using one-factorat-a-time method, orthogonal array design and response surface methodology. The optimal medium composition was determined as follows (g/L): sucrose 100.00, soy peptone 13.25, yeast extract powder 8.84, yeast peptone 13.25, Na2HPO419.85, citric acid 2.58, MgSO4·7H2O 0.40, MnSO4·5H2O 0.12, glycerol 2.76, Tween-80 1.00, and L-cysteine hydrochloride 0.50, and the optimal culture conditions were 7–8 h culture at 37 ℃ and constant pH 5.5 under nitrogen atmosphere. In small-scale and pilot-scale experiments, the optimized conditions yielded a viable cell count of 7.57 × 109CFU/mL, which increased to 2.59 × 1011CFU/g after lyophilization. The enrichment medium and culture conditions can be further verified in industrial production.
Key words:Lactobacillus reuteri; enrichment medium; high cell density fermentation
DOI:10.7506/spkx1002-6630-201714015
中图分类号:TS252.1
文献标志码:A
文章编号:1002-6630(2017)14-0097-09
引文格式:姚国强, 张雪梅, 高志敏, 等. Lactobacillus reuteri IMAU10240增殖培养基及高密度培养工艺优化[J]. 食品科学, 2017, 38(14): 97-105.
DOI:10.7506/spkx1002-6630-201714015. http://www.spkx.net.cn
YAO Guoqiang, ZHANG Xuemei, GAO Zhimin, et al. Optimization of enrichment medium and high cell density cultivation of Lactobacillus reuteri IMAU10240[J]. Food Science, 2017, 38(14): 97-105. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714015. http://www.spkx.net.cn
收稿日期:2016-09-28
基金项目:国家现代农业(奶牛)产业技术体系建设专项(CARS-37)
作者简介:姚国强(1985—),男,博士研究生,研究方向为乳酸菌发酵技术及其制剂应用。E-mail:yaoguoqiang1985@163.com
*通信作者:张和平(1965—),男,教授,博士,研究方向为乳酸菌及发酵乳制品。E-mail:hepingdd@vip.sina.com