
图1 4 种化合物的化学结构式
Fig. 1 Chemical structures of four compounds
杨 霞1,冯 锋1,2,*,刘荔贞2,陈泽忠2
(1.山西师范大学化学与材料科学学院,山西 临汾 041000;2.山西大同大学化学与环境工程学院,山西 大同 037009)
摘 要:利用高效毛细管区带电泳法,对3 个产地沙棘果粉中的芦丁、山柰酚、异鼠李素、槲皮素4 种活性物质进行同时分离测定。考察不同电泳条件对分离效率的影响,得出最佳电泳条件:缓冲溶液20 mmol/L Na2B4O7-H3BO3(质量浓度为1.5 mg/mL的β-环糊精),pH 9.55,检测波长370 nm,分离电压25 kV,进样时间5 s。在该条件下,芦丁、山柰酚、异鼠李素、槲皮素4 种活性物质在11 min内得到分离,线性范围分别为0.01~0.51、0.05~0.93、0.02~0.65、0.03~0.81 mg/mL,相关系数在0.997 1~0.999 1之间,检出限分别为5.05×10-5、2.10×10-5、3.75×10-5、1.31×10-5mg/mL(RSN=3),各物质线性关系良好。日内及日间精密度范围为0.08%~4.72%,平均回收率在95.51%~104.66%之间,相对标准偏差不大于3.92%(n=3)。在优化条件下,对4 种活性物质标准品的混合物进行测定,并用相同方法对3 个产地沙棘果粉中活性物质的提取液进行检测。结果表明:不同产地沙棘中,4 种被检测化合物的含量各不相同。沙棘中被测4 种化合物总量最高的产自新疆乌鲁木齐,最低的产自甘肃武威,而槲皮素含量以产自山西吕梁的最高,山柰酚和异鼠李素以产自新疆乌鲁木齐最高。本方法快速简便、准确可靠,可用于沙棘果粉中多种活性物质的同时检测。
关键词:高效毛细管区带电泳;芦丁;山柰酚;异鼠李素;槲皮素;沙棘
沙棘,又名酸刺、醋柳、黑刺,是一种多分布于西北、华北、西南等干旱、贫瘠地区的落叶性灌木植物。沙棘生命力强,耐寒、耐旱,在我国分布范围广,可用于沙漠绿化、防止水土流失。我国是沙棘资源最大、医用记载最早的国家[1-2]。在我国古代,沙棘常用于中药、藏药、蒙药中。现今,则作为一种药食同源植物被广泛应用。大量文献报道了沙棘中的化学成分及其功效,沙棘中含有糖类、维生素、氨基酸、有机酸、脂肪酸及微量元素等[3-7]多种化学成分;其中,异鼠李素主要来源于胡颓子科植物沙棘中,它具有止咳祛痰,活血化瘀等功效[8-10];此外,沙棘中也含有芦丁、山柰酚和槲皮素等酚类化合物,这些化合物能起到抗辐射氧化[11-13]、抗菌消炎[14-15]、调节血脂[16]、保护肝脏[17]、预防心脑血管疾病[18]及抗抑郁[19]等多种药理作用,在食品、保健品、药品、化妆品等多种领域具有广泛的应用前景和高附加的开发价值[20-21]。
目前,对沙棘中活性物质的测定方法有薄层色谱(thin layer chromatography,TLC)法[22-23],分光光度法[24],高效液相色谱(high performance liquid chromatography,HPLC)法[25-26]等,TLC法虽然操作方便,但测定结果的准确度低,用该方法测定具有一定的局限性;分光光度法因样品纯化度低,含有杂质干扰,导致分析结果产生较大偏差;HPLC法则具有成本较高,操作过程繁琐,分析时间较长等弊端。毛细管电泳技术具有柱效高,进样量少,灵敏度高,运行成本低等优点,因而被广泛应用到分离检测,本实验采用高效毛细管区带电泳(high performance capillary zone electrophoresis,HPCZE)法,对3 个产地沙棘果粉中的活性物质进行分离检测,在优化条件的基础上,建立了一种同时测定沙棘果粉中多种活性物质的新方法,为不同产地沙棘的质量评价提供了科学依据。
1.1 材料与试剂
不同产地沙棘果粉(新疆乌鲁木齐、甘肃武威、山西吕梁) 市售。
芦丁、山柰酚、异鼠李素、槲皮素对照品(纯度≥98.0%) 上海阿拉丁生化科技股份有限公司;硼砂、硼酸(均为分析纯) 天津市化学试剂三厂;氢氧化钠(分析纯) 天津市化学试剂批发公司;甲醇(分析纯) 天津市化学试剂供销公司;β-环糊精 上海化学试剂采购供应站;实验用水均为超纯水。
1.2 仪器与设备
P/ACETMMDQ高效毛细管电泳仪(包括二极管阵列检测器和32Karat7.0数据处理软件) 美国Beckman公司;未涂层柔性石英毛细管(60 cm×75 μm i.d.,有效长度50 cm) 河北省邯郸市鑫诺光纤色谱有限公司;KQ5200DA型数控超声波清洗器 昆山市超声仪器有限公司;AP250D型分析天平 美国Ohaus公司;Lambda35型紫外-可见分光光度计 美国PerkinEimer公司;PHS-25型雷磁精密酸度计 上海仪电科学仪器股份有限公司;TGL-16C高速离心机 菏泽石油化工学校仪器设备厂;Direct-Q 3UV型超纯水机 美国Millipore公司;0.22 μm一次性针头过滤器(有机系、水系)天津津腾实验设备厂。
1.3 方法
1.3.1 标准溶液的配制
精密称量芦丁、山柰酚、异鼠李素、槲皮素对照品适量,用甲醇溶解并定容配制为1.0 mg/mL的标准储备液。用0.22 μm的一次性有机系针孔过滤器过滤,置于冰箱中冷藏保存。
1.3.2 样品溶液的制备
准确称量沙棘果粉5.0 g于50 mL烧杯中,加入20 mL甲醇摇匀并封口,超声提取30 min,冷却至室温后,用甲醇补足减少的质量,以8 000 r/min高速离心10 min,取上清液,再加入38%盐酸溶液0.5 mL于75 ℃水浴水解30 min,冷却后用0.22 μm一次性有机系针孔过滤器过滤2 次,置于冰箱中保存备用。
1.3.3 电泳条件
新毛细管在使用前,用1 mol/L NaOH溶液、超纯水各冲洗30 min;再用背景缓冲溶液冲洗40 min。每天毛细管首次使用前,用1 mol/L NaOH溶液、超纯水和缓冲溶液各冲洗5 min。2 次分析间隔用1 mol/L NaOH溶液冲洗3 min,再用超纯水和缓冲溶液分别冲洗5 min,以提高重复性。所有溶液在进样前用0.22 μm一次性针头过滤器过滤,并超声脱气10 min。实验结束后,依次用1 mol/L NaOH溶液和超纯水分别冲洗5 min。
电泳条件:进样方式为压力进样,进样时间5 s;分离及检测条件:检测波长370 nm,分离电压25 kV,毛细管柱温25 ℃,运行缓冲溶液20 mmol/L Na2B4O7-H3BO3,质量浓度为1.5 mg/mL的β-环糊精,pH 9.55。
2.1 紫外吸收光谱的测定
取适当质量浓度的芦丁、山柰酚、异鼠李素、槲皮素标准品溶液,分别在波长200~450 nm范围内进行紫外扫描,各组分的吸收波长均不相同,但发现在波长370 nm处吸收最大。因此,选择370 nm作为检测波长。
2.2 电泳分离条件的优化

图1 4 种化合物的化学结构式
Fig. 1 Chemical structures of four compounds
高效毛细管电泳是离子或荷电粒子以高压电场为驱动力,在毛细管中按其淌度或分配系数的不同进行高效、快速分离的一种新型电泳分离技术。实验中测到的4 种活性物质的结构如图1所示,这几种化合物分子内都具有酚羟基,本身是电中性的,在电场中不移动,但在碱性条件下可以离解而带负电荷,样品在电解液中泳动,对样品的分析是基于样品荷质比的差异来进行分离,4 种物质在毛细管中的迁移方向与电渗流方向相反,比值越大,向阳极的迁移速度越快,在电渗流的驱动下,迁移到检测器端口的时间越长。对这4 种物质的标准品进行混合测定,其出峰的先后顺序依次为芦丁、山柰酚、异鼠李素和槲皮素。
2.2.1 柱温和分离电压对分离的影响
控制毛细管柱温可以调节电渗流(electroosmotic flow,EOF)的大小,可以改善分离效率和分离的重复性。毛细管温度的变化会影响分离效率、黏度、迁移时间和进样体积等。柱温恒定,可以保证毛细管内产生的焦耳热及时散失,确保毛细管的均衡稳定。EOF增大,缓冲溶液的黏度降低,管壁SiO2-解离能力增强,EOF增大,迁移速率增大,有利于分析物在较短时间内得到分离;但柱温太高,会产生太多的焦耳热,会使基线噪音增大,柱效下降,分离效果变差。因此,本实验选择在室温25 ℃条件下,进行电泳分析。

图2 分离电压对4 种化合物标准品分离的影响
Fig. 2 Influence of applied voltage on the separation of four standard compounds
1. 20 kV;2. 25 kV;3. 28 kV;4. 30 kV。4 种化合物标准品:a.芦丁、b.山柰酚、c.异鼠李素、d.槲皮素,图4~7同。
分离电压决定电场强度,电场强度会影响峰电流和迁移速率。分离电压增加,峰电流增大,迁移时间有所缩短,分离度增加。但太大的电压可能会出现受焦耳热影响而出现的峰展宽或变形现象。本实验在分离电压为20、25、28、30 kV条件下,考察了4 种分析物的分离情况,如图2所示。当分离电压20 kV时,各组分会出现拖尾现象,不利于样品准确分析;随着分离电压的逐渐增大,迁移时间逐渐缩短,当分离电压为25 kV时,4 种分析物在较短的时间内达到基线分离;分离电压继续增大,芦丁和山柰酚分离不完全,当电压为30 kV时,基线噪音增加。综合考虑上述因素,选择25 kV作为本实验的分离电压。
2.2.2 缓冲溶液浓度对电泳的影响
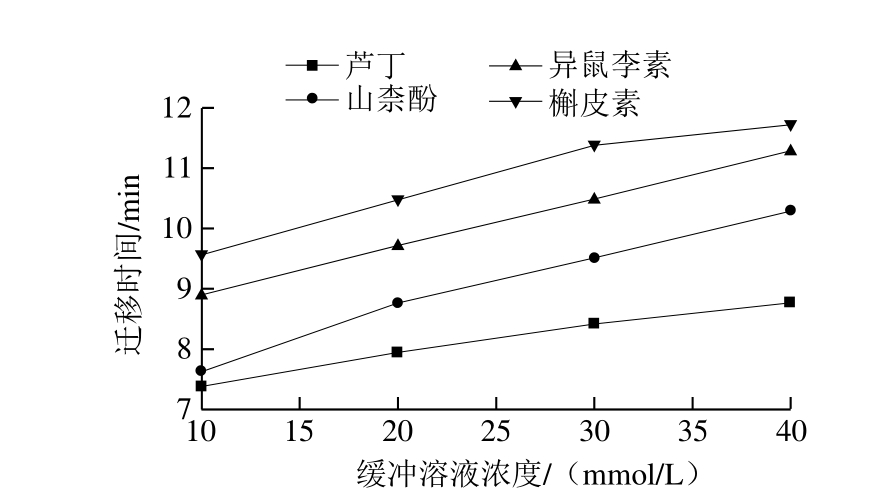
图3 运行缓冲溶液浓度对4 种化合物标准品分离的影响
Fig. 3 Influence of running buffer concentration on the separation of four standard compounds
缓冲溶液浓度会影响溶液的黏度,分析物的扩散以及Zeta电势。Zeta电势的变化会影响到EOF,进而影响迁移时间。随着缓冲溶液浓度增大,高浓度的硼酸盐会将分析物结构中的—O—转化成带负电荷的络合物形式,根据其荷质比得以分离,分离度逐渐增大,EOF也增大。但浓度太大,电流过大,焦耳热效应增加,引起峰形展宽,信噪比降低,而且迁移时间延长,分离效率降低。本实验考察了硼砂(Na2B4O7)-硼酸(H3BO3)缓冲溶液浓度为10、20、30、40 mmol/L时,4 种分析物的分离情况,如图3所示,当缓冲溶液浓度为10 mmol/L时,芦丁和山柰酚不能很好的分离;缓冲溶液浓度为20、30 mmol/L时,虽然4 种物质都能较好的分离,但缓冲溶液浓度为30 mmol/L时,迁移时间相对较长,浓度继续增大,当浓度为40 mmol/L时,异鼠李素和槲皮素分离度降低。从分离时间和分离度综合考虑,最终确定20 mmol/L Na2B4O7-H3BO3为最佳缓冲溶液浓度。
2.2.3 缓冲溶液pH值对电泳的影响

图4 运行缓冲溶液pH值对4种化合物标准品分离的影响
Fig. 4 Influence of running buffer pH on the separation of four standard compounds
毛细管电泳法的主要驱动力是EOF,而缓冲溶液pH值的变化对EOF的影响较大,主要通过影响组分的存在形式、解离程度、离子化程度等,从而改变体系的EOF。本实验分离这4 种活性物质选择在Na2B4O7-H3BO3缓冲溶液中进行,一方面是因为所检测的活性物质在该缓冲溶液中会形成络合物;另一方面是由于在碱性条件下,结构中的羟基可以发生解离。pH值太高,会使分离时间延长,电渗流增大,峰的分辨发生改变。因此,最佳pH值条件需要通过实验来优选。本实验考察了硼酸盐缓冲溶液pH值在9.15~9.65之间对4 种分析物分离的影响。如图4所示。当pH值为9.15时,芦丁和山柰酚不能分离,pH值为9.35时,芦丁和山柰酚分离不完全,当pH值为9.65时,迁移时间延长,峰形展宽。结果表明,当缓冲溶液pH值为9.55时,分离效果最佳。
2.2.4 β-环糊精加入量对电泳的影响
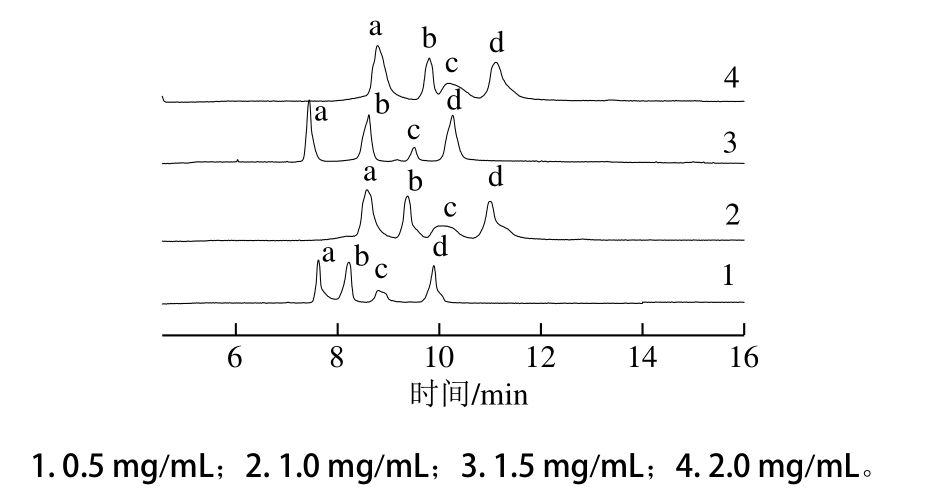
图 5β-环糊精加入量对4 种化合物标准品分离的影响
Fig. 5 Influence of addition of β-cyclodextrin on the separation of four standard compounds
缓冲溶液中适当的加入添加剂,可以改变溶液的极性,有利于改善峰形,提高分离效率。β-环糊精以其高度的选择性和良好的稳定性常用作缓冲溶液添加剂。β-环糊精的加入,会使分析物与β-环糊精之间通过非价键力形成主客体包合物,整个结构外部亲水,内部形成空腔疏水。这种特殊的结构会降低EOF,增加分离的有效距离,进而改变迁移速率,从而实现较好分离。在其他条件一定的情况下,本实验考察了在添加不同质量浓度(0.5、1.0、1.5、2.0 mg/mL)的β-环糊精后,4 种分析物的分离情况,如图5所示。当β-环糊精为0.5 mg/mL时,芦丁和山柰酚不能完全分离,异鼠李素峰形较差;当添加1.0 mg/mL和2.0 mg/mL的β-环糊精时,4 种分析物均不能完全分离,且峰形都变差。因此,β-环糊精的最佳质量浓度为1.5 mg/mL。
2.2.5 进样时间对电泳的影响

图6 进样时间对4 种化合物标准品分离的影响
Fig. 6 Influence of injection time on the separation of four standard compounds
进样时间会影响样品的进样量,进而影响到样品在毛细管中的扩散。通过选择合理的进样时间也可以改善分离效果。进样时间太短,会导致峰面积太小,分析误差大。本实验考察了进样时间在3~7 s范围内对4 种分析物分离测定的影响,如图6所示。进样时间小于5 s时,进样量少,出峰不明显。随着进样时间的延长,当进样时间大于5 s时,峰形展宽,峰拖尾现象严重。综合考虑,选择5 s作为最佳进样时间。
2.3 标准曲线的建立及检出限结果
表1 4 种化合物的线性方程、相关系数、线性范围及检出限
Table 1 Linear equations, correlation coefficients, linearity ranges and limits of detection for four compounds
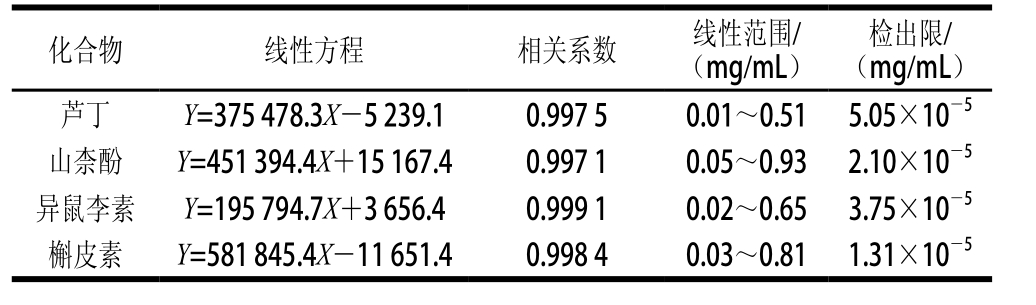
用甲醇分别稀释4 种化合物标准液,配制一系列质量浓度溶液,在优化的实验条件下依次进行电泳分析测定,以各标准品的质量浓度(mg/mL)为横坐标,对应的峰面积为纵坐标作线性回归,得到的线性方程、相关系数、线性范围及检出限如表1所示,相关系数范围为0.997 1~0.999 1,检出限的范围为1.31×10-5~5.05× 10-5mg/mL(RSN=3)。结果表明,该方法灵敏度较高,线性关系良好,可用于实际样品的测定。
2.4 精密度测定结果
表2 精密度实验(n=3)
Table 2 Relative standard deviations for inter-day and intra-day precision (n=3)

在最佳电泳条件下,对该方法用于检测4 种化合物的精密度进行考察。分别取4 种标准样品各60 μL均匀混合,日内连续进样3 次,日间进样为每天的同一时间点,3 d完成。根据所测得结果,计算日内、日间迁移时间精密度(相对标准偏差,relative standard deviation,RSD)和峰面积精密度。如表2所示,日内迁移时间RSD不大于0.20%,峰面积RSD不大于1.06%;日间迁移时间RSD不大于1.77%,峰面积RSD不大于4.72%。由此说明,该方法精密度较为良好。
2.5 加标回收率测定结果
按照1.3.2节的方法制备3 种产地沙棘实际样品,取一定量的样品3 份,分别加入低、中、高对应含量的标准品,在最佳电泳条件下平行测定3 次,计算加标回收率,结果见表3,回收率在95.51%~104.66%之间,RSD不大于3.92%。说明该方法对于测定沙棘样品具有较好的可行性。
表3 样品加标回收率实验(n=3)
Table 3 Recoveries for spiked samples (n=3)

2.6 实际样品分析
2.6.1 定性分析

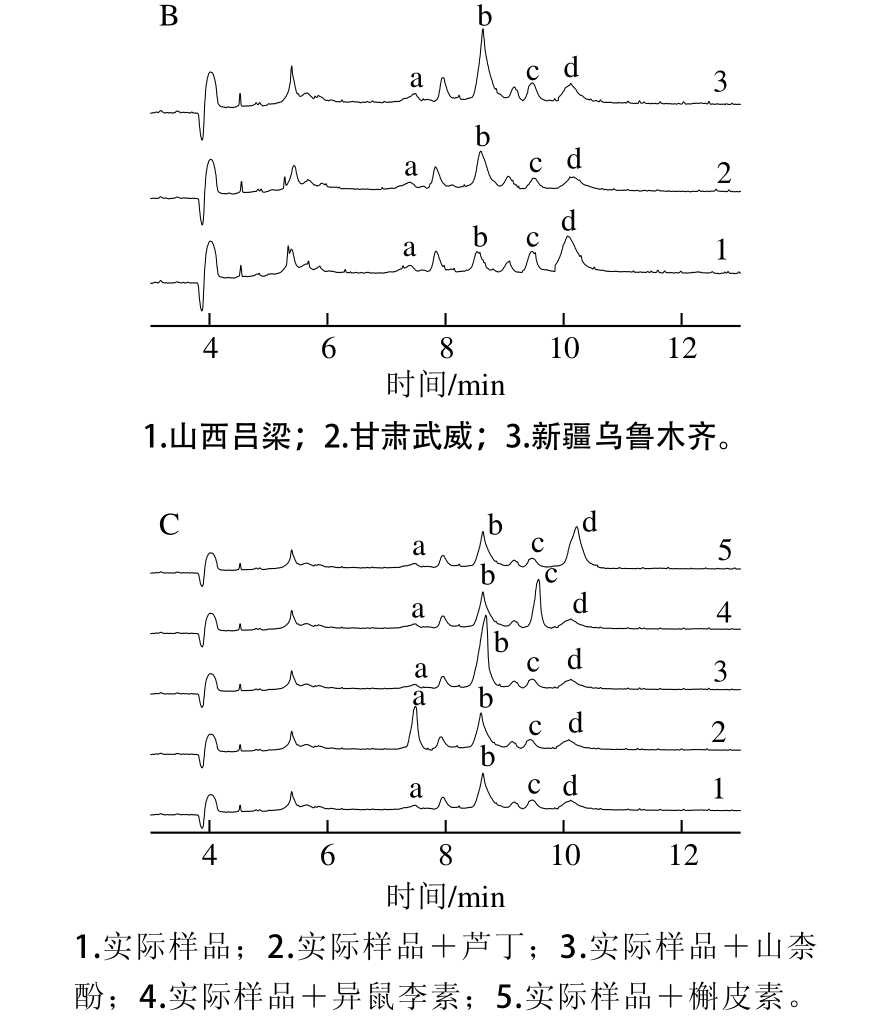
图7 4 种化合物标准品混合物(A)、不同产地沙棘样品(B)和
实
际样品(C)电泳图
Fig. 7 HPCZE profiles of mixed standard compounds (A), and unspiked (B) and spiked (C) sea burkthorn from different geographic regions
在最佳测定条件下对实际样品和4 种化合物标准品混合物测定分析,如图7A、B所示,根据迁移时间确定样品中各成分对应的峰。通过对比,证明实际样品中含有检测的4 种化合物。进一步验证,本实验采用标准加入法确定样品中确实含有要检测的4 种化合物,如图7C所示,在实际样品中分别添加一种标准品后,只有对应的电泳峰有明显的升高而没有引起其他变化,说明实际样品中确实含有检测的4 种化合物。
2.6.2 定量分析
表4 不同产地沙棘样品中化合物含量的测定结果(n=3)
Table 4 Contents of the compounds in seabuckthorn from different regions (n=3)
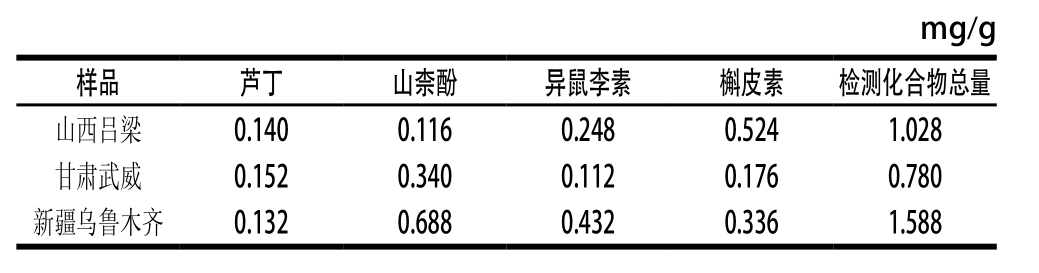
按照1.3.2节的方法分别对产自新疆乌鲁木齐、甘肃武威、山西吕梁的沙棘样品进行处理,将处理后的样品连续进样3 次,平均测定结果如表4所示。不同产地沙棘中,4 种被检测化合物的含量各不相同。沙棘中被测4 种化合物总量最高的产自新疆乌鲁木齐,最低的产自甘肃武威,而槲皮素含量以来自山西吕梁的最高,山柰酚和异鼠李素以来自新疆乌鲁木齐最高。据相关文献[27-28]报道,沙棘中活性物质的含量会因产地、土壤含水量、光照强度以及成熟度的不同而有所差异,其中,土壤含水量是决定中国沙棘种群演替方向的主要因素,它会影响沙棘的光合日变化过程以及光合“午休”。所以,不同产地沙棘成分含量的差异可能与这些因素有关。
2.7 方法对比分析
表5 4 种化合物测定方法的对比
Table 5 Comparison of HPCZE with other methods reported for the determination of four flavonoid compounds
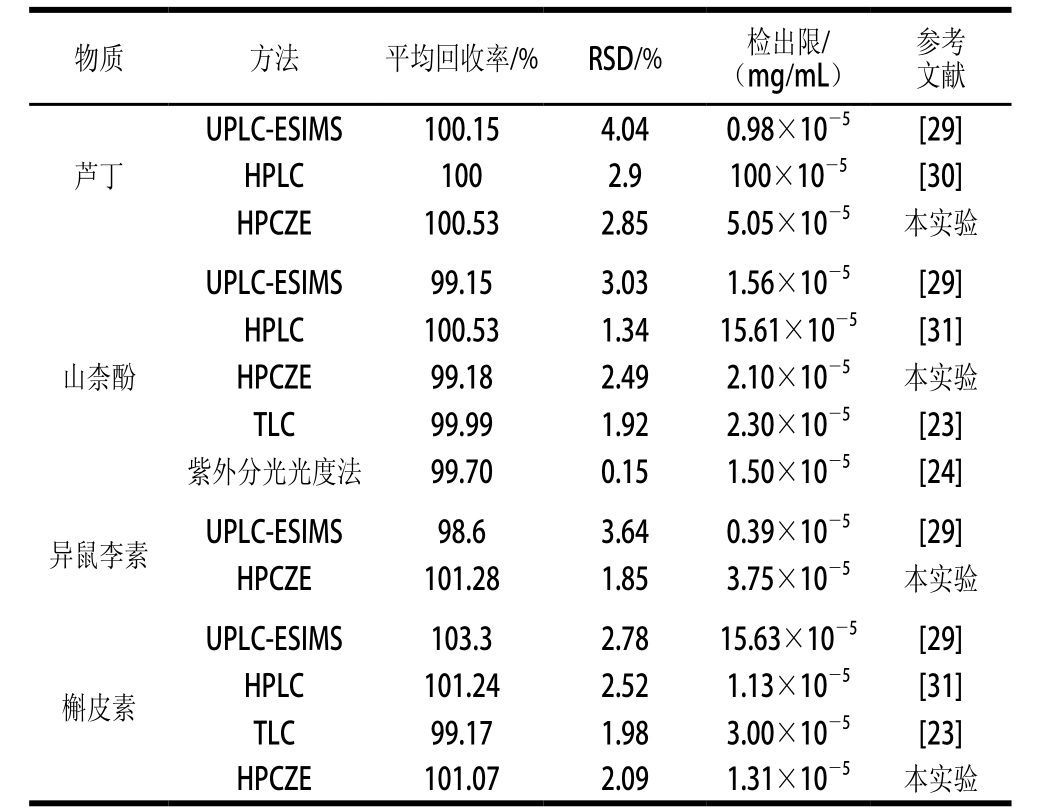
注:超高效液相色谱-电喷雾质谱(ultra high performance liquid chromatography electrospray ionization mass spectrometry,UPLC-ESIMS)法。
芦丁、山柰酚、异鼠李素和槲皮素是沙棘中的主要活性物质,其中异鼠李素是沙棘中的主要物质,同时芦丁、山柰酚和槲皮素这些化合物也具有一定的药理价值。因此,建立一种同时测定这几种物质的方法具有重要意义。在现有的研究中,关于这几种成分测定的报道较多,结合本实验测定结果,如表5所示。对照表中的数据,用不同方法对这几种物质进行检测,对比检出限,结果表明,本方法对于分离检测沙棘中的这几种活性物质较为灵敏。
本实验采用HPCZE测定不同产地沙棘中芦丁、山柰酚、异鼠李素和槲皮素4 种化合物的含量,在筛选所得的最优条件下测定,4 种化合物在11 min内得到很好分离,芦丁、山柰酚、异鼠李素和槲皮素的线性范围依次为0.01~0.51、0.05~0.93、0.02~0.65、0.03~0.81 mg/mL,相关系数分别为0.997 5、0.997 1、0.999 1、0.998 4,检出限分别为5.05×10-5、2.10×10-5、3.75×10-5、1.31× 10-5mg/mL(RSN=3),平均回收率为95.51%~104.66%,RSD不大于3.92%。实验结果表明,该方法实现了沙棘中多种化合物的自动分离检测,操作简便,分离效果好,可作为沙棘品质测定的一种方法。
参考文献:
[1] 王宏昊, 孙欣, 花圣卓, 等. 我国沙棘要用历史记载及药品开发现状[J]. 国际沙棘研究与开发, 2012, 10(4): 25-28. DOI:10.3969/ j.issn.1672-4836.2012.04.009.
[2] LI Yingqin, HU Chun. Hippophae rhamnoides L.沙棘(Shaji, Common Sea-buckthorn)[M]//Dietary Chinese Herbs. Vienna: Springer, 2015: 403-415. DOI:10.1007/978-3-211-99448-1-46.
[3] 康健, 王爱芹, 顾晶晶, 等. 新疆沙棘生产性能和主要营养成分研究[J]. 食品科学, 2009, 30(4): 99-102. DOI:10.3321/ j.issn:1002-6630.2009.04.017.
[4] STOBDAN T, KOREKAR G, B SRIVASTAVA R. Nutritional attributes and health application of seabuckthorn (Hippophae rhamnoides L.): a review[J]. Current Nutrition and Food Science, 2013, 9(2): 151-165.
[5] 陆敏, 张绍岩, 张文娜, 等. 高效液相色谱法测定沙棘汁中7 种有机酸[J]. 食品科学, 2012, 33(14): 235-237.
[6] TELESZKO M, WOJDYLO A, RUDZINSKA M, et al. Analysis of lipophilic and hydrophilic bioactive compounds content in seabuckthorn (Hippophae rhamnoides L.) berries[J]. Journal of Agricultural and Food Chemistry, 2015, 63(16): 4120-4129. DOI:10.1021/acs.jafc.5b00564.
[7] PILAT B, BIENIEK A, ZADERNOWSKI R. Chemical composition of individual morphological parts of the seabuckthorn fruit (Hippophaë rhamnoides L.)[J]. Producing Sea Buckthorn of High Quality, 2014, 29: 79.
[8] 张根臣, 刘俊宝, 李永路, 等. 浅论沙棘及其功效应用[J]. 中国西部科技, 2011, 10(5): 54-55. DOI:10.3969/j.issn.1671-6396.2011.05.023.
[9] WANI T A, WANI S M, AHMAD M, et al. Bioactive profile, health benefits and safety evaluation of seabuckthorn (Hippophae rhamnoides L.): a review[J]. Cogent Food and Agriculture, 2016, 2(1): 1128519. DOI: 10.1080/23311932.2015.1128519.
[10] MAKOVICS-ZSOHAR N, HEGEDUS A, REDEI R, et al. The antioxidant capacity of sea buckthorn (Hippophae rhamnoides L.) berries depends on the genotype and harvest time[J]. International Journal of Horticultural Science, 2014(3/4): 27-30.
[11] 花圣卓, 许涛, 王宏昊, 等. 沙棘中抗辐射损伤成分及其作用机理浅析[J]. 国际沙棘研究与开发, 2012, 10(3): 12-15. DOI:10.3969/ j.issn.1672-4836.2012.03.004.
[12] 白生文, 汤超, 田京, 等. 沙棘果渣总黄酮提取工艺及抗氧化活性分析[J]. 食品科学, 2015, 36(10): 59-64. DOI:10.7506/spkx1002-6630-201510012.
[13] MICHEL T, DESTANDAU E, ELFAKIR C. Evaluation of a simple and promising method for extraction of antioxidants from seabuckthorn (Hippophae rhamnoides L.) berries: pressurised solventfree microwave assisted extraction[J]. Food Chemistry, 2011, 126(3): 1380-1386. DOI:10.1016/j.foodchem.2010.09.112.
[14] 焦翔, 殷丽君, 程永强. 沙棘叶黄酮的提取及抑菌作用研究[J]. 食品科学, 2007, 28(8): 124-129. DOI:10.3321/ j.issn:1002-6630.2007.08.026.
[15] MICHEL T, DESTANDAU E, LE FlOCH G, et al. Antimicrobial, antioxidant and phytochemical investigations of seabuckthorn (Hippophaë rhamnoides L.) leaf, stem, root and seed[J]. Food Chemistry, 2012, 131(3): 754-760. DOI:10.1016/j.foodchem.2011.09.029.
[16] 温中平, 张红梅, 茹志萍, 等. 百通沙棘茶调节血脂作用实验研究[J].国际沙棘研究与开发, 2004, 2(3): 24-32.
[17] 王家骏, 喻道军, 刘艳, 等. 沙棘油对汞致急性肝、肾损伤的保护作用[J]. 环境与职业医学, 2011, 28(2): 109-116. DOI:10.13213/j.cnki. jeom.2011.02.019.
[18] 程嘉艺, 滕丹, 李伟, 等. 沙棘总黄酮对血管内皮细胞保护作用及机制研究[J]. 中国中西医结合杂质, 2011, 31(3): 355-358.
[19] 田俊生, 郑晓芬, 张丽增, 等. 沙棘籽油抗抑郁作用[J]. 食品科学, 2013, 34(19): 279-282. DOI:10.7506/spkx1002-6630-201319057.
[20] CHRISTAKI E. Hippophae rhamnoides L. (sea buckthorn): a potential source of nutraceuticals[J]. Food and Public Health, 2012, 2(3): 69-72. DOI:10.5923/j.fph.20120203.02.
[21] 龚志, 周晓萍. 沙棘的开发与使用价值探讨[J]. 新疆中医药, 2011, 29(2): 78-80. DOI:10.3969/j.issn.1009-3931.2011.02.045.
[22] SINGH A K, DEEP P, DUBEY S, et al. Comparative studies on antioxidant activity, total phenol content and high performance thin layer chromatography analysis of seabuckthorn (Hippophae rhamnoides L.) leaves[J]. Pharmacognosy Journal, 2014, 6(5): 5-8. DOI:10.5530/pj.2014.5.2.
[23] SNEHAL B, BHANDARE, KIRTI S, et al. Simultaneous quantification of kaempferol and quercetin in medicinal plants using HPTLC[J]. International Journal of Pharmaceutical Sciences and Research, 2016, 7(6): 2379-2384. DOI:10.13040/IJPSR.0975-8232.7(6).2379-2384.
[24] TELANGE D R, PATIL A T, TATODE A, et al. Development and validation of UV spectrophotometric method for the estimation of kaempferol in kaempferol: hydrogenated soy phosphatidylcholine (HSPC) complex[J]. Pharmaceutical Methods, 2014, 5(1): 34-38. DOI:10.5530/phm.2014.1.6.
[25] 樊鑫梅, 申雪丽, 闫丽丽, 等. 高效液相色谱法同时测定沙棘果中槲皮素、山柰酚和异鼠李素的含量[J]. 中国医院药学杂志, 2012, 32(17): 1343-1346. DOI:10.13286/j.cnki. chinhosppharmacyj.2012.17.005.
[26] 刘娟, 杨艳丽. HPLC法测定沙棘不同部位槲皮素和异鼠李素的含量[J]. 辽宁中医药大学学报, 2010, 12(6): 16-17. DOI:10.13194/ j.jlunivtcm.2010.06.18.liuj.079.
[27] 夏宣宣, 吴芹, 张光灿, 等. 土壤水分对沙棘光合日变化的影响[J]. 山东建筑大学学报, 2015, 30(5): 441-444. DOI:10.3969/ j.jssn.1003-8981.2014.05.006.
[28] 殷东生, 周志军, 郭树平. 光照对沙棘幼苗生长、生物量分配及光合特性的影响[J]. 经济林研究, 2014, 32(3): 48-53. DOI:10.3969/ j.jssn.1673-7644.2015.03.008.
[29] 付阳, 王宇坤, 刘明博, 等. UPLC-ESIMS法同时测定沙棘黄酮中5 种主要成分含量[J]. 内蒙古农业大学学报(自然科学版), 2016, 37(3): 129-133.
[30] 任强, 吴昊, 聂其婷, 等. HPLC-DAD法同时测定苦荞麦保健品中芦丁槲皮素山奈酚含量[J]. 济宁医学院学报, 2016, 39(5): 317-323. DOI:10.3969/j.issn.1000-9760.2016.05.004.
[31] 周逸芝, 刘训红, 陈菲, 等. 高效液相色谱法同时测定龙柴方中槲皮素、山奈素、异鼠李素[J]. 中成药, 2013, 35(10): 2164-2167. DOI:10.3969/j.issn.1001-1528..2013.10.023.
Simultaneous Determination of Four Active Compounds in Sea Buckthorn from Three Different Geographic Regions by High Performance Capillary Zone Electrophoresis
YANG Xia1, FENG Feng1,2,*, LIU Lizhen2, CHEN Zezhong2
(1. School of Chemistry and Material Science, Shanxi Normal University, Linfen 041000, China; 2. School of Chemical and Environmental Engineering, Shanxi Datong University, Datong 037009, China)
Abstract:A high performance capillary zone electrophoresis (HPCZE) method was developed for the simultaneous separation and determination of rutin, kaempferol, isorhamnetin and quercetin in sea buckthorn. The effects of different electrophoresis conditions on separation efficiency were investigated. The running buffer was 20 mmol/L Na2B4O7-H3BO3with 1.5 mg/mL β-cyclodextrin at pH 9.55, the detection wavelength was set at 370 nm, applied voltage 25 kV and injection time 5 s. Under these optimal conditions, rutin, kaempferol, isorhamnetin and quercetin could be fully separated from each other within eleven minutes with good linearity in the range of 0.01 to 0.51, 0.05 to 0.93, 0.02 to 0.65, and 0.03 to 0.81 mg/mL, respectively and correlation coefficients between 0.997 1 and 0.999 1. The lowest detection limits were 5.05 × 10-5, 2.10 × 10-5, 3.75 × 10-5, and 1.31 × 10-5mg/mL, respectively (RSN= 3). The average recoveries of spiked samples were in the range from 95.51% to 104.66%, with a relative standard deviation (RSD) lower than 3.92% (n = 3). Under the optimized conditions, a mixture of four standard compounds and four active compounds in extracts of sea buckthorn from three different producing areas were determined. The results showed that the total content of active compounds was the highest in seabuckthorn from Ürümqi, Xinjiang among three different producing regions, and lowest in the sample from Wuwei, Gansu. Furthermore, the sample from Lüliang, Shanxi had the highest quercetin content while the contents of kaempferol and isorhamnetin were the highest in the sample from Ürümqi, Xinjiang. This method is rapid, simple, accurate and reliable for the simultaneous detection of active compounds in sea buckthorn.
DOI:10.7506/spkx1002-6630-201714022
中图分类号:TS207.3
文献标志码:A
文章编号:1002-6630(2017)14-0144-07
引文格式:杨霞, 冯锋, 刘荔贞, 等. 高效毛细管区带电泳法同时检测3 个产地沙棘果粉中的活性物质[J]. 食品科学, 2017, 38(14): 144-150.
DOI:10.7506/spkx1002-6630-201714022. http://www.spkx.net.cn
YANG Xia, FENG Feng, LIU Lizhen, et al. Simultaneous determination of four active compounds in sea buckthorn from three different geographic regions by high performance capillary zone electrophoresis[J]. Food Science, 2017, 38(14): 144-150. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714022. http://www.spkx.net.cn
收稿日期:2016-09-24
基金项目:国家自然科学基金面上项目(21375083)
作者简介:杨霞(1990—),女,硕士研究生,研究方向为毛细管电泳技术。E-mail:18634922978@163.com
*通信作者:冯锋(1964—),男,教授,博士,研究方向为光分析化学。E-mail:feng-feng64@263.net
Key words:high performance capillary zone electrophoresis (HPCZE); rutin; kaempferol; isorhamnetin; quercetin; sea buckthorn