表1 L39(3)正交试验因素与水平
Table 1 Coded values and corresponding actual values of the optimization parameters used in L(339) orthogonal array design

魏长庆1,周 琦2,刘文玉1,*
(1.石河子大学食品学院,新疆 石河子 832000;2.油料脂质化学与营养湖北省重点实验室,湖北 武汉 430000)
摘 要:采用顶空固相微萃取-气相色谱-质谱(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用技术对新疆胡麻油挥发性成分测定分析进行优化,以期获得HS-SPME-GCMS分析胡麻油挥发性香气的最佳条件。结果表明,采用DVB/CAR/PDMS萃取头,在磁力搅拌条件下,胡麻油SPME最佳萃取条件为萃取温度50 ℃、萃取时间40 min、解吸时间4 min,在该条件下采用HS-SPME-GC-MS鉴定出的胡麻油挥发性物质达到46 种,主要包括醛类、酮类、醇类、酸类、酯类、烷烃类、杂环类及其他类物质,其中醛类、杂环类和醇类总相对含量较高,分别为30.14%、12.73%和9.25%,分离鉴定效果较好。
关键词:顶空固相微萃取-气相色谱-质谱;胡麻油;挥发性成分;分析
新疆是我国六大胡麻产区之一,胡麻油因其富含不饱和脂肪酸而被誉为“高山上的深海鱼油”[1-4]。众所周知,胡麻油品质优劣很大程度上也与其所具有的特征香气组成及含量有关[5],因此,快速、准确地分析检测胡麻油特征香气对于胡麻油品质控制和生产加工至关重要。
对于植物油香气成分的提取方法有多种,目前,植物油挥发性香气物质的常用提取技术主要包括同时蒸馏萃取、溶剂萃取、顶空萃取及固相微萃取等。同时蒸馏萃取适合提取沸点较高的挥发性及半挥发性组分,但高温长时间加热会使样品的香气组成或者结构发生变化,并且收集到的香气物质种类有限;溶剂萃取法易使低沸点挥发性物质被溶剂峰遮盖,而高沸点非挥发物质易形成干扰峰;静态顶空萃取尽管不存在溶剂峰的干扰,但对低挥发性化合物的萃取分离能力较弱;动态顶空检测限低并且灵敏度较高,但实验装置相对复杂、耗时长并且费用较高[6],而顶空固相微萃取(headspace solid phase microextraction,HS-SPME)具有方便快捷、灵敏度高、选择性与重复性好的特点,能较真实地反映植物油样品挥发性物质的基本组成,目前已广泛应用于植物油香气的分析研究中[7]。另外,SPME装置还可与高效液相色谱、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)等分析仪器联用,充分发挥各部分的优点,实现同一样品富集、进样和检测等过程的统一,显著提高了分析方法的灵敏度和分析效率[8]。近年来,HSSPME-GC-MS技术已广泛应用于多种植物油香气成分的分析鉴别,包括油脂特征香气的分析、贮藏期间油脂香气的变化以及加工过程对油脂香气形成的作用等。
因此,本实验以新疆炒籽胡麻油为研究对象,通过HS-SPME采集条件的优化选择,并结合GC-MS分析不同优化过程中的胡麻油挥发性成分的组成,旨在建立新疆胡麻油香气成分的最佳提取、分离及分析方法。
1.1 材料与试剂
炒籽胡麻油(二级) 新疆石河子汇昌粮油公司;C6~C23正构烷烃(色谱纯) 上海化学试剂公司;正己烷、环己烷(沸程60~90 ℃)(均为分析纯) 上海生工生物工程有限公司;戊醛、己醛、庚醛、苯甲醛、3-甲基-2-丁烯醛、2-己酮、己醇、辛醇、丁醇、乙酸、丙酸、己酸、戊酸、丁内酯、乙酸乙酯、正十三烷烃、正十四烷、正十六烷烃、2-甲基吡嗪、2,5-二甲基吡嗪、2,3-二甲基吡嗪、环己醇(均为色谱纯) 美国Sigma公司。
1.2 仪器与设备
SPME装置、50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)、100 μm PDMS、75 μm PDMS/DVB萃取头 美国色谱科公司;GC-14A型GC仪 日本岛津公司;TRACE MS型GC-MS联用仪 美国菲尼根公司;85-2恒温数显磁力搅拌器 金坛岸头国瑞实验仪器厂;Mettler-EL204电子天平 北京中西远大科技有限公司。
1.3 方法
1.3.1 萃取条件的优化
实验选择对胡麻油挥发性成分萃取影响较大因素进行优化分析,在预实验基础上,选取总峰面积、主峰面积和主峰个数为考察指标,筛选不同化学分子材料涂层的SPME纤维萃取头,比较添加电解质NaCl、电磁搅拌等条件对胡麻油挥发性成分萃取效果的影响,并确定优化的萃取温度、萃取时间和解吸时间等参数。在以上研究基础上,对SPME固相微萃取的条件进行正交试验优化。
1.3.2 正交试验设计
由单因素试验基础上,考察萃取温度、萃取时间、解吸时间对SPME效果的影响,以总峰面积为考察指标,采用L9(33)正交试验设计,如表1所示。
表1 L39(3)正交试验因素与水平
Table 1 Coded values and corresponding actual values of the optimization parameters used in L(339) orthogonal array design

1.3.3 HS-SPME-GC-MS分析条件
SPME条件:将不同萃取头于温度250 ℃老化100~120 min,用GC-MS测定至无干扰峰出现。
称取10 g胡麻油样品置于125 mL带硅胶盖顶空瓶中,加入1%内标物环己醇溶液10 μL,加盖密封后置于40 ℃恒温水浴,采用恒温磁力搅拌富集30 min,然后置于250 ℃的GC进样口解吸3 min并启用采集程序。
GC条件:DB-WAX石英毛细柱(30 m×0.25 mm,0.25 µm);载气为氦气,流速0.8 mL/min;进样口温度250 ℃;升温程序:初始温度40 ℃保留3 min,以6 ℃/min升到120 ℃,不保留,再以10 ℃/min升到230 ℃,保留8 min。
MS条件:电子电离源;离子源温度200 ℃;灯丝发射电流200 μA;电子能量70 eV;接口温度250 ℃;质量扫描范围33~373 u。
1.3.4 挥发性化合物定性分析
GC-MS实验数据由系统自带软件(Xcalibur)处理完成,胡麻油样品中挥发性组分经计算机检索并与商业计算机谱库NIST和Wiley比对分析,只记录匹配度不小于800的挥发性物质。在同样色谱条件下,以C6~C23的正构烷烃混合物为标准,对其进行GC-MS分析并根据下式计算待测化合物的保留指数(retention index,RI)。定性挥发性物质的RI可通过标准化合物进行对比确定,也可以通过质谱数据库检索结果或查阅文献进行比较定性。
式中:tRx为待测化合物x的调整保留时间/min;tRn为碳原子数为n的正构烷烃调整保留时间/min;tR(n+1)为碳原子数为n+1的正构烷烃调整保留时间/min;n为碳原子数。
1.3.5 挥发性化合物的定量分析
本实验中鉴定分析的挥发性物质含量并非绝对含量,而是相对于内标物的相对含量,主要采用全扫描模式下的总离子流图峰面积定量分析。
有关胡麻油特征香气成分的研究报道较少,Krist等[9]利用SPME-GC-MS分析了不同来源亚麻荠油和亚麻籽油的挥发性香气成分,研究发现其主要挥发性成分为醛类、酮类、醇类和酯类。另外,研究发现多数炒籽植物油中还含有杂环类挥发性物质,如吡嗪、呋喃、吡咯等[7,10-11]。因此,本实验选择胡麻油挥发性成分的总峰面积、主峰面积(醛类、酮类、醇类、酯类和杂环类挥发性物质)和主峰个数作为分析SPME效果的主要指标因素。
2.1 SPME条件的选择
2.1.1 不同萃取头对效果的影响
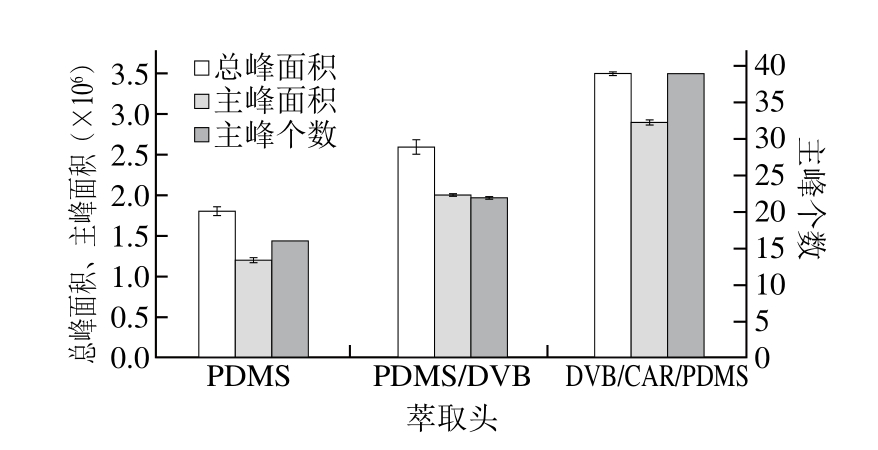
图1 不同萃取头对萃取效果的影响
Fig. 1 Comparison of different SPME fibers for extraction of volatiles from flaxseed oil
萃取头是整个SPME装置的关键,不同化学材料涂层的萃取头对挥发性物质的吸附富集能力不同,因此萃取头的涂层选择及其厚度对胡麻油挥发性成分萃取效果都有一定的影响,萃取时应依据萃取对象的性质选用不同涂层的萃取纤维。由图1可知,尽管3 种萃取头都能萃取胡麻油香气成分,但DVB/CAR/PDMS的总峰面积和主峰面积明显大于PDMS和PDMS/DVB,通过对比胡麻油中的主要挥发性物质检出个数,发现DVB/CAR/PDMS检出38 种化合物,比PDMS和PDMS/DVB多,这主要与萃取头的复合涂层对挥发性物质具有多重的选择性和吸附性有关。因此,对于胡麻油挥发性物质的萃取而言,选择分析全面、响应值较高的DVB/CAR/PDMS萃取头更加合适。Kalua等[12]选用50/30 μm DVB/CAR/PDMS萃取头对橄榄油挥发性物质进行富集,结合GC-MS分析共发现25 种特征性挥发性香气成分。
2.1.2 添加NaCl对萃取效果的影响
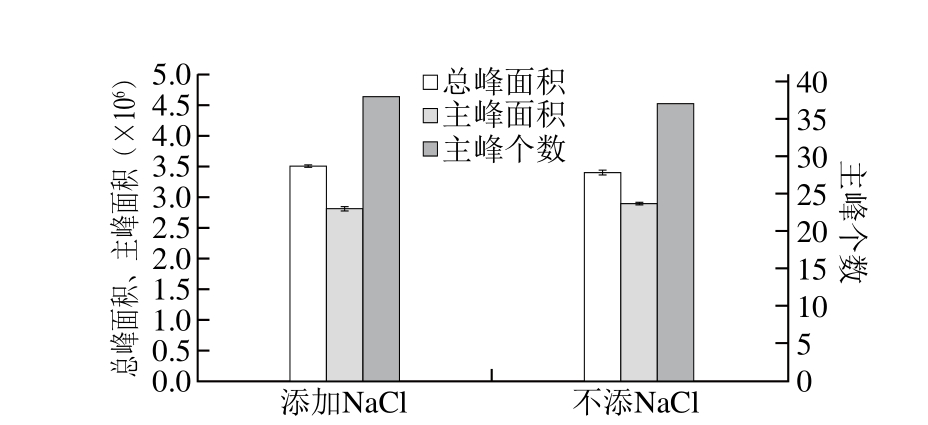
图2 添加NaCl对萃取效果的影响
Fig. 2 Effect of NaCl concentration on extraction of volatiles from flaxseed oil
在胡麻油挥发性香气物质萃取过程中加入电解质NaCl可促进香气物质的挥发度,从而提高SPME对目标挥发性物质的萃取效率[13]。然而,在挥发性香气物质富集的同时,目标分析物分子可能会与样品体系中的盐离子发生静电作用,导致分析物进入纤维涂层的能力降低。如图2所示,NaCl的加入对胡麻油挥发性香气物质萃取效果的影响并不显著,这可能与油脂中含水量低有关,多数果类香气成分的萃取与NaCl的加入密切相关,如韩素芳等[14]报道NaCl加入量对百香果香气物质萃取效果影响显著,主要原因是NaCl的加入增大了溶液的离子强度,降低了挥发性物质与水分的结合程度。
2.1.3 搅拌对萃取效果的影响
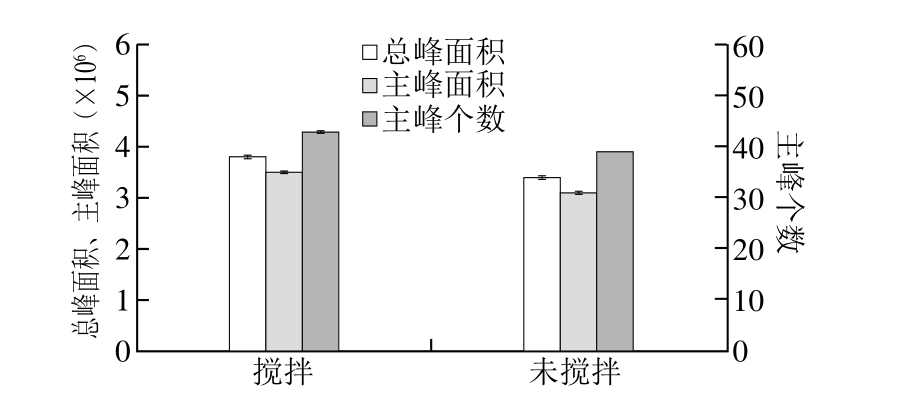
图3 搅拌对萃取效果的影响
Fig. 3 Effect of stirring on extraction of volatiles from flaxseed oil
为加快植物油香气成分的挥发及吸附速率,常在HS-SPME的液体样品瓶中加入电磁搅拌子搅拌样品,以提高挥发性物质由体系向外扩散的能力,使挥发性香气物质快速达到萃取平衡,因此磁力搅拌常与SPME组合使用[15]。从图3可以看出,搅拌状态下的总峰面积、主峰面积及主峰个数均比未搅拌状态下的要高。实验表明,胡麻油中部分挥发性低的化合物可通过电磁搅拌提高其挥发性,加速SPME纤维萃取头对挥发性香气物质的萃取效果。
2.1.4 萃取温度对萃取效果的影响
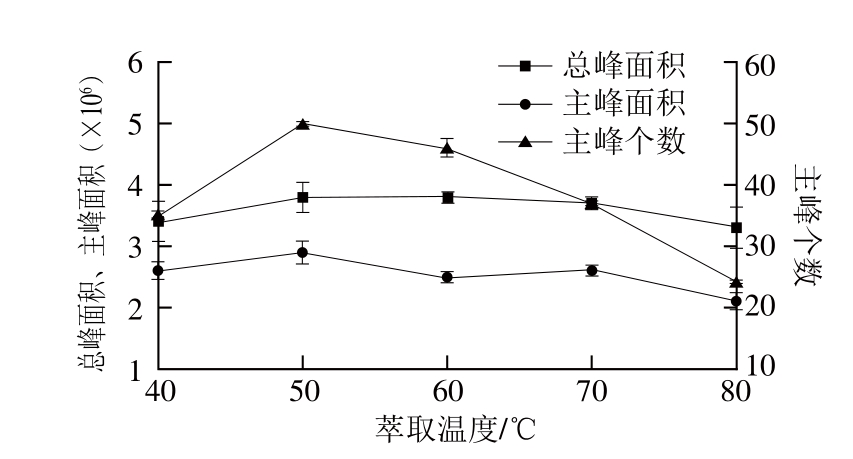
图4 萃取温度对萃取效果的影响
Fig. 4 Effect of temperature on extraction of volatiles from flaxseed oil
萃取温度对萃取采样的影响具有双重性,一方面,随着样品加热温度的升高,分子运动加快,挥发性物质萃取平衡时间缩短,萃取分析速度加快;另一方面,温度过高会导致萃取头对待测物的吸附量减少,分析效率降低[16]。另外,温度过高可能会引起胡麻油挥发性物质的热降解或氧化,并导致新的挥发性物质出现,进而使仪器检测结果的准确性降低[17],所以在使用SPME萃取挥发性物质时有必要考察其最佳萃取温度范围。由图4可以看出,随着SPME体系萃取温度的升高主峰个数明显增多,当萃取温度超过50 ℃时主峰个数开始减少,因此,萃取温度对胡麻油挥发性成分的富集具有双重性影响。总峰面积和主峰面积基本有同样的变化趋势,均由初始的上升趋势到50 ℃之后的缓慢降低,但主峰面积在60~70 ℃时又略有升高,这可能是由于温度升高导致胡麻油中脂肪酸受热分解产生了低分子的醛类、酮类、醇类等挥发性物质,进而使主峰面积略有上升,但随着萃取温度的继续升高,低沸点挥发性物质在SPME竞争吸附中处于弱势地位,又使得挥发性物质吸附量降低[15-16]。综合考虑,本实验采用50 ℃作为胡麻油香气成分的最适SPME萃取温度。
2.1.5 萃取时间对萃取效果的影响

图5 萃取时间对萃取效果的影响
Fig. 5 Effect of extraction time on extraction of volatiles from flaxseed oil
萃取时间是指分析物在吸附薄膜、顶空和溶液三相中均衡分配所需的时间。在已优化因素基础上,考察不同SPME萃取时间对胡麻油挥发性物质萃取效果的影响。由图5可以看出,在20~40 min之间,3 个考察指标均呈现上升趋势,SPME萃取头不断对胡麻油中挥发性香气物质进行富集,直至40 min时主峰面积和主峰个数达到最大值;总峰面积则在前40 min内由2.3×106增加到3.8×106,50 min之后开始缓慢下降,该现象的出现除了与待分析物的分配系数、样品性质及萃取头涂层理化性质有关外,还可能与油脂持续加热过程中脂肪酸发生降解生成更多的胡麻油挥发性香气物质有关[17]。由此看来,延长萃取时间,有利于达到萃取平衡,但时间过长会因竞争吸附而导致小分子物质的脱附。因此,萃取时间为40 min时萃取效果较好。
2.1.6 解吸时间对萃取效果的影响
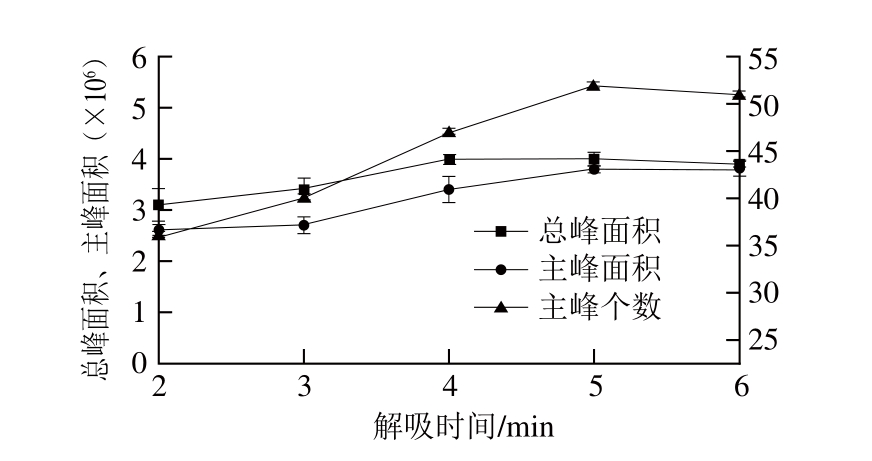
图6 解吸时间对萃取效果的影响
Fig. 6 Effect of desorption time on extraction of volatiles from flaxseed oil
在胡麻油挥发性物质富集完成后,SPME萃取头需要在GC进样口解吸。当GC解吸温度一定时,解吸时间的长短决定着胡麻油挥发性物质解吸的程度,解吸时间过长,可能会导致纤维萃取头涂层材料的损耗,使其使用寿命大大缩短,反之则可能导致分析对象解吸不完全,不仅会导致GC-MS分析结果准确性的降低,还可能会使后续测试样品受到污染。在参数优化基础上,考察不同解吸时间对SPME效果的影响。如图6所示,解吸时间在2~4 min之间,3 个考察指标均呈上升趋势,其中总峰面积在解吸4 min后几乎再没有增长,证明已基本解吸完全,而主峰个数和主峰面积在4~5 min仍处于上升趋势,5 min后才开始缓慢下降,因此选取5 min作为SPME最佳解吸时间。
2.2 SPME最佳萃取条件的确定
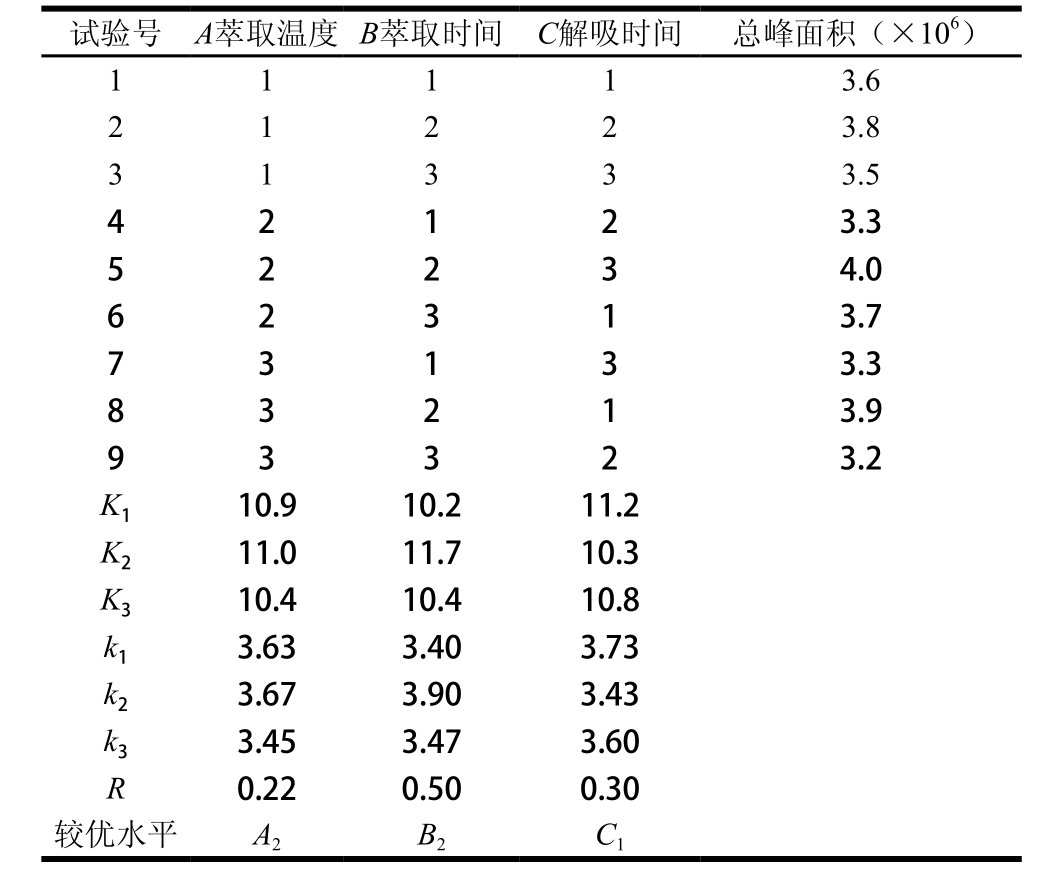
由表2可知,各因素对总峰面积影响主次顺序为B>C>A,通过极差分析及验证实验最终确定胡麻油SPME条件最佳处理组合为萃取温度50 ℃、萃取时间40 min、解吸时间4 min。
表2 正交试验设计与结果
Table 2 Orthogonal array design with experimental results
2.3 HS-SPME-GC-MS测定炒籽胡麻油挥发性成分
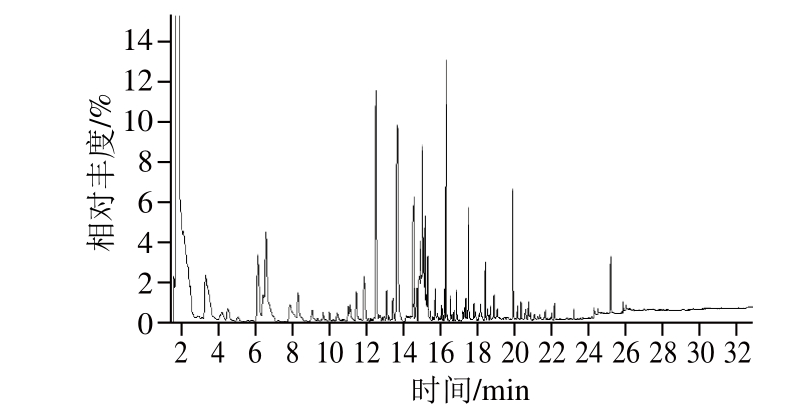
图7 胡麻油挥发性成分总离子流图
Fig. 7 GC-MS total ion current chromatogram of volatiles extracted from flaxseed oil by HS-SPME
表3 胡麻油挥发性物质HS-SPME-GC-MS分析结果
Table 3 Major volatile compounds identified from flaxseed oil by HS-SPME-GC-MS
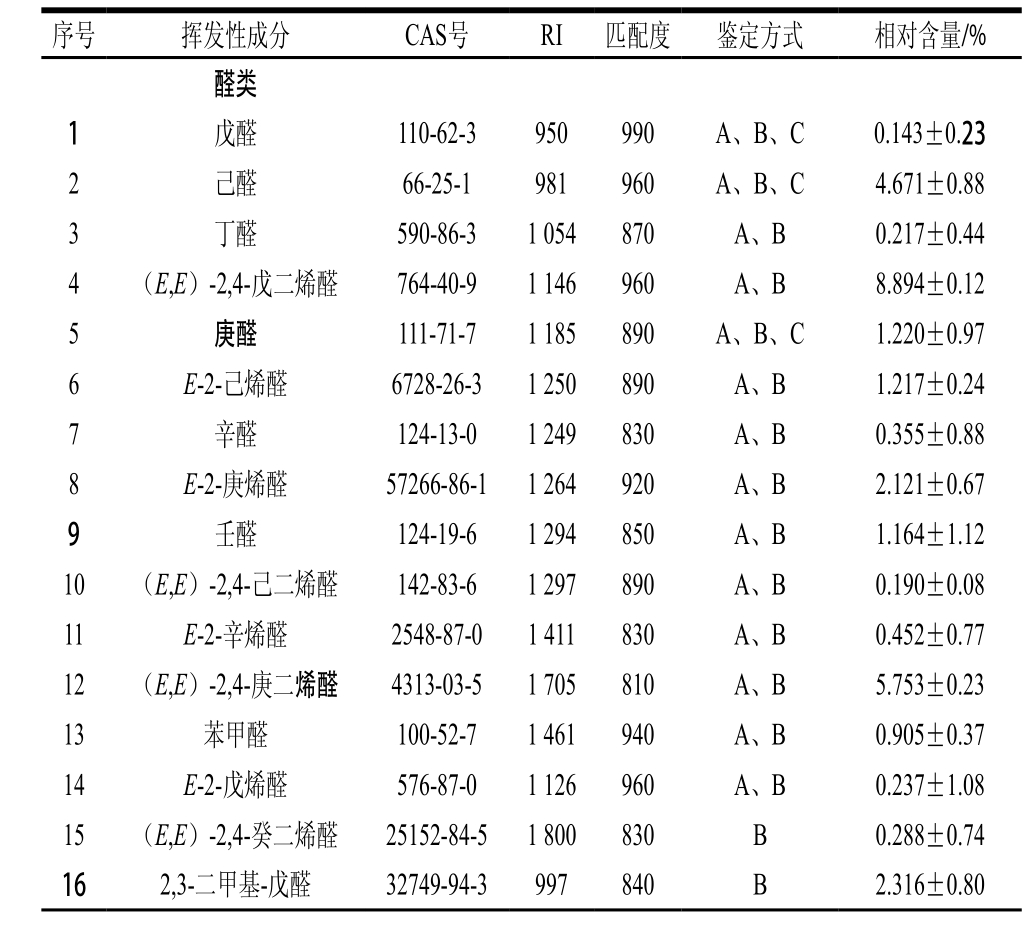
续表3

注:鉴定方法中A为RI保留指数与相关文献一致,B为MS为质谱数据库,C为标准品。
在优化SPME条件下萃取胡麻油挥发性物质,结果如图7所示,各挥发性香气成分的色谱峰相对较尖且窄,说明采用优化后的SPME条件对胡麻油挥发性物质的萃取效果较好。经GC-MS检测后与NIST和Wiley质谱库图库对比筛选,初步分析鉴别了新疆炒籽胡麻油中的主要挥发性香气成分,结果见表3。剔除萃取头过度受热产生的少量硅氧烷类杂质峰[18],采用HS-SPME-GC-MS分析鉴别出的新疆胡麻油挥发性物质共有46 种,主要包括醛类(16 种)、酮类(3 种)、醇类(9 种)、酸类(3 种)、酯类(3 种)、烷烃类(1 种)、杂环类(9 种)以及其他类物质(2 种),其中醛类、醇类和杂环类挥发性物质的相对含量较高,分别为30.14%、9.25%和12.73%。醛类中主要有己醛(4.671%)、(E,E)-2,4-戊二烯醛(8.894%)、E-2-庚烯醛(2.121%)和(E,E)-2,4-庚二烯醛(5.753%);杂环类主要有2-甲基吡嗪(3.871%)、2,5-二甲基吡嗪(4.848%)和2,3-二甲基吡嗪(1.242%);醇类主要有己醇和戊醇,相对含量分别为6.264%和1.082%。
醛类一般产生较好的风味,主要有油脂味、坚果味和青草味,多数醛类对油脂风味起到积极贡献作用[19-20]。Debora等[21]采用SPME-GC-MS分析技术就不同产地来源橄榄油中的挥发成分进行比较,发现澳洲大约有50%橄榄油中主要的挥发成分是醛类,尤其以E-2-己烯醛含量较高。Brunschwig等[22]研究发现植物油中多数C5~C9的醛呈现出脂肪味、水果味或者青草味等。王丽霞等[23]发现己醛是浙江山核桃油的特征香气成分。同样,Silva等[24]研究发现高品质的橄榄油中含有C5~C6的挥发性成分,尤其是C6的不饱和或饱和的醛类。由此看来,在植物油中醛类也是一类重要的挥发性成分,并且可利用部分醛的特征香气来间接判别植物油的品质[25-27]。
醇类挥发性物质被认为是来源于油脂中不饱和脂肪酸的生物降解,而且是生成酯类物质的主要前体物质,一般醇类挥发性物质多见于果类产品特征香气中,其种类多[28],含量差异不同,如Miyazaki等[29]研究发现E-2-辛烯醇在橘子中含量较多,但对整体风味贡献较小,却可以通过“托举”作用加强特征性香气成分的显现。杂环类挥发性香气成分主要以吡嗪类化合物为主,它主要是美拉德反应的中间产物,与胡麻油生产过程中的高温炒籽工艺有关,具有强烈的烤香和坚果味香气,是炒籽胡麻油的主要风味物质。Siegmund等[30]采用SPME和GC-MS联用分析了炒籽后南瓜籽的挥发性成分,认为吡嗪和吡咯是炒籽南瓜籽的特征香气来源。Liu Xiaojun等[31]也采用相同方法对炒籽花生油挥发性成分进行了分析,发现杂环类物挥发性质是炒籽花生油的主要香气物质。
胡麻油挥发性香气物质的最佳分离鉴定条件为DVB/ CAR/PDMS萃取头,在磁力搅拌条件下,萃取温度50 ℃、萃取时间40 min、解吸时间4 min。
通过HS-SPME-GC-MS鉴定出的新疆胡麻油挥发性物质共有46 种,主要包括醛类(16 种)、酮类(3 种)、醇类(9 种)、酸类(3 种)、酯类(3 种)、烷烃类(1 种)、杂环类(9 种)以及其他类物质(2 种),其中醛类、醇类和杂环类总相对含量较高,分别为30.14%、9.25%和12.73%。
上述研究结论可为实现待测胡麻油品质的快速判别、品质控制及产品升级提供理论基础和参考,但由于胡麻油挥发性香气种类繁多、形成过程复杂,使得其特征香气成分的鉴定、前体组成及含量的确定相对困难,因此,进一步准确分析鉴别胡麻油特征香气及其来源也是课题组下一步努力的方向。
参考文献:
[1] 张文斌. 亚麻木酚素的提取纯化与生物活性研究[D]. 无锡: 江南大学, 2007.
[2] 党占海. 胡麻产业现状及发展对策[J]. 农产品加工, 2008, 32(7): 48-56. DOI:10.3969/j.issn.1671-9646-C.2008.07.007.
[3] 魏长庆, 刘文玉, 许程剑. 胡麻籽活性成分应用研究进展[J]. 粮食与油脂, 2012, 25(4): 45-48. DOI:10.3969/j.issn.1008-9578.2012.04.002.
[4] WAHID H, DAVID A R, SADOK B, et al. A review of the methods used in the determination of flaxseed components[J]. African Journal of Biotechnology, 2012, 11(4): 724-731. DOI:10.5897/AJB11.984.
[5] LEANNE T B, SHILPA B, JESSE C, et al. Flaxseed and cardiovascular risk factors: results from a double blind, randomized, controlled clinical trial[J]. Journal of the American College of Nutrition, 2008, 27(1): 65-74. DOI:10.1016/S0898-1221(02)00115-3.
[6] GRIMM C C, LlOyD S W, MILLER J A, et al. The analysis of food volatile using direct thermal desoprtion[M]//Flavor, Fragrance, and Odor Analysis. New york, 2001: 59-80. DOI:10.1201/9780203908273.ch3.
[7] LU Xiao, LEE J, ZHANG G, et al. HS-SPME GC/MS characterization of volatiles in raw and dry-roastedalmonds (Prunus dulcis)[J]. Food Chemistry, 2014, 151(5): 31-34. DOI:10.1016/j.foodchem.2013.11.052.
[8] CHVILI K I, KUBAN V. Headspace solid-phase microextraction (HS-SPME): a microscale sampling technique for determination of monoterpene hydrocarbons in coniferous needles by gas chromatography/mass spectrometry (GC/MS)[J]. Analytical and Bioanalytical Chemistry, 2004, 378: 150-158. DOI:10.1007/s00216-003-2271-9.
[9] KRIST S, STUEBIGER G, BAIL S. Analysis of volatile compounds and triacylglycerol composition of fattyseed oil gained from flax and false flax[J]. European Journal of Lipid Science and Technology, 2006, 108: 48-60. DOI:10.1002/ejlt.200500267.
[10] LEE E, CHOE E. Changes in oxidation-derived off-flavor compounds of roasted sesame oil during accelerated storage in the dark[J]. Biocatalysis and Agricultural Biotechnology, 2012, 1(1): 89-93. DOI:10.1016/j.bcab.2011.08.003.
[11] PARK M H, JEONG M K, yEO J, et al. Application of solid phasemicroextraction (SPME) and electronic nose techniques to differentiate volatiles of sesame oils prepared with diverse roasting conditions[J]. Journal of Food Science, 2011, 76: C80-C88. DOI:10.1111/j.1750-3841.2010.01954.x.
[12] KALUA C M, BEDGOOD D R, PRENZLER P D. Development of a headspace solid phase microextraction-gas chromatography method for monitoring volatile compounds in extended time-course experiments of olive oil[J]. Analytica Chimica Acta, 2006, 556(2): 407-414. DOI:10.1016/j.aca.2005.09.050.
[13] 薛洁, 常伟, 贾士儒, 等. 酒精发酵对欧李汁香气成分的影响[J]. 酿酒科技, 2006(12): 106-109. DOI:10.3969/ j.issn.1001-9286.2006.12.028.
[14] 韩素芳, 丁明, 刘亚群, 等. 顶空固相微萃取-气相色谱-质谱测定百香果香气条件的优化[J]. 中国食品学报, 2010, 10(4): 278-284. DOI:10.3969/j.issn.1009-7848.2010.04.042.
[15] RICHARDSON T, FINLEy J W. Chemical changes in food during processing[M]. Westport, Connecticut: Avi Publication Company, Inc., 1985.
[16] ANGEROSAF, SERVILI M, SELVAGGINI R, et al. Volatile compounds in virgin olive oil: occurrence and their relationship with the quality[J]. Journal Chromatography, 2004, 1054: 17-31. DOI:10.1016/j.chroma.2004.07.093.
[17] 史文青, 薛雅琳, 何东平, 等. 花生挥发性香味识别的研究[J]. 中国粮油学报, 2012, 27(7): 58-61. DOI:10.3969/ j.issn.1003-0174.2012.07.012.
[18] 王明林, 乔鲁芹, 张莉, 等. 固相微萃取-气相色谱/质谱测定植物叶片中的挥发性物质[J]. 色谱, 2006, 24(4): 343-346. DOI:10.3321/ j.issn:1000-8713.2006.04.005.
[19] LEE J, KIM D, CHANG P. Headspace-solid phase microextraction (HS-SPME) analysis of oxidized volatiles from free fatty acids (FFA) and application for measuring hydrogen donating antioxidant activity[J]. Food Chemistry, 2007, 105: 414-420. DOI:10.1016/ j.foodchem.2006.12.059.
[20] ZELLNER B A, DUGO P, DUGO G. Gas chromatographyolfactometry in food flavor analysis[J]. Journal of Chromatography A, 2008, 1186: 123-143. DOI:10.1016/j.chroma.2007.09.006.
[21] DEBORA A T, PAIL D P, DANNy R B. Vairetal and processing effects on the volatile profile of Australian olive oils[J]. Food Chemistry, 2004, 84(3): 341-349. DOI:10.1016/S0308-8146(03)00217-6.
[22] BRUNSCHWIG C. Odor-active compounds of Tahitian vanilla flavor[J]. Food Research International, 2012, 46(1): 148-157. DOI:10.1016/j.foodres.2011.12.006.
[23] 王丽霞, 盛希茜, 韩素芳, 等. 浙江山核桃油脂香气萃取条件优化及组分分析[J]. 食品与机械, 2012, 26(1): 38-41.
[24] da SILVA M D R G, FREITAS A M C, CABRITA M J B, et al. Olive oil composition: volatile compounds[M]//Olive Oil-Constituents, Quality, Health Properties and Bioconversions, InTech. 2012: 17-46. DOI:10.5772/28512.
[25] MIyAZAKI T, PLOTTO A, BALDWIN E A, et al. Aroma characterization of tangerine hybrids by gas-chromatographyolfactometry and sensory evaluation[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 727-735. DOI:10.1002/jsfa.4663.
[25] MANEL I, INES G, GUIDO F, et al. Aroma compounds and sensory characteristics as biomarkers of quality of differently processed Tunisian virgin olive oils[J]. International Journal of Food Science and Technology, 2015, 50(8): 1764-1770. DOI:10.1111/ijfs.12830.
[26] KAFTAN A, ELMACI y. Aroma characterization of virgin olive oil from two Turkish olive varieties by SPME/GC/MS[J]. International Journal of Food Properties, 2011, 14(5): 1160-1169. DOI:10.1080/10942910903453371.
[27] AMANPOUR A, KELEBEK H, KESEN S, et al. Characterization of aroma-active compounds in Iranian cv. mari olive oil by aroma extract dilution analysis and GC-MS-olfactometry[J]. Journal of the American Oil Chemists’ Society, 2016, 93(12): 1595-1603. DOI:10.1007/s11746-016-2906-6.
[28] GIOVANELLIA S, GIUSTIA G, LUIGI C P, et al. Aroma profile and essential oil composition of Rhus coriaria fruits from four Sicilian sites of collection[J]. Industrial Crops and Products, 2017, 97: 166-174. DOI:10.1016/j.indcrop.2016.12.018.
[29] MIyAZAKI T, PLOTTO A, BALDWIN E A, et al. Aroma characterization of tangerine hybrids by gas-chromatographyolfactometry and sensory evaluation[J]. Journal of the Science of Food and Agriculture, 2012, 92(4): 727-735. DOI:10.1002/jsfa.4663.
[30] SIEGMUND B, MURKOVIC M. Changes in chemical composition of pumpkin seeds during the roasting process for production of pumpkin seed oil (part 2: volatile compounds)[J]. Food Chemistry, 2004, 84: 367-374. DOI:10.1016/S0308-8146(03)00241-3.
[31] LIU X J, JIN Q Z, LIU Y F, et al. Changes in volatile compounds of peanut oil during the roasting process for production of aromatic roasted peanut oil[J]. Journal of Food Science 2011, 76: C404-C412. DOI:10.1111/j.1750-3841.2011.02073.x.
Optimization of Headspace Solid Phase Microextraction (HS-SPME) for Analysis of Volatile Constituents of Flaxseed Oil from Xinjiang by Gas Chromatography-Mass Spectrometry (GC-MS)
WEI Changqing1, ZHOU Qi2, LIU Wenyu1,*
(1. College of Food, Shihezi University, Shihezi 832000, China; 2. Hubei Key Laboratory of Lipid Chemistry and Nutrition, Wuhan 430000, China)
Abstract:This study optimized the headspace solid phase microextraction (HS-SPME) conditions for the analysis of the volatile constituents of flaxseed oil from Xinjiang by gas chromatography-mass spectrometry (GC-MS). The optimum HSSPME conditions established were as follows: 40 min extraction using a DVB/CAR/PDMS fiber at 50 ℃ with magnetic stirring followed by 4 min desorption. Under these conditions, a total of 46 volatile compounds were identified consisting mainly of aldehydes, ketones, alcohols, acids, esters, alkanes and heterocyclics and other miscellaneous compounds with aldehydes, heterocyclics and alcohols being predominant among these, accounting for 30.14%, 12.73% and 9.25% of the total identified components, respectively. A good chromatographic separation was achieved in this study.
Key words:headspace solid phase microextraction coupled to gas chromatography-mass spectrometry (HS-SPME-GC-MS); flaxseeds oil; volatile constituents; analysis
DOI:10.7506/spkx1002-6630-201714023
中图分类号:TS22
文献标志码:A
文章编号:1002-6630(2017)14-0151-07
引文格式:魏长庆, 周琦, 刘文玉. HS-SPME-GC-MS分析新疆胡麻油挥发性成分的技术优化[J]. 食品科学, 2017, 38(14): 151-157.
DOI:10.7506/spkx1002-6630-201714023. http://www.spkx.net.cn
WEI Changqing, ZHOU Qi, LIU Wenyu. Optimization of headspace solid phase microextraction (HS-SPME) for analysis of volatile constituents of flaxseed oil from Xinjiang by gas chromatography-mass spectrometry (GC-MS)[J]. Food Science, 2017, 38(14): 151-157. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714023. http://www.spkx.net.cn
收稿日期:2016-10-12
基金项目:国家自然科学基金地区科学基金项目(31360389);国家自然科学基金青年科学基金项目(31401617);
石河子大学高层次人才引进项目(RCZX201524);油料脂质化学与营养湖北省重点实验室开放基金项目(2015)
作者简介:魏长庆(1981—),男,副教授,博士,研究方向为油脂精深加工及品质控制。E-mail:changqing_wei@126.com
*通信作者:刘文玉(1979—),女,副教授,硕士,研究方向为食品生物技术。E-mail:wenyu_liu@126.com