
图1 标准品(A)和冬枣样品(B)HPLC谱图
Fig. 1 Chromatograms of mixed sugar standards (A) and watersoluble sugars from Dongzao jujube (B) by HPLC analysis
蒲小秋1,白红进2,马倩倩2,吴翠云1,*
(1.塔里木大学植物科学学院,新疆生产建设兵团南疆特色果树生产工程实验室,新疆 阿拉尔 843300;2.塔里木大学 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
摘 要:采用高效液相色谱-蒸发光散射检测器建立鲜枣果实中不同种类可溶性糖含量的测定方法。结果表明:适宜分离条件为Waters XBridgeTMAmide色谱柱(4.6 mm×250 mm,5 μm),流动相A为0.2%三乙胺的超纯水溶液,流动相B为0.2%三乙胺-乙腈溶液,两相体积比为24∶76,柱温30 ℃,雾化管温度60 ℃,漂移管温度60℃,气流量1.6 L/min,增益值1.0。在该条件下鼠李糖、阿拉伯糖、果糖、甘露糖、葡萄糖、蔗糖、麦芽糖和乳糖均能得到较好分离(分离度≥1.5),在0.099~1.040 ng/μL范围内呈良好线性关系,8 种糖的加标回收率在93.1%~111.2%之间,相对标准偏差均小于5%;检出限(RSN=3)在0.008~0.03 ng/μL之间。该方法具有操作简便、分离效果好、分离时间短等特点,可用于鲜枣果实中不同种类可溶性糖含量的测定,与传统方法相比较更加灵敏准确,有利于品质鉴定。
关键词:鲜枣;高效液相色谱-蒸发光散射检测器;水溶性糖;单糖;低聚糖
枣(Ziziphus jujube Mill.)为鼠李科枣属植物,在我国栽培面积仅次于苹果和柑橘,产量(占世界99%)居干果中第1位[1]。新疆位于我国西北部,地域辽阔,土地资源丰富,属温带大陆性气候,日照时间长、昼夜温差大,其优越的地理环境促使新疆枣产业发展迅速,截止到2012年9月,新疆全区红枣面积已达675万 亩[2],研究认为新疆产枣果的品质优于内地,远超过其原产地[3-5]。枣果实主要营养成分有糖类、蛋白质、脂肪、无机元素、维生素及其他活性物质,是深受人们喜爱的药食兼用品种[6-8],其中枣果实糖分的种类、含量及比率对果实风味、色泽和其他营养成分有重要影响,是决定枣果实品质和商品价值的主要因素[9]。
王永康[10]制定的优异种质资源判定标准指出,可溶性固形物含量、可溶性糖含量等指标是枣果品质评价的重要指标。果实中可溶性糖分的测定方法有分光光度法、气色相色谱法、高效毛细管电泳法和高效液相色谱(high performance liquid chromatography,HPLC)法等[11]。HPLC法测定果实中可溶性糖含量时步骤相对简单,对单糖和低聚糖的分析效果较好,被广泛应用于糖类的检测[12-15]。目前利用HPLC法测定枣果实糖含量已有报道,孙涛等[12]利用HPLC和示差检测器检测山西交城县的骏枣、河南新郑的灰枣及南疆部分地区的骏枣糖组分,测得4 种糖组分分别为果糖、葡萄糖、蔗糖和麦芽糖;赵仁邦[16]利用利用HPLC和示差检测器检测出阜平大枣中存在鼠李糖、阿拉伯糖、果糖、葡萄糖、半乳糖和蔗糖,多糖酸解液中检测出鼠李糖、阿拉伯糖、果糖、葡萄糖、半乳糖和甘露糖组分;吉爽爽[17]利用HPLC和紫外检测器测定了8 种枣品种多糖组成,结果表明8 个品种枣多糖中均含有甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖等单糖,但其单糖组成比例差异较大。不同测定方法的结果往往差异较大,同一种方法应用于不同的植物多糖其差异也较大。利用HPLC和蒸发光散射检测器(evaporative light-scattering detector,ELSD)同时测定不同鲜枣品种中鼠李糖、阿拉伯糖、果糖、甘露糖、葡萄糖、蔗糖、麦芽糖和乳糖含量鲜有报道。
本研究旨在利用HPLC和ELSD联用技术,建立同时测定鲜枣果实中葡萄糖、果糖、蔗糖、麦芽糖、乳糖、鼠李糖、阿拉伯糖和甘露糖含量的方法,并与分光光度法进行比较,旨在找出快捷、准确测定鲜枣果实中多种糖组分及准确判断枣品质的方法,以期对果实品质鉴定和资源开发提供理论依据。
1.1 材料与试剂
2015年9月下旬到10月上旬采集于塔里木大学枣种质资源圃的成熟枣果。品种分别为:京39、新郑红1号、金丝小枣、乐金3号、滕州躺枣、灰枣、骏枣、观音枣、金丝蜜和冬枣。在品种资源圃中选择树体、树龄(6~8 a生)基本一致的枣树,根据枣成熟果实的取样标准在每个品种树冠外围中上部相同方位分别随机采摘20 个果实,液氮速冻后-80 ℃保存。为保证不同品种之间果实成熟度的一致性,成熟果实的取样标准为果实充分着色后5 d进行采样。
可溶性糖标准品 中国食品检验所;乙腈和三乙胺(triethylamine,TEA)均为色谱纯,其他试剂均为国产分析纯。
1.2 仪器与设备
1260型HPLC仪(配有G1311C型四元泵、G1329B自动控温自动进样器、G1316A柱温箱、G4260B ELSD、OpenLAB CDS色谱工作站) 美国Agilent公司;FA1104N电子分析天平 上海菁海仪器有限公司;HH-S6数显恒温水浴锅 金坛市医疗仪器厂;H2100R高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;RV-10控制型旋转蒸发仪 广州仪科实验室技术有限公司。
1.3 方法
1.3.1 色谱条件
Waters XBridgeTMAmide色谱柱(4.6 mm×250 mm, 5 μm);流动相A为含0.2% TEA的超纯水溶液,流动相B为0.2% TEA-乙腈溶液,两相体积比为24∶76;流速1.0 mL/min;柱温30 ℃;进样量10 μL。
ELSD参数:雾化管温度60 ℃;漂移管温度60 ℃;增益值1.0;载气为氮气;流速1.6 L/min。
1.3.2 标准溶液的配制
分别精密称取L-鼠李糖、D-阿拉伯糖、D-木糖、D-果糖、L-甘露糖、D-葡萄糖、D-蔗糖、D-麦芽糖标准品0.010 0 g(精确至0.000 1 g),用超纯水溶解并定容至2 mL,摇匀,此溶液质量浓度均为5 ng/μL,过0.45 μm微孔滤膜,4 ℃冰箱保存备用。使用时,将糖混合标准溶液用超纯水稀释配制成1、0.8、0.6、0.4、0.2、
0.1 ng/μL 6 个不同质量浓度的标准液。
1.3.3 供试样品的制备
精密称取1.000 g速冻果肉,低温冷冻研磨仪研磨,加10 mL 80%乙醇溶液,80 ℃水浴30 min,4 000 r/min离心10 min取上清液,残渣用80%乙醇溶液重复提取2 次,合并滤液,减压蒸馏除去乙醇,用超纯水定容至25 mL,过0.45 μm微孔滤膜,滤液用于测定枣果中的可溶性糖含量。
1.3.4 分光光度分析法
还原糖、蔗糖和总糖含量的测定参照张友杰[18]的方法,可溶性固形物的测定参照赵志华等[19]的方法。
2.1 色谱条件的选择
2.1.1 流动相和色谱柱温度的选择

图1 标准品(A)和冬枣样品(B)HPLC谱图
Fig. 1 Chromatograms of mixed sugar standards (A) and watersoluble sugars from Dongzao jujube (B) by HPLC analysis
本实验选择Waters XBridgeTMAmide(4.6 mm×250 mm,5 μm)色谱柱,考察糖类化合物在该色谱柱上的分离情况。结果表明,在流动相中加入TEA时可以防止待测糖分同分异构体的出现,使峰形尖锐,但信噪比增加,且TEA含量过高会造成色谱柱损伤;提高流动相中水的比例可缩短分离时间,但分离效果变差峰重叠,特别是麦芽糖和乳糖,降低流动相中水的比例可增加分离度,但分离时间延长、峰展宽严重;升高柱温可使峰形变得尖锐,信噪比降低,但分离度下降。综合考虑以上因素,以含0.2% TEA的超纯水溶液作为A相,以0.2% TEA-乙腈溶液作为B相,两相体积比为24∶76,流速1.0 mL/min,柱温为30 ℃时可以实现基线分离(分离度≥1.5),如图1所示。
2.1.2 ELSD条件的选择
漂移管温度和载气流速是ELSD的2 个重要参数,漂移管温度影响检测器的响应,温度升高,流动相蒸发趋于完全,信噪比上升,但温度过高,可能导致分析物部分汽化,信号响应值变小。雾化载气流速影响雾化器中液滴的形成,从而影响检测器的响应,信噪比随载气流速的增加而升高,但当雾化气流量过大时,气溶胶液滴的变小会造成待测成分响应信号较大程度的降低,增益值越高信号响应值越大,但信噪比增加,一般选用1.0,增益值的高低取决于样品含糖量。因此,综合考虑本实验选择雾化器温度60 ℃,漂移管温度60 ℃,增益值1.0,氮气为载气,流速1.6 L/min,可达到最小的噪声信号,色谱图基线平稳。
2.2 线性回归方程及相关系数
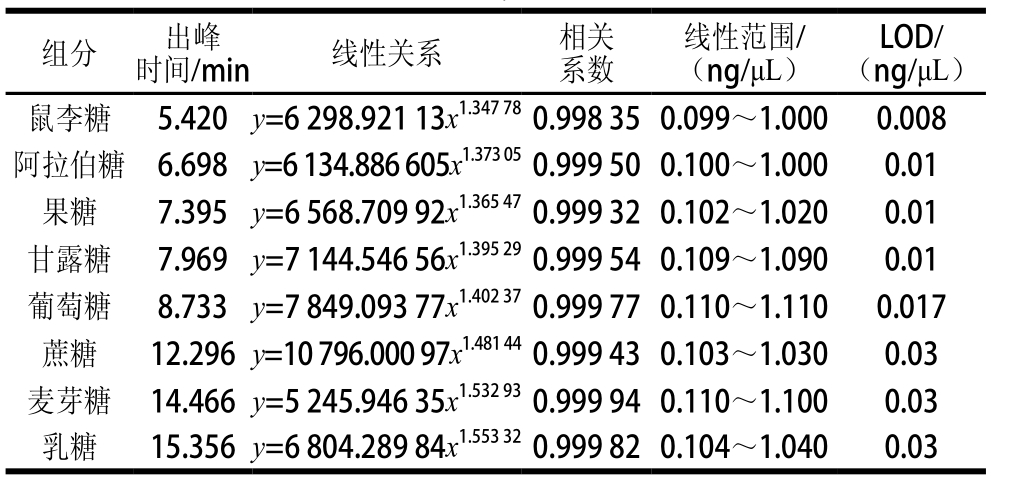
分别吸取标准混合溶液10 μL进样分析,以峰面积为纵坐标,以质量浓度为横坐标绘制标准曲线,在0.099~1.040 ng/μL之间呈良好的线性关系;将最小质量浓度的标准溶液逐级稀释,依次进样10 μL,以信噪比为3时的质量浓度作为检出限(detection of limit,LOD),LOD在0.008~0.03 ng/μL之间,表明该方法的灵敏性良好,如表1所示。
表1 混合标准样品可溶性糖含量线性关系、相关系数、LOD
Table 1 Linear equation, correlation coefficient (r2) and limit of detection LOD of water-soluble sugars in mixed standard solution determined by HPLC-ELSD
2.3 精密度和重复性结果
取标准混合溶液,重复进样5 次,每次10 μL,记录峰面积,得到8 种可溶性糖的相对标准偏差(relative standard deviation,RSD)分别为鼠李糖0.73%、阿拉伯糖1.95%、果糖0.88%、甘露糖0.41%、葡萄糖0.30%、蔗糖0.81%、麦芽糖0.62%、乳糖0.58%,在0.30%~2.00%范围内,表明该方法的精密度良好。
取一批鲜枣果样5 份,按照1.3.3节方法制备5 份供试品溶液,在选定色谱条件下各进样10 μL,以峰面积为指标,其RSD分别为鼠李糖1.41%、果糖1.60%、葡萄糖0.95%、蔗糖1.80%、麦芽糖1.50%、乳糖1.80%,表明该方法的重复性良好。
2.4 回收率实验结果
已知糖含量的枣果实样品中分别取5 份,准确加入1 ng/μL混合标准溶液1 mL后,按照1.3.3节制备供试品溶液,在相同色谱条件下进行测定,计算其平均回收率,各可溶性糖平均回收率在93.1%~111.2%之间,表明该方法准确率较高,如表2所示。
表2 8 种糖的回收率
Table 2 Recoveries of eight sugars

2.5 10 个枣品种脆熟期果实糖组分含量的比较
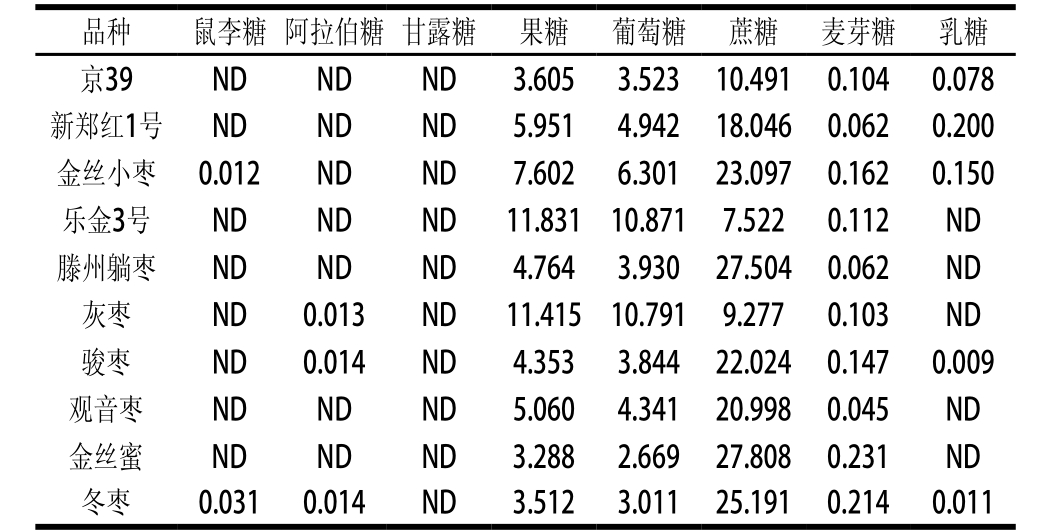
表3 HPLC-ELSD法测定鲜枣果实中不同种类可溶性糖含量
Table 3 Contents of water-soluble sugars in fresh jujube determined by HPLC-ELSD
注:ND.低于检测限。
从表3可以看出,不同枣品种脆熟期果实的可溶性糖种类和含量存在一定差异。在所有参试品种中都检测到了果糖、葡萄糖、蔗糖和麦芽糖,鼠李糖仅在金丝小枣和冬枣中被检测到,阿拉伯糖仅在灰枣、骏枣和冬枣中检测到,乳糖仅在京39、新郑红1号、金丝小枣、骏枣和冬枣中被检测到,甘露糖在所有参试品种中都未检测到,这与相关研究[20-22]结果一致,被检测到的鼠李糖、阿拉伯糖、麦芽糖和乳糖含量都很低;游离的单糖和双糖主要是果糖、葡萄糖和蔗糖,占总糖的98.9%~99.8%。在所有参试品种中果糖含量高于葡萄糖,其中,乐金3号果糖和葡萄糖含量均高于其他品种,分别为11.831%、10.871%;金丝蜜果糖和葡萄糖的含量均低于其他品种,分别为3.288%、2.669%;除灰枣和乐金3号外其他供试品种蔗糖>果糖>葡萄糖,金丝蜜蔗糖含量最高,乐京3号蔗糖含量最低,分别为27.808%、7.522%。
2.6 HPLC-ELSD法与分光光度法的比较
表4 分光光度法与HPLC-ELSD分别测定枣果实中还原糖、蔗糖和可溶性总糖含量
Table 4 Contents of reducing sugar, sucrose and total soluble sugars in fresh jujube determined by spectrophotometry and HPLC-ELSD

注:甜度=蔗糖含量×1.00+果糖含量×1.75+葡萄糖含量×0.70[23]。
由表4可以看出,分光光度法和HPLC-ELSD法测定还原糖、蔗糖和可溶性总糖基本一致,均为金丝蜜还原糖含量最低,京39可溶性总糖含量最低;乐京3号蔗糖含量最低,还原糖含量最高;金丝小枣可溶性总糖含量最高;但就RSD而言分光光度分析法明显高于HPLC-ELSD法,因此判断测定鲜枣果实还原糖、蔗糖和可溶性总糖HPLC-ELSD法优于分光光度分析法。
利用SSPS对表4进行相关性分析得到:分光光度分析法测得的还原糖、蔗糖和可溶性总糖与HPLC-ELSD测得结果呈极显著正相关r2分别为0.985、0.907和0.961,说明本实验的HPLC-ELSD测定结果与分光光度分析法测定的结果基本一致。可溶性固形物与HPLC-ELSD测得总糖和分光光度分析法测得的总糖呈极显著关系,r2分别为1.00和0.908,说明本实验建立的HPLC-ELSD法测定枣果实糖含量比分光光度分析法更接近真实值,判断一个品种的总糖含量高低采用本实验建立的HPLC-ELSD法更加科学可靠;甜度与HPLC-ELSD测得的总糖和可溶性固形物含量呈极显著正相关,r2分别为0.804和0.802,而与分光光度分析法测得的总糖无显著关系,表明利用HPLC-ELSD测定枣果实总糖含量或测定可溶性固形物可以直接判断品种的甜度,有利于品质鉴定。
本实验使用的分光光度法测定还原糖、蔗糖和可溶性总糖不需要昂贵的仪器,简便快捷,但该方法干扰因素较多,如显色试剂用量、显色反应时间、冷却时间及沸水浴时间都影响其显色,操作条件控制不好易引起误差,如王宏军等[24]研究发现显色试剂用量过多或过少都会使结果偏小;崔宏春[25]研究发现待测液冷却时间不够,测定时反应还未终止,使测定结果不准确,稳定性也较差,冷却时间过长,将使络合反应过度,生成的化合物会发生进一步聚合,产生其他物质,造成结果偏小;位杰等[26]研究发现显色时间与糖含量之间呈负相关,随着显色时间的延长,可溶性糖含量逐渐下降。
利用分光光度法只能测定还原糖总量,对还原糖的种类没有选择;测定出的蔗糖结果常比实际值偏高,实际是以蔗糖表示的一类糖的集合,这个集合体中很可能含有非蔗糖成分,使用分光光度法对蔗糖未知物的鉴定将显示出盲目性。
利用HPLC-ELSD法测定鲜枣果实可溶性糖含量时步骤相对简单,无需衍生化,可溶性糖的分析效果较好,ELSD是基于色谱柱流出物雾化后的不挥发性溶质颗粒的光散射电信号对样品的定性定量测定分析,对物质的响应不依赖于样品的光学特性,灵敏度高、无溶剂峰干扰,有利于检测较低含量的蔗糖,被广泛应用于糖类的检[27-30]。
本实验建立了鲜枣果实中鼠李糖、阿拉伯糖、甘露糖、果糖、葡萄糖、蔗糖、麦芽糖、乳糖8 种单糖和双糖的同时分离检测的HPLC-ELSD方法。研究结果表明,该检测方法样品前处理简便,检测灵敏度较高,分析时间短,实际样品检测结果与分光光度法结果相比较表明,采用HPLC-ELSD法判断枣品质更加科学可靠。
参考文献:
[1] 刘孟军, 王玖瑞, 刘平, 等. 中国枣生产与科研成就及前沿进展[J].园艺学报, 2015, 42(9): 1683-1698. DOI:10.16420/j.issn.0513-353x.2015-0538.
[2] 张昭豹. 新疆红枣消费市场调查研究[D]. 乌鲁木齐: 新疆农业大学, 2014: 7-12.
[3] 朱锐. 新疆枣树栽培适宜品种及关键技术的调查研究[D]. 北京:北京林业大学, 2010: 24-26.
[4] 马元忠. 浅谈新疆枣产业发展状况[C]//第五届全国干果生产、科研进展学术研讨会论文集. 北京: 中国农业科学技术出版社, 2007: 52-54.
[5] 李占林. 新疆枣树栽培与气候因子的关系[C]//第五届全国干果生产、科研进展学术研讨会论文集. 北京: 中国农业科学技术出版社, 2007: 305-307.
[6] 鲁周民, 刘坤, 闫忠心, 等. 枣果实营养成分及保健作用研究进展[J].园艺学报, 2010, 37(12): 2017-2024. DOI:10.16420/j.issn.0513-353x.2010.12.006.
[7] 毕金峰, 于静静, 白沙沙. 国内外枣加工技术研究现状[J].新疆农机化, 2010, 199(3): 34-36. DOI:10.13620/j.cnki.issn1007-7782.2010.03.001.
[8] 刘世军, 唐志书, 崔春利, 等. 大枣化学成分的研究进展[J]. 云南中医学院学报, 2015(3): 96-100.
[9] 秦巧平, 张上隆, 谢鸣, 等. 果实糖含量及成分调控的分子生物学研究进展[J]. 果树学报, 2005, 22(5): 519-525. DOI:10.13925/j.cnki. gsxb.2005.05.019.
[10] 王永康. 枣优异种质资源评价标准规范探讨[C]//第八届全国干果生产, 科研进展学术研讨会论文集. 北京: 中国林业出版社, 2013: 73-79.
[11] 孙艳涛, 由欣. 植物组织中糖化合物测定方法的研究进展[J]. 科教文汇: 上旬刊, 2011(10): 134-136.
[12] 孙涛, 赵子刚, 刘圣红, 等. 高效液相色谱法测定鲜枣中糖的组成[J].分析仪器, 2015(1): 38-41.
[13] MA C, SUN Z, CHEN C, et al. Simultaneous separation and determination of fructose, sorbitol, glucose and sucrose in fruits by HPLC-ELSD[J]. Food Chemistry, 2014, 145: 784-788. DOI:10.1016/ j.foodchem.2013.08.135.
[14] 宋晓晖, 谢凯, 李艳丽, 等. HPLC-ELSD法测定梨果实中不同种类可溶性糖含量[J]. 南京农业大学学报, 2012, 35(2): 87-91.
[15] KOLA O, SIMSEK M, DURAN H, et al. HPLC determination of carotenoid, organic acid, and sugar content in pepino (Solanum muricatum) fruit during the ripening period[J]. Chemistry of Natural Compounds, 2015, 51(1): 132-136. DOI:10.1007/s10600-015-1219-6.
[16] 赵仁邦. 高效液相色谱法测定枣中糖类物质[D]. 保定: 河北农业大学, 2003: 23-25.
[17] 吉爽爽. 枣中功能性糖的研究[D]. 保定: 河北农业大学, 2012: 25-30.
[18] 张友杰. 以蒽酮分光光度法测定果蔬中的葡萄糖、果糖、蔗糖和淀粉[J]. 分析化学, 1977, 5(3): 167-171.
[19] 赵志华, 李建明, 张大龙, 等. 水钾耦合对大棚厚皮甜瓜产量和可溶性固形物含量的影响[J]. 西北农林科技大学学报(自然科学版), 2013, 41(8): 161-167. DOI:10.13207/j.cnki.jnwafu.2013.08.026. [20] 彭艳芳, 李洁, 赵仁邦, 等. 金丝小枣和冬枣果实发育过程中低聚糖和多糖含量的动态研究[J]. 果树学报, 2008, 25(6): 846-850. DOI:10.13925/j.cnki.gsxb.2008.06.016.
[21] 赵爱玲, 薛晓芳, 王永康, 等. 枣果实糖酸组分特点及不同发育阶段含量的变化[J]. 园艺学报, 2016, 43(6): 1175-1185. DOI:10.16420/ j.issn.0513-353x.2015-0856.
[22] 赵仁邦, 刘孟军, 葛微, 等. 高效液相色谱法测定枣中的糖类物质[J].食品科学, 2004, 25(8): 138-142.
[23] 魏天军, 窦云萍, 张勤. 中宁圆枣果实发育成熟期生理生化变化[J].中国农学通报, 2007, 23(3): 324-327.
[24] 王宏军, 邓旭明, 蒋红, 等. 蒽酮-硫酸比色法检测多糖条件的优化[J]. 中国饲料, 2011(4): 39-41. DOI:10.15906/j.cnki.cn11-2975/ s.2011.04.011.
[25] 崔宏春. 绿茶水溶性多糖含量测定方法研究[D]. 北京: 中国农业科学院, 2009: 33-34.
[26] 位杰, 吴翠云, 蒋媛, 等. 蒽酮法测定红枣可溶性糖含量条件的优化[J].食品科学, 2014, 35(24): 136-140.
[27] 刘燕, 伊伟贞, 焦连魁, 等. 高效液相色谱法测定地黄蔗糖合成酶、蔗糖磷酸合成酶活性[J]. 中国农学通报, 2011, 27(15): 245-248.
[28] 魏鑫, 魏永祥, 刘成, 等. 高效液相色谱法测定4 个蓝莓品种果实中糖酸组分及含量[J]. 中国果树, 2013(3): 64-67. DOI:10.16626/j.cnki. issn1000-8047.2013.03.029.
[29] 付尽国, 袁龙, 楼宏铭, 等. HPLC-ELSD法测定低聚木糖中的木糖和木二糖[J]. 广东化工, 2015, 42(11): 220-221; 219.
[30] SHANMUGAVELAN P, KIM S Y, KIM J B, et al. Evaluation of sugar content and composition in commonly consumed Korean vegetables, fruits, cereals, seed plants, and leaves by HPLCELSD[J]. Carbohydrate Research, 2013, 380: 112-117. DOI:10.1016/ j.carres.2013.06.024.
Simultaneous Determination of Water-Soluble Sugars in Fresh Jujube by High Performance Liquid Chromatography with Evaporative Light-Scattering Detector (HPLC-ELSD)
PU Xiaoqiu1, BAI Hongjin2, MA Qianqian2, WU Cuiyun1,*
(1. Engineering Laboratory of Characteristic Fruit Tree Production in Southern Xinjiang of Xinjiang Production and Construction Corps, College of Plant Science, Tarim University, Alar 843300, China; 2. Xinjiang Production and Construction Corps Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Tarim University, Alar 843300, China)
Abstract:A method for the simultaneous determination of water-soluble sugars in fresh jujubes by high performance liquid chromatography with evaporative light-scattering detector (HPLC-ELSD) was established. The carbohydrates were separated on a chromatographic column of Waters XBridgeTMAmide (4.6 mm × 250 mm, 5 μm) with a mobile phase consisting of A (0.2% triethylamine aqueous solution) and B (0.2% triethylamine in acetonitrile) (A:B = 24:76, V/V). The column temperature was 30 ℃ and the atomization temperature was 60 ℃. The drift tube temperature of ELSD was 60 ℃. Nitrogen was used as the carried gas with a flow rate of 1.6 L/min and a gain value of 1.0. These experimental conditions allowed good separation of water-soluble sugars, such as rhamnose, arabinose, glucose, mannose, glucose, sucrose, maltose and lactose with a resolution of 1.5 or above. Good linearity was observed for the analytes in the concentration range of 0.099–1.040 ng/μL. The recoveries of spiked real samples ranged from 93.1% to 111.2%, with relative standard deviation (RSD) values below 5%. The limits of detection (RSN= 3) were in the range of 0.008–0.03 ng/μL. This method had a lot of advantages including simple operation, effective separation and time saving, and could be used to determine water-soluble sugars in fresh jujube. Compared with the traditional spectrophotometric method, HPLC-ELSD was more sensitive and accurate making it more suitable for quality identification of fresh jujube.
Key words:jujube fruit; high performance liquid chromatography with evaporative light-scattering detector (HPLC-ELSD); water-soluble sugar; monosaccharide; oligosaccharide
DOI:10.7506/spkx1002-6630-201714026
中图分类号:中图分类号:S665.1 文献标志码:A 文章编号:1002-6630(2017)14-0170-05
引文格式:蒲小秋, 白红进, 马倩倩, 等. HPLC-ELSD法同时测定鲜枣果实中不同种类可溶性糖含量[J]. 食品科学, 2017, 38(14): 170-174.
DOI:10.7506/spkx1002-6630-201714026. http://www.spkx.net.cn
PU Xiaoqiu, BAI Hongjin, MA Qianqian, et al. Simultaneous determination of water-soluble sugars in fresh jujube by high performance liquid chromatography with evaporative light-scattering detector (HPLC-ELSD)[J]. Food Science, 2017, 38(14): 170-174. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714026. http://www.spkx.net.cn
收稿日期:2016-09-25
基金项目:浙江大学馥莉食品研究院基金项目(KY201004);兵团科技创新团队建设项目(2014CC006);
新疆研究生科研创新项目(XJGRI2016128)
作者简介:蒲小秋(1989—),女,硕士研究生,研究方向为果树遗传育种。E-mail:504797210@qq.com
*通信作者:吴翠云(1968—),女,教授,博士,研究方向为果树种质资源与品种选育。E-mail:wcyby@163.com