葛雪筠,周德健,王 斌,陈 荫*
(浙江海洋大学食品与医药学院,浙江 舟山 316022)
摘 要:目的:采用响应面法优化中性蛋白酶辅助提取苦竹花多糖的最优条件,并对提取得到的粗多糖进行分离纯化、理化性质及体外抗氧化性测定。方法:在单因素试验基础上,考察提取时间、酶添加量、提取温度对苦竹花粗多糖得率的影响。利用响应面试验建立数学模型,确定最佳提取条件。苦竹花粗多糖经分离纯化,获取2 个组分,分别命名为SBH-1和SBH-2,其中以SBH-1为主要组分。通过高效凝胶渗透色谱和红外光谱对SBH-1组分进行单糖组成、分子质量及初步的结构研究。通过与VC对比,研究苦竹花粗多糖SBH-1的体外抗氧化活性,即1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、超氧阴离子自由基清除率及抗脂质过氧化能力的测定。结果:在中性蛋白酶添加量0.83%,提取温度46.68 ℃,提取时间115.95 min条件下,粗多糖得率为7.63%。经检测苦竹花粗多糖SBH-1组分分子质量为18.3 kD,主要由甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)3 种单糖组成比例为1.3∶2.3∶1.2。SBH-1对DPPH自由基和超氧阴离子自由基清除EC50分别为2.03 mg/mL和1.038 mg/mL。结论:采用中性蛋白酶辅助提取得到的苦竹花粗多糖简单易行,纯化得到的中性杂多糖SBH-1具有很好的活性,为进一步研究和开发提供理论基础。
关键词:苦竹花;多糖;响应面;体外抗氧化
苦竹花(Shiraia bambusicola Henn)为肉座菌科真菌竹黄的子座[1],因被寄生的竹黄蜂叮咬洞后,于竹节之间贮积的伤流液,经一段时间干涸凝结而成的块状物质,具有祛风除湿、活血舒经、止咳的功效,常用于治疗风湿痹痛、四肢麻木、小儿百日咳、白带过多等[2]功效。我国主要分布于长江流域及岭南地区,在日本和斯里兰卡也有相关报道[3-4]。本品宜于冬季采收,砍取竹秆,剖取竹黄,晾干,自然产出者甚少,目前各地大多采用火烧竹林的方法,使竹经暴热后,致使竹沥溢在竹节之间而后凝固所得,然后剖取晾干。近年来,林海萍等[5]研究竹黄菌多糖有保护肝脏,治疗慢性肝炎的功效。由此可见苦竹花作为真菌类中药,其多糖类活性成分极具深入研究和开发价值。
在工艺提取方面,传统热水提取耗时长、能耗大、效率低,碱提法和酸提法易使多糖糖苷键发生断裂,导致结构和活性改变。近年来,酶工程技术成为一种新方法,相较传统法具有高效、节能等特点,且已经广泛用于动植物有效成分的提取[6-8]。闫培生等[9]研究6 种不同生物酶对发酵菌丝体多糖的提取效果,结果表明性价比最高的是中性蛋白酶,其反应条件温和且能更好的保持多糖结构和活性。故本实验在工艺提取方面通过响应面法优化中性蛋白酶辅助提取苦竹花多糖,选取最佳提取工艺条件,并对苦竹花主要组分的抗氧化活性进行初步研究。对今后苦竹花多糖的功能性研究提供一定基础。
1.1 材料与试剂
苦竹花产自安徽黄山地区;葡聚糖系列标准品(分子质量6.1、9.6、21、47.1、107、194 kD) 中国食品药品检定研究院;中性蛋白酶(酶活力≥60 000 U/g)、丙酮、甲醇、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、VC、三羟甲基氨基甲烷(Tris)、浓盐酸、邻苯三酚、无水乙醇、铁氰化钾、三氯乙酸、氯化铁、单糖标准品(甘露糖、氨基葡萄糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖、半乳糖、木糖、岩藻糖)均为国产分析纯。
1.2 仪器与设备
电热鼓风干燥箱 上海一恒仪器有限公司;HH-1恒温水浴锅 国华电器有限公司;N-1100旋转蒸发仪日本Eyela公司;TGL-16M高速离心机 上海卢湘仪离心机仪器有限公司;UV-1800PC紫外-可见分光光度计上海美谱达仪器有限公司;FreeZone冷冻干燥机美国Labconco公司;KP-C18色谱柱(4.6 mm×150 mm, 5 ☒m) 中冉科技发展有限公司;1260型高效液相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 粗多糖的提取
将苦竹花粉碎后,置于索氏提取器内,经石油醚(沸程30~60 ℃)反复脱脂12 h。将脱脂后的苦竹花放于电热鼓风干燥箱中烘干。取干燥后的苦竹花粉末按料液比1∶20(g/mL)加入蒸馏水,按照实验设计酶解条件提取。经升温使酶失活后将水提物于8 000 r/min离心15 min,弃残渣,留上清液。上清液浓缩后,经Sevag法[10]除去游离蛋白后再加入5 倍体积无水乙醇,并于4 ℃冰箱醇沉过夜,抽滤得粗多糖。粗多糖复溶于蒸馏水后在透析袋中(截留分子质量3 500 D)透析72 h,以脱去其中的盐等小分子物质。最后透析后的样品经冷冻干燥后即得苦竹花粗多糖。按公式(1)计算粗多糖得率:
1.3.2 单因素试验设计
针对酶添加量、提取温度和提取时间,3 个主要影响因素分别进行单因素试验。固定料液比为1∶20(g/mL),每个单因素设定5 个变量,即酶添加质量分数分别为0.2%、0.4%、0.6%、0.8%、1.0%;提取温度分别为25、30、35、40、45 ℃;提取时间分别为30、60、90、120、150 min。并利用Design Expert 8.0.6软件对单因素试验结果进行优化。
1.3.3 响应面试验设计
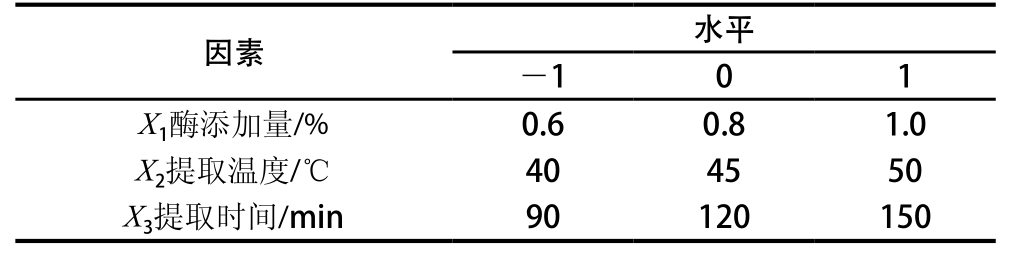
在单因素试验基础上,采用三因素三水平利用Box-Behnken模型,以表现显著的酶添加量、提取温度和提取时间3 个因素为自变量,苦竹花粗多糖提取率(Y)为响应值,如表1所示。
表1 Box-Behnken试验设计因素与水平
Table 1 Box-Behnken test factors and the level of design
1.3.4 苦竹花多糖的分离纯化
将苦竹花粗多糖溶于纯水中,配成约75 mg/mL溶液。溶液经过0.45 μm滤膜过滤后,选用Q Sepharose Fast Flow柱层析(5.5 cm×30 cm),分别经0.1、0.25、0.5、0.75、1、2 mol/L NaCl溶液进行梯度洗脱。洗脱液经硫酸-苯酚法反应后于490 nm波长处测吸光度,绘制洗脱曲线。根据绘制的线性洗脱曲线可以得到多糖洗脱的主要浓度,然后根据该洗脱的NaCl溶液浓度再进行进一步分段洗脱分离。部分收集器收集洗脱液,用硫酸-苯酚法跟踪检测绘制洗脱曲线收集多糖主要组分,组分经旋转蒸发浓缩后透析脱盐,最后冻干[11]。
1.3.5 单糖组成分析
多糖的完全酸水解:准确称取5.0 mg纯化后的多糖样品并置于安瓿管中,加入1.0 mL 2 mol/L三氟乙酸(trifluoroacetic acid,TFA)溶液,经酒精喷灯封管后置于110 ℃烘箱内水解反应8 h。水解反应完全后将样品用甲醇溶解并转移到鸡心瓶内,用甲醇反复旋蒸以除去样品中TFA,最后转移至EP管中40 ℃烘干备用。
标准品溶液的配制:准确称取等物质的量干燥至恒质量的10 种单糖标准品,加入纯水充分溶解,将其配制成1.0 mg/mL的溶液。采用PMP柱前衍生高效液相色谱法[12]对等物质的量配制的单糖标准品和多糖全水解后产物进行衍生,最后进行高效液相色谱分析。
色谱条件:KP-C18色谱柱(4.6 mm×150 mm, 5 m);流动相:磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 6.7)-乙腈(82∶18,V/V)溶液;流速1 mL/min;柱温30 ℃;进样量20 ☒L;紫外检测器波长254 nm。
m);流动相:磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 6.7)-乙腈(82∶18,V/V)溶液;流速1 mL/min;柱温30 ℃;进样量20 ☒L;紫外检测器波长254 nm。
1.3.6 苦竹花SBH-1多糖纯度分析及分子质量测定
采用高效凝胶渗透色谱法测定。色谱条件:Shodex Ohpak SB-804HQ凝胶色谱柱(300 mm×7.8 mm);柱温35 ℃;流动相为0.1 mol/L Na2SO4溶液;流速0.5 mL/min;检测器为示差检测器[13]。以标准葡聚糖分子质量的对数(lg Mw)对色谱保留时间作图,得标准曲线,计算样品分子质量。
1.3.7 红外光谱分析
采用KBr压片法。将少量苦竹花多糖样品与经干燥好的KBr粉末置于玛瑙研钵中反复研磨至均匀,然后经压片机压制成透明薄片,置于红外光谱仪下测定。红外光谱仪测定参数:背景扫描32 次;扫描范围400~4 000 cm-1;分辨率4.0 cm-1;检测器为(经氘化处理)硫酸三甘肽晶体[14]。
1.3.8 体外抗氧化测定
1.3.8.1 DPPH自由基清除能力测定
准确称取4 mg DPPH经无水乙醇溶解后存放于棕色容量瓶中,溶液呈紫色。置于4 ℃冰箱内保存。分别取不同质量浓度梯度为0、0.5、1、2、3、4、5 mg/mL的样品溶液1 mL于试管中,并加入4 mL 0.004% DPPH溶液,振荡混匀后避光处理0.5 h。以无水乙醇为空白对照测定其在波长517 nm处吸光度A;以VC作为阳性对照;待测液中加入4.0 mL DPPH自由基溶液所测定吸光度为A1[15]。并按公式(2)计算DPPH自由基清除率,DPPH自由基清除率越大则表明苦竹花SBH-1的自由基清除能力越强。
1.3.8.2 超氧阴离子自由基(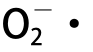 )清除能力测定
)清除能力测定
试管中分别加入pH 8.2的50 mmol/L Tris-HCl缓冲液3 mL,分别取不同质量浓度0、1、2、3、4、5 mg/mL的样品1 mL。并将其置于25 ℃恒温水浴锅中反应8 min,分别加入同样预温的30 mmol/L邻苯三酚溶液200 μL,两者混合均匀后精确反应4 min,最后滴入0.5 mL浓盐酸终止反应[16]。在波长320 nm处测定吸光度,以等体积的Tris-HCl缓冲液作为空白,以VC作为阳性对照。O2-·清除率按公式(3)计算:
式中:A0为Tris-HCl缓冲液吸光度;A1为加样品吸光度;A2为Tris-HCl缓冲液、邻苯三酚溶液(未加样品)吸光度。
1.3.8.3 抗脂质过氧化能力
卵黄悬浮液的配制:0.1 mol/L PBS(pH 7.45)-卵黄(25∶1,V/V)溶液。吸取悬浮液0.8 mL加入到不同浓度1 mL的样品溶液中,同时加入0.4 mL FeSO4溶液(24 mmol/L),置于37 ℃水浴锅中60 min。完成后加入1 mL 20%三氯乙酸溶液和1 mL 0.8%硫代苯巴比妥酸溶液。沸水精确反应15 min后离心[17]。于波长532 nm处测定吸光度,以VC作为阳性对照。样品清除率按公式(4)计算:
式中:A为样品吸光度;A0为不加样品吸光度。
2.1 单因素试验结果
2.1.1 酶添加量对粗多糖得率的影响
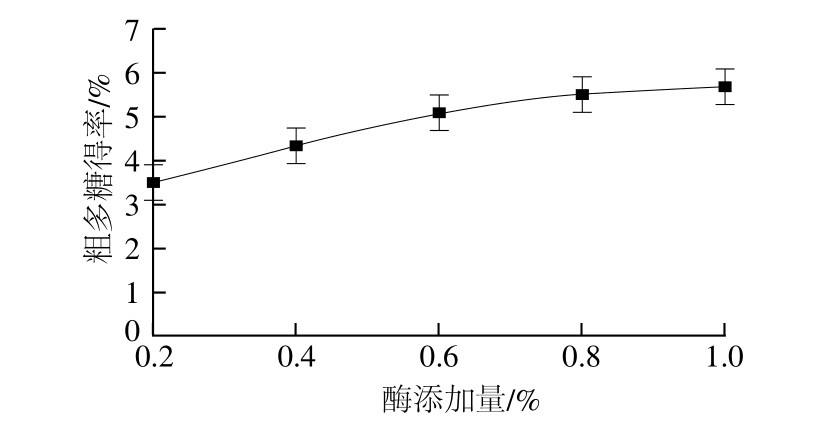
图1 酶添加量对粗多糖得率的影响
Fig. 1 Effect of enzyme concentration on the extraction efficiency of polysaccharide
由图1可以看出,随着酶添加量的增加,粗多糖得率提高。因为中性蛋白酶酶解了与多糖结合的蛋白质,从而将多糖更多地释放出来故提高了粗多糖得率。但当酶添加量超过0.8%时,曲线趋于平缓,说明中性蛋白酶已达到饱和状态。所以选择酶最佳添加量为0.8%。
2.1.2 提取温度对粗多糖得率的影响
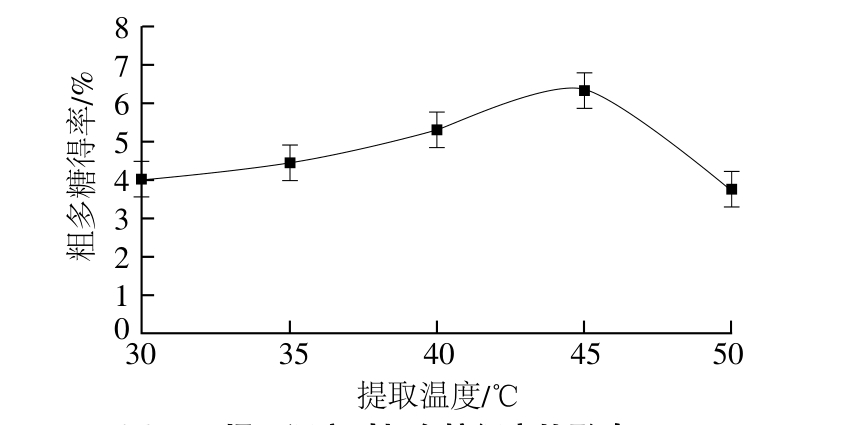
图2 提取温度对粗多糖得率的影响
Fig. 2 Effect of extraction temperature on the extraction efficiency of polysaccharide
由图2可以看出,提取温度对粗多糖得率影响较大,提取温度在45 ℃时,得率达到最大。但当提取温度超过45 ℃时得率下降明显,由于高温破坏了酶的活性,引起得率降低。因此选取最佳提取温度为45 ℃。
2.1.3 提取时间对粗多糖得率的影响
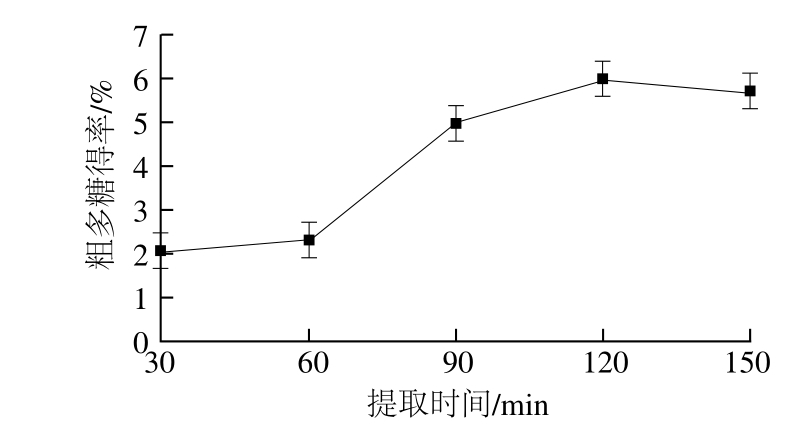
图3 提取时间对粗多糖得率的影响
Fig. 3 Effect of extraction times on the extraction efficiency of polysaccharide
由图3可以看出,随着提取时间的延长,粗多糖得率呈现上升趋势,但是当提取时间超过120 min时,粗多糖得率下降,因为提取时间过长而引起多糖结构变化使得粗多糖得率下降[18]。所以选择最佳提取时间为120 min。
2.2 响应面法优化提取工艺
2.2.1 响应面试验结果及方差分析
表2 响应面试验设计与结果
Table 2 Experimental design with experimental and predicted results for response surface analysis
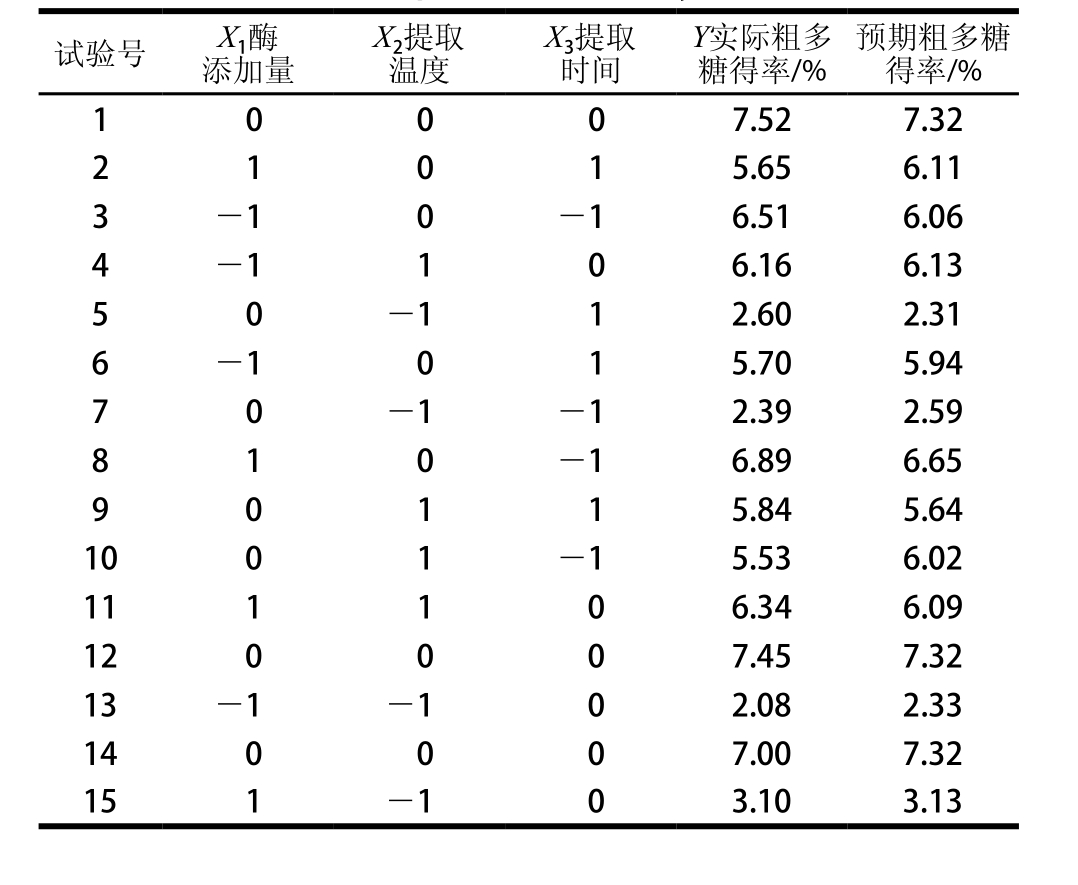
利用Design Expert 8.0.6通过表2中苦竹花粗多糖得率试验数据进行多元回归拟合,获得苦竹花粗多糖得率对编码自变量酶添加量、提取温度和提取时间的二次多项回归方程[19-20]:Y=7.32+0.19X1+1.69X2-![]()
![]()
3 回归模型方差分析
Table 3 ANOVA for the response surface model
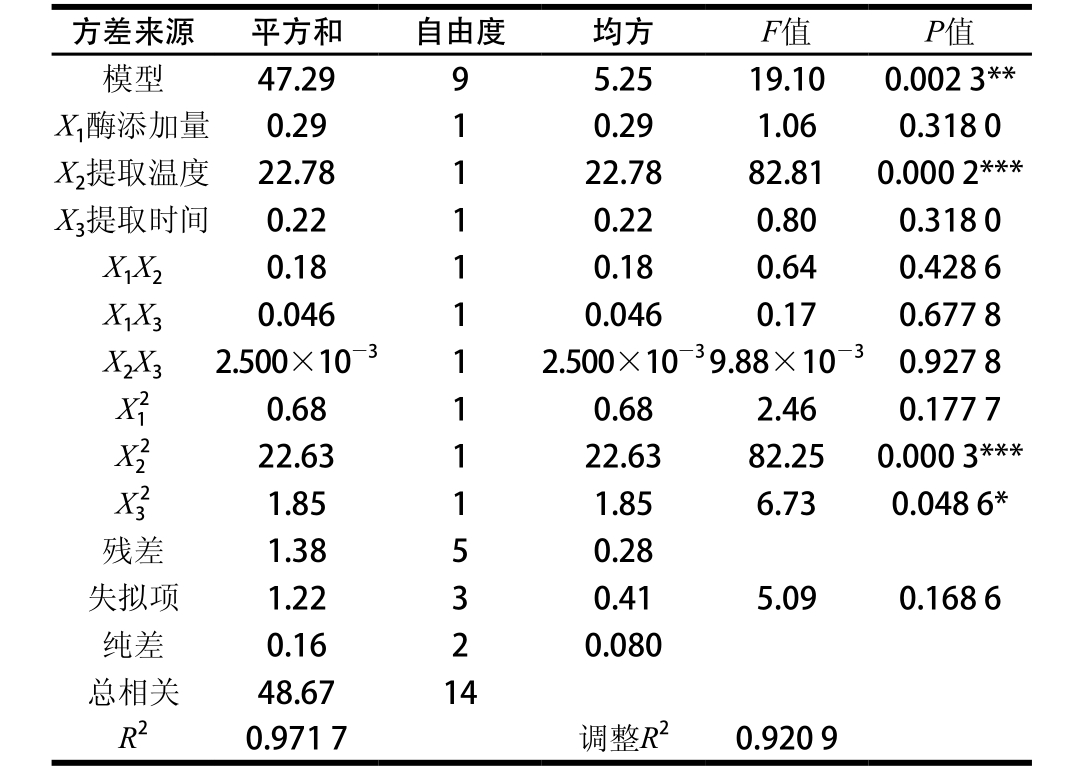
注:*.差异显著(P<0.05);**.差异高度显著(P<0.01);***.差异极显著(P<0.001)。
如表3所示,模型P值为0.002 3,说明模型显著。R2为0.971 7,失拟项P值为0.168 6不显著,表明试验方法可靠,模型拟合程度良好,可以用此模型对中性蛋白酶辅助提取苦竹花多糖得率进行分析和预测[21-22]。各试验因素对指标的重要性可由F值的大小体现出,F值越大表明对试验指标越重要[23]。试验因素的影响顺序为X2>X1>X3。
2.2.2 各因素之间交互作用及优化
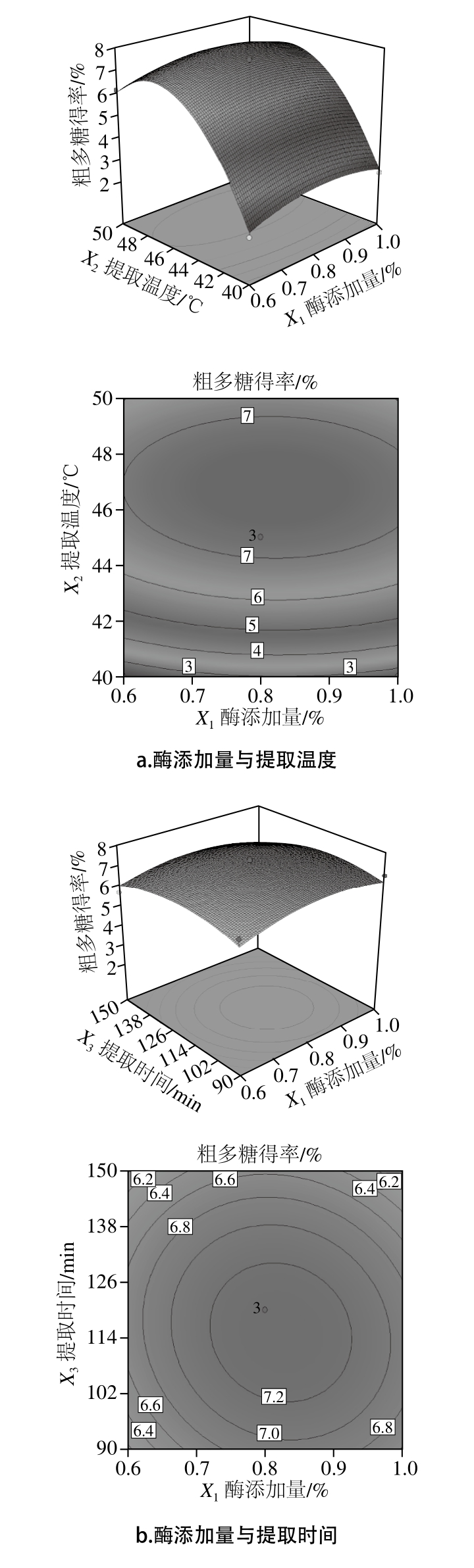
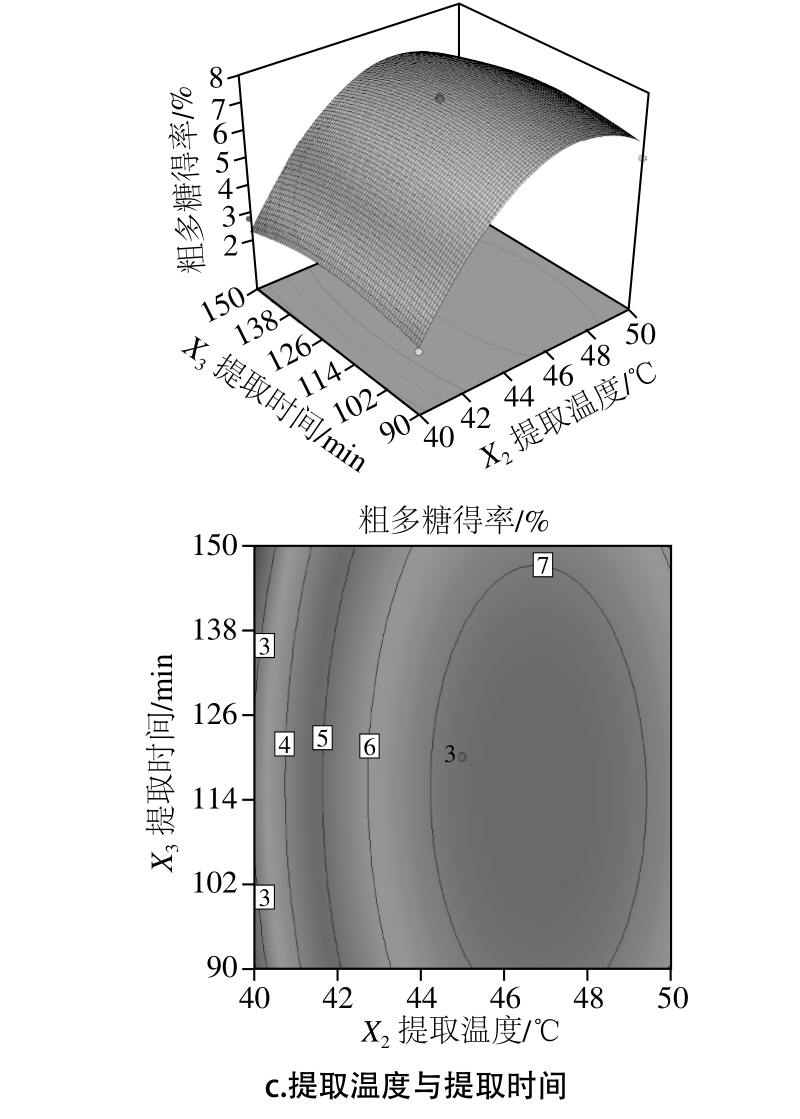
图4 响应面交互作用对粗多糖得率的影响
Fig. 4 Response surface plots showing the effects of extraction parameters on the yield of crude polysaccharide
根据二次模型所做的响应面可评价试验因素对苦竹花粗多糖得率的两两交互作用,以及确定各因素的最佳水平范围。椭圆或圆形的等高线图分别表示两因素间交互作用的强或弱[24-25],如图4所示。通过Design-Expert V8.0.6分析得到最佳粗多糖提取条件为中性蛋白酶酶添加量0.83%、提取温度46.68 ℃、提取时间115.95 min,粗多糖得率为7.63%。随后进行3 次最佳条件的验证实验,在酶添加量0.83%、提取温度46 ℃、提取时间115 min条件下,所得粗多糖得率平均值为7.4%与预测值相对误差为2.88%,说明结果可靠。
2.3 苦竹花多糖的分离纯化
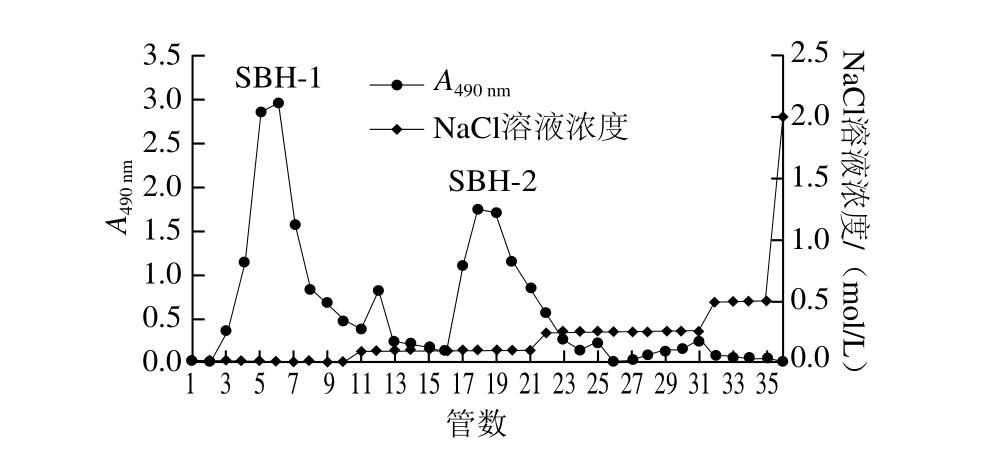
图5 苦竹花多糖Q Sepharose fast flow层析柱上的梯度洗脱图
Fig. 5 Gradient elution of the crude polysaccharides adsorbed onto Q Sepharose fast flow
采用0~2 mol/L不同梯度的NaCl溶液进行线性洗脱后进行梯度洗脱,绘制苦竹花多糖的梯度洗脱曲线,如图5所示。主要有2 个多糖洗脱组分组成。根据各峰对应的NaCl溶液浓度确定苦竹花粗多糖的洗脱条件,分别为0、0.1 mol/L NaCl溶液2 个梯度,分别将这2 个组分命名为SBH-1、SBH-2,尤以第1组分即蒸馏水洗脱下来的组分最多。所以本实验主要针对组分SBH-1进行研究。收集组分SBH-1,旋蒸浓缩后,经72 h透析后除去盐分,最后浓缩冻干。
2.3.1 单糖组成分析
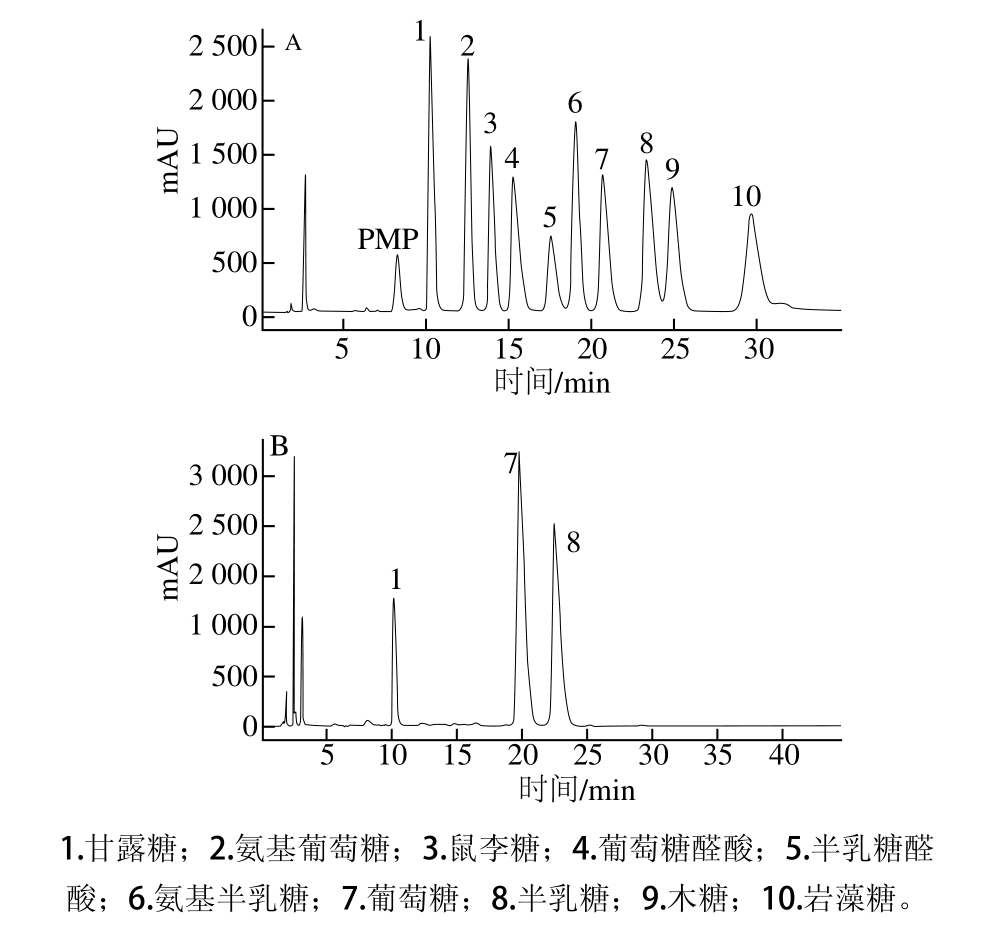
图6 单糖标准品(A)和SBH-1(B)的PMP柱前衍生高效液相色谱图
Fig. 6 HPLC chromatograms of the PMP pre-column derivatives of monosaccharide standards and SBH-1
如图6所示,苦竹花多糖由甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal)3 种单糖组成比例为1.3∶2.3∶1.2。叶淳渠等[26]研究的竹黄SB-Ⅰ和SB-Ⅱ单糖组成分别为阿拉伯糖、半乳糖、葡萄糖和阿拉伯糖、甘露糖、半乳糖、葡萄糖。陈佳佳等[27]研究竹黄子实体中BPS-1单糖组成为葡萄糖和甘露糖。本实验测得SBH-1的单糖组成鲜见国内文献报道。
2.3.2 多糖纯度及分子质量测定
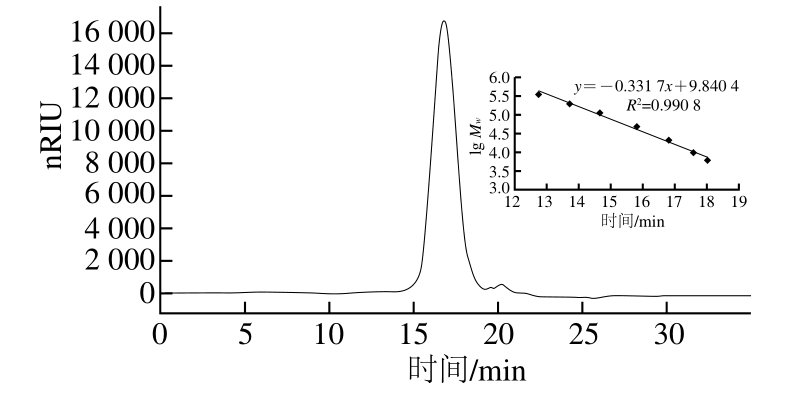
图7 SBH-1高效凝胶渗透色谱图
Fig. 7 HPGPC chromatogram of SBH-1
利用高效凝胶渗透色谱法,测定纯度的同时根据已知分子质量的葡聚糖出峰时间即可推算出多糖的分子质量。如图7所示,SBH-1的出峰时间为16.817 min且呈现单一对称狭窄的峰,表明SBH-1纯度较高,有助于进行下一步的分析。根据回归方程y=-0.331 7x+9.840 4(R2=0.990 8)计算可得SBH-1分子质量为18.3 kD。
2.3.3 红外光谱分析
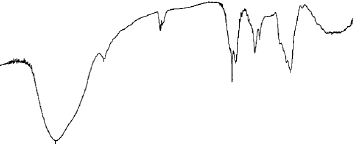
图8 SBH-1红外吸收光谱
Fig. 8 IR spectrum of SBH-1
如图8所示,在3 423 cm-1有很强的O—H伸缩振动特征吸收带;在2 934 cm-1处是糖类C—H伸缩振动吸收峰;1 632 cm-1处可能为结合水的吸收峰;1 037cm-1处为C—O—C的吸收峰。840 cm-1可能为多糖的α构型[28]。2.4 苦竹花多糖SBH-1的体外抗氧化活性分析
DPPH自由基清除模型,广泛应用于物质清除自由基能力的定量分析[29],在波长517 nm处测定吸光度越大则表明清除能力越强。虽然超氧阴离子自由基在有机体中相对为弱的氧化剂,但在体内可由歧化反应等产生过氧化物及羟自由基,对DNA及细胞膜造成一定损害引起一系列有害的生化反应[30-31]。
2.4.1 DPPH自由基清除能力
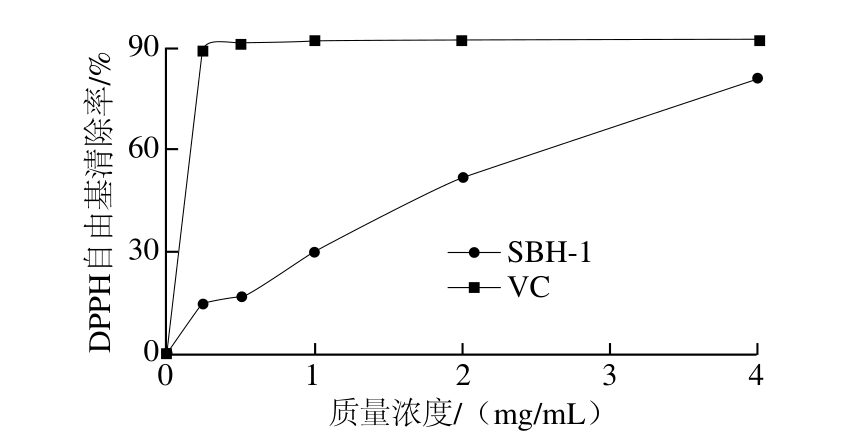
图9 SBH-1对DPPH自由基清除曲线
Fig. 9 DPPH radical scavenging capacity of SBH-1
由图9可知,DPPH自由基清除率随苦竹花多糖SBH-1的质量浓度的增大而增大,呈现量效关系。并且在质量浓度为4 mg/mL时清除率就已经达到88.1%。根据回归方程y=21.763X+5.922 9计算得EC50为2.03 mg/mL。说明苦竹花多糖有很好的自由基清除能力。
2.4.2 苦竹花多糖SBH-1对O2-·的清除能力
由图10可知,苦竹花多糖在质量浓度为1 mg/mL时清除率已经达到57.0%,且随着质量浓度的提高清除能力也呈上升趋势。根据回归方程y=0.179 01X+0.314 1可得苦竹花多糖EC50为1.038 mg/mL。可见苦竹花多糖具有较好的O2-·清除能力。
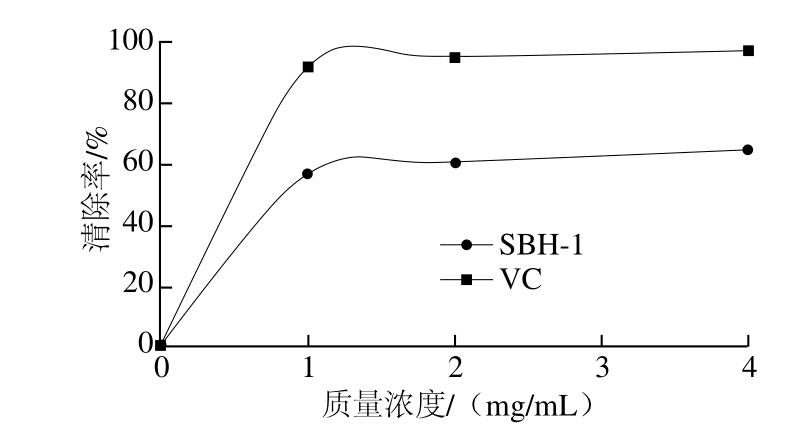
图10 SBH?的清除曲线
Fig. 10 Superoxide anion radical scavenging capacity of SBH-1
2.4.3 苦竹花多糖SBH-1的抗脂质过氧化能力
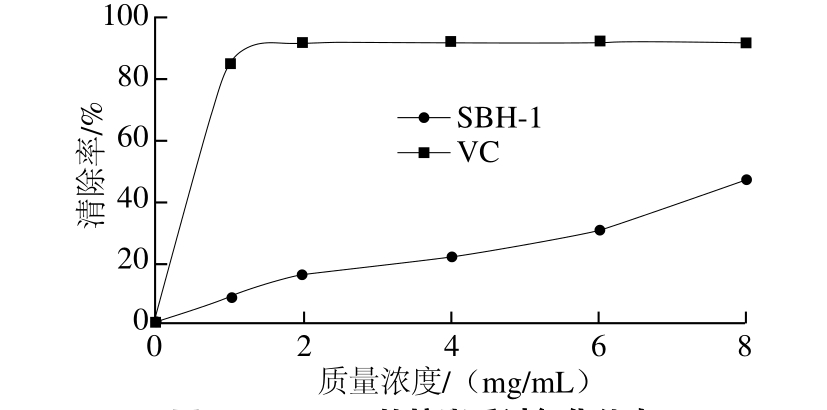
图11 SBH-1的抗脂质过氧化能力
Fig. 11 Effect of SBH-1 against lipid peroxidation
如图11所示,SBH-1的抗脂质过氧化能力随着SBH-1质量浓度增加而增加,当质量浓度为8 mg/mL时,清除率达到47.1%,且还呈上升趋势。可见SBH-1有一定的抗脂质过氧化能力。
本实验在单因素试验基础上,利用响应面对苦竹花进行酶法提取多糖条件优化,当中性蛋白酶添加量0.83%、提取温度46.68 ℃、提取时间115.95 min条件下,粗多糖得率为7.63%。且实验中经过分离纯化得到苦竹花多糖的主要组分SBH-1主要含甘露糖(Man)、葡萄糖(Glc)和半乳糖(Gal)3 种单糖组成,分子质量为18.3 kD。SBH-1具有较强的自由基清除能力,可以作为潜在的多糖来源抗氧化剂。本实验为进一步深入研究食药两用类真菌苦竹花多糖,提供了一定的理论依据。
参考文献:
[1] 梁晓辉, 蔡宇杰, 廖翔儒, 等. 药用真菌竹黄的研究进展[J].食品与生物技术学报, 2008, 27(5): 21-26. DOI:10.3321/ j.issn:1673-1689.2008.05.004.
[2] 钟树荣, 赵海, 李安明, 等. 一种尚待开发的中药: 竹黄[J]. 中草药, 2002, 33(4): 372-374. DOI:10.3321/j.issn:0253-2670.2002.04.041.
[3] 贾小明, 徐晓红, 庄百川, 等. 药用竹黄菌的生物学研究进展[J]. 微生物学通报, 2006, 33(3): 147-150. DOI:10.3969/ j.issn.0253-2654.2006.03.029.
[4] CHENG T F, JIA X M, MA X H, et al. Phylogenetic study on Shiraia bambusicola by rDNA sequence analyses[J]. Journal of Basic Microbiology, 2004, 44(5): 339-350. DOI:10.1002/jobm.200410434.
[5] 林海萍, 陈声明, 陈超龙. 一种值得开发利用的药用真菌: 竹黄[J]. 浙江林业科技, 2002, 22(1): 77-80. DOI:10.3321/j.issn:0253-2670.2002.04.041.
[6] 陈丽安, 张鸣镝. 两步酶法提取玉米胚芽蛋白的工艺研究[J]. 食品工业科技, 2014, 35(1): 219-226.
[7] 陈炼红, 杨丽珠, 索化夷, 等. 响应面法优化松茸多糖酶法提取工艺及其体外抗氧化分析[J]. 食品科学, 2014, 35(16): 23-28. DOI:10.7506/spkx1002-6630-201416005.
[8] 曾柏全, 周小芹, 解西玉. 纤维素酶-微波法提取脐橙皮橙皮苷工艺优化[J]. 食品科学, 2010, 31(4): 85-89.
[9] 闫培生, 马丽雅, 朱国振, 等. 荷叶离褶伞液体发酵及生物酶法提取菌丝体多糖的研究[J]. 中国农业科技导报, 2010, 12(4): 84-89. DOI:10.3969/j.issn.1008-0864.2010.04.16.
[10] 姜虹, 李新龙, 李海平, 等. 响应面法优化淫羊藿多糖超声提取工艺研究[J]. 长春师范学院学报(自然科学版), 2013, 32(1): 59-64. DOI:10.3969/j.issn.1008-178X(z).2013.01.018.
[11] CHEN Y, MAO W, WANG B, et al. Preparation and characterization of an extracellular polysaccharide produced by the deep-sea fungus Penicillium griseofulvum[J]. Bioresource Technology, 2013, 132: 178-181. DOI:10.1016/j.biortech.2012.12.075.
[12] 戴军, 朱松, 汤坚, 等. PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报, 2007, 26(2): 206-210. DOI:10.3969/j.issn.1004-4957.2007.02.015.
[13] 殷秀红, 赵峡, 张紫恒, 等. 紫贻贝多糖的提取、分离和基本理化性质分析[J]. 中国海洋药物杂志, 2011, 30(2): 12-17. DOI:10.13400/ j.cnki.cjmd.2011.02.007.
[14] 张惟杰. 糖复合物生化研究[M]. 2版. 杭州: 浙江大学出版社, 1999.
[15] SUN Y, ZHANG W, ZHENG T, et al. Hydrogen sulfide inhibits enzymatic browning of fresh-cut lotus root slices by regulating phenolic metabolism[J]. Food Chemistry, 2015, 169: 430-438. DOI:10.1016/j.foodchem.2015.01.065.
[16] CHANDRIKA L P, FEREIDOON S. Optimization of extraction of phenolic compounds from wheat using response surface methodology[J]. Food Chemistry, 2005, 93(1): 47-56. DOI:10.1016/ j.foodchem.2004.08.050.
[17] LIU Xin, SUN Zhengliang, ZHANG Miansong, et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers, 2012, 90(4): 1664-1670. DOI:10.1016/j.carbpol.2012.07.047.
[18] 翟为, 张美双, 张莉霞, 等. 复合酶法提取海带多糖工艺优化[J]. 食品科学, 2012, 33(18): 6-9.
[19] 黄璞, 谢明勇, 聂少平, 等. 响应曲面法优化微波辅助提取黑灵芝孢子多糖工艺研究[J]. 食品科学, 2007, 28(10): 200-203. DOI:10.3321/ j.issn:1002-6630.2007.10.044.
[20] HOU X J, CHEN W. Optimization of extraction process of crude polysaccharides from wild edible Bachu mushroom by response surface methodology[J]. Carbohydrate Polymers, 2008, 72(1): 67-74. DOI:10.1016/j.carbpol.2007.07.034.
[21] VAZQUEZ G, FREIRE M S, SANTOS J, et al. Optimization of polyphenols extraction from chestnut shell by response surface methodology[J]. Waste and Biomass Valorization, 2010, 1(1): 219-255. DOI:10.1007/s12649-010-9012-z.
[22] LIU Qidi, QIN Kunming, SHEN Baojia, et al. Optimization of the processing technology of Fructus Arctii by response surface methodology[J]. Chinese Journal of Natural Medicines, 2015, 13(3): 222-231. DOI:10.1016/S1875-5364(15)30008-X.
[23] 马伟, 尹莉芳, 周建平, 等. Box-Behnken中心组合设计优化甘草酸二铵缓释片的处方[J]. 中草药, 2008(10): 1486-1490. DOI:10.3321/ j.issn:0253-2670.2008.10.015.
[24] XU H, SUN L, SHI Y, et al. Optimization of cultivation conditions for extracellular polysaccharide and mycelium biomass by Morchella esculenta As51620[J]. Biochemical Engineering Journal, 2008, 39(1): 66-67. DOI:10.1016/j.bej.2007.08.013.
[25] 万俊, 蒋爱民, 曲直, 等. 响应面法优化Camembert干酪加工工艺[J]. 现代食品科技, 2012, 28(7): 840-844. DOI:10.13982/ j.mfst.1673-9078.2012.07.027.
[26] 叶淳渠, 方积年. 竹黄多糖SB-Ⅰ及SB-Ⅱ的组成研究: Ⅰ.竹黄多糖SB-Ⅰ及SB-Ⅱ的检定及克分子比测定[J]. 药学学报, 1981, 16(7): 524-528. DOI:10.16438/j.0513-4870.1981.07.007.
[27] 陈佳佳, 扶教龙, 顾华杰, 等. 竹黄多糖BSP-1的组成和抗氧化活性分析[J]. 食品研究与开发, 2008, 29(8): 120-122. DOI:10.3969/ j.issn.1005-6521.2008.08.034.
[28] SHINGEL K I. Determination of structural peculiarities of dextran, pullulan and γ-irradiated pullulan by Fourier-transform IR spectroscopy[J]. Carbohydrate Research, 2002, 337: 1445-1451. DOI:10.1016/S0008-6215(02)00209-4.
[29] SCHERER R, GODOY H T. Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method[J]. Food Chemistry, 2009, 112(3): 654-658. DOI:10.1016/j.foodchem.2008.06.026.
[30] 陈洋. 酶催化的类FENTON反应产生羟自由基及其对DNA损伤作用的电化学研究[D]. 武汉: 湖北大学, 2012.
[31] 张晨晨, 刘俊, 潘会君, 等. 过量ROS/RNS引发的线粒体功能障碍与代谢性心血管病及中药介入[J]. 中国中药杂志, 2011, 36(17): 30-36. DOI:10.4268/cjcmm20111725.
Optimization of Neutroproteinase-Assistant Extraction of Polysaccharide from the Stroma of Shiraia bambusicola Henn by Response Surface Analysis and Characterization of the Extracted Polysaccharide
GE Xuejun, ZHOU Dejian, WANG Bin, CHEN Yin*
(College of Food and Pharmacy, Zhejiang Ocean University, Zhoushan 316022, China)
Abstract:Objective: This study aimed to optimize the neutroproteinase-assisted extraction of polysaccharides from the stroma of Shiraia bambusicola Henn using response surface methodology (RSM) and to investigate the separation, purification, characterization and antioxidant activity of the polysaccharides. Methods: The effects of extraction time, enzyme concentration and extraction temperature on the yield of polysaccharides were examined by using one-factor-ata-time experiments. These extraction conditions were optimized through mathematical modeling. The crude extract was fractionated into two fractions: SBH-1 and SBH-2, with SBH-1 being among them. The monosaccharide composition, molecular mass and structure of SBH-1 were detected by high performance gel permeation chromatography (HPGPC) and infrared spectroscopy, respectively. The in vitro antioxidant activity was measured in comparison with VC by superoxide anion scavenging, 1,1-diphenyl-2-picrylhydrazyl (DPPH) scavenging, and lipid peroxidation inhibition assays. Results: The maximum yield of crude polysaccharides of 7.63% was obtained at 115.95 min of extraction at 46.68 ℃ with 0.83% neutral proteinase. The molecular mass of SBH-1 was determined to be 18.3 kD, and its monosaccharide composition consisted of glucose, mannose, and galactose with a ratio of 1.3:2.3:1.2. The EC50values for scavenging of DPPH and superoxide anion radials were 2.03 and 1.038 mg/mL respectively. Conclusions: The neutroproteinase-assistant extraction procedure was simple and easy to operate. SBH-1 was a neutral heteropolysaccharide with high activity. This study can provides a theoretical basis for further research and development of polysaccharides from S. bambusicola Henn.
Key words:Shiraia bambusicola Henn; polysaccharide; response surface methodology; antioxidant activity
DOI:10.7506/spkx1002-6630-201714030
中图分类号:中图分类号:Q946.3;TS201.2 文献标志码:A 文章编号:1002-6630(2017)14-0193-07
引文格式:葛雪筠, 周德健, 王斌, 等. 响应面法优化中性蛋白酶提取苦竹花多糖及多糖性质分析[J]. 食品科学, 2017, 38(14): 193-199.
DOI:10.7506/spkx1002-6630-201714030. http://www.spkx.net.cn
GE Xuejun, ZHOU Dejian, WANG Bin, et al. Optimization of neutroproteinase-assistant extraction of polysaccharide from the stroma of Shiraia bambusicola Henn by response surface analysis and characterization of the extracted polysaccharide[J]. Food Science, 2017, 38(14): 193-199. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714030. http://www.spkx.net.cn
收稿日期:2016-10-10
基金项目:国家自然科学基金青年科学基金项目(41406142);浙江省自然科学基金项目(21136000114)
作者简介:葛雪筠(1990—),男,硕士研究生,研究方向为天然产物提取与应用。E-mail:1184872992@qq.com
*通信作者:陈荫(1984—),男,副教授,博士,研究方向为糖化学与糖工程学。E-mail:mojojo1984@163.com