王 政,黄广民*,赵 斌,李山丹,陆大兴,胡 旦
(海南大学食品学院,海南 海口 570228)
摘 要:以新鲜椰衣粗纤维为原料,采用NaOH溶液提取分离椰衣中的半纤维素,并对其结构进行分析表征。结果表明:在料液比1∶50(g/mL)条件下,NaOH溶液质量分数5%,提取时间4.0 h,提取温度65 ℃时,椰衣半纤维素的产率最高,达14.33%。对所得样品进行红外光谱分析,确认为椰衣半纤维素,采用凝胶渗透色谱分析,数均分子质量为49 049 D,质均分子质量为368 354 D。所得椰衣半纤维素,用稀硫酸水解,高效液相色谱分析,其保留时间与标准木糖保留时间高度吻合。
关键词:椰衣纤维;半纤维素;结构分析
椰子栽培在我国有上千年的历史,主要分布在海南岛、雷州半岛、云南省西双版纳等热带和亚热带地区。海南省是椰子的主产地,全国90%以上的椰子产自海南[1],据统计,2015年止,全省年产椰子达到2.23亿个,椰子也成为海南省重要的热带油料经济作物,在海南省农业经济发展中起了举足轻重的作用。椰子由外果皮、中果皮、内果皮、种皮、种仁(胚乳)、胚及椰子水等组成[2]。外果皮和中果皮属称椰衣,主要由纤维素、半纤维素和少量木质素组成,约占全果质量的33%~35%[3]。椰衣是椰子加工的废弃物,椰衣加工可分离出椰衣长纤维和棕纤维(俗称椰糠)。椰衣广泛用于制作中密度纤维板、缆绳;椰糠多用于做农业的保水剂、植物培养基和生物肥料[4-6]。椰衣半纤维素为可再生资源,这一独特的资源并未发挥出应有的优势,因此开展椰衣纤维和半纤维素的利用研究意义重大。
自然界中半纤维素主要以杂多糖的形式存在于植物中,其化学结构主要是由五元糖、六元糖通过糖基或糖醛酸基键合连接而成高分子混合多糖[7],糖类主要有D-木糖、D-葡萄糖、D-甘露糖、D-半乳糖、L-阿拉伯糖、D-葡萄糖醛酸等[8]。植物品种不同,半纤维素的结构也不同,所组成的混合多糖也不同。半纤维素具有特殊的化学结构和独特的生理功能,可用于发酵生产乙醇、微生物筛选、改性后可做热塑性及抗水性材料等[9-11],目前广泛应用于生物、医药、食品、造纸及能源化工等各个领域[12-14]。但关于椰衣半纤维素的化学结构归属鲜见报道。
半纤维素多从植物中提取,提取方法主要有:酸法、碱法、蒸汽爆破法、酶法和碱性过氧化物抽提等[15]。稀酸提取法研究较多,碱法提取研究相对较少,相比而言,碱法提取操作简单,且提取效果好,成本相对较低[16]。本实验用碱法提取椰衣纤维中半纤维素,可为椰果副产物资源的综合开发利用提供相应的应用支持,为海南椰子产业发展及环境保护具有重要意义。碱法提取原理主要利用半纤维素在碱溶液中部分降解,转化为分子质量相对低的低聚糖溶解在溶液中,经分离提纯后得到[17]。提取过程即使采用较为温和的条件,也会产生剥皮反应,即在碱性条件下从半纤维素分子的还原性末端基而使其降解的反应,提取条件强烈时,还会产生碱性水解现象[18]。本实验以新鲜椰衣纤维为原料,采用稀NaOH溶液提取,探究椰衣纤维中半纤维素提取的最优工艺条件,所得椰衣半纤维素用红外光谱仪、凝胶渗透色谱仪和高效液相色谱仪等检测,并对其结构进行分析和表征。
1.1 材料与试剂
新鲜椰衣粗纤维由海南省文昌市会文生物工程有限公司提供。NaOH、盐酸、95%乙醇等所用试剂均为国产分析纯。
1.2 仪器与设备
RE52CS旋转蒸发器 上海市亚荣生化仪器厂;GL-20G-Ⅱ离心机 上海安亭科学仪器厂;Tensor27傅里叶变换红外光谱仪 德国Bruker公司;1515凝胶渗透色谱仪、2695高效液相色谱仪 美国Waters公司;EL204电子天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 椰衣半纤维素的提取及分离
准确称取1.000 0 g椰衣纤维于三颈烧瓶中,按料液比1∶50(g/mL)加入50 mL一定质量分数的NaOH溶液,使椰衣纤维浸没于NaOH溶液中,再将烧瓶置于恒温水浴中,分别装上回流冷凝管和温度计,加热升温至一定温度,提取一定时间,过滤,弃去固体的椰衣纤维,滤液用适量稀盐酸调节pH值至中性,转入旋转蒸发器圆底烧瓶,以60 ℃真空蒸发浓缩至约原体积的1/3,加入3倍体积95%乙醇溶液使固体物沉淀,滤去乙醇,所得红褐色固体即为椰衣半纤维素粗品,将椰衣半纤维素粗品再用酸化乙醇精制,得到椰衣半纤维素精品,即将所得的粗品用150 mL加入5~6滴盐酸酸化的70%乙醇溶液分3 次洗涤,弃去乙醇,将所得固体转入蒸发皿,置于真空干燥箱,60 ℃干燥,得到灰白色粉状椰衣半纤维素精品,将样品置于干燥器中冷却至室温,准确称质量[19],按下式计算椰衣半纤维素产率:
式中:m为干燥后样品质量/g;M为原椰衣粗纤维质量/g。
1.3.2 提取时间对椰衣半纤维素产率的影响
准确称取1.000 0 g椰衣纤维于250 mL三颈烧瓶,按1.3.1节方法提取,按料液比为1∶50(g/mL)的比例加入50 mL质量分数5% NaOH溶液,使椰衣纤维全部浸没于NaOH溶液中,提取时间分别为1、2、3、4、5、6、7、8 h,得到椰衣半纤维素,再用酸化乙醇精制后,得到椰衣半纤维素精品,准确称质量,计算椰衣半纤维素产率。
1.3.3 NaOH溶液质量分数对椰衣半纤维素产率的影响
准确称取1.000 0 g椰衣纤维于250 mL三颈烧瓶,按1.3.1节方法提取,按料液比为1∶50(g/mL)的比例,加入50 mL NaOH溶液,NaOH溶液质量分数分别为1%、2%、3%、4%、5%、6%,使椰衣纤维全部浸没于NaOH溶液中,提取时间4 h,得到椰衣半纤维素,再用酸化乙醇精制后,得到椰衣半纤维素精品,准确称质量,计算椰衣半纤维素产率。
1.3.4 提取温度对椰衣半纤维素产率的影响
准确称取1.000 0 g椰衣纤维于250 mL三颈烧瓶,按1.3.1节方法提取,按料液比1∶50(g/mL)的比例,加入50 mL 5% NaOH溶液,使椰衣纤维全部浸没于NaOH溶液中,提取时间4 h,提取温度分别为50、55、60、65、70、75、80 ℃,得到椰衣半纤维素,再用酸化乙醇精制后,得到椰衣半纤维素精品,准确称质量,计算椰衣半纤维素产率。
1.3.5 正交试验设计
表1 正交试验设计因素与水平
Table 1 Factors and their coded and actual levels used in orthogonal array design

为考察各个因素对椰衣半纤维素产率的影响,本实验主要选择NaOH溶液质量分数、提取时间、提取温度这3 个影响因素,根据单因素试验结果,选择L9(34)进行正交试验,分别考察各个因素对椰衣半纤维素产率的影响程度和变化趋势,如表1所示。
1.3.6 傅里叶红外光谱测定
称取一定量的椰衣半纤维素样品于玻璃研钵中,加入一定量的溴化钾晶体,充分研磨混合均匀,取适量混合粉末于压片装置中,以一定压力压片得到溴化钾-半纤维素片。将溴化钾-半纤维素片置于傅里叶变换红外光谱仪,以红外灯作光源,测定其化学结构[20]。
1.3.7 凝胶渗透色谱测定
称取一定量的椰衣半纤维素样品,加入超纯水将样品全部溶解,配制成浓度为2~3 mol/L溶液,采用凝胶渗透色谱,测定椰衣半纤维素的分子质量[21]。
1.3.8 高效液相色谱测定
准确称取2.000 0 g椰衣半纤维素精品于150 mL烧杯中,加入10 mL 质量分数72%硫酸溶液,搅拌溶解,置于30 ℃恒温水浴中保温1 h,每5~10 min搅拌1 次,此后加入90 mL去离子水,用表面皿盖住烧杯,置于高压锅中,121 ℃加热水解1 h,取出冷却、过滤,用NaOH调pH值至中性,过滤,取滤液于60 ℃旋蒸浓缩,0.22 μm微孔膜过滤,备用。
分别准确称取木糖、葡萄糖、鼠李糖、果糖及甘露糖等样品各1.000 0 g,加少量超纯水溶解,转入100 mL容量瓶中,加超纯水稀释定容,0.22 μm微孔膜过滤,备用。
准确移取样品液及标准单糖样品溶液,分别置于不同样品瓶中,用高效液相色谱仪检测椰衣半纤维素水解液中的糖。
色谱条件:Luna 5u氨基柱(250 mm×4.60 mm,0.25 µm);柱温25 ℃;流动相:乙腈-水(77∶33,V/V)溶液;流速1.0 mL/min;检测器温度35 ℃;进样量15 μL。
2.1 提取时间对椰衣半纤维素产率的影响
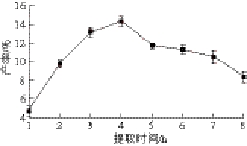
图1 提取时间对椰衣半纤维素产率的影响
Fig. 1 Effects of extraction time on the yield of hemicellulose
如图1所示,利用稀NaOH溶液提取椰衣半纤维素,提取时间小于4 h时,随着提取时间的延长,椰衣半纤维素的产率急剧上升;提取时间为4 h时,椰衣半纤维素的产率达到最大值为14.33%;提取时间大于4 h时,随着提取时间延长,椰衣半纤维素产率逐渐下降。可能是因为提取时间过长,椰衣半纤维素部分降解转化为低聚糖或单糖溶解于稀碱液中,导致半纤维素产率下降,因此,最佳提取时间为4 h。
2.2 NaOH溶液质量分数对椰衣半纤维素产率的影响
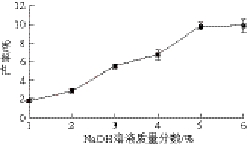
图2 NaOH溶液质量分数对椰衣半纤维素产率的影响
Fig. 2 Effect of sodium hydroxide concentration on the
yield of hemicellulose
如图2所示,NaOH溶液质量分数小于5%时,随着NaOH溶液质量分数的增加,椰衣半纤维素的产率逐渐上升;NaOH溶液质量分数为5%时,椰衣半纤维素产率达到9.73%,且曲线出现一拐点;NaOH溶液质量分数大于5%,随着NaOH溶液质量分数的增大,椰衣半纤维素产率趋于平缓(6.00%~9.80%)。然而,实验中NaOH溶液质量分数大于5%时,已有少量纤维素和木质素发生部分降解,导致椰衣半纤维素中杂质增加,给后续的分离和杂质去除增加困难,因此NaOH溶液最佳质量分数选5%为宜。
2.3 提取温度对椰衣半纤维素产率的影响

图3 提取温度对椰衣半纤维素产率的影响
Fig. 3 Effect of extraction temperature on the yield of hemicellulose
如图3所示,提取温度小于60 ℃时,随着提取温度的上升,椰衣半纤维素的产率逐渐上升;提取温度为60 ℃时,椰衣半纤维素产率达到最大值为11.17%;提取温度大于60 ℃时,随着提取温度的上升,椰衣半纤维素产率逐渐下降。可能是因为随着提取温度上升,椰衣半纤维素发生部分降解,转化为低聚糖或单糖溶解于碱性溶液中,使沉淀分离得到的半纤维素的量减少。因此提取椰衣半纤维素的最佳温度为60 ℃。
2.4 碱法提取椰衣半纤维素正交试验
表2 正交试验设计及结果
Table 2 Orthogonal array design with experimental results

如表2所示,极差R可以看出,料液比不变时,碱法提取椰衣半纤维素产率各因素的影响程度为:NaOH溶液质量分数>提取温度>提取时间。碱法提取椰衣半纤维素的最佳工艺组合为A2B2C3,即NaOH溶液质量分数5%,提取时间4.0 h,提取温度65 ℃。经验证结果表明,采用该组合条件进行提取,椰衣半纤维素产率最高,达到14.33%。
2.5 椰衣半纤维素红外光谱分析
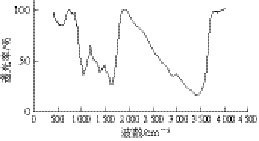
图4 椰衣半纤维素红外光谱图
Fig. 4 Infrared spectrum of hemicellulose
红外光谱检测原理是利用样品分子中某个基团的振动频率或转动频率与红外光频率相同时,分子即可吸收能量由原来的基态振动能吸收跃迁到能量较高的振动能级,振动与能级跃迁后,该波长的红外光就会被样品吸收[22],记录样品对不同波长的红外光的吸收,以波长或波数为横坐标,表示吸收峰的位置,透光率或吸光度为纵坐标表示吸收强度,即可绘制出红外光谱图,根据红外光谱图可对被测物质进行结构分析和鉴定[23]。为进一步验证椰衣纤维碱法提取得到的产物是椰衣半纤维素和样品的纯度及化学结构,对样品进行红外光谱分析。按1.3.6节处理样品,置于傅里叶变换红外光谱仪中,用红外光扫描检测样品中碳水化合物的化学结构。从图4可以看出,1 628~534 cm-1是椰衣半纤维素的糖环特征吸收峰[24]。3 422 cm-1和2 924 cm-1为椰衣半纤维素和吸收水中的—OH和C—H键产生的吸收峰,1 628 cm-1处为水的吸收峰。898 cm-1处的峰值为椰衣半纤维素各糖单元之间互相连接的β-糖苷键[25],1 041 cm-1处的特征吸收为糖单元中的羟基强的吸收峰[26]。1 396 cm-1处的峰值为糖单元中的羟基及木聚糖结构的C—O—C伸缩振动[27]峰值。结果表明,椰衣纤维碱法提取得到的是椰衣半纤维素,是由木聚糖组成的高分子碳水化合物。
2.6 凝胶渗透色谱测定结果
表3 凝胶渗透色谱实验结果
Table 3 Characteristics of hemicelluloses detected by gel permeation chromatography
红外光谱分析结果已表明所提取的样品是椰衣半纤维素,采用凝胶渗透色谱仪,分别测定样品的数均分子质量和重均分子质量,如表3所示。彭云云[28]采用碱抽提法分离的蔗渣半纤维素的重均分子质量和多分散性值为29 949 D和1.87,而本实验提取得到的椰衣半纤维素的均分子质量及分散性偏高,可能的原因有2 种,其一是椰衣纤维的化学结构不同于蔗渣,其半纤维素的分子质量结构也不同,其二是用碱液提取,有少量的椰衣纤维素和木质素降解,混入椰衣半纤维素样品中,导致结果偏高。程和丽等[26]用碱法提取玉米秆中的半纤维素并进行结构表征,结果表明分离、测定方法与原料本身的化学结构对半纤维素分子质量的测定结果均有一定的影响,且半纤维素结构复杂,目前没有方法能够得到完全不含杂质的样品。
2.7 高效液相色谱测定结果
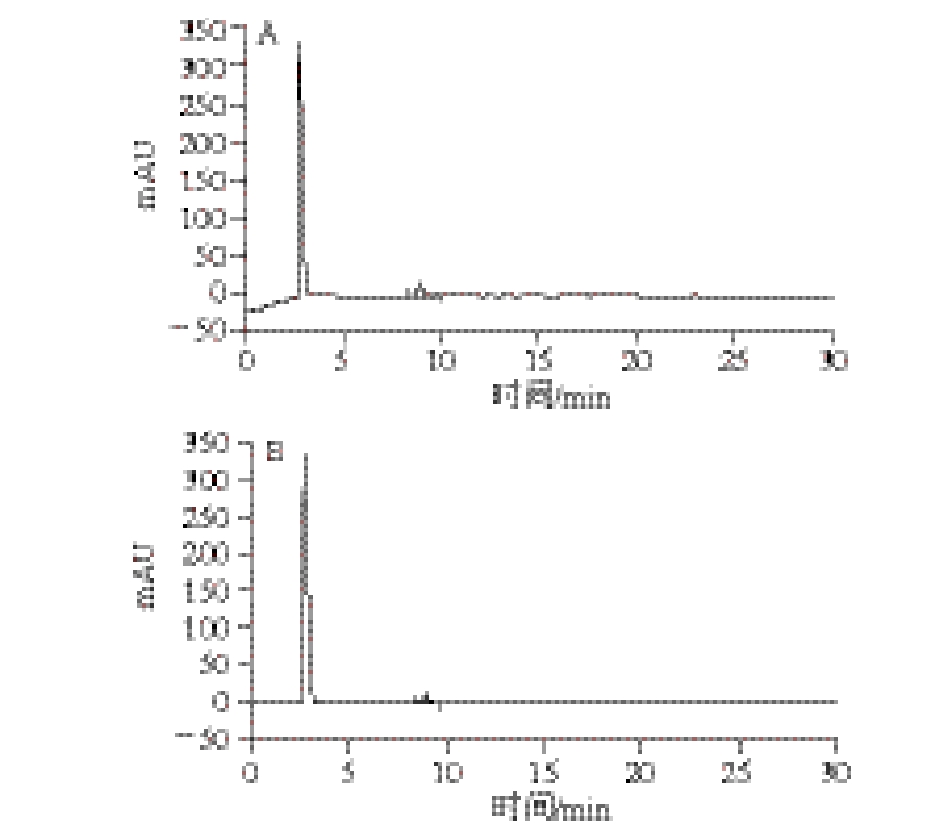
图5 木糖标准品(A)和椰衣半纤维素水解后样品液(B)高效液相色谱图
Fig. 5 High performance liquid chromatograms of standard xylose (A) and sample (B)
表4 各标准品出峰时间
Table 4 Peak times of standard sugars
为进一步了解椰衣半纤维素水解后单糖组成,按照1.3.8节方法对样品进行处理,分别将水解液及标准品溶液,分别注入高效液相色谱仪,测定其水解液中的单糖的保留时间和5 种单糖标准品的保留时间,如图5、表4所示。椰衣半纤维素水解液中糖的保留时间与标准木糖的保留时间高度吻合,且没有检出其他杂质峰,因此,椰衣半纤维素用稀硫酸水解,水解液含有的单糖为木糖。
李欣欣等[29]对天然椰壳纤维及其增强复合材料进行研究,结果表明椰纤维中结晶化的纤维素呈螺旋状嵌在不定性的木质素与半纤维素中,椰衣纤维具有高强度、高弹性、强的抗拉强度是因椰衣纤维素与不定型的木质素和木聚糖组成的半纤维素呈螺旋状嵌制交缠的结构所致。
采用稀NaOH溶液能从椰衣纤维中提取半纤维素。正交试验表明,影响椰衣半纤维素提取率的各因素影响顺序为NaOH溶液质量分数、提取温度、提取时间。在料液比1∶50(g/mL)、NaOH溶液质量分数5%、提取时间4.0 h、提取温度65 ℃时,椰衣半纤维素产率最高,达14.33%。所得样品进行红外光谱分析,确认为椰衣半纤维素,采用凝胶渗透色谱分析,椰衣半纤维素数均分子质量为49 049 D,质均分子质量为368 354 D,再经高效液相色谱检测,椰衣半纤维素水解液中单糖的保留时间与标准木糖的保留时间高度吻合,没有检出杂质峰。因此,椰衣半纤维素水解后主要成分为木糖,椰衣半纤维素是由木糖组成的均多糖,没有发现其他糖。
参考文献:
[1] 刘伟丽, 唐月娥. 海南经济特区发展报告[C]//中国经济特区发展报告. 深圳: 中国深圳大学中国质量经济发展研究所, 2015: 280-300.
[2] 夏秋瑜, 李瑞, 赵松林, 等. 椰子的利用价值及综合加工技术[J].中国热带农业, 2007(3): 37-38.
[3] 肖红. 椰子的开发利用[J]. 海南大学学报(自然科学版), 2003, 21(2): 183-189. DOI:10.3969/j.issn.1004-1729.2003.02.022.
[4] 郑侃, 梁栋, 张喜瑞. 椰子废弃物综合利用现状与分析[J]. 广州农业科学, 2013(5): 175-176. DOI:10.16768/j.issn.1004-874x.2013.05.055.
[5] 李新菊, 陈华, 赵松林. 海南发展椰衣栽培基质加工业的前景分析[J]. 热带农业科学, 2001(5): 37-39. DOI:10.3969/ j.issn.1009-2196.2001.05.009.
[6] 张建国. 我国椰子产业现状及发展战略分析[J]. 中国农业信息, 2016(6): 139-141. DOI:10.3969/j.issn.1672-0423.2016.06.094.
[7] 彭锋. 农林生物质半纤维素分离纯化、结构表征及化学改性的研究[D]. 广州: 华南理工大学, 2010: 20-30.
[8] SUN R C, LAWTHER J M, BANKS W. Fractional and structural characterization of wheat straw hemicelluloses[J]. Carbohydrate Polymers, 1996, 29(4): 325-331. DOI:10.1016/S0144-8617(96)00018-5.
[9] 张伯坤, 张美云, 李金宝. 半纤维素提取技术及综合利用研究进展[J]. 黑龙江造纸, 2009, 37(3): 12-14. DOI:10.3969/ j.issn.1673-0283.2009.03.004.
[10] 崔红艳. 半纤维素的分离和分析方法及其应用研究进展[J]. 黑龙江造纸, 2011, 39(1): 46-47. DOI:10.3969/j.issn.1673-0283.2011.01.015.
[11] 王雪鹏, 管斌, 汤海青, 等. 半纤维素制备方法的改进及其应用[J]. 食品与生物技术学报, 2003, 22(6): 85-88. DOI:10.3321/ j.issn:1673-1689.2003.06.020.
[12] 杨恒, 张素风. 热水预提取半纤维素在造纸中的应用[J]. 天津造纸, 2011, 33(3): 26-27.
[13] 王兴, 周景辉. 半纤维素及其衍生物作为造纸助剂的研究进展[J]. 黑龙江造纸, 2014, 42(1): 11-13. DOI:10.3969/ j.issn.1673-0283.2014.01.004.
[14] 张盆, 胡惠仁, 石淑兰. 半纤维素的应用[J]. 天津造纸, 2006, 28(2): 16-18.
[15] HUANG H J, SHRI R. A review of separation technologies in current and future biorefineries[J]. Seperation Purification Technologies, 2008, 62: 130-135. DOI:10.1016/j.seppur.2007.12.011.
[16] 林妲, 彭红, 王娜, 等. 半纤维素分离纯化研究进展[J]. 中国造纸, 2011, 30(1): 60-64. DOI:10.3969/j.issn.0254-508X.2011.01.016.
[17] 尉慰奇, 武书彬, 彭云云. 麦草水溶性和碱溶性半纤维素的分离与表征[J]. 林产化学与工业, 2010, 30(6): 66-67.
[18] 熊月林. 香蕉纤维的制取及其结构理化性能研究[D]. 上海: 东华大学, 2007: 35-42.
[19] 李玲. 椰壳半纤维素的提取及表征[D]. 海口: 海南大学, 2012: 18-25.
[20] 钱贵明, 刘嘉, 张引, 等. 傅里叶变换中红外光谱在食品快速分析与检测中的应用[J]. 粮食与油脂, 2013, 26(6): 29-30.
[21] 缪琪. 凝胶渗透色谱法在果蔬农残分析中的应用[D]. 兰州: 甘肃农业大学, 2007: 4-20.
[22] 熊英. 近红外光谱的原理及应用[J]. 中山大学研究生学刊(自然科学与医学版), 2013(2): 16-30.
[23] 翁诗甫. 傅里叶变换红外光谱分析[M]. 北京: 化学工业出版社, 2010: 316-317.
[24] 任俊莉, 孙润仓, 刘传富, 等. 阳离子蔗渣半纤维素的合成及表征[J].华南理工大学学报(自然科学版), 2007, 35(4): 86-90. DOI:10.3321/ j.issn:1000-565X.2007.04.019.
[25] SUN J X, SUN X F, SUN R C, et al. Fractional extraction and structural characterization of sugarcane bagasse hemicellulost[J]. Carbohydrate Polymers, 2004, 56(2): 195-204. DOI:10.1016/ j.carbpol.2004.02.002.
[26] 程合丽. 玉米杆半纤维素的碱法提取与表征[J]. 中国造纸学报, 2011, 26(3): 26-29.
[27] SUN J X, SUN X F, ZHAO H, et al. Isolation and characterization of cellulose from sugarcane bagasse[J]. Polymer Degradation and Stability, 2004, 84: 331-339. DOI:10.1016/j.polymdegradstab.2004.02.008.
[28] 彭云云. 蔗渣半纤维素的化学结构及其热裂解特性研究[D]. 广州:华南理工大学, 2010.
[29] 李欣欣, 张伟, 吴平平, 等. 天然椰壳纤维及其增强复合材料[J].上海化工, 1994(14): 28-30.
Extraction and Structural Characterization of Hemicellulose from Coconut Coir Fiber
WANG Zheng, HUANG Guangmin*, ZHAO Bin, LI Shandan, LU Daxing, HU Dan
(College of Food Science and Technology, Hainan University, Haikou 570228, China)
Abstract:In this investigation, hemicellulose was extracted from crude coconut coir fiber with aqueous sodium hydroxide solution, and its structure was analyzed. It turned out that the highest yield (14.33%) of hemicellulose was obtained when the extraction was performed at 65 ℃ for 4.0 h in 5% sodium hydroxide solution with a solid-to-solvent ratio of 1:50 (g/mL). The extracted product was confirmed as hemicelluloses using infrared spectroscopy. By gel permeation chromatography, the number-average molecular weight of the hemicellulose was 49 049 D and weight-average molecular weight 368 354 D. The hemicellulose was hydrolyzed with sulfuric acid and analyzed by high performance liquid chromatography, and the results showed that the retention time was completely consistent with that of standard xylose.
Key words:coir fiber; hemicellulose; structural characterization
DOI:10.7506/spkx1002-6630-201714038
中图分类号:TQ352
文献标志码:A
文章编号:1002-6630(2017)14-0245-05
引文格式:王政, 黄广民, 赵斌, 等. 椰衣半纤维素的提取及其结构表征[J]. 食品科学, 2017, 38(14): 245-249.
DOI:10.7506/ spkx1002-6630-201714038. http://www.spkx.net.cn
WANG Zheng, HUANG Guangmin, ZHAO Bin, et al. Extraction and structural characterization of hemicellulose from coconut coir fiber[J]. Food Science, 2017, 38(14): 245-249. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714038. http://www.spkx.net.cn
收稿日期:2016-10-08
基金项目:海南省自然科学基金项目(20153161);海南省研究生创新科研课题(Hys2016-46)
作者简介:王政(1993—),男,硕士研究生,研究方向为糖及碳水化合物化学。E-mail:540546138@qq.com
*通信作者:黄广民(1957—),男,教授,学士,研究方向为生物能源、糖及碳水化合物化学。E-mail:hgmin886699@163.com